13.4: Efectos de la Temperatura y Presión sobre la Solubilidad
- Page ID
- 77930
- Comprender la relación entre temperatura, presión y solubilidad.
- Entender que la solubilidad de un sólido puede aumentar o disminuir con el aumento de la temperatura,
- Entender que la solubilidad de un gas disminuye con un aumento de la temperatura y una disminución de la presión.
Experimentalmente se encuentra que la solubilidad de la mayoría de los compuestos depende fuertemente de la temperatura y, si es un gas, también de la presión. Como veremos, la capacidad de manipular la solubilidad cambiando la temperatura y la presión tiene varias consecuencias importantes.
Efecto de la Temperatura sobre la Solubilidad de Sólidos
La figura\(\PageIndex{1}\) muestra gráficas de las solubilidades de varios compuestos orgánicos e inorgánicos en agua en función de la temperatura. Aunque la solubilidad de un sólido generalmente aumenta con el aumento de la temperatura, no existe una relación simple entre la estructura de una sustancia y la dependencia de la temperatura de su solubilidad. Muchos compuestos (como la glucosa y\(\ce{CH_3CO_2Na}\)) exhiben un aumento dramático en la solubilidad con el aumento de la temperatura. Otros (como\(\ce{NaCl}\) y\(\ce{K_2SO_4}\)) exhiben poca variación, y aún otros (como\(\ce{Li_2SO_4}\)) se vuelven menos solubles con el aumento de la temperatura.
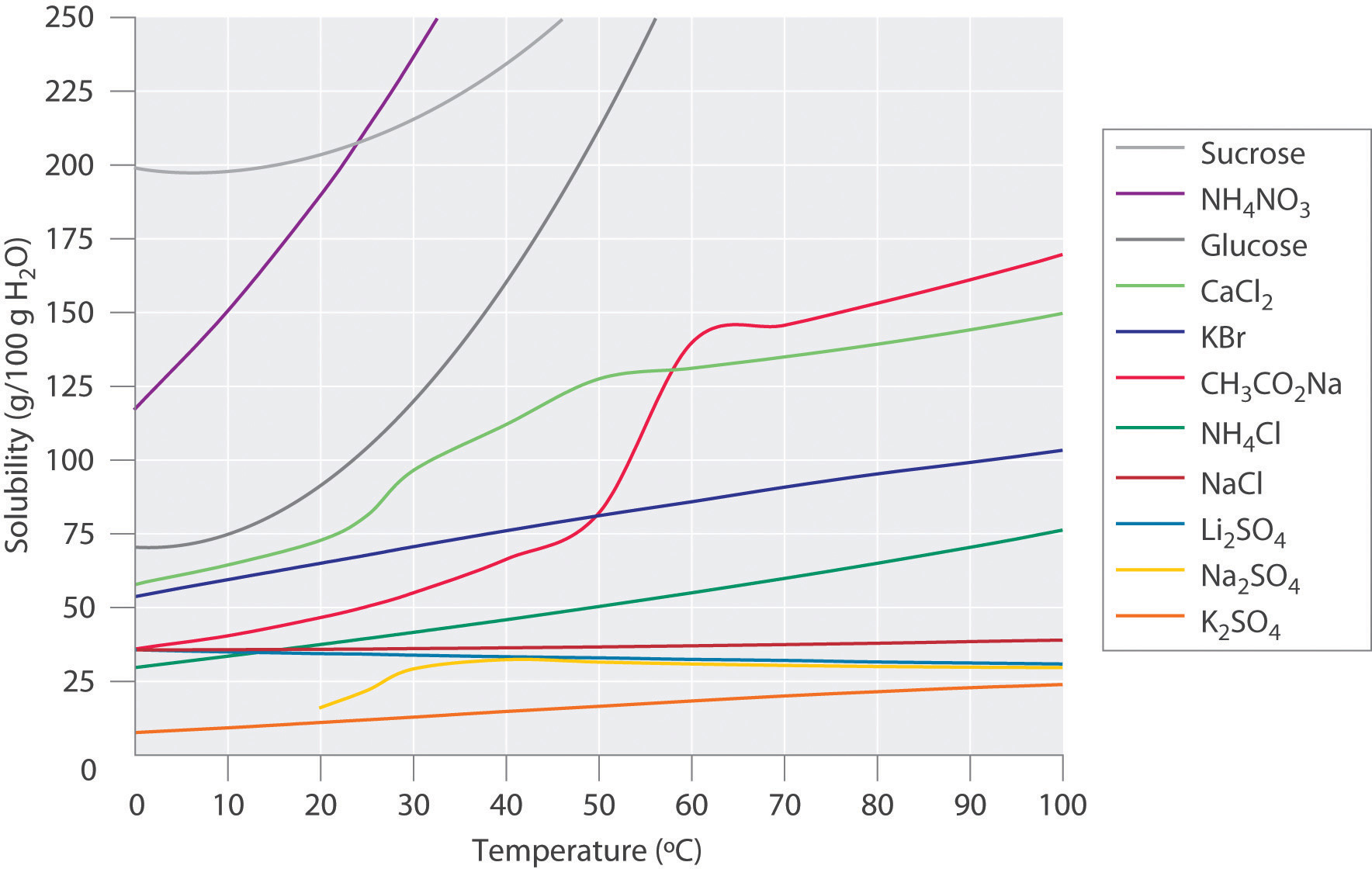
Observe en particular las curvas para\(\ce{NH4NO3}\) y\(\ce{CaCl2}\). La disolución del nitrato amónico en agua es endotérmica (\(ΔH_{soln} = +25.7\; kJ/mol\)), mientras que la disolución del cloruro de calcio es exotérmica (\(ΔH_{soln} = −68.2 \;kJ/mol\)), sin embargo, la Figura\(\PageIndex{1}\) muestra que la solubilidad de ambos compuestos aumenta bruscamente con el aumento de la temperatura. De hecho, las magnitudes de los cambios tanto en la entalpía como en la entropía para la disolución son dependientes de la temperatura. Debido a que la solubilidad de un compuesto está determinada en última instancia por diferencias relativamente pequeñas entre números grandes, generalmente no hay una buena manera de predecir cómo variará la solubilidad con la temperatura.
La variación de la solubilidad con la temperatura se ha medido para una amplia gama de compuestos, y los resultados se publican en muchos libros de referencia estándar. Los químicos suelen ser capaces de utilizar esta información para separar los componentes de una mezcla por cristalización fraccionada, la separación de compuestos en base a sus solubilidades en un disolvente dado. Por ejemplo, si tenemos una mezcla de 150 g de acetato de sodio (\(\ce{CH_3CO_2Na}\)) y 50 g de\(\ce{KBr}\), podemos separar los dos compuestos disolviendo la mezcla en 100 g de agua a 80°C y luego enfriando la solución lentamente a 0°C. De acuerdo con las curvas de temperatura en la Figura\(\PageIndex{1}\), ambos compuestos se disuelven en agua a 80°C, y los 50 g de\(\ce{KBr}\) restos en solución a 0°C, solo unos 36 g de\(\ce{CH3CO2Na}\) son solubles en 100 g de agua a 0°C, sin embargo, por lo que aproximadamente 114 g (150 g − 36 g) de\(\ce{CH_3CO_2Na}\) cristalizan al enfriarse. Los cristales se pueden separar entonces por filtración. Así, la cristalización fraccionada nos permite recuperar aproximadamente 75% del original\(\ce{CH_3CO_2Na}\) en forma esencialmente pura en un solo paso.
La cristalización fraccionada es una técnica común para purificar compuestos tan diversos como los mostrados en la Figura\(\PageIndex{1}\) y desde antibióticos hasta enzimas. Para que la técnica funcione correctamente, el compuesto de interés debe ser más soluble a alta temperatura que a baja temperatura, de manera que bajar la temperatura provoca que se cristalice de la solución. Además, las impurezas deben ser más solubles que el compuesto de interés (como fue\(\ce{KBr}\) en este ejemplo) y preferiblemente estar presentes en cantidades relativamente pequeñas.
Efecto de la Temperatura sobre la Solubilidad de Gases
La solubilidad de los gases en líquidos disminuye con el aumento de la temperatura, como se muestra en la Figura\(\PageIndex{2}\). Las interacciones intermoleculares atractivas en la fase gaseosa son esencialmente cero para la mayoría de las sustancias. Cuando un gas se disuelve, lo hace porque sus moléculas interactúan con moléculas solventes. Debido a que el calor se libera cuando se forman estas nuevas interacciones atractivas, disolver la mayoría de los gases en líquidos es un proceso exotérmico (\(ΔH_{soln} < 0\)). Por el contrario, agregar calor a la solución proporciona energía térmica que supera las fuerzas de atracción entre el gas y las moléculas de disolvente, disminuyendo así la solubilidad del gas. El fenómeno es similar al implicado en el aumento de la presión de vapor de un líquido puro al aumentar la temperatura. En el caso de la presión de vapor, sin embargo, son fuerzas atractivas entre las moléculas de disolvente las que están siendo superadas por la energía térmica añadida cuando se incrementa la temperatura.
La disminución de las solubilidades de los gases a temperaturas más altas tiene implicaciones tanto prácticas como ambientales. Cualquiera que hierva agua de manera rutinaria en una tetera o hervidor eléctrico sabe que un depósito blanco o gris se acumula en el interior y eventualmente debe ser removido. El mismo fenómeno ocurre a una escala mucho mayor en las calderas gigantes utilizadas para suministrar agua caliente o vapor para aplicaciones industriales, donde se llama “escala de caldera”, un depósito que puede disminuir seriamente la capacidad de las tuberías de agua caliente (Figura\(\PageIndex{3}\)). El problema no es únicamente moderno: acueductos que fueron construidos por los romanos hace 2000 años para transportar agua fría de regiones alpinas a regiones más cálidas y secas del sur de Francia estaban obstruidos por depósitos similares. La química detrás de la formación de estos depósitos es moderadamente compleja y se describirá en otra parte, pero la fuerza impulsora es la pérdida\(\ce{CO2}\) de disolución disuelta. El agua dura contiene iones disueltos\(\ce{Ca^{2+}}\) y\(\ce{HCO3^{-}}\) (bicarbonato). El bicarbonato de calcio (\(\ce{Ca(HCO3)2}\)es bastante soluble en agua, pero el carbonato de calcio (\(\ce{CaCO3}\)) es bastante insoluble. Una solución de iones bicarbonato puede reaccionar para formar dióxido de carbono, ion carbonato y agua:
\[\ce{2HCO3^{-}(aq) -> CO3^{2-}(aq) + H2O(l) + CO2(aq)} \label{13.9} \]
El calentamiento de la solución disminuye la solubilidad de\(\ce{CO2}\), la cual escapa a la fase gaseosa por encima de la solución. En presencia de iones de calcio, los iones carbonato precipitan como carbonato de calcio insoluble, el componente principal de la escala de la caldera.


En la contaminación térmica, el agua de lago o río que se utiliza para enfriar un reactor industrial o una central eléctrica se devuelve al ambiente a una temperatura superior a la normal. Debido a la solubilidad reducida de\(\ce{O2}\) a temperaturas más altas (Figura\(\PageIndex{2}\)), el agua más caliente contiene menos oxígeno disuelto que el agua cuando ingresó a la planta. Los peces y otros organismos acuáticos que necesitan oxígeno disuelto para vivir pueden sofocarse literalmente si la concentración de oxígeno de su hábitat es demasiado baja. Debido a que el agua tibia y empobrecida en oxígeno es menos densa, tiende a flotar sobre el agua más fría, más densa y rica en oxígeno del lago o río, formando una barrera que evita que el oxígeno atmosférico se disuelva. Eventualmente, incluso los lagos profundos pueden ser asfixiados si no se corrige el problema. Adicionalmente, la mayoría de los peces y otros organismos acuáticos no mamíferos son de sangre fría, lo que significa que su temperatura corporal es la misma que la temperatura de su ambiente. Las temperaturas sustancialmente mayores que el rango normal pueden provocar estrés severo o incluso la muerte. Los sistemas de enfriamiento para centrales eléctricas y otras instalaciones deben diseñarse para minimizar cualquier efecto adverso en las temperaturas de los cuerpos de agua circundantes.

Un efecto similar se observa en el aumento de las temperaturas de cuerpos de agua como la bahía K0oi89Chesapeake, el estuario más grande de América del Norte, donde se ha implicado como causa el calentamiento\ lobal. Por cada 1.5°C que calienta el agua de la bahía, la capacidad del agua para disolver el oxígeno disminuye en aproximadamente 1.1%. Muchas especies marinas que se encuentran en el límite sur de sus distribuciones han desplazado sus poblaciones más al norte. En 2005, el anguila, que forma un importante hábitat de vivero para peces y mariscos, desapareció de gran parte de la bahía tras las altas temperaturas récord del agua. Presumiblemente, la disminución de los niveles de oxígeno disminuyó las poblaciones de almejas y otros alimentadores de filtro, lo que luego disminuyó la transmisión de luz para permitir que el pasto anguila crezca. Las complejas relaciones en ecosistemas como la Bahía de Chesapeake son especialmente sensibles a las fluctuaciones de temperatura que provocan un deterioro de la calidad del hábitat.
Efecto de la presión sobre la solubilidad de gases: Ley de Henry
La presión externa tiene muy poco efecto sobre la solubilidad de líquidos y sólidos. En contraste, la solubilidad de los gases aumenta a medida que aumenta la presión parcial del gas por encima de una solución. Este punto se ilustra en la Figura\(\PageIndex{4}\), que muestra el efecto del aumento de presión sobre el equilibrio dinámico que se establece entre las moléculas de gas disuelto en solución y las moléculas en la fase gaseosa por encima de la solución. Debido a que la concentración de moléculas en la fase gaseosa aumenta al aumentar la presión, la concentración de moléculas de gas disueltas en la solución en equilibrio también es mayor a presiones más altas.
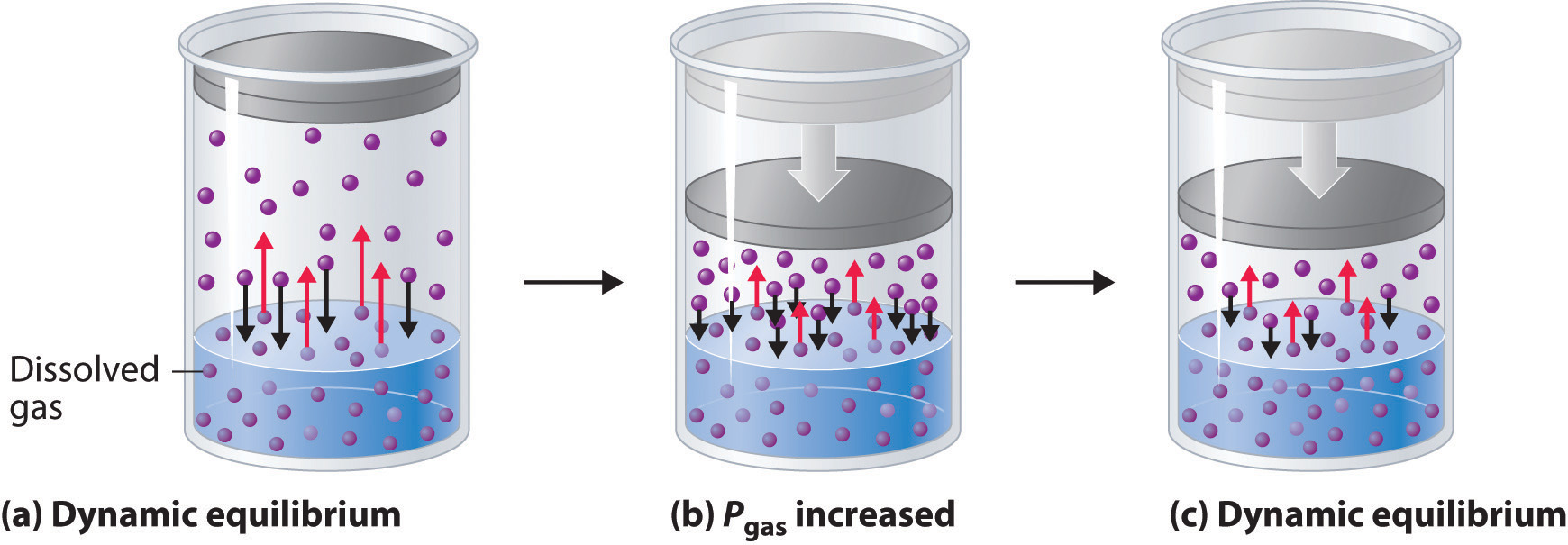
La relación entre la presión y la solubilidad de un gas es descrita cuantitativamente por la ley de Henry, que lleva el nombre de su descubridor, el médico y químico inglés William Henry (1775—1836):
\[C = kP \label{13.3.1} \]
donde
- \(C\)es la concentración de gas disuelto en equilibrio,
- \(P\)es la presión parcial del gas, y
- \(k\)es la constante de la ley de Henry, que debe determinarse experimentalmente para cada combinación de gas, disolvente y temperatura.
Aunque la concentración de gas puede expresarse en cualquier unidad conveniente, utilizaremos la molaridad exclusivamente. Por lo tanto, las unidades de la constante de la ley de Henry son mol/ (l·atm) = m/atm. Los valores de las constantes de la ley de Henry para soluciones de varios gases en agua a 20°C se listan en la Tabla\(\PageIndex{1}\).
Como\(\PageIndex{1}\) demuestran los datos de la Tabla, la concentración de un gas disuelto en agua a una presión dada depende fuertemente de sus propiedades físicas. Para una serie de sustancias relacionadas, las fuerzas de dispersión de Londres aumentan a medida que aumenta la masa molecular. Así, entre los elementos del Grupo 18, las constantes de la ley de Henry aumentan sin problemas de\(\ce{He}\) a\(\ce{Ne}\) a\(\ce{Ar}\).
| Gas | Constante de la Ley de Henry [mol/ (l·atm)] × 10 −4 |
|---|---|
| \(\ce{He}\) | 3.9 |
| \(\ce{Ne}\) | 4.7 |
| \(\ce{Ar}\) | 15 |
| \(\ce{H_2}\) | 8.1 |
| \(\ce{N_2}\) | 7.1 |
| \(\ce{O_2}\) | 14 |
| \(\ce{CO_2}\) | 392 |
El nitrógeno y el oxígeno son los dos gases más prominentes en la atmósfera terrestre y comparten muchas propiedades físicas similares. Sin embargo, como\(\PageIndex{1}\) muestra la Tabla,\(\ce{O2}\) es dos veces más soluble en agua que\(\ce{N2}\). Muchos factores contribuyen a la solubilidad, incluyendo la naturaleza de las fuerzas intermoleculares en juego. Para una discusión detallada, consulte “El misterio de solubilidad en gas de relación O 2/N 2” de Rubin Battino y Paul G. Seybold (J. Chem. Ing. Data 2011, 56, 5036—5044),
Gases que reaccionan químicamente con el agua, como\(\ce{HCl}\) y los otros haluros de hidrógeno,\(\ce{H2S}\), y\(\ce{NH3}\), no obedecen a la ley de Henry; todos estos gases son mucho más solubles de lo que predice la ley de Henry. Por ejemplo,\(\ce{HCl}\) reacciona con agua para dar\(\ce{H^{+}(aq)}\) y\(\ce{Cl^{-}(aq)}\),\(\ce{HCl}\) moléculas no disueltas, y su disociación en iones da como resultado una solubilidad mucho mayor que la esperada para una molécula neutra.
Los gases que reaccionan con el agua no obedecen a la ley de Henry.
La ley de Henry tiene aplicaciones importantes. Por ejemplo, burbujas de\(\ce{CO2}\) forma tan pronto como se abre una bebida carbonatada debido a que la bebida se embotelló bajo una presión mayor\(\ce{CO2}\) a 1 atm. Cuando se abre la botella, la presión\(\ce{CO2}\) por encima de la solución cae rápidamente, y parte del gas disuelto se escapa de la solución en forma de burbujas. La ley de Henry también explica por qué los buceadores tienen que tener cuidado de ascender a la superficie lentamente después de una inmersión si están respirando aire comprimido. A las presiones más altas bajo el agua, más N2 del aire se disuelve en los fluidos internos del buceador. Si el buzo asciende demasiado rápido, el rápido cambio de presión provoca\(\ce{N2}\) que se formen pequeñas burbujas por todo el cuerpo, condición conocida como “las curvas”. Estas burbujas pueden bloquear el flujo de sangre a través de los pequeños vasos sanguíneos, causando un gran dolor e incluso resultando fatales en algunos casos.
Debido a la baja constante de la ley de Henry\(\ce{O2}\) en el agua, los niveles de oxígeno disuelto en el agua son demasiado bajos para apoyar las necesidades energéticas de los organismos multicelulares, incluidos los humanos. Para aumentar la\(\ce{O2}\) concentración en fluidos internos, los organismos sintetizan moléculas portadoras altamente solubles que se unen\(\ce{O2}\) reversiblemente. Por ejemplo, los glóbulos rojos humanos contienen una proteína llamada hemoglobina que se une específicamente\(\ce{O2}\) y facilita su transporte de los pulmones a los tejidos, donde se utiliza para oxidar moléculas de alimentos para proporcionar energía. La concentración de hemoglobina en sangre normal es de aproximadamente 2.2 mM, y cada molécula de hemoglobina puede unirse a cuatro\(\ce{O2}\) moléculas. Si bien la concentración de disuelto\(\ce{O2}\) en suero sanguíneo a 37°C (temperatura corporal normal) es de sólo 0.010 mM, la\(\ce{O2}\) concentración total disuelta es 8.8 mM, casi mil veces mayor de lo que sería posible sin hemoglobina. Se han desarrollado portadores de oxígeno sintéticos a base de alcanos fluorados para su uso como reemplazo de emergencia para la sangre completa. A diferencia de la sangre donada, estos “sustitutos de la sangre” no requieren refrigeración y tienen una larga vida útil. Sus constantes muy altas de la ley de Henry\(\ce{O2}\) dan como resultado concentraciones de oxígeno disuelto comparables a las de la sangre normal.
Un video sobre la ley de Henry. Enlace de video: Ley de Henry (La solubilidad de gases en solventes), YouTube (opens in new window) [youtu.be]
La constante de la ley de Henry para\(\ce{O2}\) en agua a 25°C es\(1.27 \times 10^{-3} M/atm\), y la fracción molar de\(\ce{O2}\) en la atmósfera es 0.21. Calcular la solubilidad\(\ce{O2}\) en agua a 25°C a una presión atmosférica de 1.00 atm.
Dado: Constante de la ley de Henry, fracción molar de\(\ce{O2}\), y presión
Preguntado por: solubilidad
Estrategia:
- Utilice la ley de Dalton de presiones parciales para calcular la presión parcial de oxígeno. (Para más información sobre la ley de Dalton de presiones parciales)
- Utilizar la ley de Henry para calcular la solubilidad, expresada como la concentración de gas disuelto.
Solución:
A Según la ley de Dalton, la presión parcial de\(\ce{O2}\) es proporcional a la fracción molar de\(\ce{O2}\):
\[\begin{align*} P_A &= \chi_A P_t \\[4pt] &= (0.21)(1.00\; atm) \\[4pt] &= 0.21\; atm \end{align*} \nonumber \]
B De la ley de Henry, la concentración de oxígeno disuelto en estas condiciones es
\[\begin{align*} [\ce{CO2}] &= k P_{\ce{O2}} \\[4pt] &=(1.27 \times 10^{-3}\; M/\cancel{atm}) (0.21\; \cancel{atm}) \\[4pt] &=2.7 \times 10^{-4}\; M \end{align*} \nonumber \]
Para entender por qué los refrescos “fizz” y luego ir “plano” después de ser abiertos, calcular la concentración de disuelto\(\ce{CO2}\) en un refresco:
- embotellado bajo una presión de 5.0 atm de\(\ce{CO2}\)
- en equilibrio con la presión parcial normal de\(\ce{CO_2}\) en la atmósfera (aproximadamente\(3 \times 10^{-4} \;atm\)). La constante de la ley de Henry para\(\ce{CO2}\) en agua a 25°C es\(3.4 \times 10^{-2}\; M/atm\).
- Contestar a
-
\(0.17 M\)
- Respuesta b
-
\(1 \times 10^{-5} M\)
Resumen
La solubilidad de la mayoría de las sustancias depende fuertemente de la temperatura y, en el caso de los gases, de la presión. La solubilidad de la mayoría de los solutos sólidos o líquidos aumenta con el aumento de la temperatura. Los componentes de una mezcla a menudo se pueden separar mediante cristalización fraccionada, que separa los compuestos de acuerdo a sus solubilidades. La solubilidad de un gas disminuye con el aumento de la temperatura. La ley de Henry describe la relación entre la presión y la solubilidad de un gas.


