13.5: Propiedades coligativas de las soluciones
- Page ID
- 77938
- Describir la relación entre la concentración de soluto y las propiedades físicas de una solución.
- Comprender que el número total de partículas de soluto no volátil determina la disminución de la presión de vapor, el aumento en el punto de ebullición y la disminución en el punto de congelación de una solución frente al disolvente puro.
Muchas de las propiedades físicas de las soluciones difieren significativamente de las de las sustancias puras discutidas en capítulos anteriores, y estas diferencias tienen importantes consecuencias. Por ejemplo, el rango limitado de temperatura del agua líquida (0°C—100°C) limita severamente su uso. Las soluciones acuosas tienen tanto un punto de congelación más bajo como un punto de ebullición más alto que el agua pura. Probablemente una de las aplicaciones más familiares de este fenómeno es la adición de etilenglicol (“anticongelante”) al agua en un radiador de automóvil. Este soluto baja el punto de congelación del agua, evitando que el motor se agriete en climas muy fríos por la expansión del agua pura al congelarse. El anticongelante también permite que el sistema de enfriamiento funcione a temperaturas superiores a 100°C sin generar suficiente presión para explotar.
Los cambios en el punto de congelación y punto de ebullición de una solución dependen principalmente del número de partículas de soluto presentes en lugar del tipo de partículas. Tales propiedades de las soluciones se llaman propiedades coligativas (del latín colligatus, que significa “unidos” como en una cantidad). Como veremos, la presión de vapor y la presión osmótica de las soluciones también son propiedades coligativas.
Cuando determinamos el número de partículas en una solución, es importante recordar que no todas las soluciones con la misma molaridad contienen la misma concentración de partículas de soluto. Consideremos, por ejemplo, soluciones acuosas 0.01 M de sacarosa,\(\ce{NaCl}\), y\(\ce{CaCl_2}\). Debido a que la sacarosa se disuelve para dar una solución de moléculas neutras, la concentración de partículas de soluto en una solución de sacarosa 0.01 M es 0.01 M. En contraste, ambos\(\ce{NaCl}\) y\(\ce{CaCl_2}\) son compuestos iónicos que se disocian en agua para producir iones solvatados. Como resultado, una solución acuosa 0.01 M de\(\ce{NaCl}\) contiene 0.01 M\(\ce{Na^{+}}\) iones y 0.01 M\(\ce{Cl^{−}}\) iones, para una concentración total de partículas de 0.02 M. De manera similar, la\(\ce{CaCl_2}\) solución contiene 0.01 M\(\ce{Ca^{2+}}\) iones y 0.02 M\(\ce{Cl^{−}}\) iones, para una concentración total de partículas de 0.03 M. Estos son correctos para soluciones diluidas, donde la disociación de los compuestos para formar iones solvatados por separado es completa.
A concentraciones más altas (típicamente >1 M), especialmente con sales de iones pequeños y altamente cargados (como\(\ce{Mg^{2+}}\) o\(\ce{Al^{3+}}\)), o en soluciones con disolventes menos polares, la disociación para dar iones separados a menudo es incompleta. La suma de las concentraciones de las partículas de soluto disueltas dicta las propiedades físicas de una solución. En la siguiente discusión, por lo tanto, debemos tener firmemente en mente la naturaleza química del soluto.
Presión de Vapor de Soluciones y Ley de Raoult
Agregar un soluto no volátil, uno cuya presión de vapor es demasiado baja para medirlo fácilmente, a un solvente volátil disminuye la presión de vapor del solvente. Podemos entender este fenómeno cualitativamente examinando la Figura\(\PageIndex{1}\), que es un diagrama esquemático de la superficie de una solución de glucosa en agua. En una solución acuosa de glucosa, una porción del área superficial está ocupada por moléculas de glucosa no volátiles en lugar de moléculas de agua volátiles. Como resultado, menos moléculas de agua pueden ingresar a la fase de vapor por unidad de tiempo, a pesar de que las moléculas de agua superficial tienen la misma distribución de energía cinética que lo harían en el agua pura. Al mismo tiempo, la velocidad a la que las moléculas de agua en la fase de vapor chocan con la superficie y vuelven a entrar en la solución no se ve afectada. El efecto neto es desplazar el equilibrio dinámico entre el agua en las fases vapor y líquida, disminuyendo la presión de vapor de la solución en comparación con la presión de vapor del disolvente puro.
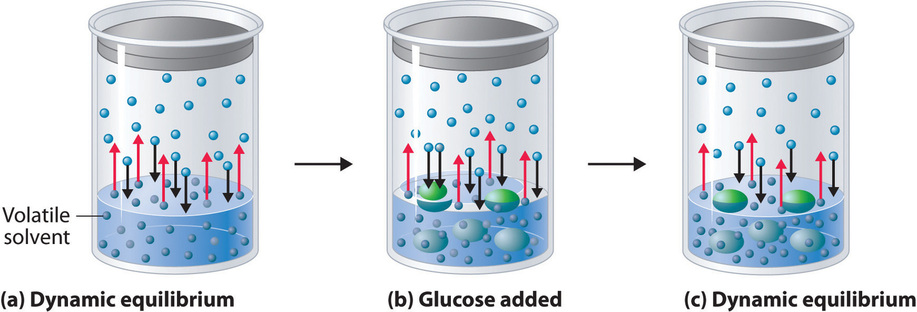
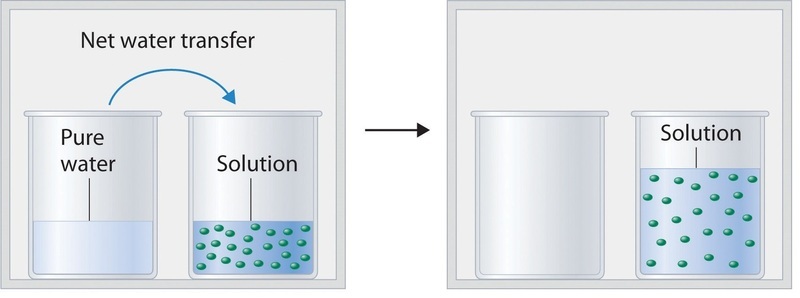
La figura\(\PageIndex{2}\) muestra dos vasos de precipitados, uno que contiene agua pura y otro que contiene una solución acuosa de glucosa, en una cámara sellada. Podemos ver que el sistema tiene dos equilibrios competitivos: el vapor de agua se condensará en ambos vasos a la misma velocidad, pero las moléculas de agua se evaporarán más lentamente de la solución de glucosa porque hay menos moléculas de agua en la superficie. Eventualmente, toda el agua se evaporará del vaso de precipitados que contiene el líquido con la mayor presión de vapor (agua pura) y se condensará en el vaso que contiene el líquido con la presión de vapor más baja (la solución de glucosa). Si el sistema consistiera solo en un vaso de precipitados de agua dentro de un recipiente sellado, el equilibrio entre el líquido y el vapor se lograría con bastante rapidez, y la cantidad de agua líquida en el vaso de precipitados permanecería constante.
Si las partículas de un soluto son esencialmente del mismo tamaño que las del disolvente y tanto el soluto como el disolvente tienen probabilidades aproximadamente iguales de estar en la superficie de la solución, entonces el efecto de un soluto sobre la presión de vapor del disolvente es proporcional al número de sitios ocupados por soluto partículas en la superficie de la solución. Duplicar la concentración de un soluto dado hace que el doble de sitios superficiales sean ocupados por moléculas de soluto, resultando en el doble de la disminución de la presión de vapor. La relación entre la composición de la solución y la presión de vapor es,
\[P_A=\chi_AP^0_A \label{13.5.1} \]
donde\(P_A\) está la presión de vapor del componente A de la solución (en este caso el disolvente),\(\chi_A\) es la fracción molar de\(A\) en solución, y\(P^0_A\) es la presión de vapor de puro\(A\). \(\ref{13.5.1}\)La ecuación se conoce como ley de Raoult, después del químico francés que la desarrolló. Si la solución contiene solo un solo soluto no volátil (B), entonces\(\chi_A + \chi_B = 1\), y podemos sustituirlo\(\chi_A = 1 − \chi_B\) para obtener
\[\begin{align} P_A &=(1−\chi_B)P^0_A \\[4pt] &=P^0_A−\chi_BP^0_A \label{13.5.2} \end{align} \]
Reordenando y definiendo\(ΔP_A=P^0_A−P_A\), obtenemos una relación entre la disminución de la presión de vapor y la fracción molar del soluto no volátil:
\[ \begin{align} P^0_A−P_A &=ΔP_A \\[4pt] &=\chi_BP^0_A \label{13.5.3} \end{align} \]
Podemos resolver problemas de presión de vapor de dos maneras: usando Ecuación\(\ref{13.5.1}\) para calcular la presión de vapor real por encima de una solución de un soluto no volátil, o usando Ecuación\(\ref{13.5.3}\) para calcular la disminución de la presión de vapor causada por una cantidad especificada de un soluto no volátil.
El etilenglicol (\(\ce{HOCH_2CH_2OH}\)), el ingrediente principal en el anticongelante automotriz comercial, aumenta el punto de ebullición del fluido del radiador al disminuir su presión de vapor. A 100°C, la presión de vapor del agua pura es de 760 mmHg. Calcular la presión de vapor de una solución acuosa que contiene 30.2% de etilenglicol en masa, concentración comúnmente utilizada en climas que no se enfrían extremadamente en invierno.
Dado: identidad del soluto, porcentaje en masa y presión de vapor del disolvente puro
Preguntado por: presión de vapor de solución
Estrategia:
- Calcular el número de moles de etilenglicol en una cantidad arbitraria de agua, y luego calcular la fracción molar de agua.
- Utilice la ley de Raoult para calcular la presión de vapor de la solución.
Solución:
A Una solución 30.2% de etilenglicol contiene 302 g de etilenglicol por kilogramo de solución; el resto (698 g) es agua. Para utilizar la ley de Raoult para calcular la presión de vapor de la solución, debemos conocer la fracción molar del agua. Así primero debemos calcular el número de moles tanto de etilenglicol (EG) como de agua presentes:
\[moles \; EG=(302 \;\cancel{g}) \left( \dfrac{1\; mol}{62.07\; \cancel{g}} \right)=4.87\; mol\; EG \nonumber \]
\[moles \; H_2O=(698 \;\cancel{g}) \left( \dfrac{1\; mol}{18.02\; \cancel{g}} \right)=38.7\; mol\; H_2O \nonumber \]
La fracción molar de agua es así
\[\chi_{H_2O}=\dfrac{38.7\; \cancel{mol} \; H_2O}{38.7\; \cancel{mol}\; H_2O +4.87 \cancel{mol}\; EG} =0.888 \nonumber \]
B De la ley de Raoult (Ecuación\(\ref{13.5.1}\)), la presión de vapor de la solución es
\[ \begin{align*} P_{H_2O} &=(\chi_{H2_O})(P^0_{H_2O}) \\[4pt] &=(0.888)(760\; mmHg) =675 \;mmHg \end{align*} \nonumber \]
Alternativamente, podríamos resolver este problema calculando la fracción molar de etilenglicol y luego usando la ecuación\(\ref{13.5.3}\) para calcular la disminución resultante en la presión de vapor:
\[\chi_{EG}=\dfrac{4.87\; mol\; EG}{4.87\; mol\; EG+38.7\; mol\; H_2O}=0.112 \nonumber \]
\[ΔP_{H2_O}=(\chi_{EG})(P^0_{H_2O})=(0.112)(760\; mmHg)=85.1\; mmHg \nonumber \]
\[P_{H_2O}=P^0_{H_2O}−ΔP_{H_2O}=760\; mmHg−85.1\; mmHg=675\; mmHg \nonumber \]
El mismo resultado se obtiene utilizando cualquiera de los dos métodos.
El agua de mar es una solución acuosa de\(\ce{NaCl}\) aproximadamente 3.0% en masa con aproximadamente 0.5% de otras sales en masa. Calcular la disminución en la presión de vapor del agua a 25°C causada por esta concentración de\(\ce{NaCl}\), recordando que 1 mol de\(\ce{NaCl}\) produce 2 mol de partículas de soluto. La presión de vapor del agua pura a 25°C es de 23.8 mmHg.
- Contestar
-
0.45 mmHg. Esto puede parecer una cantidad pequeña, pero constituye una disminución de aproximadamente 2% en la presión de vapor del agua y explica en parte la mayor humedad en el centro-norte de Estados Unidos cerca de los Grandes Lagos, que son lagos de agua dulce. Por lo tanto, la disminución tiene importantes implicaciones para la modelización climática.
Incluso cuando un soluto es volátil, lo que significa que tiene una presión de vapor medible, todavía podemos usar la ley de Raoult. En este caso, calculamos la presión de vapor de cada componente por separado. La presión de vapor total de la solución (\(P_{tot}\)) es la suma de las presiones de vapor de los componentes:
\[P_{tot}=P_A+P_B=\chi_AP^0_A+\chi_BP^0_B \label{13.5.4} \]
Porque\(\chi_B = 1 − \chi_A\) para un sistema de dos componentes,
\[P_{tot}=\chi_AP^0_A+(1−\chi_A)P^0_B \label{13.5.5} \]
Por lo tanto, necesitamos especificar la fracción molar de solo uno de los componentes en un sistema de dos componentes. Consideremos, por ejemplo, la presión de vapor de soluciones de benceno y tolueno de diversas composiciones. A 20°C, las presiones de vapor de benceno puro y tolueno son 74.7 y 22.3 mmHg, respectivamente. La presión de vapor del benceno en una solución benceno—tolueno es
\[P_{C_6H_6}=\chi_{C_6H_6}P^0_{C_6H_6} \label{13.5.6} \]
y la presión de vapor del tolueno en la solución es
\[P{C_6H_5CH_3}=\chi_{C_6H_5CH_3}P^0_{C_6H_5CH3} \label{13.5.7} \]
Ecuaciones\(\ref{13.5.6}\) y ambas\(\ref{13.5.7}\) están en forma de la ecuación para una línea recta:\(y = mx + b\), dónde\(b = 0\). Las gráficas de las presiones de vapor de ambos componentes frente a las fracciones molares son, por lo tanto, líneas rectas que pasan por el origen, como se muestra en la Figura\(\PageIndex{3}\). Además, una gráfica de la presión de vapor total de la solución frente a la fracción molar es una línea recta que representa la suma de las presiones de vapor de los componentes puros. Así, la presión de vapor de la solución es siempre mayor que la presión de vapor de cualquiera de los componentes.
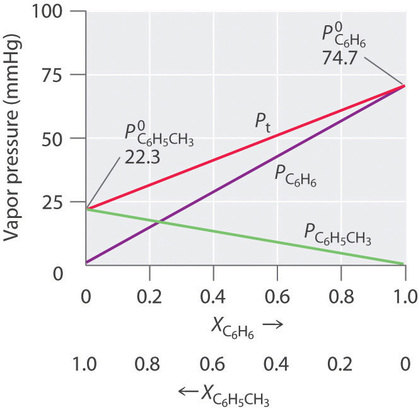
Una solución de dos componentes volátiles que se comporta como la solución de la Figura\(\PageIndex{3}\), la cual se define como una solución que obedece a la ley de Raoult. Como un gas ideal, una solución ideal es un sistema hipotético cuyas propiedades pueden describirse en términos de un modelo simple. Las mezclas de benceno y tolueno se aproximan a una solución ideal porque las fuerzas intermoleculares en los dos líquidos puros son casi idénticas tanto en tipo como en magnitud. En consecuencia, el cambio en la entalpía en la formación de la solución es esencialmente cero (\(ΔH_{soln} ≈ 0\)), que es una de las características definitorias de una solución ideal.
Las soluciones ideales y los gases ideales son modelos simples que ignoran las interacciones intermoleculares.
La mayoría de las soluciones reales, sin embargo, no obedecen precisamente a la ley de Raoult, así como la mayoría de los gases reales no obedecen exactamente a la ley del gas ideal. Las soluciones reales generalmente se desvían de la ley de Raoult porque las interacciones intermoleculares entre los dos componentes A y B difieren. Podemos distinguir entre dos tipos generales de comportamiento, dependiendo de si las interacciones intermoleculares entre las moléculas A y B son más fuertes o más débiles que las interacciones A—A y B-B en los componentes puros. Si las interacciones A—B son más fuertes que las interacciones A-A y B-B, cada componente de la solución presenta una presión de vapor más baja de la esperada para una solución ideal, al igual que la solución en su conjunto. Las interacciones favorables A-B estabilizan eficazmente la solución en comparación con el vapor. Este tipo de comportamiento se llama una desviación negativa de la ley de Raoult. Los sistemas estabilizados por enlaces de hidrógeno entre dos moléculas, como la acetona y el etanol, exhiben desviaciones negativas de la ley de Raoult. Por el contrario, si las interacciones A-B son más débiles que las interacciones A-A y B-B, pero el aumento de entropía es suficiente para permitir que se forme la solución, tanto A como B tienen una mayor tendencia a escapar de la solución a la fase de vapor. El resultado es una presión de vapor mayor a la esperada para una solución ideal, produciendo una desviación positiva de la ley de Raoult. En una solución de\(\ce{CCl_4}\) metanol, por ejemplo, las\(\ce{CCl_4}\) moléculas no polares interrumpen la extensa red de enlaces de hidrógeno en metanol, y las moléculas de metanol más ligeras tienen fuerzas de dispersión de Londres más débiles que las\(\ce{CCl_4}\) moléculas más pesadas. En consecuencia, las soluciones\(\ce{CCl_4}\) y el metanol presentan desviaciones positivas de la ley de Raoult.
Para cada sistema, compare las interacciones intermoleculares en los líquidos puros y en la solución para decidir si la presión de vapor será mayor que la predicha por la ley de Raoult (desviación positiva), aproximadamente igual a la predicha por la ley de Raoult (una solución ideal), o menor que la presión predicho por la ley de Raoult (desviación negativa).
- ciclohexano y etanol
- metanol y acetona
- n-hexano e isooctano (2,2,4-trimetilpentano)
Dado: identidad de líquidos puros
Preguntado por: desviación prevista de la ley de Raoult (Ecuación\ ref {13.5.1})
Estrategia:
Identificar si cada líquido es polar o no polar, y luego predecir el tipo de interacciones intermoleculares que ocurren en solución.
Solución:
- El etanol líquido contiene una extensa red de enlaces de hidrógeno y el ciclohexano es no polar. Debido a que las moléculas de ciclohexano no pueden interactuar favorablemente con las moléculas polares de etanol, perturbarán el enlace de hidrógeno. Por lo tanto, las interacciones A—B serán más débiles que las interacciones A—A y B-B, lo que conducirá a una presión de vapor más alta que la predicha por la ley de Raoult (una desviación positiva).
- El metanol contiene una extensa red de enlaces de hidrógeno, pero en este caso las moléculas polares de acetona crean interacciones A—B que son más fuertes que las interacciones A—A o B-B, lo que lleva a una entalpía negativa de la solución y una presión de vapor más baja que la predicha por la ley de Raoult (una desviación negativa).
- El hexano y el isooctano son moléculas no polares (el isooctano en realidad tiene un momento dipolar muy pequeño, pero es tan pequeño que se puede ignorar). De ahí que las fuerzas intermoleculares predominantes en ambos líquidos sean las fuerzas de dispersión de Londres. Esperamos que las interacciones A—B sean comparables en fuerza a las interacciones A—A y B—B, lo que lleva a una presión de vapor en buena concordancia con la predicha por la ley de Raoult (una solución ideal).
Para cada sistema, compare las interacciones intermoleculares en los líquidos puros con los de la solución para decidir si la presión de vapor será mayor que la predicha por la ley de Raoult (desviación positiva), aproximadamente igual a la predicha por la ley de Raoult (una solución ideal), o menor que la presión predicha por la ley de Raoult (desviación negativa):
- benceno y n-hexano
- etilenglicol y\(\ce{CCl_4}\)
- ácido acético y n-propanol
- Contestar a
-
aproximadamente igual
- Respuesta b
-
desviación positiva (presión de vapor mayor a la predicha)
- Respuesta c
-
desviación negativa (presión de vapor inferior a la predicha)
Un video discutiendo la ley de Roult. Video Link: Introducción a la presión de vapor de una solución (Ley de Raoult), YouTube (opens in new window) [youtu.be]
Un Video Discutiendo Cómo encontrar la Presión de Vapor de una Solución. Enlace de video: Encontrar la presión de vapor de una solución (soluto no iónico-no volátil), YouTube (opens in new window) [youtu.be]
Elevación del punto de ebullición
Recordemos que el punto de ebullición normal de una sustancia es la temperatura a la que la presión de vapor es igual a 1 atm. Si un soluto no volátil disminuye la presión de vapor de un disolvente, también debe afectar el punto de ebullición. Debido a que la presión de vapor de la solución a una temperatura dada es menor que la presión de vapor del disolvente puro, lograr una presión de vapor de 1 atm para la solución requiere una temperatura mayor que el punto de ebullición normal del disolvente. Así, el punto de ebullición de una solución es siempre mayor que el del disolvente puro. Podemos ver por qué esto debe ser cierto comparando el diagrama de fases para una solución acuosa con el diagrama de fases para agua pura (Figura\(\PageIndex{4}\)). La presión de vapor de la solución es menor que la del agua pura a todas las temperaturas. En consecuencia, la curva líquido-vapor para la solución cruza la línea horizontal correspondiente a P = 1 atm a una temperatura mayor que la curva para el agua pura.
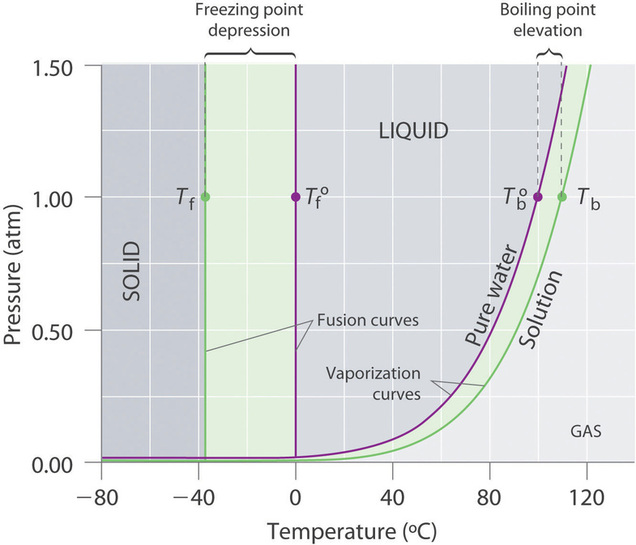
Figura\(\PageIndex{4}\): Diagramas de fases de agua pura y una solución acuosa de un soluto no volátil. La curva de vaporización para la solución se encuentra por debajo de la curva para el agua pura a todas las temperaturas, lo que resulta en un aumento en el punto de ebullición y una disminución en el punto de congelación de la solución.
El punto de ebullición de una solución con un soluto no volátil es siempre mayor que el punto de ebullición del disolvente puro.
La magnitud del incremento en el punto de ebullición está relacionada con la magnitud de la disminución en la presión de vapor. Como acabamos de discutir, la disminución en la presión de vapor es proporcional a la concentración del soluto en la solución. De ahí que la magnitud del incremento en el punto de ebullición también debe ser proporcional a la concentración del soluto (Figura\(\PageIndex{5}\)).
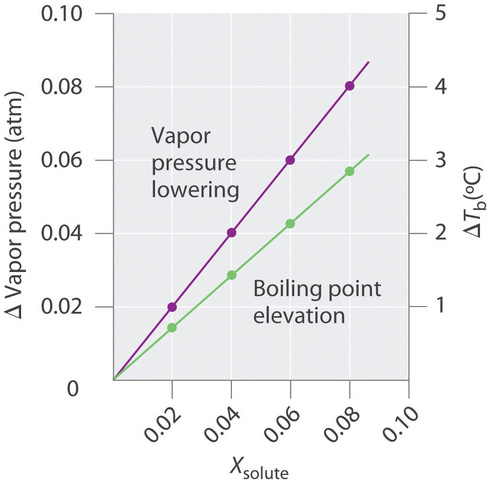
Podemos definir la elevación del punto de ebullición (\(ΔT_b\)) como la diferencia entre los puntos de ebullición de la solución y el disolvente puro:
\[ΔT_b=T_b−T^0_b \label{13.5.8} \]
donde\(T_b\) está el punto de ebullición de la solución y\(T^0_b\) es el punto de ebullición del disolvente puro. Podemos expresar la relación entre\(ΔT_b\) y concentración de la siguiente manera
\[ΔT_b = mK_b \label{13.5.9} \]
donde m es la concentración del soluto expresada en molalidad, y\(K_b\) es la constante de elevación del punto de ebullición de molal del disolvente, que tiene unidades de °C/m. La tabla\(\PageIndex{1}\) enumera\(K_b\) valores característicos para varios solventes de uso común. Para soluciones relativamente diluidas, la magnitud de ambas propiedades es proporcional a la concentración de soluto.
| Solvente | Punto de ebullición (°C) | K b (°C/m) | Punto de congelación (°C) | K f (°C/m) |
|---|---|---|---|---|
| ácido acético | 117.90 | 3.22 | 16.64 | 3.63 |
| benceno | 80.09 | 2.64 | 5.49 | 5.07 |
| d- (+) -alcanfor | 207.4 | 4.91 | 178.8 | 37.8 |
| disulfuro de carbono | 46.2 | 2.42 | −112.1 | 3.74 |
| tetracloruro de carbono | 76.8 | 5.26 | −22.62 | 31.4 |
| cloroformo | 61.17 | 3.80 | −63.41 | 4.60 |
| nitrobenceno | 210.8 | 5.24 | 5.70 | 6.87 |
| agua | 100.00 | 0.51 | 0.00 | 1.86 |
La concentración del soluto se expresa típicamente como molalidad en lugar de fracción molar o molaridad por dos razones. Primero, debido a que la densidad de una solución cambia con la temperatura, el valor de la molaridad también varía con la temperatura. Si el punto de ebullición depende de la concentración de soluto, entonces por definición el sistema no se mantiene a una temperatura constante. Segundo, la molalidad y la fracción molar son proporcionales para soluciones relativamente diluidas, pero la molalidad tiene un valor numérico mayor (una fracción molar puede estar solo entre cero y uno). El uso de la molalidad nos permite eliminar ceros no significativos.
De acuerdo con la Tabla\(\PageIndex{1}\), la constante de elevación del punto de ebullición del molal para el agua es de 0.50 °C/m. Así, una solución acuosa de 1.00 m de un soluto molecular no volátil como glucosa o sacarosa tendrá un incremento en el punto de ebullición de 0.51°C, para dar un punto de ebullición de 100.51°C a 1.00 atm. El incremento en el punto de ebullición de una\(\ce{NaCl}\) solución acuosa de 1.00 m será aproximadamente el doble que el de la solución de glucosa o sacarosa debido a que 1 mol de\(\ce{NaCl}\) produce 2 moles de iones disueltos. De ahí que una\(\ce{NaCl}\) solución de 1.00 m tendrá un punto de ebullición de aproximadamente 101.02°C.
En Ejemplo\(\PageIndex{1}\), calculamos que la presión de vapor de una solución acuosa 30.2% de etilenglicol a 100°C es 85.1 mmHg menor que la presión de vapor del agua pura. Declaramos (sin ofrecer pruebas) que esto debería resultar en un punto de ebullición más alto para la solución en comparación con el agua pura. Ahora que hemos visto por qué esta afirmación es correcta, calcular el punto de ebullición de la solución acuosa de etilenglicol.
Dado: composición de la solución
Preguntado por: punto de ebullición
Estrategia:
Calcular la molalidad del etilenglicol en la solución de 30.2%. Después usa Ecuación\(\ref{13.5.9}\) para calcular el aumento en el punto de ebullición.
Solución:
De Ejemplo\(\PageIndex{1}\), sabemos que una solución 30.2% de etilenglicol en agua contiene 302 g de etilenglicol (4.87 mol) por 698 g de agua. La molalidad de la solución es así
\[\text{molality of ethylene glycol}= \left(\dfrac{4.87 \;mol}{698 \; \cancel{g} \;H_2O} \right) \left(\dfrac{1000\; \cancel{g}}{1 \;kg} \right)=6.98\, m \nonumber \]
De la ecuación\(\ref{13.5.9}\), el aumento en el punto de ebullición es por lo tanto
\[ΔT_b=m K_b=(6.98 \cancel{m})(0.51°C/\cancel{m})=3.6°C \nonumber \]
Se predice así que el punto de ebullición de la solución sea 104°C. Con una concentración de soluto de casi 7 m, sin embargo, la suposición de una solución diluida utilizada para obtener la Ecuación\(\ref{13.5.9}\) puede no ser válida.
Supongamos que\(\ce{NaCl}\) se agrega una cucharada (5.00 g) de a 2.00 L de agua a 20.0°C, que luego se lleva a ebullición para cocer los espaguetis. ¿A qué temperatura hervirá el agua?
- Contestar
-
100.04°C, o 100°C a tres cifras significativas. (Recordemos que 1 mol de\(\ce{NaCl}\) produce 2 mol de partículas disueltas. El pequeño aumento de temperatura significa que agregar sal al agua utilizada para cocinar la pasta esencialmente no tiene ningún efecto sobre el tiempo de cocción).
Un video sobre la elevación del punto de ebullición y la depresión del punto de congelación. Enlace de video: Elevación del punto de ebullición y depresión del punto de congelación, YouTube (opens in new window) [youtu.be] (opens in new window)
Depresión del punto de congelación
El diagrama de fases de la Figura\(\PageIndex{4}\) muestra que la disolución de un soluto no volátil en agua no sólo eleva el punto de ebullición del agua sino que también disminuye su punto de congelación. La curva sólido-líquido para la solución cruza la línea correspondiente a una\(P = 1\,atm\) temperatura menor que la curva para el agua pura.
Podemos entender este resultado imaginando que tenemos una muestra de agua a la temperatura normal del punto de congelación, donde existe un equilibrio dinámico entre sólido y líquido. Las moléculas de agua chocan continuamente con la superficie del hielo y entran en la fase sólida al mismo ritmo que las moléculas de agua están saliendo de la superficie del hielo y entrando en la fase líquida. Si disolvemos un soluto no volátil como la glucosa en el líquido, las moléculas de glucosa disueltas reducirán el número de colisiones por unidad de tiempo entre las moléculas de agua y la superficie del hielo porque algunas de las moléculas que chocan con el hielo serán glucosa. La glucosa, sin embargo, tiene una estructura muy diferente a la del agua, y no puede caber en la red de hielo. En consecuencia, la presencia de moléculas de glucosa en la solución solo puede disminuir la velocidad a la que las moléculas de agua en el líquido colisionan con la superficie del hielo y solidifican. En tanto, la velocidad a la que las moléculas de agua salen de la superficie del hielo y entran en la fase líquida no cambia. El efecto neto es hacer que el hielo se derrita. La única manera de restablecer un equilibrio dinámico entre el agua sólida y líquida es bajar la temperatura del sistema, lo que disminuye la velocidad a la que las moléculas de agua abandonan la superficie de los cristales de hielo hasta que sea igual a la velocidad a la que las moléculas de agua en la solución chocan con el hielo.
Por analogía con nuestro tratamiento de la elevación del punto de ebullición, la depresión del punto de congelación (\(ΔT_f\)) se define como la diferencia entre el punto de congelación del disolvente puro y el punto de congelación de la solución:
\[ ΔT_f=T^0_f−T_f \label{13.5.10} \]
donde\(T^0_f\) está el punto de congelación del solvente puro y\(T_f\) es el punto de congelación de la solución.
El orden de los términos se invierte en comparación con la Ecuación\(\ref{13.5.8}\) para expresar la depresión del punto de congelación como un número positivo. La relación entre\(ΔT_f\) y la concentración de soluto viene dada por una ecuación análoga a la ecuación\(\ref{13.5.9}\):
\[ΔT_f = mK_f \label{13.5.11} \]
donde\(m\) está la molalidad de la solución y\(K_f\) es la constante de depresión del punto de congelación del molal para el disolvente (en unidades de °C/m).
Al igual que\(K_b\), cada disolvente tiene un valor característico de\(K_f\) (ver Tabla\(\PageIndex{1}\)). La depresión del punto de congelación depende del número total de partículas disueltas de soluto no volátil, al igual que con la elevación del punto de ebullición. Así, una\(\ce{NaCl}\) solución acuosa tiene una depresión del punto de congelación dos veces más grande que una solución de glucosa de la misma molalidad.
Las personas que viven en climas fríos utilizan la depresión del punto de congelación en su beneficio de muchas maneras. Por ejemplo, la sal se usa para derretir hielo y nieve en carreteras y aceras, se agrega etilenglicol al agua refrigerante del motor para evitar que se destruya un motor de automóvil, y se agrega metanol al líquido del lavaparabrisas para evitar que el líquido se congele.
La disminución de la presión de vapor, el aumento en el punto de ebullición y la disminución en el punto de congelación de una solución frente a un líquido puro dependen del número total de partículas de soluto no volátiles disueltas.
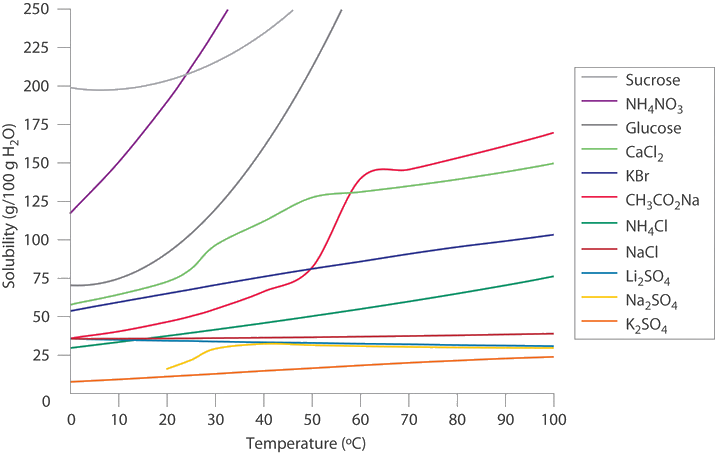
En regiones más frías de Estados Unidos,\(\ce{NaCl}\) o a menudo\(\ce{CaCl_2}\) se rocía en carreteras heladas en invierno para derretir el hielo y hacer que la conducción sea más segura. Utilice los datos de la Figura a continuación para estimar las concentraciones de dos soluciones saturadas a 0°C, una de\(\ce{NaCl}\) y una de\(\ce{CaCl_2}\), y calcular los puntos de congelación de ambas soluciones para ver qué sal es probable que sea más efectiva en el derretimiento del hielo.
Dado: solubilidades de dos compuestos
Preguntado por: concentraciones y puntos de congelación
Estrategia:
- Estimar la solubilidad de cada sal en 100 g de agua a partir de la figura. Determinar el número de moles de cada uno en 100 g y calcular las molalidades.
- Determinar las concentraciones de las sales disueltas en las soluciones. Sustituir estos valores en Ecuación\(\ref{13.5.11}\) para calcular las depresiones del punto de congelación de las soluciones.
Solución:
A A partir de la Figura anterior, podemos estimar las solubilidades de\(\ce{NaCl}\) y\(\ce{CaCl_2}\) ser de aproximadamente 36 g y 60 g, respectivamente, por cada 100 g de agua a 0 °C; las concentraciones correspondientes en molalidad son
\[m_{NaCl}=\left(\dfrac{36 \; \cancel{g \;NaCl}}{100 \;\cancel{g} \;H_2O}\right)\left(\dfrac{1\; mol\; NaCl}{58.44\; \cancel{ g\; NaCl}}\right)\left(\dfrac{1000\; \cancel{g}}{1\; kg}\right)=6.2\; m \nonumber \]
\[m_{CaCl_2}=\left(\dfrac{60\; \cancel{g\; CaCl_2}}{100\;\cancel{g}\; H_2O}\right)\left(\dfrac{1\; mol\; CaCl_2}{110.98\; \cancel{g\; CaCl_2}}\right)\left(\dfrac{1000 \;\cancel{g}}{1 kg}\right)=5.4\; m \nonumber \]
La menor masa de fórmula de\(\ce{NaCl}\) más que compensa su menor solubilidad, resultando en una solución saturada que tiene una concentración ligeramente mayor que\(CaCl_2\).
B Debido a que estas sales son compuestos iónicos que se disocian en agua para producir dos y tres iones por unidad de fórmula\(\ce{NaCl}\) y\(CaCl_2\), respectivamente, las concentraciones reales de las especies disueltas en las dos soluciones saturadas son 2 × 6.2 m = 12 m para\(\ce{NaCl}\) y 3 × 5.4 m = 16 m para\(CaCl_2\). Las depresiones resultantes del punto de congelación se pueden calcular usando la ecuación\(\ref{13.5.11}\):
\[\ce{NaCl}: ΔT_f=mK_f=(12\; \cancel{m})(1.86°C/\cancel{m})=22°C \nonumber \]
\[\ce{CaCl2}: ΔT_f=mK_f=(16\;\cancel{m})(1.86°C/\cancel{m})=30°C \nonumber \]
Debido a que el punto de congelación del agua pura es 0°C, los puntos de congelación reales de las soluciones son −22°C y −30°C, respectivamente. Tenga en cuenta que\(CaCl_2\) es sustancialmente más efectivo para bajar el punto de congelación del agua porque sus soluciones contienen tres iones por unidad de fórmula. De hecho,\(CaCl_2\) es la sal que se suele vender para uso doméstico, y también se suele utilizar en autopistas.
Debido a que las solubilidades de ambas sales disminuyen con la disminución de la temperatura, el punto de congelación puede reducirse solo en una cierta cantidad, independientemente de la cantidad de sal que se esparza en una carretera helada. Si la temperatura está significativamente por debajo de la temperatura mínima a la que una de estas sales provocará que el hielo se derrita (digamos -35°C), no tiene sentido usar sal hasta que se caliente
Calcular el punto de congelación de la solución 30.2% de etilenglicol en agua cuya presión de vapor y punto de ebullición calculamos en los Ejemplos\(\PageIndex{5}\) y\(\PageIndex{5}\).
- Contestar
-
−13.0°C
Disponer estas soluciones acuosas en orden decreciente de puntos de congelación: 0.1 m\(KCl\), 0.1 m de glucosa, 0.1 m de SrCl2, 0.1 m de etilenglicol, 0.1 m de ácido benzoico y 0.1 m de HCl.
Dado: molalidades de seis soluciones
Preguntado por: puntos de congelación relativos
Estrategia:
- Identifique cada soluto como un electrolito fuerte, débil o no, y use esta información para determinar el número de partículas de soluto producidas.
- Multiplique este número por la concentración de la solución para obtener la concentración efectiva de partículas de soluto. La solución con la mayor concentración efectiva de partículas de soluto tiene la mayor depresión del punto de congelación.
Solución:
A Debido a que las concentraciones molales de las seis soluciones son las mismas, debemos enfocarnos en cuáles de las sustancias son electrolitos fuertes, que son electrolitos débiles, y cuáles son no electrolitos para determinar el número real de partículas en solución. \(\ce{KCl}\)\(\ce{SrCl_2}\), y\(\ce{HCl}\) son electrolitos fuertes que producen dos, tres y dos iones por unidad de fórmula, respectivamente. El ácido benzoico es un electrolito débil (aproximadamente una partícula por molécula), y la glucosa y el etilenglicol no son electrolitos (una partícula por molécula).
B Las molalidades de las soluciones en términos de las partículas totales de soluto son:\(\ce{KCl}\) y\(\ce{HCl}\), 0.2 m;\(SrCl_2\), 0.3 m; glucosa y etilenglicol, 0.1 m; y ácido benzoico, 0.1—0.2 m. Debido a que la magnitud de la disminución en el punto de congelación es proporcional a la concentración de partículas disueltas, el orden de los puntos de congelación de las soluciones es: glucosa y etilenglicol (punto de congelación más alto, menor depresión del punto de congelación) > ácido benzoico >\(\ce{HCl}\) =\(\ce{KCl}\) >\(\ce{SrCl_2}\).
Disponer estas soluciones acuosas en orden de aumentar los puntos de congelación: 0.2 m\(\ce{NaCl}\), 0.3 m de ácido acético, 0.1 m\(\ce{CaCl_2}\) y 0.2 m de sacarosa.
- Contestar
-
0.2 m\(\ce{NaCl}\) (punto de congelación más bajo) < 0.3 m ácido acético ≈ 0.1 m\(\ce{CaCl_2}\) < 0.2 m sacarosa (punto de congelación más alto)
También se pueden usar propiedades coligativas para determinar la masa molar de un compuesto desconocido. Un método que se puede llevar a cabo en el laboratorio con un equipo mínimo es medir el punto de congelación de una solución con una masa conocida de soluto. Este método es preciso para soluciones diluidas (≤ 1% en masa) porque los cambios en el punto de congelación suelen ser lo suficientemente grandes como para medir con precisión y precisión. Al comparar\(K_b\) y\(K_f\) valores en la Tabla\(\PageIndex{1}\), vemos que los cambios en el punto de ebullición son menores que los cambios en el punto de congelación para un disolvente dado. Las elevaciones del punto de ebullición son por lo tanto más difíciles de medir con precisión. Por esta razón, la depresión del punto de congelación se usa más comúnmente para determinar la masa molar que la elevación del punto de ebullición. Debido a su muy grande valor de\(K_f\) (37.8°C/m), a menudo se utiliza d- (+\(\PageIndex{1}\)) -alcanfor (Tabla) para determinar la masa molar de compuestos orgánicos por este método.
Una muestra de 7.08 g de azufre elemental se disuelve en 75.0 g de\(CS_2\) para crear una solución cuyo punto de congelación es −113.5°C. Usa estos datos para calcular la masa molar del azufre elemental y así la fórmula de las\(\ce{S_n}\) moléculas disueltas (es decir, ¿cuál es el valor de\(n\)?).
Dado: masas de soluto y disolvente y punto de congelación
Preguntado por: masa molar y número de\(\ce{S}\) átomos por molécula
Estrategia:
- Utilice la Ecuación\(\ref{13.5.10}\), el punto de congelación medido de la solución, y el punto de congelación\(CS_2\) de la Tabla\(\PageIndex{1}\) para calcular la depresión del punto de congelación. Después usa Ecuación\(\ref{13.5.11}\) y el valor\(K_f\) de de Tabla\(\PageIndex{1}\) para calcular la molalidad de la solución.
- A partir de la molalidad calculada, determinar el número de moles de soluto presentes.
- Utilizar la masa y el número de moles del soluto para calcular la masa molar de azufre en solución. Dividir el resultado por la masa molar de azufre atómico para obtener\(n\), el número de átomos de azufre por mol de azufre disuelto.
Solución:
A El primer paso es calcular la depresión del punto de congelación usando la ecuación\(\ref{13.5.10}\):
\[ΔT_f=T^0_f−T_f=−112.1°C−(−113.5°C)=1.4°C \nonumber \]
Entonces la ecuación\(\ref{13.5.11}\) da
B El número total de moles de soluto presentes en la solución es
\[\text{moles solute}=\left(\dfrac{0.37 mol}{\cancel{kg}}\right) (75.0\; g) \left(\dfrac{1 kg}{1000\; g}\right)=0.028 \;mol \nonumber \]
C Ahora sabemos que 0.708 g de azufre elemental corresponde a 0.028 mol de soluto. La masa molar de azufre disuelto es así
\[\text{molar mass}=\dfrac{7.08\; g}{0.028\; mol}=260\; g/mol \nonumber \]
La masa molar de azufre atómico es de 32 g/mol, por lo que debe haber 260/32 = 8.1 átomos de azufre por mol, correspondiente a una fórmula de\(\ce{S_8}\).
Uno de los subproductos formados durante la síntesis de\(C_{60}\) es un sólido rojo intenso que contiene solo carbono. Una solución de 205 mg de este compuesto en 10.0 g de\(CCl_4\) tiene un punto de congelación de −23.38°C. ¿Cuáles son la masa molar y la fórmula más probable de la sustancia?
- Contestar
-
847 g/mol;\(\ce{C_{70}}\)
Un Video Discutiendo cómo encontrar el Peso Molecular de un Desconocido usando Propiedades Colligativas. Enlace de video: Encontrar el peso molecular de un desconocido usando propiedades coligativas, YouTube (opens in new window) [youtu.be]
Presión osmótica
La presión osmótica es una propiedad coligativa de las soluciones que se observa usando una membrana semipermeable, una barrera con poros lo suficientemente pequeños como para permitir el paso de moléculas de disolvente pero no moléculas de soluto o iones. El flujo neto de disolvente a través de una membrana semipermeable se llama ósmosis (del griego osmós, que significa “empujar”). La dirección del flujo neto de disolvente es siempre del lado con la menor concentración de soluto al lado con la concentración más alta.
La ósmosis se puede demostrar usando un tubo en U como el que se muestra en la Figura\(\PageIndex{6}\), que contiene agua pura en el brazo izquierdo y una solución acuosa diluida de glucosa en el brazo derecho. Se produce un flujo neto de agua a través de la membrana hasta que los niveles en los brazos finalmente dejan de cambiar, lo que indica que se ha alcanzado el equilibrio. La presión osmótica (\(\Pi\)) de la solución de glucosa es la diferencia en la presión entre los dos lados, en este caso las alturas de las dos columnas. Aunque la membrana semipermeable permite que las moléculas de agua fluyan en cualquier dirección, la velocidad de flujo no es la misma en ambas direcciones porque la concentración de agua no es la misma en los dos brazos. El flujo neto de agua a través de la membrana se puede prevenir aplicando una presión en el brazo derecho que es igual a la presión osmótica de la solución de glucosa.
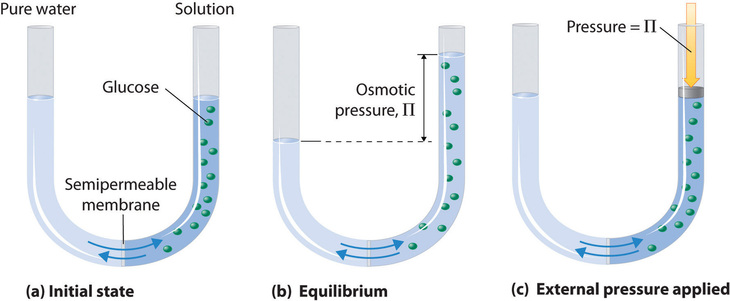
Al igual que con cualquier otra propiedad coligativa, la presión osmótica de una solución depende de la concentración de partículas de soluto disuelto. La presión osmótica obedece a una ley que se asemeja a la ecuación ideal del gas:
\[\Pi=\dfrac{nRT}{V}=MRT \label{13.5.12} \]
donde\(M\) es el número de moles de soluto por unidad de volumen de solución (es decir, la molaridad de la solución),\(R\) es la constante de gas ideal, y\(T\) es la temperatura absoluta.
Como se muestra en Ejemplo\(\PageIndex{7}\), las presiones osmóticas tienden a ser bastante altas, incluso para soluciones bastante diluidas.
Cuando se colocan en una solución salina concentrada, ciertas levaduras son capaces de producir altas concentraciones internas de glicerol para contrarrestar la presión osmótica del medio circundante. Supongamos que las células de levadura se colocan en una solución acuosa que contiene 4.0%\(\ce{NaCl}\) en masa; la densidad de la solución es de 1.02 g/mL a 25°C.
- Calcular la presión osmótica de una\(\ce{NaCl}\) solución acuosa al 4.0% a 25°C.
- Si la presión osmótica normal dentro de una célula de levadura es de 7.3 atm, correspondiente a una concentración total de partículas disueltas de 0.30 M, ¿qué concentración de glicerol deben sintetizar las células para equilibrar exactamente la presión osmótica externa a 25°C?
Dado: concentración, densidad y temperatura de la\(\ce{NaCl}\) solución; presión osmótica interna de la célula
Preguntado por: presión osmótica de\(\ce{NaCl}\) solución y concentración de glicerol necesaria
Estrategia:
- Calcular la molaridad de la\(\ce{NaCl}\) solución usando la masa de fórmula del soluto y la densidad de la solución. Después calcular la concentración total de partículas disueltas.
- Utilice la Ecuación\ ref {13.5.12} para calcular la presión osmótica de la solución.
- Restar la presión osmótica normal de las células de la presión osmótica de la solución salina para obtener la presión adicional necesaria para equilibrar las dos. Utilice la Ecuación\ ref {13.5.12} para calcular la molaridad del glicerol necesaria para crear esta presión osmótica.
Solución:
A La solución contiene 4.0 g de\(\ce{NaCl}\) por 100 g de solución. Usando la fórmula masa de\(\ce{NaCl}\) (58.44 g/mol) y la densidad de la solución (1.02 g/mL), podemos calcular la molaridad:
\[ \begin{align*} M_{NaCl} &=\dfrac{moles\; NaCl}{\text{liter solution}} \\[4pt] &=\left(\dfrac{4.0 \; \cancel{g} \;NaCl}{58.44\; \cancel{g}/mol\; NaCl}\right)\left(\dfrac{1}{100\; \cancel{g \;solution}}\right)\left(\dfrac{1.02\; \cancel{g\; solution}}{1.00\; \cancel{mL}\; solution}\right)\left(\dfrac{1000\; \cancel{mL}}{1\; L}\right) \\[4pt] &= 0.70\; M\; \ce{NaCl} \end{align*} \nonumber \]
Debido a que 1 mol de\(\ce{NaCl}\) produce 2 mol de partículas en solución, la concentración total de partículas disueltas en la solución es (2) (0.70 M) = 1.4 M.
B Ahora podemos usar la Ecuación\ ref {13.5.12} para calcular la presión osmótica de la solución:
\[ \begin{align*} \Pi &=MRT \\[4pt] &=(1.4 \;mol/L)\left[ 0.0821\; (L⋅atm)/(K⋅mol) \right ] (298\; K)\\[4pt] &=34 \;atm\end{align*} \nonumber \]
C Si las células de levadura van a equilibrar exactamente la presión osmótica externa, deben producir suficiente glicerol para dar una presión interna adicional de (34 atm − 7.3 atm) = 27 atm. El glicerol es un no electrolito, por lo que podemos resolver la Ecuación\ ref {13.5.12} para la molaridad correspondiente a esta presión osmótica:
\[ \begin{align*} M&=\dfrac{\Pi}{RT}\\[4pt] &=\dfrac{27\; \cancel{atm}}{[0.0821(L⋅\cancel{atm})/(\cancel{K}⋅mol)] (298 \;\cancel{K})}\\[4pt] &=1.1 \;M \;\text{glycerol} \end{align*} \nonumber \]
Al resolver este problema, también podríamos haber reconocido que la única forma en que las presiones osmóticas pueden ser las mismas dentro de las células y en la solución es si las concentraciones de partículas disueltas son las mismas. Se nos da que la concentración normal de partículas disueltas en las células es 0.3 M, y hemos calculado que la\(\ce{NaCl}\) solución es efectivamente 1.4 M en partículas disueltas. Por lo tanto, las células de levadura deben sintetizar suficiente glicerol para aumentar la concentración interna de partículas disueltas de 0.3 M a 1.4 M, es decir, una concentración adicional de 1.1 M de glicerol.
Supongamos que los fluidos dentro de una salchicha son aproximadamente 0.80 M en partículas disueltas debido a la sal y nitrito de sodio utilizados para prepararlos. Calcula la presión osmótica dentro de la salchicha a 100°C para conocer por qué cocineros experimentados perforan la piel semipermeable de los embutidos antes de hervirlos.
- Contestar
-
24 atm
Debido a la gran magnitud de las presiones osmóticas, la ósmosis es extraordinariamente importante en bioquímica, biología y medicina. Prácticamente cada barrera que separa un organismo o célula de su entorno actúa como una membrana semipermeable, permitiendo el flujo de agua pero no de solutos. Lo mismo ocurre con los compartimentos dentro de un organismo o célula. Algunas barreras especializadas, como las de tus riñones, son ligeramente más permeables y utilizan un proceso relacionado llamado diálisis, que permite que pasen tanto el agua como las moléculas pequeñas pero no moléculas grandes como las proteínas.
El mismo principio se ha utilizado durante mucho tiempo para conservar las frutas y sus vitaminas esenciales durante el largo invierno. Las altas concentraciones de azúcar se utilizan en mermeladas y jaleas no solo por dulzura sino porque aumentan en gran medida la presión osmótica. Así, cualquier bacteria no muerta en el proceso de cocción se deshidrata, lo que evita que se multipliquen en un medio rico para el crecimiento bacteriano. Un proceso similar al usar sal evita que las bacterias crezcan en jamón, tocino, cerdo salado, bacalao salado y otras carnes en conserva. El efecto de la presión osmótica se ilustra dramáticamente en la Figura\(\PageIndex{7}\), que muestra lo que sucede cuando los glóbulos rojos se colocan en una solución cuya presión osmótica es mucho menor o mucho mayor que la presión interna de las células.
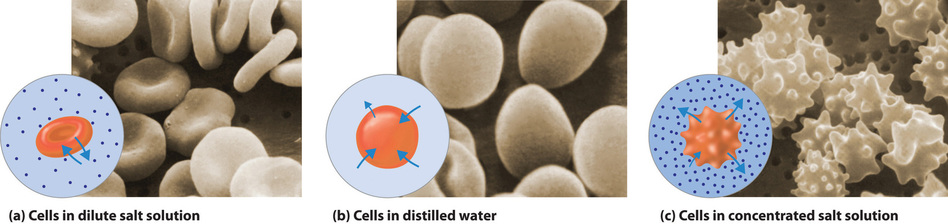
Además de la acción capilar, los árboles utilizan presión osmótica para transportar agua y otros nutrientes desde las raíces hasta las ramas superiores. La evaporación del agua de las hojas da como resultado un aumento local en la concentración de sal, lo que genera una presión osmótica que arrastra el agua por el tronco del árbol hacia las hojas.
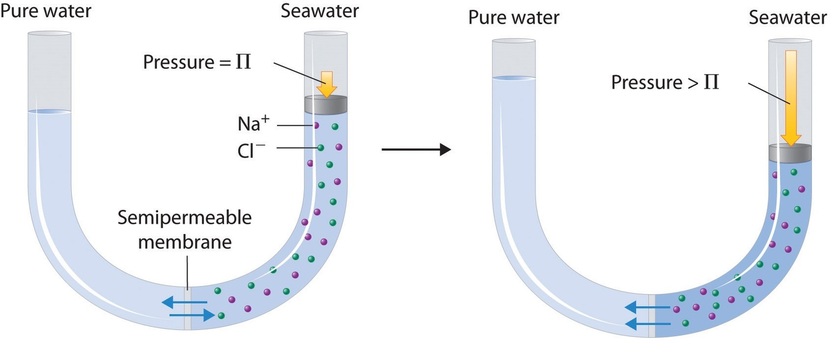
Finalmente, se puede utilizar un proceso llamado ósmosis inversa para producir agua pura a partir del agua de mar. Como se muestra esquemáticamente en la Figura\(\PageIndex{8}\), la aplicación de alta presión al agua de mar obliga a las moléculas de agua a fluir a través de una membrana semipermeable que separa el agua pura de la solución, dejando atrás la sal disuelta. Las plantas de desalinización a gran escala que pueden producir cientos de miles de galones de agua dulce al día son comunes en las tierras desérticas del Medio Oriente, donde abastecen una gran proporción del agua dulce que necesita la población. Instalaciones similares ahora se están utilizando para abastecer de agua dulce en el sur de California. Las unidades pequeñas de ósmosis inversa operadas manualmente pueden producir aproximadamente 5 L de agua dulce por hora, lo suficiente para mantener vivas a 25 personas, y ahora son equipos estándar en los botes salvavidas de la Marina de los Estados Unidos.
Un Video Discutiendo la Presión Osmótica. Video Link: Presión osmótica, YouTube (opens in new window) [youtu.be] (opens in new window)
Propiedades coligativas de las soluciones electrolíticas
Hasta ahora hemos asumido que podríamos simplemente multiplicar la concentración molar de un soluto por el número de iones por unidad de fórmula para obtener la concentración real de partículas disueltas en una solución electrolítica. Hemos utilizado este modelo simple para predecir propiedades tales como puntos de congelación, puntos de fusión, presión de vapor y presión osmótica. Si este modelo fuera perfectamente correcto, esperaríamos que la depresión del punto de congelación de una solución de cloruro de sodio de 0.10 m, con 2 moles de iones por mol de\(\ce{NaCl}\) en solución, sea exactamente el doble que la de una solución de 0.10 m de glucosa, con solo 1 mol de moléculas por mol de glucosa en solución. En realidad, no siempre es así. En cambio, el cambio observado en los puntos de congelación para soluciones acuosas de 0.10 m de\(\ce{NaCl}\) y\(\ce{KCl}\) son significativamente menores de lo esperado (−0.348°C y −0.344°C, respectivamente, en lugar de −0.372°C), lo que sugiere que hay menos partículas de las que esperábamos están presentes en solución.
La relación entre el número real de moles de soluto añadidos para formar una solución y el número aparente determinado por las propiedades coligativas se denomina factor van't Hoff (\(i\)) y se define de la siguiente manera:
\[i=\dfrac{\text{apparent number of particles in solution}}{\text{ number of moles of solute dissolved}} \label{13.5.13} \]
Nombrado así por Jacobus Hendricus van 't Hoff (1852—1911), profesor holandés de química en la Universidad de Ámsterdam que ganó el primer Premio Nobel de Química (1901) por su trabajo sobre termodinámica y soluciones.
A medida que aumenta la concentración de soluto, el factor van 't Hoff disminuye.
El factor van 't Hoff es, por lo tanto, una medida de una desviación del comportamiento ideal. Cuanto menor sea el factor van 't Hoff, mayor será la desviación. Como\(\PageIndex{2}\) muestran los datos de la Tabla, los factores de van't Hoff para los compuestos iónicos son algo menores de lo esperado; es decir, sus soluciones aparentemente contienen menos partículas de las predichas por el número de iones por unidad de fórmula. A medida que aumenta la concentración del soluto, el factor van't Hoff disminuye debido a que los compuestos iónicos generalmente no se disocian totalmente en solución acuosa.
| Compuesto | i (medido) | i (ideal) |
|---|---|---|
| glucosa | 1.0 | 1.0 |
| sacarosa | 1.0 | 1.0 |
| \(NaCl\) | 1.9 | 2.0 |
| \(HCl\) | 1.9 | 2.0 |
| \(MgCl_2\) | 2.7 | 3.0 |
| \(FeCl_3\) | 3.4 | 4.0 |
| \(Ca(NO_3)_2\) | 2.5 | 3.0 |
| \(AlCl_3\) | 3.2 | 4.0 |
| \(MgSO_4\) | 1.4 | 2.0 |
En cambio, algunos de los iones existen como pares de iones, un catión y un anión que por un breve tiempo se asocian entre sí sin una capa intermedia de moléculas de agua (Figura\(\PageIndex{9}\)). Cada una de estas unidades temporales se comporta como una sola partícula disuelta hasta que se disocia. Los iones altamente cargados como\(Mg^{2+}\),,\(Al^{3+}\)\(SO_4^{2−}\), y\(PO_4^{3−}\) tienen una mayor tendencia a formar pares de iones debido a sus fuertes interacciones electrostáticas. El número real de iones solvatados presentes en una solución se puede determinar midiendo una propiedad coligativa a varias concentraciones de soluto.
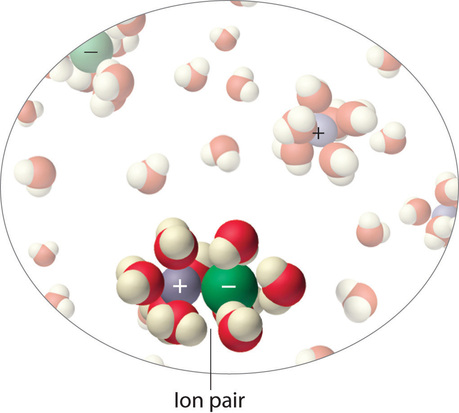
Una solución acuosa de 0.0500 M\(FeCl_3\) tiene una presión osmótica de 4.15 atm a 25°C. Calcular el factor van 't Hoff\(i\) para la solución.
Dado: concentración de soluto, presión osmótica y temperatura
Preguntado por: factor van 't Hoff
Estrategia:
- Utilice la Ecuación\(\ref{13.5.12}\) para calcular la presión osmótica esperada de la solución con base en la concentración efectiva de partículas disueltas en el disolvente.
- Calcular la relación entre la presión osmótica observada y el valor esperado. Multiplique este número por el número de iones de soluto por unidad de fórmula, y luego use la ecuación\(\ref{13.5.13}\) para calcular el factor van't Hoff.
Solución:
A Si\(\ce{FeCl_3}\) se disocia completamente en solución acuosa, produciría cuatro iones por unidad de fórmula [Fe3+ (aq) más 3Cl− (ac)] para una concentración efectiva de partículas disueltas de 4 × 0.0500 M = 0.200 M. La presión osmótica sería
\[\begin{align*} \Pi &=MRT \\[4pt] &=(0.200 \;mol/L) \left[0.0821\;(L⋅atm)/(K⋅mol) \right] (298\; K)=4.89\; atm \end{align*} \nonumber \]
B La presión osmótica observada es de solo 4.15 atm, presumiblemente debido a la formación de pares iónicos. La relación de la presión osmótica observada al valor calculado es de 4.15 atm/4.89 atm = 0.849, lo que indica que la solución contiene (0.849) (4) = 3.40 partículas por mol de\(\ce{FeCl_3}\) disuelto. Alternativamente, podemos calcular la concentración de partículas observada a partir de la presión osmótica de 4.15 atm:
\[4.15\; atm=M \left( \dfrac{0.0821 \;(L⋅atm)}{(K⋅mol)}\right) (298 \;K) \nonumber \]
o después de reorganizar
\[M = 0.170 mol \nonumber \]
La relación de este valor al valor esperado de 0.200 M es de 0.170 M/0.200 M = 0.850, lo que nuevamente nos da (0.850) (4) = 3.40 partículas por mol de\(\ce{FeCl_3}\) disuelto. De Equation\(\ref{13.5.13}\), el factor van 't Hoff para la solución es
\[i=\dfrac{\text{3.40 particles observed}}{\text{1 formula unit}\; \ce{FeCl_3}}=3.40 \nonumber \]
Calcular el factor van't Hoff para una solución acuosa de 0.050 m\(MgCl_2\) que tenga un punto de congelación medido de −0.25°C.
- Contestar
-
2.7 (versus un valor ideal de 3).
Un video discutiendo las propiedades coligativas en las soluciones. Video Link: Propiedades Colligativas en Soluciones, YouTube (opens in new window) [youtu.be]
Resumen
Las propiedades coligativas de una solución dependen únicamente del número total de partículas disueltas en solución, no de su identidad química. Las propiedades coligativas incluyen presión de vapor, punto de ebullición, punto de congelación y presión osmótica. La adición de un soluto no volátil (uno sin una presión de vapor medible) disminuye la presión de vapor del disolvente. La presión de vapor de la solución es proporcional a la fracción molar de disolvente en la solución, una relación conocida como ley de Raoult. Las soluciones que obedecen a la ley de Raoult se llaman soluciones ideales. La mayoría de las soluciones reales muestran desviaciones positivas o negativas de la ley de Raoult. La elevación del punto de ebullición (\(ΔT_b\)) y la depresión del punto de congelación (\(ΔT_f\)) de una solución se definen como las diferencias entre los puntos de ebullición y congelación, respectivamente, de la solución y el disolvente puro. Ambos son proporcionales a la molalidad del soluto. Cuando una solución y un disolvente puro están separados por una membrana semipermeable, barrera que permite el paso de moléculas de disolvente pero no moléculas de soluto, el flujo de disolvente en direcciones opuestas es desigual y produce una presión osmótica, que es la diferencia de presión entre los dos lados del membrana. La ósmosis es el flujo neto de disolvente a través de dicha membrana debido a las diferentes concentraciones de soluto. La diálisis utiliza una membrana semipermeable con poros que permiten que solo pequeñas moléculas de soluto y moléculas de disolvente pasen a través. En soluciones más concentradas, o en soluciones de sales con iones altamente cargados, los cationes y aniones pueden asociarse para formar pares de iones, lo que disminuye su efecto sobre las propiedades coligativas de la solución. El grado de formación de pares iónicos viene dado por el factor van't Hoff (i), la relación entre el número aparente de partículas en solución y el número predicho por la estequiometría de la sal.
- Ley de Henry:\[C = kP \nonumber \]
- Ley de Raoult:\[P_A=\chi_AP^0_A \nonumber \]
- disminución de la presión de vapor:\[P^0_A−P_A=ΔP_A=\chi_BP^0_A \nonumber \]
- presión de vapor de un sistema que contiene dos componentes volátiles:\[P_{tot}=\chi_AP^0_A+(1−\chi_A)P^0_B \nonumber \]
- elevación del punto de ebullición:\[ΔT_b = mK_b \nonumber \]
- depresión del punto de congelación:\[ΔT_f = mK_f \nonumber \]
- presión osmótica:\[\Pi=nRTV=MRT \nonumber \]
- factor van 't Hoff:\[i=\dfrac{\text{apparent number of particles in solution}}{\text{ number of moles of solute dissolved}} \nonumber \]


