13.6: Partículas agregadas
- Page ID
- 77920
- Distinguir entre soluciones verdaderas y soluciones con partículas agregadas.
Las suspensiones y coloides son dos tipos comunes de mezclas cuyas propiedades son en muchos sentidos intermedias entre las de soluciones verdaderas y mezclas heterogéneas. Una suspensión Mezcla heterogénea de partículas con diámetros de aproximadamente 1 µm que se distribuyen a lo largo de una segunda fase y que se separan de la fase dispersante en reposo. es una mezcla heterogénea de partículas con diámetros de aproximadamente 1 µm (1000 nm) que se distribuyen a lo largo de una segunda fase. Las suspensiones comunes incluyen pintura, sangre y chocolate caliente, que son partículas sólidas en un líquido, y aerosoles, que son partículas líquidas en un gas. Si se deja reposar la suspensión, las dos fases se separarán, razón por la cual las pinturas deben agitarse o agitarse a fondo antes de su uso. Un coloide Mezcla heterogénea de partículas con diámetros de aproximadamente 2—500 nm que se distribuyen a lo largo de una segunda fase y no se separan de la fase dispersante en reposo. también es una mezcla heterogénea, pero las partículas de un coloide son típicamente más pequeñas que las de una suspensión, generalmente en el intervalo de 2 a aproximadamente 500 nm de diámetro. Los coloides incluyen niebla y nubes (partículas líquidas en un gas), leche (partículas sólidas en un líquido) y mantequilla (partículas sólidas en un sólido). Otros coloides se utilizan industrialmente como catalizadores. A diferencia de una suspensión, las partículas en un coloide no se separan en dos fases al reposar. La única combinación de sustancias que no pueden producir una suspensión o un coloide es una mezcla de dos gases porque sus partículas son tan pequeñas que siempre forman verdaderas soluciones. Las propiedades de las suspensiones, coloides y soluciones se resumen en la Tabla 13.6.1.
Cuadro 13.6.1 Propiedades de Soluciones Líquidas, Coloides y Suspensiones
| Tipo de Mezcla | Tamaño aproximado de las partículas (nm) | Propiedades características | Ejemplos |
|---|---|---|---|
| solución | < 2 | no filtrable; no se separa de pie; no dispersa la luz visible | aire, vino blanco, gasolina, agua salada |
| coloide | 2—500 | dispersa la luz visible; translúcida u opaca; no filtrable; no se separa de pie | humo, niebla, tinta, leche, mantequilla, queso |
| suspensión | 500—1000 | turbio u opaco; filtrable; se separa de pie | agua fangosa, cacao caliente, sangre, pintura |
Coloides y Suspensiones
Los coloides fueron caracterizados por primera vez alrededor de 1860 por Thomas Graham, quien también nos dio la ley de difusión y derrame de Graham. Si bien algunas sustancias, como el almidón, la gelatina y el pegamento, parecen disolverse en agua para producir soluciones, Graham encontró que se difunden muy lentamente o nada en comparación con soluciones de sustancias como la sal y el azúcar. Graham acuñó la palabra coloide (del griego kólla, que significa “pegamento”) para describir estas sustancias, así como las palabras sol Una dispersión de partículas sólidas en un líquido o sólido. y gel Un sol semisólido en el que toda la fase líquida ha sido absorbida por las partículas sólidas. describir ciertos tipos de coloides en los que todo el disolvente ha sido absorbido por las partículas sólidas, evitando así que la mezcla fluya fácilmente, como vemos en Jell-O. Otros dos tipos importantes de coloides son los aerosoles Una dispersión de partículas sólidas o líquidas en un gas. , que son dispersiones de partículas sólidas o líquidas en un gas, y emulsiones, que son dispersiones de un líquido en otro líquido con el que es inmiscible.
Los coloides comparten muchas propiedades con soluciones. Por ejemplo, las partículas en ambas son invisibles sin un microscopio potente, no se asientan al estar de pie, y pasan por la mayoría de los filtros. Sin embargo, las partículas en un coloide dispersan un haz de luz visible, fenómeno conocido como el efecto Tyndall El fenómeno de dispersar un haz de luz visible. , El efecto lleva el nombre de su descubridor, John Tyndall, un físico inglés (1820—1893). mientras que las partículas de una solución no. El efecto Tyndall es responsable de la forma en que los rayos de los faros de los automóviles son claramente visibles desde un lado en una noche de niebla pero no se pueden ver desde un lado en una noche clara. También es responsable de los rayos de luz coloreados que se ven en muchas puestas de sol, donde la luz del sol es dispersada por gotitas de agua y partículas de polvo altas en la atmósfera. Un ejemplo del efecto Tyndall se muestra en la Figura 13.6.1.

Figura 13.6.1 Efecto Tyndall, la dispersión de la luz por coloides El vidrio de la izquierda tiene plata coloidal diluida, la del agua del grifo derecha. El rayo puntero láser rojo se dispersa por el efecto Tyndall en el cristal de la izquierda.
Aunque los coloides y suspensiones pueden tener partículas de tamaño similar, los dos difieren en estabilidad: las partículas de un coloide permanecen dispersas indefinidamente a menos que se cambie la temperatura o composición química del medio dispersante. La explicación química de la estabilidad de los coloides depende de si las partículas coloidales son hidrofílicas o hidrofóbicas.
La mayoría de las proteínas, incluidas las responsables de las propiedades de la gelatina y el pegamento, son hidrófilas porque su superficie exterior está cubierta en gran parte con grupos polares o cargados. El almidón, un polímero de ramificaciones largas de moléculas de glucosa, también es hidrófilo. Una partícula coloidal hidrofílica interactúa fuertemente con el agua, dando como resultado una capa de moléculas de agua fuertemente unidas que evita que las partículas se agreguen cuando chocan. El calentamiento de dicho coloide puede causar agregación debido a que las partículas chocan con mayor energía e interrumpen la capa protectora del disolvente. Además, el calor hace que las estructuras proteicas se desplieguen, exponiendo grupos hidrófobos previamente enterrados que ahora pueden interactuar con otros grupos hidrófobos y hacer que las partículas se agreguen y precipiten de la solución Cuando se hierve un huevo, por ejemplo, la clara de huevo, que es principalmente una suspensión coloidal de una proteína llamada albúmina, se despliega y expone sus grupos hidrófobos, los cuales se agregan y hacen que la albúmina precipite como un sólido blanco.
En algunos casos, un coloide estable puede transformarse en una suspensión agregada mediante una modificación química menor. Consideremos, por ejemplo, el comportamiento de la hemoglobina, un componente importante de los glóbulos rojos. Las moléculas de hemoglobina normalmente forman una suspensión coloidal dentro de los glóbulos rojos, que normalmente tienen forma de “rosquilla” y se deforman fácilmente, lo que les permite exprimir a través de los capilares para entregar oxígeno a los tejidos. En una enfermedad hereditaria común llamada anemia falciforme, uno de los aminoácidos en la hemoglobina que tiene una cadena lateral de ácido carboxílico hidrófilo (glutamato) es reemplazado por otro aminoácido que tiene una cadena lateral hidrófoba (valina, Figura 9.7.1 5.16). Bajo algunas condiciones, las moléculas anormales de hemoglobina pueden agregarse para formar fibras largas y rígidas que hacen que los glóbulos rojos se deformen, adoptando una forma característica de hoz que impide que pasen a través de los capilares (Figura 13.6.2). La reducción en el flujo sanguíneo resulta en calambres severos, articulaciones inflamadas y daño hepático. Hasta hace poco, muchos pacientes con anemia falciforme fallecieron antes de los 30 años de edad por infección, coágulos sanguíneos o insuficiencia cardíaca o renal, aunque los individuos con el rasgo genético de células falciformes son más resistentes a la malaria que aquellos con hemoglobina “normal”.
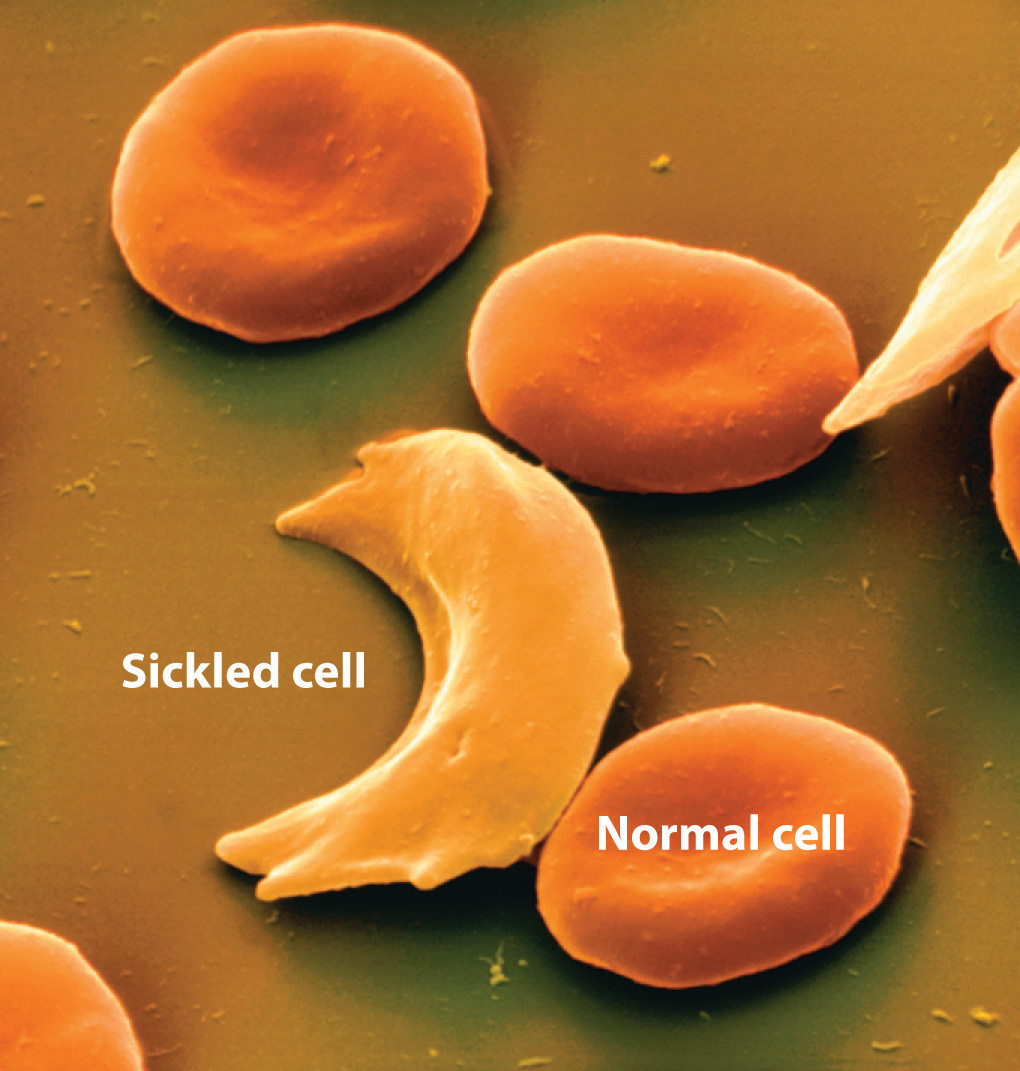
Figura 13.6.2 Anemia falciforme La forma característica de los glóbulos rojos falciformes es el resultado de la agregación fibrosa de moléculas de hemoglobina dentro de la célula.

Figura 13.6.3 Formación de nuevas tierras por la desestabilización de una suspensión coloidal Esta fotografía satelital muestra el delta del río Mississippi desde Nueva Orleans (arriba) hasta el Golfo de México (abajo). Donde el agua de mar se mezcla con agua dulce del río Mississippi, las partículas coloidales de arcilla en el agua del río precipitan (área bronceada).
La agregación y precipitación también pueden resultar cuando la capa externa cargada de una partícula es neutralizada por iones con la carga opuesta. En las vías navegables interiores, las partículas de arcilla, que tienen una superficie cargada, forman una suspensión coloidal. Las altas concentraciones de sal en el agua de mar neutralizan la carga sobre las partículas, provocando que precipiten y formen tierra en las desembocaduras de grandes ríos, como se ve en la vista satelital de la Figura 13.6.3. La neutralización de carga también es una estrategia importante para precipitar partículas sólidas a partir de coloides gaseosos como el humo, y es ampliamente utilizada para reducir las emisiones de partículas de las centrales eléctricas que queman combustibles fósiles.
Emulsiones
Emulsiones Una dispersión de una fase líquida en otro líquido con el que es inmiscible. son coloides formados por la dispersión de un líquido hidrofóbico en agua, poniendo así dos líquidos mutuamente insolubles, como el aceite y el agua, en estrecho contacto. Se han desarrollado diversos agentes para estabilizar emulsiones, siendo los más exitosos las moléculas que combinan una “cola” hidrofóbica relativamente larga con una “cabeza” hidrofílica:
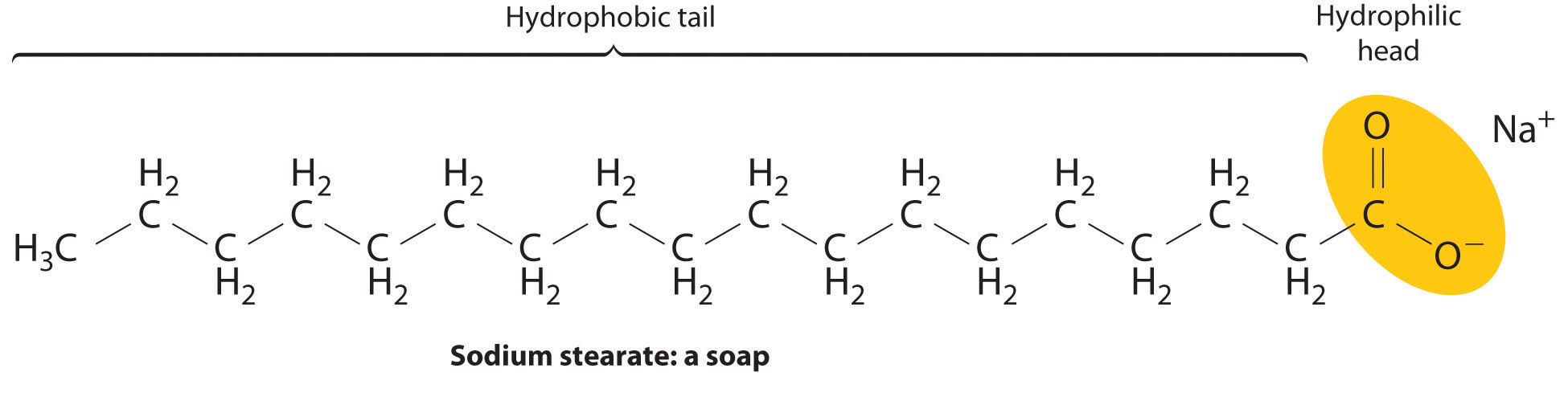
Ejemplos de tales agentes emulsionantes incluyen jabones, que son sales de ácidos carboxílicos de cadena larga, tales como estearato de sodio [CH 3 (CH 2) 16 CO 2-Na +], y detergentes, tales como dodecilsulfato de sodio [CH 3 (CH 2) 11 OSO 3 − Na +], cuyas estructuras son las siguientes:
Cuando lavas tu ropa, las colas hidrofóbicas de los jabones y detergentes interactúan con partículas hidrófobas de suciedad o grasa a través de fuerzas de dispersión, disolviéndose en el interior de la partícula hidrofóbica. Luego, el grupo hidrófilo se expone en la superficie de la partícula, lo que le permite interactuar con el agua a través de fuerzas ión-dipolo y enlaces de hidrógeno. Esto hace que las partículas de suciedad o grasa se dispersen en el agua de lavado y permite que se eliminen mediante enjuague. Agentes similares se utilizan en la industria alimentaria para estabilizar emulsiones como la mayonesa.
Un mecanismo relacionado nos permite absorber y digerir las grasas en palomitas de maíz con mantequilla y papas fritas. Para solubilizar las grasas para que puedan ser absorbidas, la vesícula biliar secreta un líquido llamado bilis hacia el intestino delgado. La bilis contiene una variedad de sales biliares, moléculas similares a detergentes que emulsionan las grasas.
Micelas
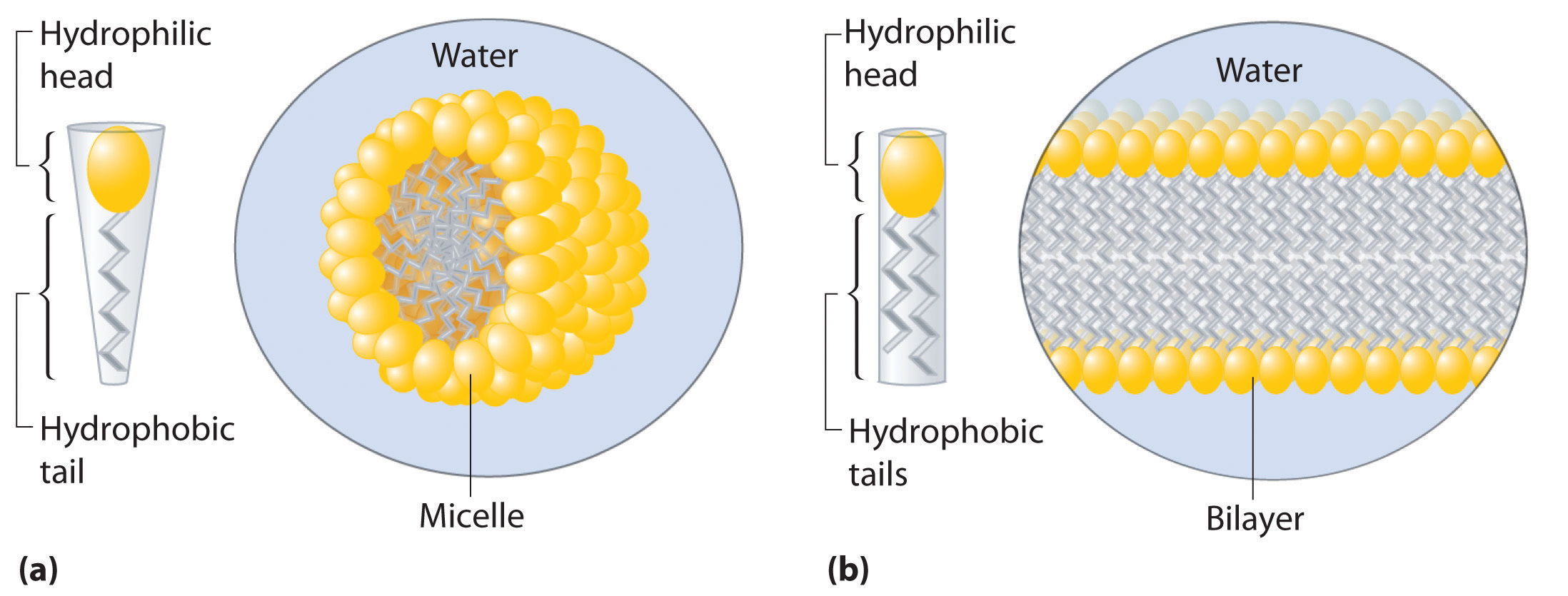
Los detergentes y jabones son sorprendentemente solubles en agua a pesar de sus colas hidrófobas. El motivo de su solubilidad es que, de hecho, no forman soluciones simples. En cambio, por encima de una cierta concentración forman espontáneamente micelas Un agregado esférico o cilíndrico de detergentes o jabones en agua que minimiza el contacto entre las colas hidrófobas de los detergentes o jabones y el agua. , que son agregados esféricos o cilíndricos que minimizan el contacto entre las colas hidrófobas y el agua. En una micela, solo las cabezas hidrófilas están en contacto directo con el agua, y las colas hidrófobas están en el interior del agregado (parte (a) en la Figura 13.6.4).
Figura 13.6.4 Las micelas y una bicapa fosfolipídica (a) Los jabones y detergentes, que contienen una sola cola hidrófoba en cada molécula, forman micelas esféricas con las colas entrelazadas en el interior y los grupos de cabeza hidrófilos en el exterior. (b) Los fosfolípidos, que tienen dos colas hidrófobas, tienden a formar capas dobles extendidas en las que las colas hidrófobas están intercaladas entre los grupos de cabeza hidrófilos.
Una gran clase de moléculas biológicas llamadas fosfolípidos Una gran clase de moléculas biológicas similares a detergentes que tienen una cabeza hidrófila y dos colas hidrófobas y que forman bicapas. consiste en moléculas de tipo detergente con una cabeza hidrofílica y dos colas hidrófobas, como se puede observar en la molécula de fosfatidilcolina. La cola adicional da como resultado una forma cilíndrica que evita que los fosfolípidos formen una micela esférica. En consecuencia, los fosfolípidos forman bicapas Una lámina bidimensional que consiste en una doble capa de moléculas de fosfolípidos dispuestas cola con cola. , láminas extendidas que consisten en una doble capa de moléculas. Como se muestra en la parte (b) de la Figura 13.6.4, las colas hidrófobas están en el centro de la bicapa, donde no están en contacto con el agua, y las cabezas hidrófilas están en las dos superficies, en contacto con la solución acuosa circundante.
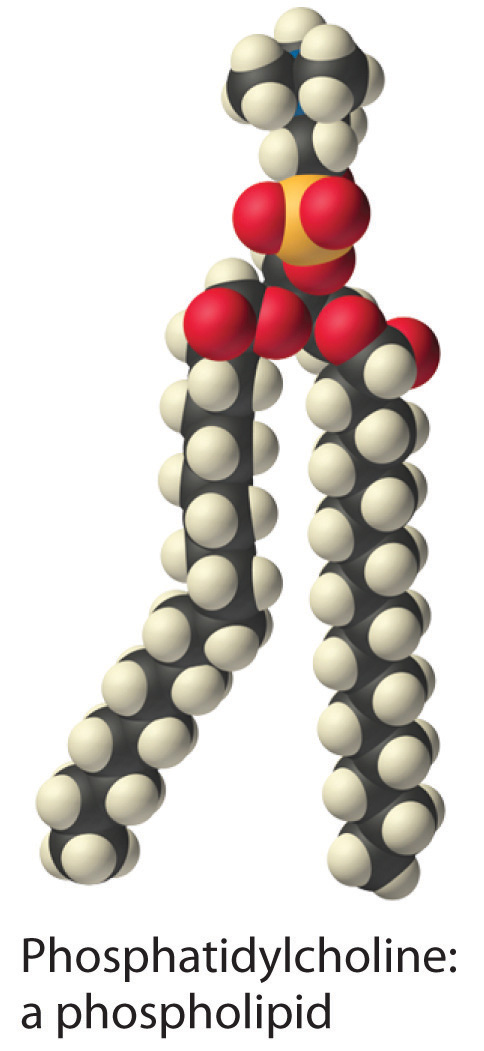
Una membrana celular Mezcla de fosfolípidos que forman una bicapa de fosfolípidos alrededor de la célula. es esencialmente una mezcla de fosfolípidos que forman una bicapa de fosfolípidos. Una definición de una célula Una colección de moléculas, capaces de reproducirse, que está rodeada por una bicapa fosfolipídica. es una colección de moléculas rodeadas por una bicapa de fosfolípidos que es capaz de reproducirse. Las células más simples son las bacterias, que consisten en un solo compartimento rodeado por una sola membrana. Las células animales y vegetales son mucho más complejas, sin embargo, y contienen muchos tipos diferentes de compartimentos, cada uno rodeado por una membrana y capaz de llevar a cabo tareas especializadas.
Resumen
Una suspensión es una mezcla heterogénea de partículas de una sustancia distribuidas a lo largo de una segunda fase; las partículas dispersas se separan de la fase dispersante en reposo. En contraste, las partículas en un coloide son más pequeñas y no se separan al estar de pie. Un coloide puede clasificarse como un sol, una dispersión de partículas sólidas en un líquido o sólido; un gel, un sol semisólido en el que toda la fase líquida ha sido absorbida por las partículas sólidas; un aerosol, una dispersión de partículas sólidas o líquidas en un gas; o un emulsión, una dispersión de una fase líquida en otra. Un coloide se puede distinguir de una solución verdadera por su capacidad para dispersar un haz de luz, conocido como el efecto Tyndall. Los coloides hidrofílicos contienen una capa externa de grupos que interactúan favorablemente con el agua, mientras que los coloides hidrófobos tienen una superficie externa con poca afinidad por el agua. Las emulsiones se preparan dispersando un líquido hidrófobo en agua. En ausencia de una fase líquida hidrófoba dispersa, las soluciones de detergentes en agua forman agregados esféricos organizados llamados micelas. Los fosfolípidos son una clase de moléculas similares a detergentes que tienen dos colas hidrófobas unidas a una cabeza hidrófila. Una bicapa es una lámina bidimensional que consiste en una doble capa de moléculas de fosfolípidos dispuestas cola a cola con un interior hidrófobo y un exterior hidrófilo. Las células son colecciones de moléculas que están rodeadas por una bicapa fosfolipídica llamada membrana celular y son capaces de reproducirse por sí mismas.
Llave para llevar
- Los coloides y suspensiones son mezclas cuyas propiedades son en muchos sentidos intermedias entre las de soluciones verdaderas y mezclas heterogéneas.
Problemas conceptuales
-
¿En qué se diferencia un coloide de una suspensión? ¿Cuál tiene un mayor efecto en las propiedades de los disolventes, como la presión de vapor?
-
¿La leche homogeneizada es un coloide o una suspensión? ¿El plasma humano es un coloide o una suspensión? Justifica tus respuestas.
-
¿Cómo separarías los componentes de una emulsión de grasa dispersada en una solución acuosa de cloruro de sodio?
Colaboradores
- Anonymous