14.5: Uso de gráficas para determinar leyes de velocidad, constantes de velocidad y órdenes de reacción
- Page ID
- 78276
- Utilizar gráficas para analizar la cinética de una reacción.
En la Sección 14.3, aprendió que la ley de velocidad integrada para cada tipo de reacción común (cero, primer o segundo orden en un solo reactivo) se puede trazar como una línea recta. El uso de estas gráficas ofrece una alternativa a los métodos descritos para mostrar cómo cambia la concentración de reactivos con el tiempo y determinar el orden de reacción.
Ilustraremos el uso de estas gráficas considerando la descomposición térmica del gas NO 2 a temperaturas elevadas, la cual ocurre de acuerdo con la siguiente reacción:
\( 2NO_{2}\left ( g \right ) \overset{\Delta}{\rightarrow} 2NO\left ( g \right )+O_{2}\left ( g \right ) \tag{14.4.1}\)
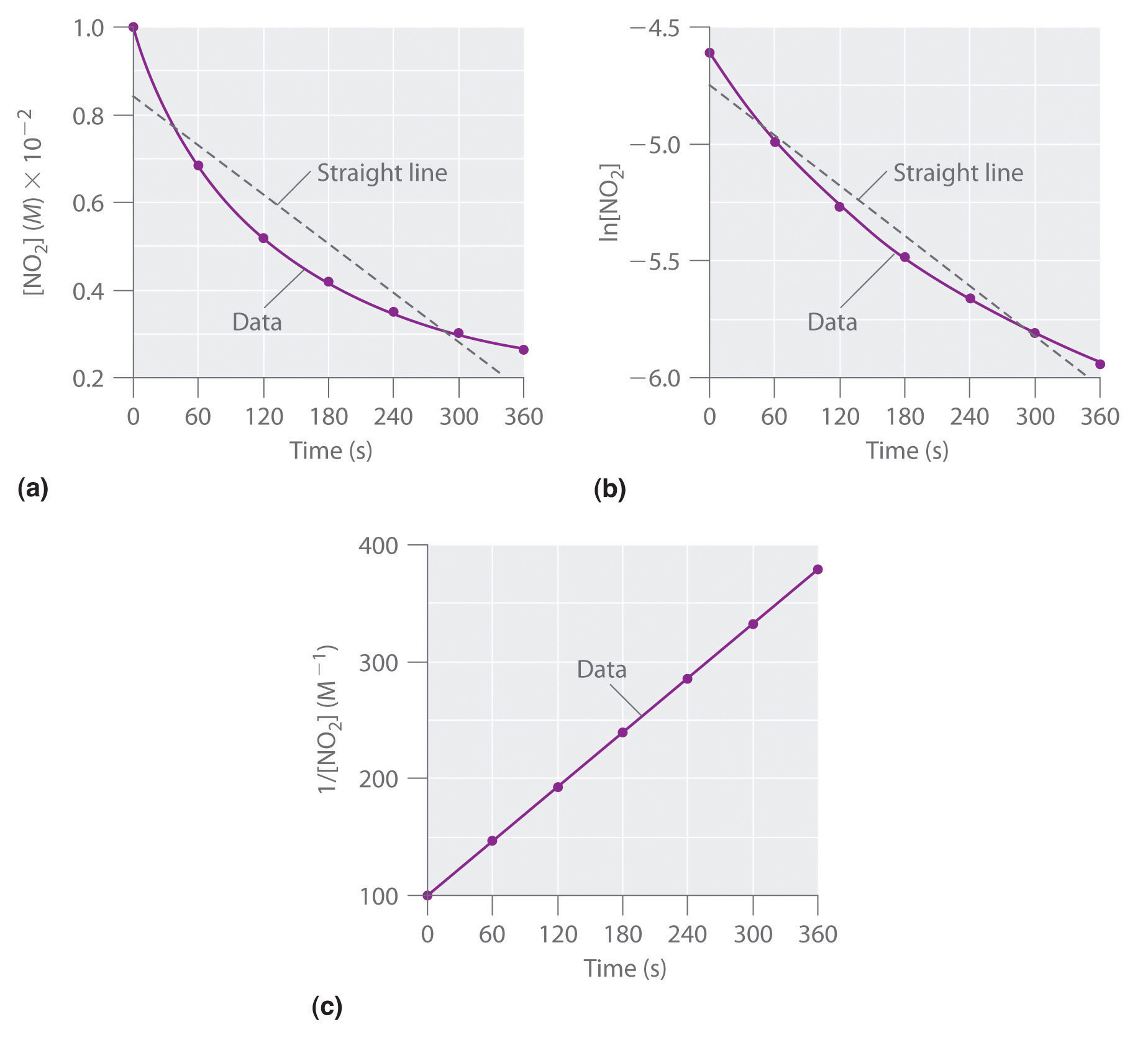
Los datos experimentales para esta reacción a 330°C se listan en la Tabla 14.4.1; se proporcionan como [NO 2], ln [NO 2] y 1/ [NO 2] versus tiempo para corresponder a las leyes de velocidad integradas para reacciones de orden cero, primero y segundo, respectivamente. Las concentraciones reales de NO 2 se representan frente al tiempo en la parte (a) en la Figura 14.4.1. Debido a que la trama de [NO 2] versus t no es una línea recta, sabemos que la reacción no es de orden cero en NO 2. Una gráfica de ln [NO 2] versus t (parte (b) en la Figura 14.4.1) nos muestra que la reacción no es de primer orden en NO 2 porque una reacción de primer orden daría una línea recta. Habiendo eliminado el comportamiento de orden cero y primer orden, construimos una gráfica de 1/ [NO 2] versus t (parte (c) en la Figura 14.4.1). Esta gráfica es una línea recta, lo que indica que la reacción es de segundo orden en NO 2.
Cuadro 14.4.1 Concentración de NO 2 en función del tiempo a 330°C
| Tiempo (s) | [NO 2] (M) | ln [NO 2] | 1/ [NO 2] (M −1) |
|---|---|---|---|
| 0 | 1.00 × 10 −2 | −4.605 | 100 |
| 60 | 6.83 × 10 −3 | −4.986 | 146 |
| 120 | 5.18 × 10 −3 | −5.263 | 193 |
| 180 | 4.18 × 10 −3 | −5.477 | 239 |
| 240 | 3.50 × 10 −3 | −5.655 | 286 |
| 300 | 3.01 × 10 −3 | −5.806 | 332 |
| 360 | 2.64 × 10 −3 | −5.937 | 379 |
Figura 14.4.1 La descomposición de NO 2 Estas gráficas muestran la descomposición de una muestra de NO 2 a 330°C como (a) la concentración de NO 2 frente a t, (b) el logaritmo natural de [NO 2] versus t, y (c) 1/ [NO 2] versus t.
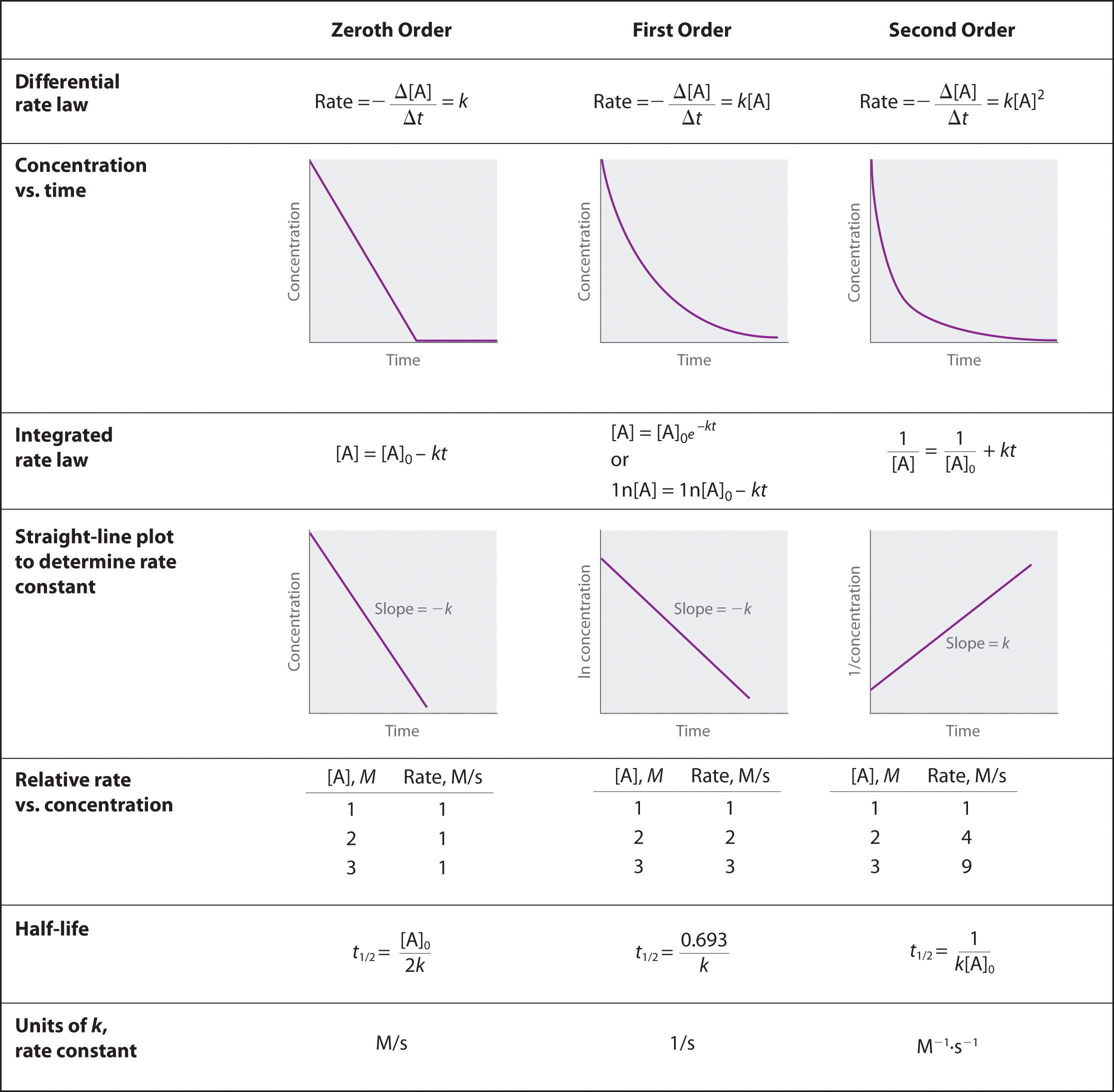
Acabamos de determinar el orden de reacción usando datos de un solo experimento trazando la concentración del reactivo en función del tiempo. Debido a las formas características de las líneas mostradas en la Figura 14.4.2, las gráficas pueden ser utilizadas para determinar el orden de reacción de una reacción desconocida. En contraste, el método descrito en la Sección 14.3 requirió múltiples experimentos a diferentes concentraciones de NO 2 así como velocidades iniciales precisas de reacción, lo que puede ser difícil de obtener para reacciones rápidas.
Figura 14.4.2 Propiedades de las reacciones que obedecen a leyes de tasa de orden cero, primer y segundo orden
Ejemplo 14.4.1
El pentóxido de dinitrógeno (N 2 O 5) se descompone a NO 2 y O 2 a temperaturas relativamente bajas en la siguiente reacción:
\( 2N_{2}O_{5}\left ( soln \right ) \rightarrow 4NO_{2}\left ( soln \right )+O_{2}\left ( g \right ) \)
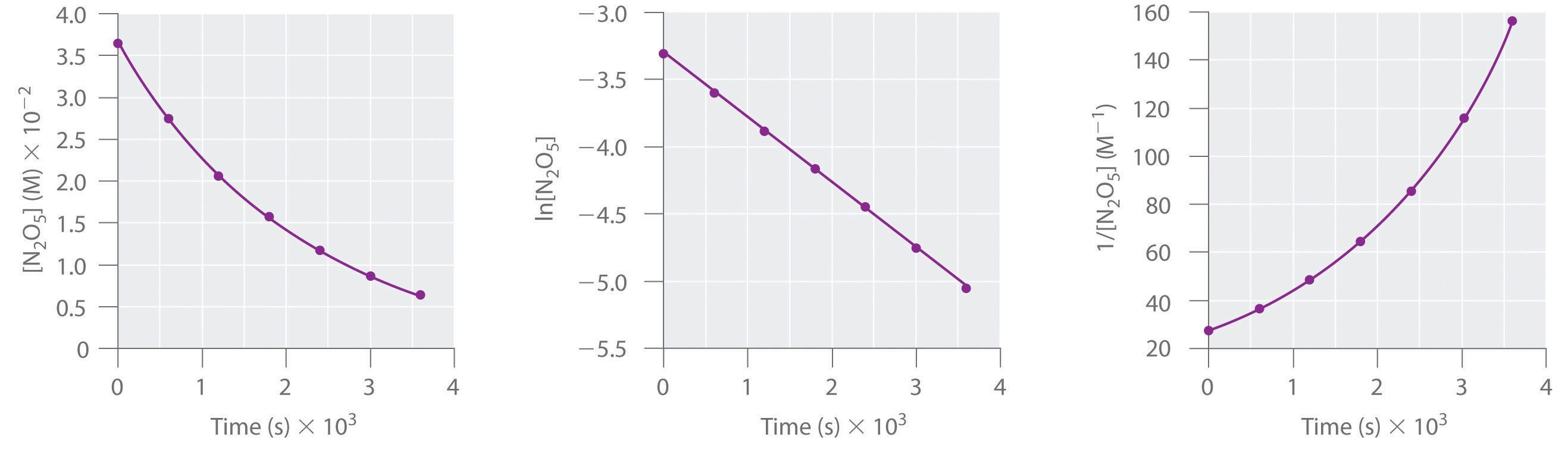
Esta reacción se lleva a cabo en una solución de CCl 4 a 45°C Las concentraciones de N 2 O 5 en función del tiempo se listan en la siguiente tabla, junto con los logaritmos naturales y las concentraciones recíprocas de N 2 O 5. Trazar una gráfica de la concentración versus t, ln concentración versus t, y 1/concentración versus t y luego determinar la ley de tasa y calcular la constante de velocidad.
| Tiempo (s) | [N 2 O 5] (M) | ln [N 2 O 5] | 1/ [N 2 O 5] (M −1) |
|---|---|---|---|
| 0 | 0.0365 | −3.310 | 27.4 |
| 600 | 0.0274 | −3.597 | 36.5 |
| 1200 | 0.0206 | −3.882 | 48.5 |
| 1800 | 0.0157 | −4.154 | 63.7 |
| 2400 | 0.0117 | −4.448 | 85.5 |
| 3000 | 0.00860 | −4.756 | 116 |
| 3600 | 0.00640 | −5.051 | 156 |
Dado: ecuación química equilibrada, tiempos de reacción y concentraciones
Preguntado por: gráfico de datos, ley de tarifas y constante de tasa
Estrategia:
A Utilice los datos de la tabla para trazar por separado la concentración, el logaritmo natural de la concentración y el recíproco de la concentración (el eje vertical) versus el tiempo (el eje horizontal). Compare las gráficas con las de la Figura 14.4.2 para determinar el orden de reacción.
B Escribe la ley de velocidad para la reacción. Utilizando los datos apropiados de la tabla y la gráfica lineal correspondiente a la ley de velocidad para la reacción, se calcula la pendiente de la línea trazada para obtener la constante de velocidad para la reacción.
Solución:
A Aquí están las gráficas de [N 2 O 5] versus t, ln [N 2 O 5] versus t, y 1/ [N 2 O 5] versus t:
La gráfica de ln [N 2 O 5] versus t da una línea recta, mientras que las parcelas de [N 2 O 5] versus t y 1/ [N 2 O 5] versus t no lo hacen. Esto significa que la descomposición de N 2 O 5 es de primer orden en [N 2 O 5].
B Por lo tanto, la ley de velocidad para la reacción es
\( rate = k \left [N_{2}O_{5} \right ]\)
El cálculo de la constante de velocidad es sencillo porque sabemos que la pendiente de la parcela de ln [A] versus t para una reacción de primer orden es − k. Podemos calcular la pendiente utilizando dos puntos cualesquiera que se encuentren en la línea en la parcela de ln [N 2 O 5] versus t. Usando los puntos para t = 0 y 3000 s,
\( slope= \dfrac{ln\left [N_{2}O_{5} \right ]_{3000}-ln\left [N_{2}O_{5} \right ]_{0}}{3000\;s-0\;s} = \dfrac{\left [-4.756 \right ]-\left [-3.310 \right ]}{3000\;s} =4.820\times 10^{-4}\;s^{-1} \)
Así k = 4.820 × 10 −4 s −1.
Ejercicio
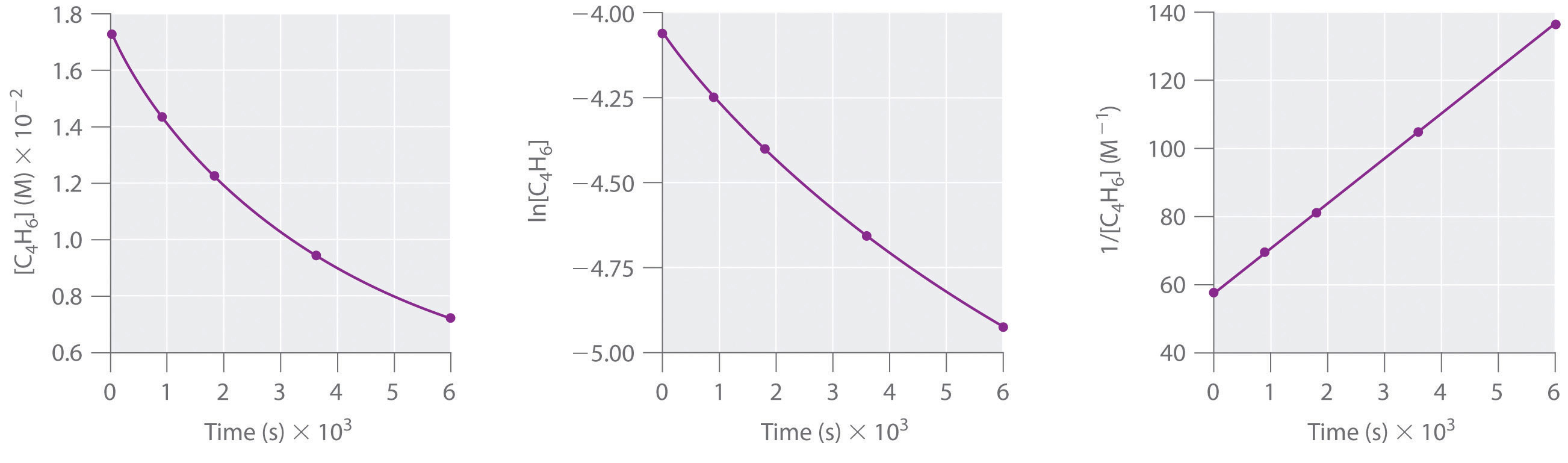
1,3-butadieno (CH 2 =CH—CH=CH 2; C 4 H 6) es una molécula orgánica volátil y reactiva utilizada en la producción de caucho. Por encima de la temperatura ambiente, reacciona lentamente para formar productos. Las concentraciones de C 4 H 6 en función del tiempo a 326°C se listan en la siguiente tabla junto con ln [C 4 H 6] y las concentraciones recíprocas. Grafique los datos como concentración versus t, ln concentración versus t y 1/concentración versus t. Luego se determina el orden de reacción en C 4 H 6, la ley de velocidad y la constante de velocidad para la reacción.
| Tiempo (s) | [C 4 H 6] (M) | ln [C 4 H 6] | 1/ [C 4 H 6] (M −1) |
|---|---|---|---|
| 0 | 1.72 × 10 −2 | −4.063 | 58.1 |
| 900 | 1.43 × 10 −2 | −4.247 | 69.9 |
| 1800 | 1.23 × 10 −2 | −4.398 | 81.3 |
| 3600 | 9.52 × 10 −3 | −4.654 | 105 |
| 6000 | 7.30 × 10 −3 | −4.920 | 137 |
Contestar
segundo orden en C 4 H 6; tasa = k [C 4 H 6] 2; k = 1.3 × 10 −2 M −1 ·s −1
Resumen
Para una reacción de orden cero, una gráfica de la concentración de cualquier reactivo frente al tiempo es una línea recta con una pendiente de − k. Para una reacción de primer orden, una gráfica del logaritmo natural de la concentración de un reactivo frente al tiempo es una línea recta con una pendiente de − k. Para una reacción de segundo orden, una gráfica de la inversa de la concentración de un reactivo frente al tiempo es una línea recta con una pendiente de k.
Llave para llevar
- Trazar la concentración de un reactivo en función del tiempo produce un gráfico con una forma característica que puede ser utilizada para identificar el orden de reacción en ese reactivo.
Problemas conceptuales
-
Compare las leyes de tarifas diferenciales e integradas de primer orden con respecto a lo siguiente. ¿Hay alguna información que pueda obtenerse de la ley de tasa integrada que no pueda obtenerse de la ley de tasa diferencial?
- la magnitud de la constante de velocidad
- la información necesaria para determinar el orden
- la forma de las gráficas
-
En la reacción de un solo paso y segundo orden 2A → productos, ¿cómo se compararía una gráfica de [A] versus tiempo con una gráfica de 1/ [A] versus tiempo? ¿Cuál de estos sería el más similar al mismo conjunto de gráficas para A durante la reacción de un solo paso, de segundo orden A + B → productos? Explique.
-
Para reacciones del mismo orden, ¿cuál es la relación entre la magnitud de la constante de velocidad y la velocidad de reacción? Si estuvieras comparando reacciones con órdenes diferentes, ¿podrían hacerse los mismos argumentos? ¿Por qué?
RESPUESTAS
-
- Para una reacción dada bajo condiciones particulares, la magnitud de la constante de velocidad de primer orden no depende de si se usa una ley de tasa diferencial o una ley de tasa integrada.
- La ley de tasa diferencial requiere múltiples experimentos para determinar el orden de los reactivos; la ley de tasa integrada solo necesita un experimento.
- Usando la ley de tasa diferencial, una gráfica de concentración versus tiempo es una curva con una pendiente que se vuelve menos negativa con el tiempo, mientras que para la ley de tasa integrada, una gráfica de ln [reactante] versus tiempo da una línea recta con pendiente = − k. La ley de velocidad integrada permite calcular la concentración de un reactivo en cualquier momento durante la reacción; la ley de tasa diferencial no lo hace.
-
La velocidad de reacción aumenta a medida que aumenta la constante de velocidad. No podemos comparar directamente las velocidades de reacción y las constantes de velocidad para reacciones de diferentes órdenes porque no son matemáticamente equivalentes.
Problemas numéricos
-
Un método de uso de gráficos para determinar el orden de reacción es usar información de velocidad relativa. Trazar el log de la velocidad relativa versus log de concentración relativa proporciona información sobre la reacción. Aquí hay un ejemplo de datos de una reacción de orden cero:
Relativo [A] (M) Tasa Relativa (M/s) 1 1 2 1 3 1 Variar [A] no altera la velocidad de reacción. Usando las tasas relativas en la tabla, generar gráficas de log (tasa) versus log (concentración) para reacciones de orden cero, primer y segundo orden. ¿Qué representa la pendiente de cada línea?
-
La siguiente tabla sigue la descomposición del gas N 2 O 5 examinando la presión parcial del gas en función del tiempo a 45°C. ¿Cuál es el orden de reacción? ¿Cuál es la constante de tasa? ¿Cuánto tiempo tardaría la presión en alcanzar 105 mmHg a 45°C?
Tiempo (s) Presión (mmHg) 0 348 400 276 1600 156 3200 69 4800 33
Colaboradores
- Anonymous
Modificado por Joshua B. Halpern