14.6: Vida media y cinética de desintegración radiactiva
- Page ID
- 78256
- Saber usar las vidas medias para describir las tasas de reacciones de primer orden.
Vidas medias
Otro enfoque para describir las velocidades de reacción se basa en el tiempo requerido para que la concentración de un reactivo disminuya a la mitad de su valor inicial. Este periodo de tiempo se llama la semivida El periodo de tiempo que tarda la concentración de un reactivo en disminuir a la mitad de su valor inicial. de la reacción, escrita como t 1/2. Así, la vida media de una reacción es el tiempo requerido para que la concentración del reactivo disminuya de [A] 0 a [A] 0 /2. Si dos reacciones tienen el mismo orden, la reacción más rápida tendrá una vida media más corta, y la reacción más lenta tendrá una vida media más larga.
La vida media de una reacción de primer orden bajo un conjunto dado de condiciones de reacción es una constante. Esto no es cierto para las reacciones de orden cero y segundo. La vida media de una reacción de primer orden es independiente de la concentración de los reactivos. Esto se hace evidente cuando reorganizamos la ley de tasa integrada para una reacción de primer orden (Ecuación 14.3.6) para producir la siguiente ecuación:
\( ln \dfrac{\left [ A \right ]_{0}}{\left [ A \right ]} = kt \tag{14.5.1} \)
Sustituir [A] 0 /2 por [A] y t 1/2 por t (para indicar una vida media) en la Ecuación 14.5.1 da
\( ln \dfrac{\left [ A \right ]_{0}}{\left [ A \right ]_{0}/2} = ln 2=kt_{1/2} \tag{14.5.2} \)
El logaritmo natural de 2 (a tres decimales) es 0.693. Sustituyendo este valor en la ecuación, obtenemos la expresión para la vida media de una reacción de primer orden:
\( t_{1/2}=\dfrac{0.693}{k} \tag{14.5.3} \)
Así, para una reacción de primer orden, cada semivida sucesiva es el mismo período de tiempo, como se muestra en la Figura 14.5.1 “La vida media de una reacción de primer orden”, y es independiente de [A].
Figura 14.5.1 La vida media de una reacción de primer orden Esta gráfica muestra la concentración del reactivo en una reacción de primer orden en función del tiempo e identifica una serie de semividas, intervalos en los que la concentración del reactivo disminuye en un factor de 2. En una reacción de primer orden, cada vida media es el mismo período de tiempo.
Si conocemos la constante de velocidad para una reacción de primer orden, entonces podemos usar vidas medias para predecir cuánto tiempo se necesita para que la reacción alcance un cierto porcentaje de finalización.
| Número de vidas medias | Porcentaje de reactivo restante | |
|---|---|---|
| 1 | \( \dfrac{100 \%}{2}=50\% \) | \( \dfrac{1}{2}\left (100 \% \right )= 50 \% \) |
| 2 | \( \dfrac{50 \%}{2} =25 \%\) | \( \dfrac{1}{2} \left ( \dfrac{1}{2} \right )\left (100 \% \right )= 25 \% \) |
| 3 | \( \dfrac{25 \%}{2}=12.5 \% \) | \( \dfrac{1}{2} \left ( \dfrac{1}{2} \right ) \left ( \dfrac{1}{2} \right ) \left (100 \% \right )= 12.5 \% \) |
| n | \( \dfrac{100 \%}{2^{n}} \) | \( \left ( \dfrac{1}{2} \right )^{n} \left (100 \% \right )= \left ( \dfrac{1}{2} \right )^{n} \% \) |
Como puede ver en esta tabla, la cantidad de reactivo que queda después de n semividas de una reacción de primer orden es (1/2) n veces la concentración inicial.
Tenga en cuenta el patrón
Para una reacción de primer orden, la concentración del reactivo disminuye en una constante con cada vida media y es independiente de [A].
Ejemplo 14.5.1
El fármaco anticancerígeno cisplatino se hidroliza en agua con una constante de velocidad de 1.5 × 10 −3 min −1 a pH 7.0 y 25°C, calculando la vida media para la reacción de hidrólisis bajo estas condiciones. Si una solución recién preparada de cisplatino tiene una concentración de 0.053 M, ¿cuál será la concentración de cisplatino después de 5 semividas? después de 10 vidas medias? ¿Cuál es el porcentaje de finalización de la reacción después de 5 semividas? después de 10 vidas medias?
Dado: constante de tasa, concentración inicial y número de vidas medias
Preguntado por: vida media, concentraciones finales y porcentaje de finalización
Estrategia:
Una Ecuación de Uso 14.5.3 para calcular la vida media de la reacción.
B Multiplique la concentración inicial por 1/2 a la potencia correspondiente al número de semividas para obtener las concentraciones restantes después de esas semividas.
C Restar la concentración restante de la concentración inicial. Luego divide por la concentración inicial, multiplicando la fracción por 100 para obtener el porcentaje de finalización.
Solución:
A Podemos calcular la vida media de la reacción usando la Ecuación 14.5.3:
\( t_{1/2}=\dfrac{0.693}{k}=\dfrac{0.693}{1.5 \times 10^{-3}\;min^{-1}}=4.6 \times 10^{2}\;min \)
Por lo tanto, la mitad del cisplatino tarda casi 8 h en hidrolizarse.
B Después de 5 semividas (aproximadamente 38 h), la concentración restante de cisplatino será la siguiente:
\( \dfrac{0.053\;M}{2^{5}}=\dfrac{0.053\;M}{32}=0.0017\;M \)
Después de 10 semividas (77 h), la concentración restante de cisplatino será la siguiente:
\( \dfrac{0.053\;M}{2^{10}}=\dfrac{0.053\;M}{1024}=5.2 \times 10^{-5}\;M \)
C El porcentaje de finalización después de 5 semividas será el siguiente:
\( percent\;completion=\dfrac{\left (0.053\;M-0.0017\;M \right )100}{0.53\;M}=97\% \)
El porcentaje de finalización después de 10 semividas será el siguiente:
\( percent\;completion=\dfrac{\left (0.053\;M-5.2 \times 10^{-5}\;M \right )100}{0.53\;M}=100\% \)
Por lo tanto, una reacción química de primer orden es 97% completa después de 5 semividas y 100% completa después de 10 semividas.
Ejercicio
En el Ejemplo 4 se encontró que el cloruro de etilo se descompone a etileno y HCl en una reacción de primer orden que tiene una constante de velocidad de 1.6 × 10 −6 s −1 a 650°C. ¿Cuál es la vida media de la reacción bajo estas condiciones? Si un matraz que originalmente contiene cloruro de etilo 0.077 M se calienta a 650°C, ¿cuál es la concentración de cloruro de etilo después de 4 semividas?
Respuesta: 4.3 × 10 5 s = 120 h = 5.0 días; 4.8 × 10 −3 M
Tasas de desintegración radiactiva
Como aprendiste en el Capítulo 1 la radiactividad, o desintegración radiactiva, es la emisión de una partícula o un fotón que resulta de la descomposición espontánea del núcleo inestable de un átomo. La tasa de desintegración radiactiva es una propiedad intrínseca de cada isótopo radiactivo que es independiente de la forma química y física del isótopo radiactivo.. La tasa también es independiente de la temperatura. En esta sección, describiremos las tasas de desintegración radiactiva y cómo se pueden usar las semividas para monitorear los procesos de desintegración radiactiva.
En cualquier muestra de una sustancia radiactiva dada, el número de átomos del isótopo radiactivo debe disminuir con el tiempo a medida que sus núcleos se desintegran en núcleos de un isótopo más estable. Usando N para representar el número de átomos del isótopo radiactivo, podemos definir la tasa de desintegración La disminución en el número de núcleos de un radioisótopo por unidad de tiempo. de la muestra, que también se denomina su actividad (A) La disminución en el número de núcleos de un radioisótopo por unidad de tiempo: A=−δN/δT como la disminución en el número de núcleos del radioisótopo por unidad de tiempo:
\( A=-\dfrac{\Delta N}{\Delta t} \tag{14.5.4}\)
La actividad generalmente se mide en desintegraciones por segundo (dps) o desintegraciones por minuto (dpm).
La actividad de una muestra es directamente proporcional al número de átomos del isótopo radiactivo en la muestra:
\( A=kN \tag{14.5.5}\)
Aquí, el símbolo k es la constante de desintegración radiactiva, que tiene unidades de tiempo inverso (por ejemplo, s-1, yr -1) y un valor característico para cada isótopo radiactivo. Si combinamos la Ecuación 14.5.4 y la Ecuación 14.5.6 obtenemos la relación entre el número de desintegraciones por unidad de tiempo y el número de átomos del isótopo en una muestra:
\( -\dfrac{\Delta N}{\Delta t}=kN \tag{14.5.6}\)
La ecuación 14.5.6 es la misma que la ecuación para la velocidad de reacción de una reacción de primer orden (Ecuación 14.3.5), excepto que usa números de átomos en lugar de concentraciones. De hecho, la desintegración radiactiva es un proceso de primer orden y puede describirse en términos de la ley de tasa diferencial (Ecuación 14.4.7) o la ley de tasa integrada:
\( N=N_{0}e^{-kt} \tag{14.5.7}\)
\( ln \dfrac{N}{N_{0}}=-kt \tag{14.5.8} \)
Porque la desintegración radiactiva es un proceso de primer orden, el tiempo requerido para que la mitad de los núcleos en cualquier muestra de un isótopo radiactivo se descomponga es una constante, llamado la vida media del isótopo. La vida media nos dice cuán radiactivo es un isótopo (el número de desintegraciones por unidad de tiempo); por lo tanto, es la propiedad más comúnmente citada de cualquier radioisótopo. Para un número dado de átomos, los isótopos con vidas medias más cortas se descomponen más rápidamente, experimentando un mayor número de desintegraciones radiactivas por unidad de tiempo que los isótopos con vidas medias más largas. Las vidas medias de varios isótopos se enumeran en el Cuadro 14.5.1, junto con algunas de sus aplicaciones.
Cuadro 14.5.1 Vida media y aplicaciones de algunos isótopos radiactivos
| Isótopo radiactivo | Half-Vida | Usos Típicos |
|---|---|---|
| hidrógeno-3 (tritio) | 12.32 años | trazador bioquímico |
| carbono-11 | 20.33 min | tomografía por emisión de positrones (imagen biomédica) |
| carbono-14 | 5.70 × 10 3 años | datación de artefactos |
| sodio-24 | 14.951 h | trazador del sistema cardiovascular |
| fósforo-32 | 14.26 días | trazador bioquímico |
| potasio-40 | 1.248 × 10 9 años | datación de rocas |
| hierro-59 | 44.495 días | trazador de por vida de glóbulos rojos |
| cobalto-60 | 5.2712 años | radioterapia para el cáncer |
| tecnecio-99 m * | 6.006 h | imágenes biomédicas |
| yodo-131 | 8.0207 días | estudios tiroideos trazador |
| radio-226 | 1.600 × 10 3 años | radioterapia para el cáncer |
| uranio-238 | 4.468 × 10 9 años | datación de rocas y corteza terrestre |
| americio-241 | 432.2 años | detectores de humo |
| *La m denota metaestable, donde un núcleo de estado excitado decae al estado fundamental del mismo isótopo. | ||
Tenga en cuenta el patrón
La desintegración radiactiva es un proceso de primer orden.
Técnicas de datación por radioisótopos
En nuestra discusión anterior, utilizamos la vida media de una reacción de primer orden para calcular cuánto tiempo había estado ocurriendo la reacción. Debido a que las reacciones de desintegración nuclear siguen una cinética de primer orden y tienen una constante de velocidad que es independiente de la temperatura y del entorno químico o físico, podemos realizar cálculos similares utilizando las vidas medias de los isótopos para estimar las edades de los artefactos geológicos y arqueológicos. Las técnicas que se han desarrollado para esta aplicación se conocen como técnicas de datación por radioisótopos.
El método más común para medir la edad de los objetos antiguos es la datación por carbono-14. El isótopo carbono-14, creado continuamente en las regiones altas de la atmósfera terrestre, reacciona con el oxígeno atmosférico u ozono para formar 14 CO 2. Como resultado, el CO 2 que las plantas utilizan como fuente de carbono para sintetizar compuestos orgánicos siempre incluye una cierta proporción de 14 moléculas de CO 2 así como 12 CO 2 y 13 CO 2 no radiactivas. Cualquier animal que come una planta ingiere una mezcla de compuestos orgánicos que contiene aproximadamente las mismas proporciones de isótopos de carbono que los de la atmósfera. Cuando el animal o la planta muere, los núcleos de carbono-14 en sus tejidos se descomponen a núcleos de nitrógeno-14 por un proceso radiactivo conocido como desintegración beta, que libera electrones de baja energía (partículas β) que pueden detectarse y medirse:
\( ^{14}C\rightarrow ^{14}N + \beta ^{-} \tag{14.5.8} \)
La vida media para esta reacción es de 5700 ± 30 años.
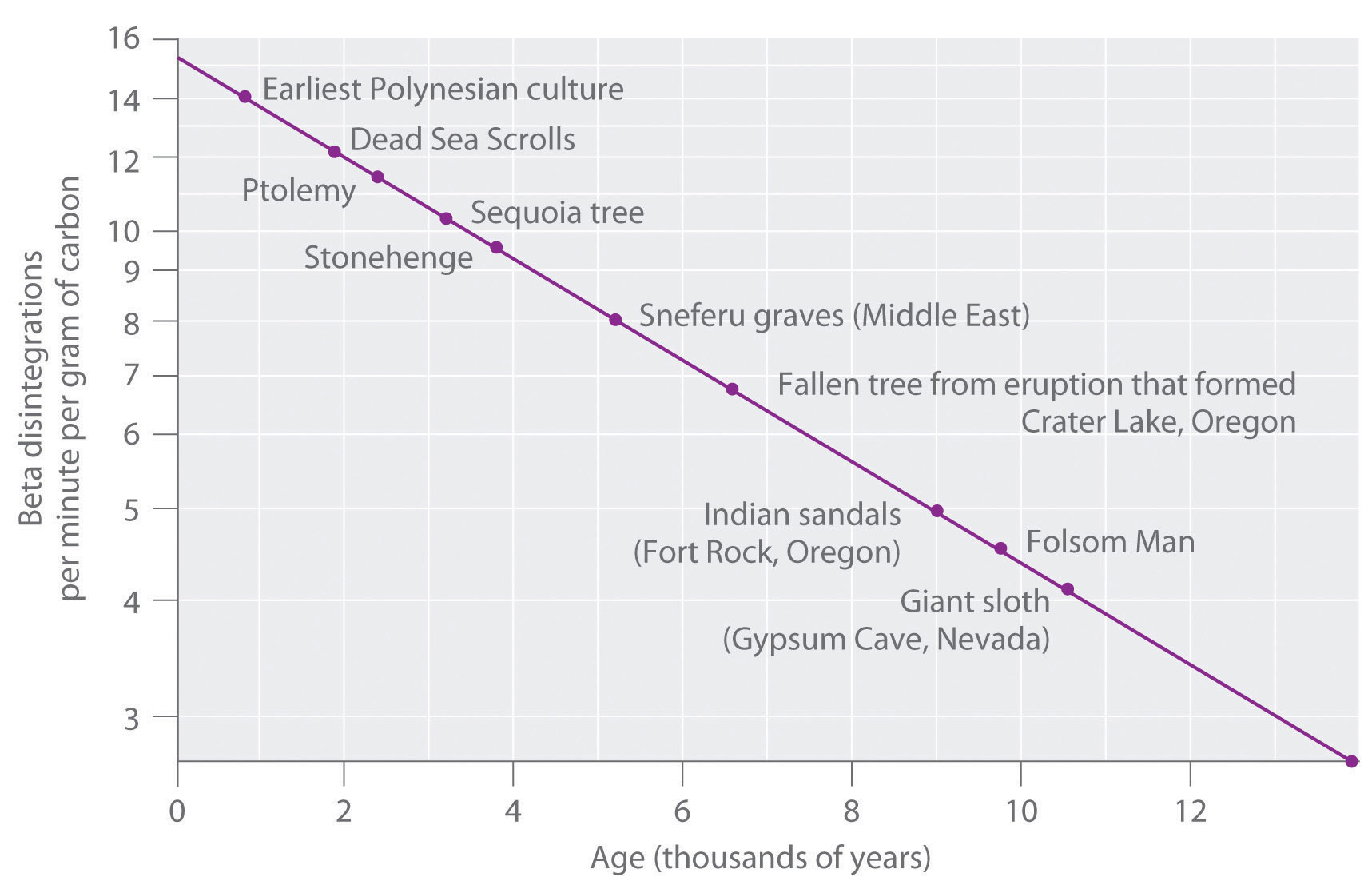
La relación 14 C/ 12 C en organismos vivos es de 1.3 × 10 −12, con una tasa de desintegración de 15 dpm/g de carbono (Figura 14.18). La comparación de las desintegraciones por minuto por gramo de carbono de una muestra arqueológica con las de una muestra recientemente viva permite a los científicos estimar la edad del artefacto, como se ilustra en el Ejemplo 11. Mediante este método se asume implícitamente que la relación 14 CO 2/12 CO 2 en la atmósfera es constante, lo cual no es estrictamente correcto. Otros métodos, como la datación por anillos de árboles, se han utilizado para calibrar las fechas obtenidas por la datación por radiocarbono, y todas las fechas de radiocarbono reportadas ahora se corrigen por cambios menores en la relación 14 CO 2/12 CO 2 a lo largo del tiempo.
Figura 14.5.2 Datación por radiocarbono Una gráfica de la actividad específica de 14 C versus edad para varias muestras arqueológicas muestra una relación lineal inversa entre el contenido de 14 C (una escala logarítmica) y la edad (una escala lineal).
Ejemplo 14.5.2
En 1990, los restos de un hombre aparentemente prehistórico fueron encontrados en un glaciar que se derritió en los Alpes italianos. El análisis del contenido de 14 C de muestras de madera de sus herramientas dio una tasa de descomposición de 8.0 dpm/g de carbono. ¿Cuánto tiempo hace que murió el hombre?
Dado: isótopo y actividad final
Preguntado por: tiempo transcurrido
Estrategia:
A Usar la Ecuación 14.5.5 para calcular N 0/N. Después, sustituya el valor de la semivida de 14 C en la Ecuación 14.5.3 para encontrar la constante de velocidad para la reacción.
B Utilizando los valores obtenidos para N 0/N y la constante de velocidad, resolver la Ecuación 14.5.7 para obtener el tiempo transcurrido.
Solución:
Se conoce la actividad inicial a partir de la identidad del isótopo (15 dpm/g), la actividad final (8.0 dpm/g) y la vida media, por lo que podemos usar la ley de velocidad integrada para una reacción nuclear de primer orden (Ecuación 14.5.7) para calcular el tiempo transcurrido (la cantidad de tiempo transcurrido desde la madera para las herramientas fue cortado y comenzó a decairse).
\( ln \dfrac{N}{N_{0}}=-kt \)
\( \dfrac{ln \left (N_{0}/N \right )}{k}=t \)
A A partir de la Ecuación 14.5 .5, sabemos que A = kN. Por lo tanto, podemos usar las actividades inicial y final (A 0 = 15 dpm y A = 8.0 dpm) para calcular N 0/N:
\( \dfrac{A_{0}}{A}= \dfrac{\cancel{k}N_{0}}{\cancel{k}N}=\dfrac{N_{0}}{N}=\dfrac{15.}{8.0} \)
Ahora solo necesitamos calcular la constante de velocidad para la reacción a partir de su vida media (5730 años) usando la Ecuación 14.5.3:
\( t_{1/2}=\dfrac{0.693}{k} \)
Esta ecuación se puede reorganizar de la siguiente manera:
\( k=\dfrac{0.693}{t_{1/2}}=\dfrac{0.693}{5730\;yr}=1.22 \times 10^{-4} \; yr^{-1} \)
B Sustituyendo en la ecuación por t,
\( t=\dfrac{ln\left ( N_{0}/N \right )}{k}=\dfrac{ln\left ( 15./8.0 \right )}{1.22 \times 10^{-4} \; yr^{-1}}=5.2 \times 10^{3} \; yr \)
De nuestros cálculos, el hombre murió hace 5200 años.
Ejercicio
Se cree que los humanos llegaron por primera vez al hemisferio occidental durante la última Edad de Hielo, presumiblemente al viajar sobre un puente terrestre expuesto entre Siberia y Alaska. Los arqueólogos han estimado que esto ocurrió hace unos 11,000 años, pero algunos argumentan que los descubrimientos recientes en varios sitios en América del Norte y del Sur sugieren una llegada mucho más temprana. El análisis de una muestra de carbón vegetal de un incendio en uno de esos sitios dio una tasa de desintegración de 14 C de 0.4 dpm/g de carbono. ¿Cuál es la edad aproximada de la muestra?
Respuesta: 30,000 yr
Resumen
La vida media de una reacción es el tiempo requerido para que la concentración del reactivo disminuya a la mitad de su valor inicial. La vida media de una reacción de primer orden es una constante que se relaciona con la constante de velocidad para la reacción: t 1/2 = 0.693/ k.
Las reacciones de desintegración radiactiva son reacciones de primer orden. La tasa de desintegración, o actividad, de una muestra de una sustancia radiactiva es la disminución en el número de núcleos radiactivos por unidad de tiempo.
Claves para llevar
- La vida media de una reacción de primer orden es independiente de la concentración de los reactivos.
- Las vidas medias de los isótopos radiactivos se pueden utilizar para fechar objetos.
Ecuaciones Clave
vida media de reacción de primer orden
Ecuación 14.5.3\( t_{1/2}=\dfrac{0.693}{k} \)
desintegración radiactiva
Ecuación 14.5 .5:\( A=kN \)
Problemas conceptuales
-
¿Qué quieren decir los químicos con la vida media de una reacción?
-
Si una muestra de un isótopo sufre más desintegraciones por segundo que el mismo número de átomos de otro isótopo, ¿cómo se comparan sus vidas medias?
Problemas numéricos
-
Las vidas medias para la reacción A + B → C se calcularon a tres valores de [A] 0, y [B] fue igual en todos los casos. Los datos se enumeran en la siguiente tabla:
[A] 0 (M) t ½ (s) 0.50 420 0.75 280 1.0 210 ¿Esta reacción sigue la cinética de primer orden? ¿En qué basas tu respuesta?
-
El 2-nitrobenzoato de etilo (NO 2 C 6 H 4 CO 2 C 2 H 5) se hidroliza en condiciones básicas. Se utilizó una parcela de [NO 2 C 6 H 4 CO 2 C 2 H 5] versus t para calcular t ½, con los siguientes resultados:
[NO 2 C 6 H 4 CO 2 C 2 H 5] (M/cm 3) t ½ (s) 0.050 240 0.040 300 0.030 400 ¿Es esta una reacción de primer orden? Explica tu razonamiento.
-
El azometano (CH 3 N 2 CH 3) se descompone a 600 K a C 2 H 6 y N 2. La descomposición es de primer orden en azometano. Calcular t ½ a partir de los datos de la siguiente tabla:
Tiempo (s) P Azometano (atm) 0 8.2 × 10 −2 2000 3.99 × 10 −2 4000 1.94 × 10 −2 ¿Cuánto tiempo tardará en completarse 99.9% la descomposición?
-
La descomposición de primer orden del peróxido de hidrógeno tiene una vida media de 10.7 h a 20°C. ¿Cuál es la constante de velocidad (expresada en s −1) para esta reacción? Si empezaste con una solución que fuera 7.5 × 10 −3 M H 2 O 2, ¿cuál sería la tasa inicial de descomposición (M/s)? ¿Cuál sería la concentración de H 2 O 2 después de 3.3 h?
RESPUESTAS
-
No; la reacción es de segundo orden en A debido a que la vida media disminuye al aumentar la concentración de reactivos según t 1/2 = 1/ k [A 0].
-
t 1/2 = 1.92 × 10 3 s o 1920 s; 19100 s o 5.32 hrs.
Colaboradores
- Anonymous
Modificado por Joshua B. Halpern