14.7: Velocidades de Reacción - Una Vista Microscópica
- Page ID
- 78277
- Determinar los pasos individuales de una reacción simple.
Una de las principales razones para estudiar la cinética química es utilizar mediciones de las propiedades macroscópicas de un sistema, como la velocidad de cambio en la concentración de reactivos o productos con el tiempo, para descubrir la secuencia de eventos que ocurren a nivel molecular durante una reacción. Esta descripción molecular es el mecanismo de la reacción; describe cómo los átomos, iones o moléculas individuales interactúan para formar productos particulares. Los cambios paso a paso se denominan colectivamente el mecanismo de reacción.
En un motor de combustión interna, por ejemplo, el isooctano reacciona con el oxígeno para dar dióxido de carbono y agua:
\( 2C_{8}H_{18}\left ( l \right ) + 25O_{2}\left ( g \right ) \rightarrow 16CO_{2}\left ( g \right ) + 18H_{2}O\left ( g \right ) \tag{14.6.1}\)
Para que esta reacción ocurra en una sola etapa, 25 moléculas de dioxígeno y 2 moléculas de isooctano tendrían que colisionar simultáneamente y convertirse en 34 moléculas de producto, lo cual es muy poco probable. Es más probable que una serie compleja de reacciones tenga lugar de manera escalonada. Cada reacción individual, que se denomina reacción elemental Cada una de las complejas series de reacciones que tienen lugar de manera escalonada para convertir los reactivos en productos. , involucra uno, dos o (raramente) tres átomos, moléculas o iones. La secuencia general de reacciones elementales es el mecanismo de la reacción. La suma de los pasos individuales, o reacciones elementales, en el mecanismo debe dar la ecuación química equilibrada para la reacción global.
Molecularidad y el paso de determinación de la velocidad
Para demostrar cómo el análisis de reacciones elementales nos ayuda a determinar el mecanismo general de reacción, examinaremos la reacción mucho más simple del monóxido de carbono con el dióxido de nitrógeno.
\( NO_{2}\left ( g \right ) + CO\left ( g \right ) \rightarrow NO\left ( g \right ) + CO_{2} \left ( g \right ) \tag{14.6.2}\)
A partir de la ecuación química equilibrada, se podría esperar que la reacción se produzca a través de una colisión de una molécula de NO 2 con una molécula de CO que resulte en la transferencia de un átomo de oxígeno de nitrógeno a carbono. La ley de velocidad determinada experimentalmente para la reacción, sin embargo, es la siguiente:
\( rate = k\left [ NO_{2} \right ]^{2} \tag{14.6.3} \)
El hecho de que la reacción sea de segundo orden en [NO 2] e independiente de [CO] nos dice que no ocurre por el simple modelo de colisión esbozado anteriormente. Si lo hiciera, su ley de tasa pronosticada sería tasa = k [NO 2] [CO].
El siguiente mecanismo de dos pasos es consistente con la ley de tasa si el paso 1 es mucho más lento que el paso 2:
\ (\ begin {matrix}paso\; 1 & NO_ {2} + NO_ {2}\ overset {lento} {\ fila derecha} NO_ {3} + NO & elemental\; reacción\\
paso\; 2 &\ subrayado {NO_ {3} + CO\ fila derecha NO_ {2} + CO_ {2}} & elemental\; reacción\\
suma y NO_ {2}} + CO\ fila derecha NO + CO_ {2} & amp; reacción global
\ final {matriz}\)
De acuerdo con este mecanismo, la reacción global ocurre en dos etapas, o reacciones elementales. Sumar los pasos 1 y 2 y cancelar en ambos lados de la ecuación da la ecuación química equilibrada general para la reacción. La molécula de NO 3 es una especie intermedia A en un mecanismo de reacción que no aparece en la ecuación química equilibrada para la reacción global. en la reacción, una especie que no aparece en la ecuación química equilibrada para la reacción global. Se forma como producto del primer paso pero se consume en el segundo paso.
Tenga en cuenta el patrón
La suma de las reacciones elementales en un mecanismo de reacción debe dar la ecuación química equilibrada global de la reacción.
Uso de la Molecularidad para Describir una Ley de Tasas
La molecularidad El número de moléculas que colisionan durante cualquier etapa en un mecanismo de reacción. de una reacción elemental es el número de moléculas que chocan durante ese paso en el mecanismo. Si solo hay una sola molécula reaccionante en una reacción elemental, ese paso se designa como unimolecular; si hay dos moléculas reaccionantes, es bimolecular; y si hay tres moléculas reaccionantes (una situación relativamente rara), es termolecular. Las reacciones elementales que implican la colisión simultánea de más de tres moléculas son altamente improbables y nunca se han observado experimentalmente. (Para entender por qué, ¡intenta hacer que tres o más canicas o bolas de billar choquen entre sí simultáneamente!)
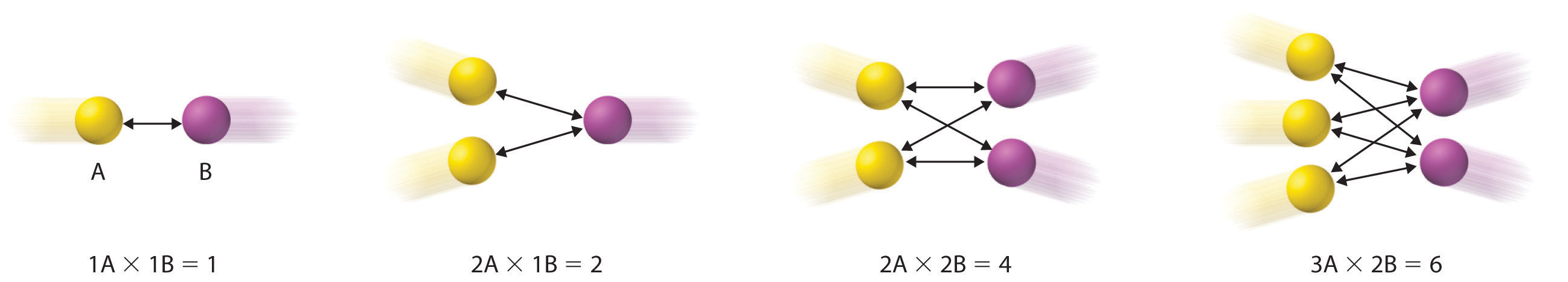
Escribir la ley de velocidad para una reacción elemental es sencillo porque sabemos cuántas moléculas deben colisionar simultáneamente para que ocurra la reacción elemental; de ahí que el orden de la reacción elemental sea el mismo que su molecularidad (Cuadro 14.6.1). Por el contrario, la ley de velocidad para la reacción no se puede determinar a partir de la ecuación química equilibrada para la reacción global. La ley general de velocidad para una reacción elemental unimolecular (A → productos) es la velocidad = k [A]. Para las reacciones bimoleculares, la velocidad de reacción depende del número de colisiones por unidad de tiempo, que es proporcional al producto de las concentraciones de los reactivos, como se muestra en la Figura 14.6.1 Para una reacción elemental bimolecular de la forma A + B → productos, la ley general de velocidad es velocidad = k [A] [B].
Tabla 14.6.1 Tipos comunes de reacciones elementales y sus leyes de tasa
| Reacción elemental | Molecularidad | Ley de tarifas | Orden de reacción |
|---|---|---|---|
| A → productos | unimolecular | tasa = k [A] | primero |
| 2A → productos | bimolecular | tasa = k [A] 2 | segundo |
| A + B → productos | bimolecular | tasa = k [A] [B] | segundo |
| 2A + B → productos | termolecular | tasa = k [A] 2 [B] | tercero |
| A + B + C → productos | termolecular | tasa = k [A] [B] [C] | tercero |
Figura 14.6.1 La base para escribir leyes de tasa de reacciones elementales Este diagrama ilustra cómo el número de posibles colisiones por unidad de tiempo entre dos especies reaccionantes, A y B, depende del número de partículas A y B presentes. El número de colisiones entre partículas A y B aumenta a medida que el producto del número de partículas, no como la suma. Es por ello que la ley de velocidad para una reacción elemental depende del producto de las concentraciones de las especies que chocan en ese paso.
Identificar el paso de determinación de la tasa
Tenga en cuenta la diferencia importante entre las leyes de velocidad de escritura para reacciones elementales y la ecuación química equilibrada de la reacción general. Debido a que la ecuación química equilibrada no revela necesariamente las reacciones elementales individuales por las cuales se produce la reacción, no podemos obtener la ley de velocidad para una reacción a partir de la ecuación química equilibrada global por sí sola. De hecho, es la ley de velocidad para la reacción general más lenta, que es la misma que la ley de velocidad para el paso más lento en el mecanismo de reacción, el paso determinante de velocidad El paso más lento en un mecanismo de reacción. , que debe dar la ley de velocidad determinada experimentalmente para la reacción general. Esta afirmación es cierta si un paso es sustancialmente más lento que todos los demás, típicamente por un factor de 10 o más. Si dos o más pasos lentos tienen tasas comparables, las leyes de tasas determinadas experimentalmente pueden volverse complejas. Nuestra discusión se limita a reacciones en las que un paso puede identificarse como sustancialmente más lento que cualquier otro. La razón de esto es que cualquier proceso que ocurra a través de una secuencia de pasos puede tener lugar no más rápido que el paso más lento de la secuencia. En una línea de ensamblaje automotriz, por ejemplo, un componente no se puede usar más rápido de lo que se produce. De igual manera, la presión arterial está regulada por el flujo de sangre a través de los conductos más pequeños, los capilares. Debido a que el movimiento a través de los capilares constituye el paso determinante de la velocidad en el flujo sanguíneo, la presión arterial puede ser regulada por medicamentos que hacen que los capilares se contraigan o dilaten. Una reacción química que se produce a través de una serie de reacciones elementales no puede tener lugar más rápido que el paso más lento de la serie de reacciones.
Paso determinante de la tasa. El fenómeno de un paso determinante de la tasa puede compararse con una sucesión de embudos. El embudo de menor diámetro controla la velocidad a la que se llena la botella, ya sea la primera o la última de la serie. Verter líquido en el primer embudo más rápido de lo que puede drenar a través de los resultados más pequeños en un desbordamiento.
Mire las leyes de velocidad para cada reacción elemental en nuestro ejemplo, así como para la reacción general.
\ (\ begin {matrix}paso\; 1 & NO_ {2} + NO_ {2}\ overset {k_ {1}} {\ rightarrow} NO_ {3} + NO & rate=k_ {1}\ left [NO_ {2}\ right] ^ {2} predicho\\
paso\; 2 &\ subrayado {NO_ {3} + CO\ overset {k_ {2}} {\ fila derecha} NO_ {2} + CO_ {2}} & tasa=k_ {2}\ izquierda [NO_ {3}\ derecha]\ izquierda [CO _ {2}\ derecha] predicho\\
suma y NO_ {2} + CO\ overset {k} {\ rightarrow} NO + CO_ {2} & rate=k\ left [NO_ {2}\ right] ^ {2} observado
\ end {matrix}\)
La ley de velocidad determinada experimentalmente para la reacción de NO 2 con CO es la misma que la ley de velocidad predicha para el paso 1. Esto nos dice que la primera reacción elemental es el paso determinante de la velocidad, por lo que k para la reacción general debe ser igual a k 1. Es decir, el NO 3 se forma lentamente en el paso 1, pero una vez que se forma, reacciona muy rápidamente con el CO en el paso 2.
En ocasiones los químicos son capaces de proponer dos o más mecanismos que son consistentes con los datos disponibles. Sin embargo, si un mecanismo propuesto predice la ley de tasa experimental incorrecta, el mecanismo debe ser incorrecto.
Ejemplo 14.6.1
En un mecanismo alternativo para la reacción de NO 2 con CO, N 2 O 4 aparece como intermedio.
\ (\ begin {matrix}paso\; 1 & NO_ {2} + NO_ {2}\ overset {k_ {1}} {\ fila derecha} N_ {2} O_ {4}\
paso\; 2 &\ subrayado {N_ {2} O_ {4} + CO\ overset {k_ {2}} {\ rightarrow} NO+ {2}} + CO_ {2}}\\
suma y NO_ {2} + CO\ fila derecha NO + CO_ {2}
\ final {matriz}\)
Escribe la ley de tarifas para cada reacción elemental. ¿Este mecanismo es consistente con la ley de tasas determinada experimentalmente (tasa = k [NO 2] 2)?
Dado: reacciones elementales
Preguntado por: ley de tarifas para cada reacción elemental y ley general de tarifas
Estrategia:
A Determinar la ley de velocidad para cada reacción elemental en la reacción.
B Determinar qué ley de velocidad corresponde a la ley de velocidad determinada experimentalmente para la reacción. Esta ley de tarifas es la indicada para el paso determinante de la tasa.
Solución:
A La ley de tasa para el paso 1 es tasa = k 1 [NO 2] 2; para el paso 2, es tasa = k 2 [N 2 O 4] [CO].
B Si el paso 1 es lento (y por lo tanto el paso determinante de la velocidad), entonces la ley de velocidad general para la reacción será la misma: velocidad = k 1 [NO 2] 2. Esto es lo mismo que la ley de tarifas determinada experimentalmente. De ahí que este mecanismo, con N 2 O 4 como intermedio, y el descrito anteriormente, con NO 3 como intermedio, son cinéticamente indistinguibles. En este caso, se necesitan más experimentos para distinguir entre ellos. Por ejemplo, el investigador podría intentar detectar los intermedios propuestos, NO 3 y N 2 O 4, directamente.
Ejercicio A
El monocloruro de yodo (ICl) reacciona con H 2 de la siguiente manera:
\( 2ICl \left ( g \right ) + H_{2}\left ( g \right ) \rightarrow HCl\left ( g \right ) + I_{2} \left ( s \right ) \)La ley de tasa determinada experimentalmente es la tasa = k [iCl] [H 2]. Escribir un mecanismo de dos pasos para esta reacción usando solo reacciones elementales bimoleculares y demostrar que es consistente con la ley de velocidad experimental. (Pista: HI es un intermedio.)
Responder
\ (\ begin {matrix}paso\; 1 & iCl+ H_ {2}\ overset {k_ {1}} {\ fila derecha} HCl + HI & tasa = k_ {1}\ izquierda [iCL\ derecha]\ izquierda [H_ {2}\ derecha] lento\
paso\; 2 &\ subrayado {HI + iCL\ overset {k_ {2}} {fila derecha} HCl + I_ {2}} y tasa = k_ {2}\ izquierda [HI\ derecha]\ izquierda [iCL\ derecha] rápido\\
suma y 2iCL + H_ {2}\ fila derecha 2HCl + I_ {2}
\ final {matriz}\)
Este mecanismo es consistente con la ley de tasa experimental si el primer paso es el paso determinante de la tasa.
Ejercicio B
La reacción entre NO y H 2 se produce a través de un proceso de tres etapas:
\ (\ begin {matrix}paso\; 1 & NO + NO\ overset {k_ {1}} {\ fila derecha} N_ {2} O_ {2} + NO & rápido\\
paso\; 2 & N_ {2} O_ {2} + H_ {2}\ overset {k_ {2}} {\ fila derecha} N_ {2} O + H_ {2} O & lento\\
paso 3 & N_ {2} O + H_ {2}\ overset {k_ {3}} {\ fila derecha} N_ {2} + H_ {2} O & amp; rápido
\ end {matriz}\)
Escriba la ley de velocidad para cada reacción elemental, escriba la ecuación química equilibrada para la reacción general e identifique el paso determinante de la velocidad. ¿La ley de velocidad para el paso determinante de la velocidad es consistente con la ley de velocidad derivada experimentalmente para la reacción general: velocidad = k [NO] 2 [H 2] 2?
Responder
- tasa = k 1 [NO] 2;
- tasa = k 2 [N 2 O 2] [H 2];
- tasa = k 3 [N 2 O] [H 2];
- 2NO (g) + 2H 2 (g) → N 2 (g) + 2H 2 O (g)
- paso 2
- Sí, porque la tasa de formación de [N 2 O 2] = k 1 [NO] 2. Sustituir k 1 [NO] 2 por [N 2 O 2] en la ley de velocidad para el paso 2 da la ley de velocidad derivada experimentalmente para la reacción química global, donde k = k 1 k 2.
Reacciones en Cadena
Muchos mecanismos de reacción, como los discutidos hasta ahora, consisten en sólo dos o tres reacciones elementales. Muchos otros consisten en largas series de reacciones elementales. Los mecanismos más comunes son las reacciones en cadena Un mecanismo de reacción en el que una o más reacciones elementales que contienen una especie altamente reactiva se repiten una y otra vez durante el proceso de reacción. , en el que una o más reacciones elementales que contienen una especie altamente reactiva se repiten una y otra vez durante el proceso de reacción. Las reacciones en cadena ocurren en la combustión de combustible, explosiones, la formación de muchos polímeros y los cambios de tejido asociados con el envejecimiento. También son importantes en la química de la atmósfera.
Las reacciones en cadena se describen como que tienen tres etapas. El primero es la iniciación, un paso que produce uno o más intermedios reactivos. A menudo estos intermedios son radicales Especies que tienen uno o más electrones de valencia desapareados. , especies que tienen un electrón de valencia desapareado. En la segunda etapa, propagación, los intermedios reactivos se consumen continuamente y se regeneran mientras se forman los productos. Los intermedios también se consumen pero no se regeneran en la etapa final de una reacción en cadena, terminación, generalmente formando productos estables.
Veamos la reacción del metano con cloro a temperaturas elevadas (400°C—450°C), una reacción en cadena utilizada en la industria para fabricar cloruro de metilo (CH 3 Cl), diclorometano (CH 2 Cl 2), cloroformo (CHCl 3) y tetracloruro de carbono (CCl 4) :
\( CH_{4} + Cl_{2} \rightarrow CH_{3}Cl + HCl \)
\( CH_{3}Cl + Cl_{2} \rightarrow CH_{2}Cl_{2} + HCl \)
\(CH_{2}Cl_{2} + Cl_{2} \rightarrow CHCl_{3} + HCl \)
\(CHCl_{3} + Cl_{2} \rightarrow CCl_{4} + HCl \)
La cloración directa generalmente produce una mezcla de los cuatro productos que contienen carbono, que luego deben separarse por destilación. En nuestra discusión, examinaremos únicamente las reacciones en cadena que conducen a la preparación de CH 3 Cl.
En la etapa de iniciación de esta reacción, el enlace Cl-Cl relativamente débil se escinde a temperaturas de aproximadamente 400°C para producir átomos de cloro (Cl·):
\( Cl_{2}\rightarrow 2Cl\cdot \)Durante la propagación, un átomo de cloro elimina un átomo de hidrógeno de una molécula de metano para dar HCl y CH 3 ·, el radical metilo:
\( Cl\cdot + CH_{4} \rightarrow CH_{3} \cdot + HCl \)El radical metilo reacciona entonces con una molécula de cloro para formar cloruro de metilo y otro átomo de cloro, Cl·:
\( CH_{3} \cdot + Cl_{2}\rightarrow CH_{3}Cl + Cl\cdot \)La suma de las reacciones de propagación es la misma que la ecuación química equilibrada global para la reacción:
\ (\ comenzar {matriz}\ cancelar {Cl\ cdot} + CH_ {4}\ fila derecha\ cancelar {CH_ {3}\ cdot} + HCl\\
\ subrayado {\ cancelar {CH_ {3}\ cdot} + Cl_ {2}\ fila derecha CH_ {3} Cl +\ cancelar {Cl\ cdot}}\
Cl_ {2} + CH_ {4}\ fila derecha CH_ {3} Cl + HCl
\ final {matriz}\)
Sin una reacción de terminación de cadena, las reacciones de propagación continuarían hasta que se consumiera el metano o el cloro. Debido a que las especies radicales reaccionan rápidamente con casi cualquier cosa, sin embargo, incluyéndose entre sí, eventualmente forman compuestos neutros, terminando así la reacción en cadena de cualquiera de tres maneras:
\ (\ comenzar {matriz}CH_ {3}\ cdot + Cl\ cdot\ fila derecha CH_ {3} Cl\\
CH_ {3}\ cdot + CH_ {3}\ cdot\ cdot\ fila derecha H_ {3} CCH_ {3}\
Cl\ cdot + Cl\ cdot\ cdot\ fila derecha Cl_ {2}
\ final {matriz}
Aquí está la reacción en cadena global, con el producto deseado (CH 3 Cl) en negrita:
| Iniciación: | Cl 2 → 2Cl· |
| Propagación: | Cl· + CH 4 → CH 3 · + HCl |
| CH 3 · + Cl 2 → CH 3 Cl + Cl· | |
| Terminación: | CH 3 · + Cl· → CH 3 Cl |
| CH 3 · + CH 3 · → H 3 CCH 3 | |
| Cl· + Cl· → Cl 2 |
Las reacciones en cadena responsables de las explosiones generalmente tienen una característica adicional: la existencia de uno o más pasos de ramificación de cadena, en los que un radical reacciona para producir dos o más radicales, cada uno de los cuales puede continuar para iniciar una nueva reacción en cadena. La repetición de la etapa de ramificación tiene un efecto de cascada tal que una sola etapa de iniciación genera un gran número de reacciones en cadena. El resultado es una reacción muy rápida o una explosión.
La reacción de H 2 y O 2, utilizada para propulsar cohetes, es un ejemplo de una reacción de ramificación en cadena:
| Iniciación: | H 2 + O 2 → HO 2 · + H· |
| Propagación: | HO 2 · + H 2 → H 2 O + OH· |
| OH· + H 2 → H 2 O + H· | |
| Terminación: | H· + O 2 → OH· + ·O· |
| ·O· + H 2 → OH· + H· |
Las reacciones de terminación ocurren cuando los radicales H· u OH· extraordinariamente reactivos reaccionan con una tercera especie. La complejidad de una reacción en cadena hace que sea inviable escribir una ley de velocidad para la reacción general.
Resumen
Un mecanismo de reacción es la trayectoria microscópica por la cual los reactivos se transforman en productos. Cada paso es una reacción elemental. Las especies que se forman en un paso y se consumen en otro son intermedias. Cada reacción elemental puede describirse en términos de su molecularidad, el número de moléculas que chocan en ese paso. El paso más lento en un mecanismo de reacción es el paso determinante de la velocidad. Las reacciones en cadena consisten en tres tipos de reacciones: iniciación, propagación y terminación. Los intermedios en las reacciones en cadena suelen ser radicales, especies que tienen un electrón de valencia desapareado.
Llave para llevar
- Una reacción química equilibrada no revela necesariamente ni las reacciones elementales individuales por las que se produce una reacción ni su ley de velocidad.
Problemas conceptuales
-
¿Cómo se relaciona el término molecularidad con las reacciones elementales? ¿Cómo se relaciona con la ecuación química equilibrada global?
-
¿Cuál es la relación entre el orden de reacción y la molecularidad de una reacción? ¿Cuál es la relación entre el orden de reacción y la ecuación química equilibrada?
-
Cuando se determina la ley de velocidad para una reacción dada, ¿por qué es válido suponer que la concentración de un intermedio no cambia con el tiempo durante el transcurso de la reacción?
-
Si conoce la ley de tasas para una reacción general, ¿cómo determinaría qué reacción elemental es la que determina la velocidad? Si un intermedio está contenido en la etapa de determinación de la velocidad, ¿cómo se puede derivar de este paso la ley de velocidad determinada experimentalmente para la reacción?
-
Dar el paso de determinación de la tasa para cada caso.
- El tráfico está respaldado en una autopista porque dos carriles se funden en uno.
- El gas fluye desde un cilindro presurizado equipado con un regulador de gas y luego se burbujea a través de una solución.
- Un documento que contiene texto y gráficos se descarga de Internet.
-
Antes de ser enviado a una tarea, un James Bond envejecido fue enviado a una granja de salud donde parte del enfoque del programa era purgar su cuerpo de radicales. ¿Por qué este objetivo se consideró importante para su salud?
Problemas numéricos
-
El ciclopropano, un anestésico leve, se reorganiza a propileno a través de una colisión que produce y destruye una especie energizada. Los pasos importantes en este reordenamiento son los siguientes:
donde M es cualquier molécula, incluyendo ciclopropano. Solo aquellas moléculas de ciclopropano con suficiente energía (denotadas con un asterisco) pueden reorganizarse a propileno. ¿Qué paso determina la constante de velocidad de la reacción general?
-
Por encima de aproximadamente 500 K, la reacción entre NO 2 y CO para producir CO 2 y NO sigue la ley de tasa de segundo orden Δ [CO 2] /Δ t = k [NO 2] [CO]. A temperaturas más bajas, sin embargo, la ley de tasa es Δ [CO 2] /Δ t = k′ [NO 2] 2, para lo cual se sabe que el NO 3 es un intermedio en el mecanismo. Proponer un mecanismo completo de baja temperatura para la reacción basado en esta ley de velocidad. ¿Qué paso es el más lento?
-
Nitramida (O 2 NNH 2) se descompone en solución acuosa a N 2 O y H 2 O. ¿Cuál es la ley de velocidad experimental (Δ [N 2 O] /Δ t) para la descomposición de nitramida si el mecanismo para la descomposición es el siguiente?
\ (\ begin {matrix}
O_ {2} NNH_ {2}\ xrightarrow [k_ {-1}] {k_ {1}} O_ {2} NNH^ {-} + H^ {+} y rápido\\
O_ {2} NNH^ {-}\ sobreajustado {k_ {2}} {\ fila derecha} N_ {2} O + OH^ {-} & lento\\
H^ {+} + OH^ {-}\ overset {k_ {3}} {\ fila derecha} H_ {2} O & rápido
\ fin {matriz}
\)Supongamos que las tasas de las reacciones hacia adelante y hacia atrás en la primera ecuación son iguales.
-
Se dan las siguientes reacciones:
\ (\ comenzar {matriz}
A + B\ xfila derecha [k_ {-1}] {k_ {1}} C + D\
D + E\ overset {k_ {2}} {\ fila derecha} F
\ final {matriz}
\)¿Cuál es la relación entre las magnitudes relativas de k −1 y k 2 si estas reacciones tienen la ley de velocidad Δ [F] /Δ t = k [A] [B] [E]/[C]? ¿Cómo se compara la magnitud de k 1 con la de k 2? ¿En qué condiciones esperarías que la ley de tasa sea Δ [F] /Δ t = k ′ [A] [B]? Supongamos que las tasas de las reacciones hacia adelante y hacia atrás en la primera ecuación son iguales.
RESPUESTAS
-
Es probable que el paso k 2 sea limitante de velocidad; la velocidad no puede continuar más rápido que el segundo paso.
-
\ (tasa = k_ {2}\ dfrac {k_ {1}\ izquierda [O_ {2} NNH_ {2}\ derecha]} {k_ {-1}\ izquierda [H^ {+}\ derecha]} = k\ dfrac {\ izquierda [O_ {2} NNH_ {2}\ derecha]} {\ izquierda [H^ {+}\ derecha]}
)