14.8: El modelo de colisión de la cinética química
- Page ID
- 78270
- Entender por qué y cómo ocurren las reacciones químicas.
En la Sección 14.6, usted vio que es posible utilizar estudios cinéticos de un sistema químico, como el efecto de cambios en las concentraciones de reactivos, para deducir eventos que ocurren a escala microscópica, como colisiones entre partículas individuales. Dichos estudios han llevado al modelo de colisión de la cinética química, que es una herramienta útil para comprender el comportamiento de las especies químicas reaccionantes. Según el modelo de colisión, una reacción química solo puede ocurrir cuando las moléculas, átomos o iones reaccionantes colisionan con más de una cierta cantidad de energía cinética y en la orientación adecuada. El modelo de colisión explica por qué, por ejemplo, la mayoría de las colisiones entre moléculas no resultan en una reacción química. Las moléculas de nitrógeno y oxígeno en un solo litro de aire a temperatura ambiente y 1 atm de presión chocan aproximadamente 10 30 veces por segundo. Si cada colisión produjera dos moléculas de NO, la atmósfera se habría convertido en NO y luego en NO 2 hace mucho tiempo. En cambio, en la mayoría de las colisiones, las moléculas simplemente rebotan entre sí sin reaccionar, tanto como las canicas rebotan entre sí cuando chocan. El modelo de colisión también explica por qué tales reacciones químicas ocurren más rápidamente a temperaturas más altas. Por ejemplo, las velocidades de reacción de muchas reacciones que ocurren a temperatura ambiente aproximadamente el doble con un aumento de temperatura de solo 10°C En esta sección, utilizaremos el modelo de colisión para analizar esta relación entre temperatura y velocidad de reacción.
Energía de activación
En el Capítulo 10 se discutió la teoría molecular cinética de los gases, la cual mostró que la energía cinética promedio de las partículas de un gas aumenta con el aumento de la temperatura. Debido a que la velocidad de una partícula es proporcional a la raíz cuadrada de su energía cinética, aumentar la temperatura también aumentará el número de colisiones entre moléculas por unidad de tiempo. Lo que la teoría molecular cinética de los gases no explica es por qué la velocidad de reacción de la mayoría de las reacciones se duplica aproximadamente con un aumento de temperatura de 10°C Este resultado es sorprendentemente grande considerando que un aumento de 10°C en la temperatura de un gas de 300 K a 310 K aumenta la energía cinética de las partículas en solo aproximadamente 4%, conduciendo a un aumento en la velocidad molecular de solo aproximadamente 2% y un aumento correspondientemente pequeño en el número de colisiones bimoleculares por unidad de tiempo.
El modelo de colisión de la cinética química explica este comportamiento al introducir el concepto de energía de activación (E a) La barrera energética o umbral que corresponde a la cantidad mínima de energía que deben tener las partículas en una reacción para reaccionar cuando se collidan. . Definiremos este concepto utilizando la reacción del NO con el ozono, que juega un papel importante en el agotamiento del ozono en la capa de ozono:
\( NO\left ( g \right ) + O_{3}\left ( g \right )\rightarrow NO_{2} \left ( g \right ) + O_{2}\left ( g \right ) \tag{14.7.1} \)
El aumento de la temperatura de 200 K a 350 K provoca que la constante de velocidad para esta reacción en particular aumente en un factor de más de 10, mientras que el aumento en la frecuencia de colisiones bimoleculares sobre este rango de temperatura es de solo 30%. Por lo tanto, algo que no sea un aumento en la tasa de colisión debe estar afectando la velocidad de reacción.
La velocidad de reacción, no la constante de velocidad, variará con la concentración. La constante de velocidad, sin embargo, varía con la temperatura. La Figura 14.. 7.1 muestra una gráfica de la constante de velocidad de la reacción de NO con O 3 a diversas temperaturas. La relación no es lineal sino que se asemeja a las relaciones observadas en las gráficas de presión de vapor versus temperatura (Capítulo 11) y de conductividad versus temperatura (Capítulo 12). En los tres casos, la forma de las gráficas resulta de una distribución de energía cinética sobre una población de partículas (electrones en el caso de la conductividad; moléculas en el caso de la presión de vapor; y moléculas, átomos o iones en el caso de las velocidades de reacción). Sólo una fracción de las partículas tiene suficiente energía para superar una barrera energética.
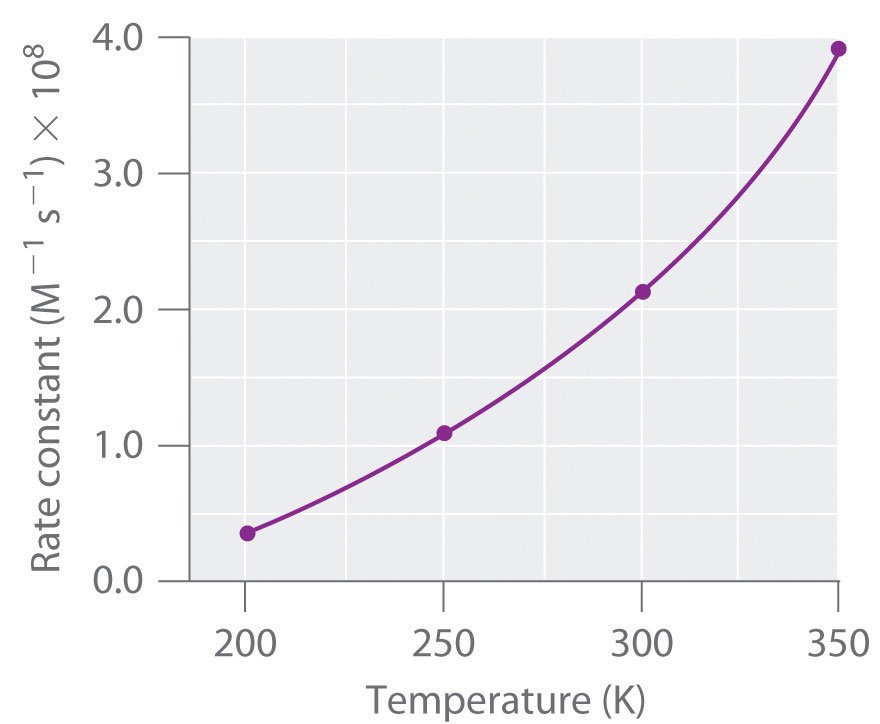
Figura 14.7.1 Constante de velocidad versus temperatura para la reacción de NO con O 3 La forma no lineal de la curva es causada por una distribución de energía cinética sobre una población de moléculas. Sólo una fracción de las partículas tiene suficiente energía para superar una barrera energética, pero a medida que aumenta la temperatura, el tamaño de esa fracción aumenta.
En el caso de la presión de vapor, las partículas deben superar una barrera energética para escapar de la fase líquida a la fase gaseosa. Esta barrera corresponde a la energía de las fuerzas intermoleculares que mantienen unidas las moléculas en el líquido. En conductividad, la barrera es la brecha de energía entre las bandas llenas y vacías. En las reacciones químicas, la barrera energética corresponde a la cantidad de energía que deben tener las partículas para reaccionar cuando chocan. Este umbral de energía, llamado la energía de activación, fue postulado por primera vez en 1888 por el químico sueco Svante Arrhenius (1859—1927; Premio Nobel de Química 1903). Es la cantidad mínima de energía necesaria para que ocurra una reacción. Las moléculas reaccionantes deben tener suficiente energía para superar la repulsión electrostática, y se requiere una cantidad mínima de energía para romper los enlaces químicos para que se puedan formar otros nuevos. Las moléculas que chocan con menos de la energía umbral rebotan entre sí químicamente sin cambios, con solo su dirección de desplazamiento y su velocidad alterada por la colisión. Las moléculas que son capaces de superar la barrera energética son capaces de reaccionar y formar una disposición de átomos llamada el complejo activado También llamado el estado de transición, la disposición de los átomos que primero se forma cuando las moléculas son capaces de superar la energía de activación y reaccionar. o el estado de transición También llamado el complejo activado, la disposición de los átomos que primero se forma cuando las moléculas son capaces de superar la energía de activación y reaccionar. de la reacción. El complejo activado no es un intermedio de reacción; no dura lo suficiente para ser detectado fácilmente.
Tenga en cuenta el patrón
Cualquier fenómeno que dependa de la distribución de la energía térmica en una población de partículas tiene una dependencia no lineal de la temperatura.
Graficando los cambios de energía durante una reacción
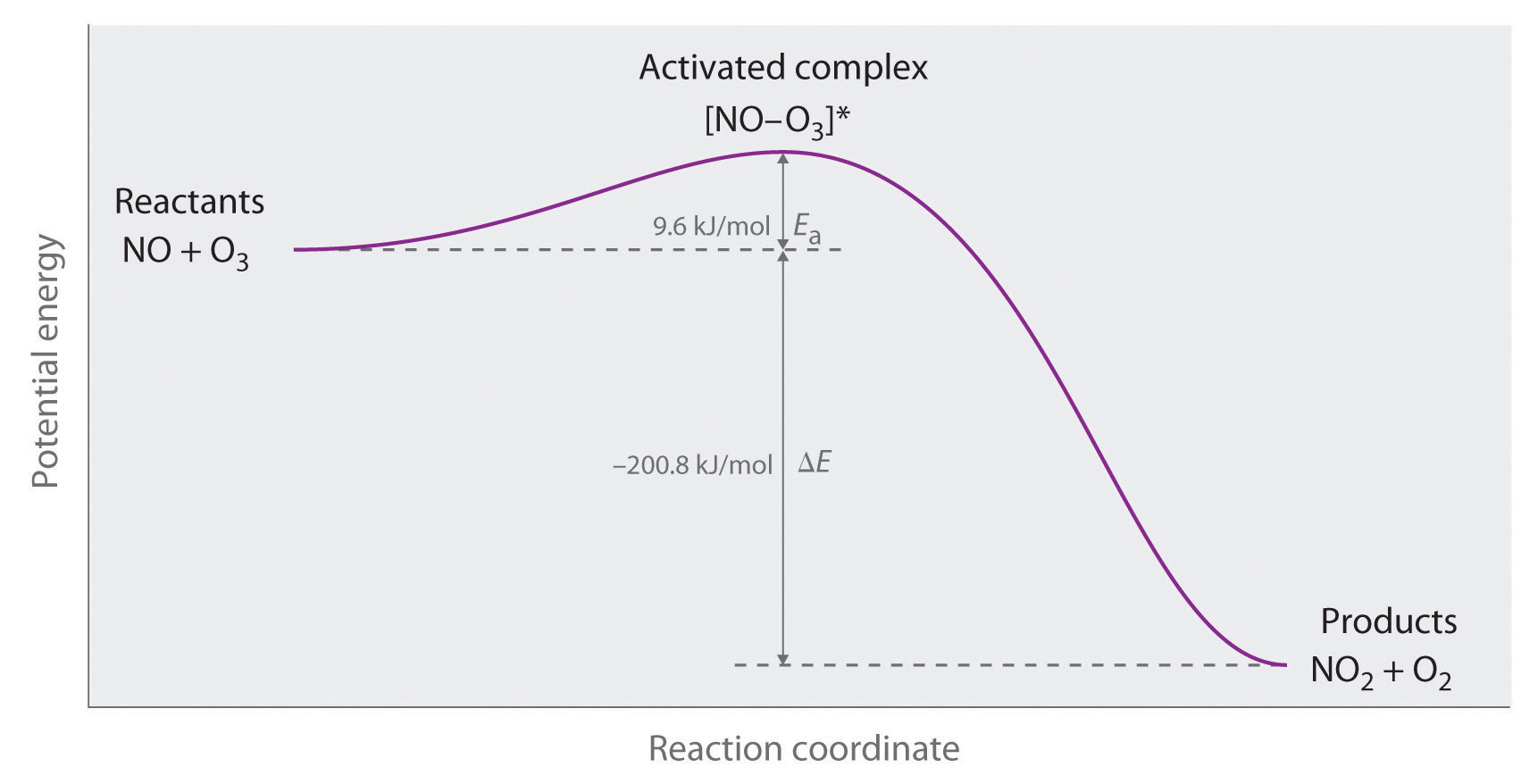
Podemos graficar la energía de una reacción trazando la energía potencial del sistema a medida que avanza la reacción. La Figura 14.7.2 muestra una gráfica para el sistema NO—O 3, en la que el eje vertical es la energía potencial y el eje horizontal es la coordenada de reacción, lo que indica el progreso de la reacción con el tiempo. El complejo activado se muestra entre paréntesis con un asterisco. El cambio general en la energía potencial para la reacción (Δ E) es negativo, lo que significa que la reacción libera energía. (En este caso, Δ E es −200.8 kJ/mol.) Para reaccionar, sin embargo, las moléculas deben superar la barrera energética a la reacción (E a es 9.6 kJ/mol). Es decir, se deben poner 9.6 kJ/mol en el sistema como la energía de activación. Por debajo de este umbral, las partículas no tienen suficiente energía para que ocurra la reacción.
Figura 14.7.2 Energía del Complejo Activado para el Sistema NO—O 3 El diagrama muestra cómo varía la energía de este sistema a medida que la reacción avanza de los reactivos a los productos. Obsérvese el incremento inicial de energía requerida para formar el complejo activado.
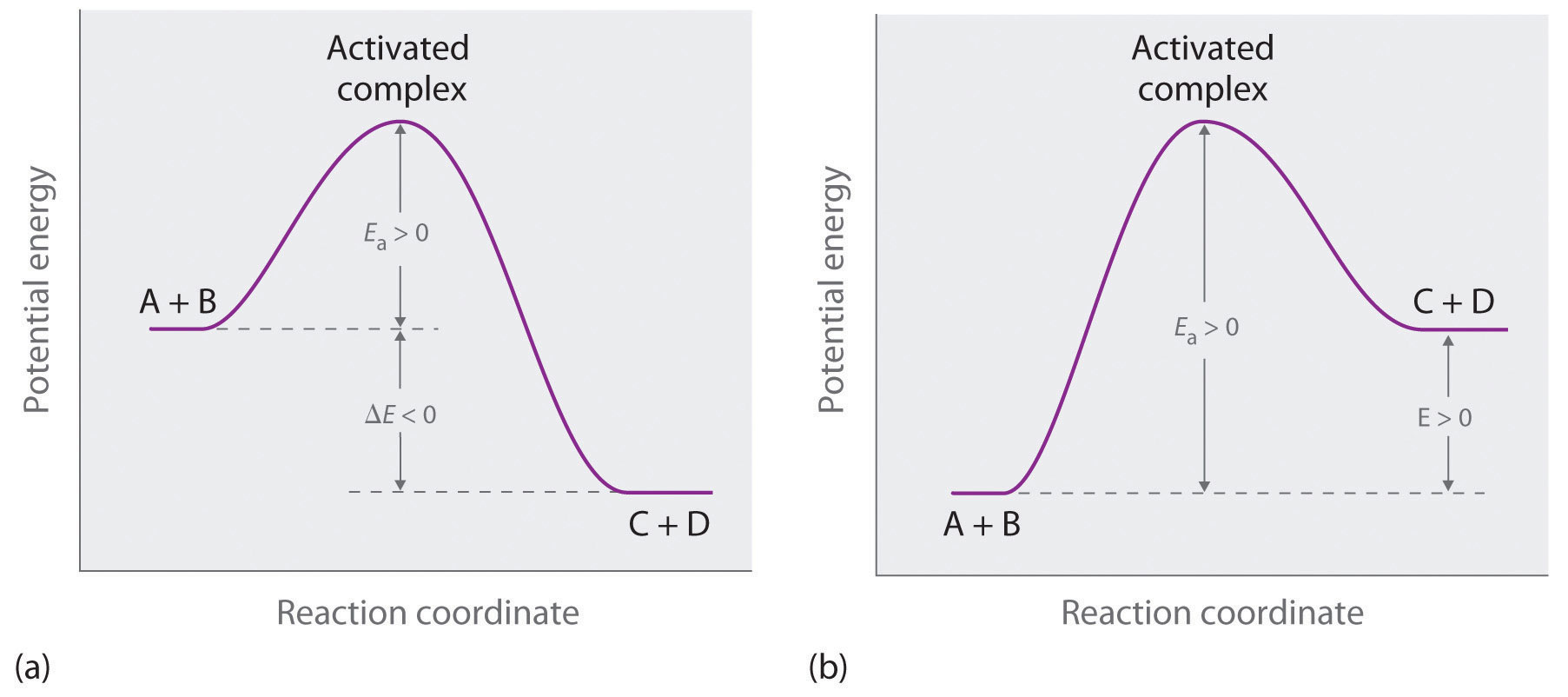
La parte (a) de la Figura 14.7.3 ilustra la situación general en la que los productos tienen una energía potencial menor que los reactivos. En contraste, la parte (b) de la Figura 14.22 ilustra el caso en el que los productos tienen una energía potencial mayor que los reactivos, por lo que la reacción global requiere un aporte de energía; es decir, es energéticamente cuesta arriba, y Δ E > 0. Si bien los cambios de energía que resultan de una reacción pueden ser positivos, negativos o incluso cero, en todos los casos se debe superar una barrera energética antes de que pueda ocurrir una reacción. Esto quiere decir que la energía de activación es siempre positiva.
Figura 14.7.3 Diferenciación entre E a y Δ E Los diagramas de energía potencial para una reacción con (a) Δ E < 0 y (b) Δ E > 0 ilustran el cambio en la energía potencial del sistema a medida que los reactivos se convierten en productos. E a siempre es positivo. Para una reacción como la que se muestra en (b), E a debe ser mayor que Δ E.
Tenga en cuenta el patrón
Para reacciones similares en condiciones comparables, la que tenga la menor E a ocurrirá más rápidamente.
Mientras que Δ E está relacionado con la tendencia de una reacción a ocurrir espontáneamente, E a nos da información sobre la velocidad de reacción y la rapidez con la que cambia la velocidad de reacción con la temperatura. (Para mayor información sobre las reacciones espontáneas, véase el Capítulo 18.) Para dos reacciones similares en condiciones comparables, la reacción con la E a más pequeña ocurrirá más rápidamente.
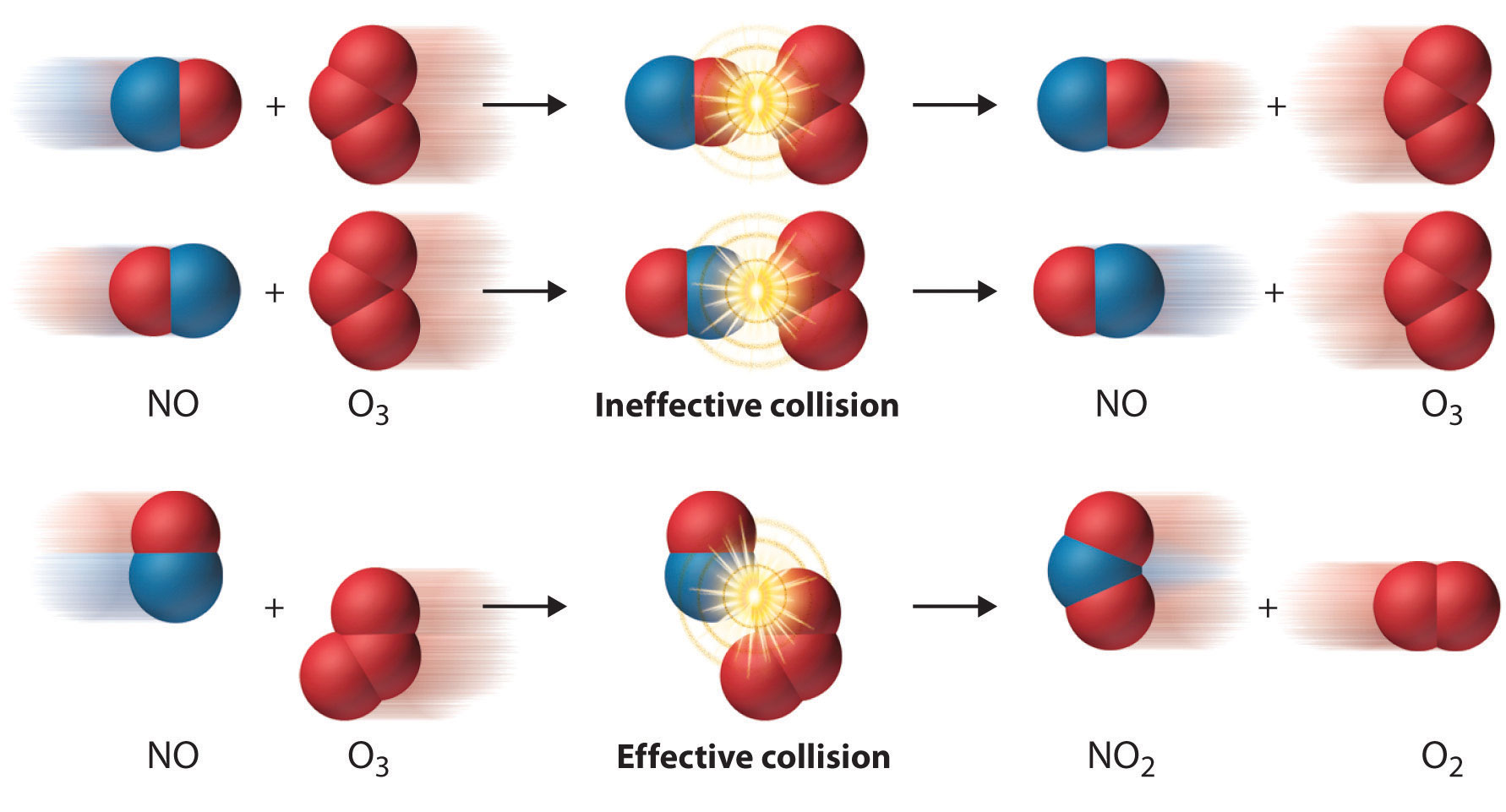
Aun cuando la energía de las colisiones entre dos especies reaccionantes es mayor que E a, sin embargo, la mayoría de las colisiones no producen una reacción. La probabilidad de que ocurra una reacción depende no sólo de la energía de colisión sino también de la orientación espacial de las moléculas cuando colisionan. Para que NO y O 3 produzcan NO 2 y O 2, un átomo de oxígeno terminal de O 3 debe colisionar con el átomo de nitrógeno del NO en un ángulo que permita que O 3 transfiera un átomo de oxígeno al NO para producir NO 2 (Figura 14.7.4. Todas las demás colisiones no producen ninguna reacción. Debido a que menos del 1% de todas las orientaciones posibles de NO y O 3 resultan en una reacción a energías cinéticas mayores que E a, la mayoría de las colisiones de NO y O 3 son improductivas. La fracción de orientaciones que resultan en una reacción se denomina factor estérico (p) La fracción de orientaciones de partículas que resultan en una reacción química. , y, en general, su valor puede variar de 0 (ninguna orientación de las moléculas da como resultado reacción) a 1 (todas las orientaciones dan como resultado reacción).
Figura 14.7.4 El efecto de la orientación molecular sobre la reacción de NO y O 3 La mayoría de las colisiones de moléculas de NO y O 3 ocurren con una orientación incorrecta para que ocurra una reacción. Solo aquellas colisiones en las que el átomo de N del NO colisiona con uno de los átomos O terminales de O 3 son probables que produzcan NO 2 y O 2, incluso si las moléculas chocan con E > E a.
La ecuación de Arrhenius
La Figura 14.7.5 muestra tanto las distribuciones de energía cinética como un diagrama de energía potencial para una reacción. Las áreas sombreadas muestran que a la temperatura más baja (300 K), solo una pequeña fracción de moléculas choca con energía cinética mayor que E a; sin embargo, a la temperatura más alta (500 K) una fracción mucho mayor de moléculas chocan con energía cinética mayor que E a. En consecuencia, la velocidad de reacción es mucho más lenta a la temperatura más baja porque solo unas pocas moléculas chocan con suficiente energía para superar la barrera energética potencial.
Figura 14.7.5 Superando la Barrera Energética ante una Reacción Este gráfico yuxtapone las distribuciones de energía de muestras de menor temperatura (300 K) y temperatura más alta (500 K) de un gas contra el diagrama de energía potencial para una reacción. Solo aquellas moléculas en la región sombreada de la curva de distribución de energía tienen E > E a y por lo tanto son capaces de cruzar la barrera de energía separando reactivos y productos. La fracción de moléculas con E > E a es mucho mayor a 500 K que a 300 K, por lo que la reacción ocurrirá mucho más rápidamente a 500 K.
Para una reacción elemental A + B, todos los factores que afectan la velocidad de reacción pueden resumirse en una sola serie de relaciones:
tasa = (frecuencia de colisión) (factor estérico) (fracción de colisiones con E > E a)donde
\( rate = k\left [ A \right ]\left [ B \right ] \tag{14.7.2} \)
Arrhenius utilizó estas relaciones para llegar a una ecuación que relaciona la magnitud de la constante de velocidad para una reacción con la temperatura, la energía de activación, y la constante, A, llamada constante del factor de frecuencia A en la ecuación de Arrhenius, convierte concentraciones a colisiones por segundo. :
\( k = A e^{-E_{a}/RT} \tag{14.7.3} \)
El factor de frecuencia se utiliza para convertir concentraciones en colisiones por segundo. Debido a que la frecuencia de colisiones depende de la temperatura, A en realidad no es constante. En cambio, A aumenta ligeramente con la temperatura ya que el aumento de la energía cinética de las moléculas a temperaturas más altas hace que se muevan un poco más rápido y así sufran más colisiones por unidad de tiempo La ecuación 14.39 se conoce como la ecuación de Arrhenius Una expresión que resume el modelo de colisión de la cinética química: k= Aexp (E a/RT) y resume el modelo de colisión de la cinética química, donde T es el absoluto temperatura (en K) y R es la constante de gas ideal [8.314 J/ (K·mol)]. E a indica la sensibilidad de la reacción a los cambios de temperatura. La velocidad de reacción con una E a grande aumenta rápidamente al aumentar la temperatura, mientras que la velocidad de reacción con una E a más pequeña aumenta mucho más lentamente al aumentar la temperatura.
Si conocemos la velocidad de reacción a diversas temperaturas, podemos usar la ecuación de Arrhenius para calcular la energía de activación. Tomando el logaritmo natural de ambos lados de la Ecuación 14.7 .3,
\( ln\;k = ln\;A - \dfrac{E_{a}}{RT} = ln\;A + \left [\left (-\dfrac{E_{a}}{R} \right ) \left ( \dfrac{1}{T} \right ) \right ] \tag{14.7.4} \)
La ecuación 14.40 es la ecuación de una línea recta, y = mx + b, donde y = ln k y x = 1/ T. Esto significa que una gráfica de ln k versus 1/ T es una línea recta con una pendiente de − E a/R y una intercepción de ln A. De hecho, necesitamos medir la velocidad de reacción a solo dos temperaturas para estimar E a.
Conocer la E a una temperatura nos permite predecir la velocidad de reacción a otras temperaturas. Esto es importante en la cocina y conservación de alimentos, por ejemplo, así como en el control de reacciones industriales para prevenir posibles desastres. El procedimiento para determinar E a partir de velocidades de reacción medidas a varias temperaturas se ilustra en el Ejemplo 13.
Ejemplo 14.7.1
Mucha gente cree que la tasa de gorjeo de un grillo de árbol está relacionada con la temperatura. Para ver si esto es cierto, los biólogos han realizado mediciones precisas de la tasa de gorjeo de grillo de árbol (f) en función de la temperatura (T). Utilice los datos de la siguiente tabla, junto con la gráfica de ln [tasa de chirrido] versus 1/ T en la Figura 14.7.6 para calcular E a para la reacción bioquímica que controla el chirrido del grillo. Luego predice la tasa de chirrido en una tarde muy calurosa, cuando la temperatura es de 308 K (35°C, o 95°F).
| Frecuencia (f; chirps/min) | ln f | T (K) | 1/ T (K) |
|---|---|---|---|
| 200 | 5.30 | 299 | 3.34 × 10 −3 |
| 179 | 5.19 | 298 | 3.36 × 10 −3 |
| 158 | 5.06 | 296 | 3.38 × 10 −3 |
| 141 | 4.95 | 294 | 3.40 × 10 −3 |
| 126 | 4.84 | 293 | 3.41 × 10 −3 |
| 112 | 4.72 | 292 | 3.42 × 10 −3 |
| 100 | 4.61 | 290 | 3.45 × 10 −3 |
| 89 | 4.49 | 289 | 3.46 × 10 −3 |
| 79 | 4.37 | 287 | 3.48 × 10 −3 |
Dado: tasa de chirrido a diversas temperaturas
Preguntado por: energía de activación y tasa de chirrido a temperatura especificada
Estrategia:
A A partir de la gráfica de ln f versus 1/ T en la Figura 14.7.6, calcular la pendiente de la línea (− E a/R) y luego resolver para la energía de activación.
B Ecuación Express 14.7.4 en términos de k 1 y T 1 y luego en términos de k 2 y T 2.
C Restar las dos ecuaciones; reorganizar el resultado para describir k 2/k 1 en términos de T 2 y T 1.
D Utilizando los datos medidos de la tabla, resuelve la ecuación para obtener la relación k 2/k 1. Usando el valor listado en la tabla para k 1, resuelve para k 2.
Solución:
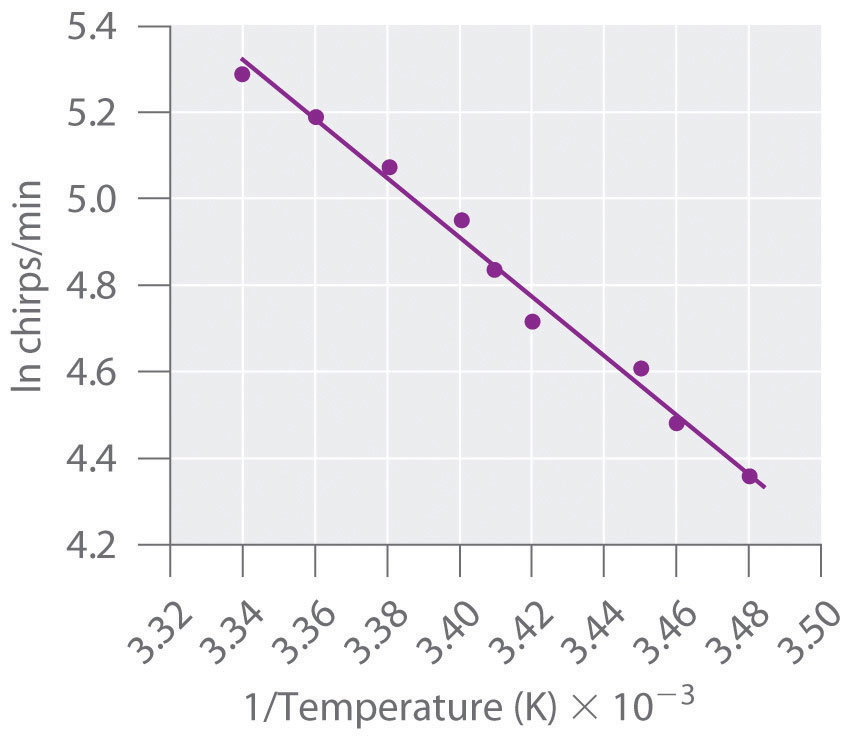
A Si el gorjeo del grillo está controlado por una reacción que obedece a la ecuación de Arrhenius, entonces una gráfica de ln f versus 1/ T debería dar una línea recta (Figura 14.7.6). Además, la pendiente de la parcela de ln f versus 1/ T debe ser igual a − E a/R. Podemos utilizar los dos puntos finales de la Figura 14.7.6 para estimar la pendiente:
\( slope = \dfrac{\Delta \;ln\; f}{\Delta \left ( 1/T \right )} = \dfrac{5.30 - 4.37}{3.34\times 10^{-3} \; K^{-1} - 3.48\times 10^{-3} \; K^{-1}} \)
Una línea de mejor ajuste por computadora a través de todos los puntos tiene una pendiente de −6.67 × 10 3 K, por lo que nuestra estimación es muy cercana. Ahora lo usamos para resolver para la energía de activación:
\( E_{a} = \dfrac{0.93}{-0.041\times 10^{-3} \; K^{-1}} = 6.6 \times 10^{3} \; K \)
B Si se conocen la energía de activación de una reacción y la constante de velocidad a una temperatura, entonces podemos calcular la velocidad de reacción a cualquier otra temperatura. Podemos usar la Ecuación 14.40 para expresar la constante de velocidad conocida (k 1) a la primera temperatura (T1) de la siguiente manera:
\( ln\;k_{1}= ln\; A -\dfrac{E_{a}}{RT_{1}} \)
De igual manera, podemos expresar la constante de velocidad desconocida (k 2) a la segunda temperatura (T 2) de la siguiente manera:
\( ln\;k_{2}= ln\; A -\dfrac{E_{a}}{RT_{2}} \)
C Estas dos ecuaciones contienen cuatro cantidades conocidas (E a, T 1, T 2 y k 1) y dos incógnitas (A y k 2). Podemos eliminar A restando la primera ecuación de la segunda:
\( ln\;k_{2} - ln\;k_{1}= \left (ln\; A -\dfrac{E_{a}}{RT_{2}} \right ) - \left (ln\; A -\dfrac{E_{a}}{RT_{1}} \right ) = -\dfrac{E_{a}}{RT_{2}} + \dfrac{E_{a}}{RT_{1}} \)
Entonces
\( ln\; \dfrac {k_{2}}{k_{1}}= -\dfrac{E_{a}}{R} \left (\dfrac{1}{T_{1}} - \dfrac{1}{T_{2}} \right ) \)
D Para obtener la mejor predicción de la tasa de chirping a 308 K (T 2), tratamos de elegir para T1 y k1 la constante de velocidad medida y la temperatura correspondiente en la tabla de datos que se encuentra más cerca de la línea de mejor ajuste en el gráfico. Escogiendo datos para T 1 = 296 K, donde f = 158, y utilizando la E a calculada previamente,
\( ln\; \dfrac {k_{2}}{k_{1}}= -\dfrac{E_{a}}{R} \left (\dfrac{1}{T_{1}} - \dfrac{1}{T_{2}} \right ) = \dfrac{55\; kJ/mol}{8.314\; J/\left ( K\cdot mol \right )} \left ( \dfrac{1000 \;J}{1 \; kJ} \right ) \left ( \dfrac{1}{296 \; K}-\dfrac{1}{308 \; K} \right ) = 0.87 \)
Así k 308/k 296 = 2.4 y k 308 = (2.4) (158) = 380, y la tasa de chirping en una noche cuando la temperatura es 308 K se predice que sea 380 chirps por minuto.
Ejercicio
La ecuación para la descomposición de NO 2 a NO y O 2 es de segundo orden en NO 2:
\( 2NO_{2}\left ( g \right ) \rightarrow 2NO\left ( g \right ) + O_{2}\left ( g \right ) \)
Los datos para la velocidad de reacción en función de la temperatura se enumeran en la siguiente tabla. Calcular E a para la reacción y la constante de velocidad a 700 K.
| T (K) | k (M −1 ·s −1) |
|---|---|
| 592 | 522 |
| 603 | 755 |
| 627 | 1700 |
| 652 | 4020 |
| 656 | 5030 |
Respuesta: E a = 114 kJ/mol; k 700 = 18,600 M −1 ·s −1 = 1.86 × 10 4 M −1 ·s −1.
¿Qué E a da como resultado una duplicación de la velocidad de reacción con un aumento de 10°C en la temperatura de 20° a 30°C?
Respuesta: alrededor de 51 kJ/mol
Figura 14.7.6 Determinación gráfica de E a para el chirrido de grillo de árbol Cuando se traza el logaritmo natural de la tasa de gorjeo de grillo de árbol versus 1/ T, resulta una línea recta. La pendiente de la línea sugiere que la velocidad de chirping es controlada por una sola reacción con una E a de 55 kJ/mol.
Resumen
Se requiere una energía mínima (energía de activación, E a) para que una colisión entre moléculas resulte en una reacción química. Las gráficas de energía potencial para un sistema versus la coordenada de reacción muestran una barrera energética que debe superarse para que ocurra la reacción. La disposición de los átomos en el punto más alto de esta barrera es el complejo activado, o estado de transición, de la reacción. A una temperatura dada, cuanto mayor sea la E a, más lenta será la reacción. La fracción de orientaciones que resultan en una reacción es el factor estérico. El factor de frecuencia, el factor estérico y la energía de activación están relacionados con la constante de velocidad en la ecuación de Arrhenius: k = Aexp (-E a/RT). Una gráfica del logaritmo natural de k versus 1/ T es una línea recta con una pendiente de − E a/R.
Llave para llevar
- Para que ocurra una reacción química, se debe superar un umbral de energía, y las especies reaccionantes también deben tener la orientación espacial correcta.
Ecuación Clave
Ecuación de Arrhenius
\( k = A e^{-E_{a}/RT} \tag{14.7.3} \)
Problemas conceptuales
-
Aunque un aumento en la temperatura resulta en un aumento de la energía cinética, este aumento en la energía cinética no es suficiente para explicar la relación entre la temperatura y las velocidades de reacción. ¿Cómo se relaciona la energía de activación con la cinética química de una reacción? ¿Por qué un aumento en la temperatura aumenta la velocidad de reacción a pesar de que la energía cinética promedio sigue siendo menor que la energía de activación?
-
Para cualquier reacción dada, ¿cuál es la relación entre la energía de activación y cada una de las siguientes?
- repulsiones electrostáticas
- formación de enlaces en el complejo activado
- la naturaleza del complejo activado
-
Si le preocupa si una reacción ocurrirá rápidamente, ¿por qué estaría más interesado en conocer la magnitud de la energía de activación que el cambio en la energía potencial para la reacción?
-
El producto C en la reacción A + B → C + D se puede separar fácilmente de la mezcla de reacción. Se le ha dado A puro y B puro y se le dice que determine la energía de activación para esta reacción para determinar si la reacción es adecuada para la síntesis industrial de C. ¿Cómo harías esto? ¿Por qué necesitas conocer la magnitud de la energía de activación para tomar una decisión sobre la factibilidad?
-
Por encima de E a, las moléculas chocan con suficiente energía para superar la barrera energética para una reacción. ¿Es posible que una reacción se produzca a una temperatura inferior a la necesaria para alcanzar E a? Explica tu respuesta.
-
¿Cuál es la relación entre A, E a y T? ¿Cómo afecta un aumento de A a la velocidad de reacción?
-
De dos reacciones altamente exotérmicas con diferentes valores de E a, que necesitarían ser monitoreadas con más cuidado: ¿la que tiene el valor menor o la que tiene el valor más alto? ¿Por qué?
Problemas numéricos
-
¿Qué sucede con la velocidad aproximada de una reacción cuando la temperatura de la reacción se incrementa de 20°C a 30°C? ¿Qué sucede con la velocidad de reacción cuando la temperatura se eleva a 70°C? Para una reacción dada a temperatura ambiente (20°C), ¿cuál es la forma de una gráfica de la velocidad de reacción frente a la temperatura a medida que la temperatura se incrementa a 70°C?
-
El acetaldehído, utilizado en espejos plateados y algunos perfumes, sufre una descomposición de segundo orden entre 700 y 840 K. A partir de los datos de la siguiente tabla, ¿diría que el acetaldehído sigue la regla general de que cada aumento de temperatura de 10 K duplica la velocidad de reacción?
T (K) k (M −1 ·s −1) 720 0.024 740 0.051 760 0.105 800 0.519 -
El bromoetano reacciona con el ion hidróxido en agua para producir etanol. La energía de activación para esta reacción es de 90 kJ/mol. Si la velocidad de reacción es 3.6 × 10 −5 m/s a 25°C, ¿cuál sería la velocidad de reacción a las siguientes temperaturas?
- 15°C
- 30°C
- 45°C
-
Una reacción catalizada por enzimas tiene una energía de activación de 15 kcal/mol. ¿En qué se diferenciaría el valor de la constante de velocidad entre 20°C y 30°C? Si la enzima redujo la E a de 25 kcal/mol a 15 kcal/mol, ¿en qué factor ha aumentado la enzima la velocidad de reacción a cada temperatura?
-
Los datos de la siguiente tabla son las constantes de velocidad en función de la temperatura para la dimerización de 1,3-butadieno. ¿Cuál es la energía de activación para esta reacción?
T (K) k (M −1 ·min −1) 529 1.4 560 3.7 600 25 645 82 -
La velocidad de reacción a 25°C es de 1.0 × 10 −4 m/s. Al aumentar la temperatura a 75°C, la velocidad de reacción se incrementa a 7.0 × 10 −2 m/s. Estimar E a para este proceso. Si E a fuera 25 kJ/mol y la velocidad de reacción a 25°C es de 1.0 × 10 −4 m/s, ¿cuál sería la velocidad de reacción a 75°C?
RESPUESTAS
-
La velocidad de reacción se duplicará aproximadamente: 20°C a 30°C, la velocidad de reacción aumenta en aproximadamente 2 1 = 2; 20°C a 70°C, la velocidad de reacción aumenta en aproximadamente 2 5 = 32 veces. Una gráfica de la velocidad de reacción frente a la temperatura dará un incremento exponencial: velocidad ∝ 2 Δ T /10.
-
- 1.0 × 10 −5 m/s
- 6.6 × 10 −5 m/s
- 3.5 × 10 −4 m/s
-
100 kJ/mol