15.4: Condiciones de no equilibrio
- Page ID
- 77971
- Predecir en qué dirección procederá una reacción.
En la Sección 15.3, vimos que conocer la magnitud de la constante de equilibrio bajo un conjunto dado de condiciones permite a los químicos predecir el alcance de una reacción. A menudo, sin embargo, los químicos deben decidir si un sistema ha alcanzado el equilibrio o si la composición de la mezcla continuará cambiando con el tiempo. En esta sección, describimos cómo analizar cuantitativamente la composición de una mezcla de reacción para hacer esta determinación.
El cociente de reacción
Para determinar si un sistema ha alcanzado el equilibrio, los químicos utilizan una cantidad llamada cociente de reacción (Q) Una cantidad derivada de un conjunto de valores medidos en cualquier momento durante la reacción de cualquier mezcla de reactivos y productos, independientemente de si el sistema está en equilibrio: Q = [C] c [D] d/[A] a [B] b para la ecuación química equilibrada general aA + bB cC + dD. La expresión para el cociente de reacción tiene precisamente la misma forma que la expresión constante de equilibrio, excepto que Q puede derivarse de un conjunto de valores medidos en cualquier momento durante la reacción de cualquier mezcla de los reactivos y los productos, independientemente de si el sistema está en equilibrio. Por lo tanto, para la siguiente reacción general:
\[aA+bB \rightarrow cC+dD \notag \]
el cociente de reacción se define como sigue:
\[Q=\dfrac{[C]^c[D]^d}{[A]^a[B]^b} \tag{15.4.1}\]
El cociente de reacción Q p análogo a K p, puede escribirse para cualquier reacción que involucre gases mediante el uso de las presiones parciales de los componentes.
Para entender cómo se obtiene la información usando un cociente de reacción, considere la disociación del tetroóxido de dinitrógeno a dióxido de nitrógeno,
\[N_2O_{4(g)} \rightleftharpoons 2NO_{2(g)} \notag \]
para lo cual K = 4.65 × 10 −3 a 298 K. Podemos escribir Q para esta reacción de la siguiente manera:
\[Q=\dfrac{[NO_2]^2}{[N_2O_4]} \tag{15.4.2}\]
En la siguiente tabla se enumeran los datos de tres experimentos en los que se obtuvieron muestras de la mezcla de reacción y se analizaron a intervalos de tiempo equivalentes, y se calcularon los valores correspondientes de Q para cada uno. Cada experimento comienza con diferentes proporciones de producto y reactivo:
| Experimento | [NO 2] (M) | [N 2 O 4] (M) | Q = [NO 2] 2/[N 2 O 4] |
|---|---|---|---|
| 1 | 0 | 0.0400 | \(\dfrac{0^2}{0.0400}=0\) |
| 2 | 0.0600 | 0 | \(\dfrac{(0.0600)^2}{0}=\text{undefined}\) |
| 3 | 0.0200 | 0.0600 | \(\dfrac{(0.0200)^2}{0.0600}=6.67 \times 10^{−3}\) |
Como demuestran estos cálculos, Q puede tener cualquier valor numérico entre 0 e infinito (indefinido); es decir, Q puede ser mayor que, menor o igual a K.
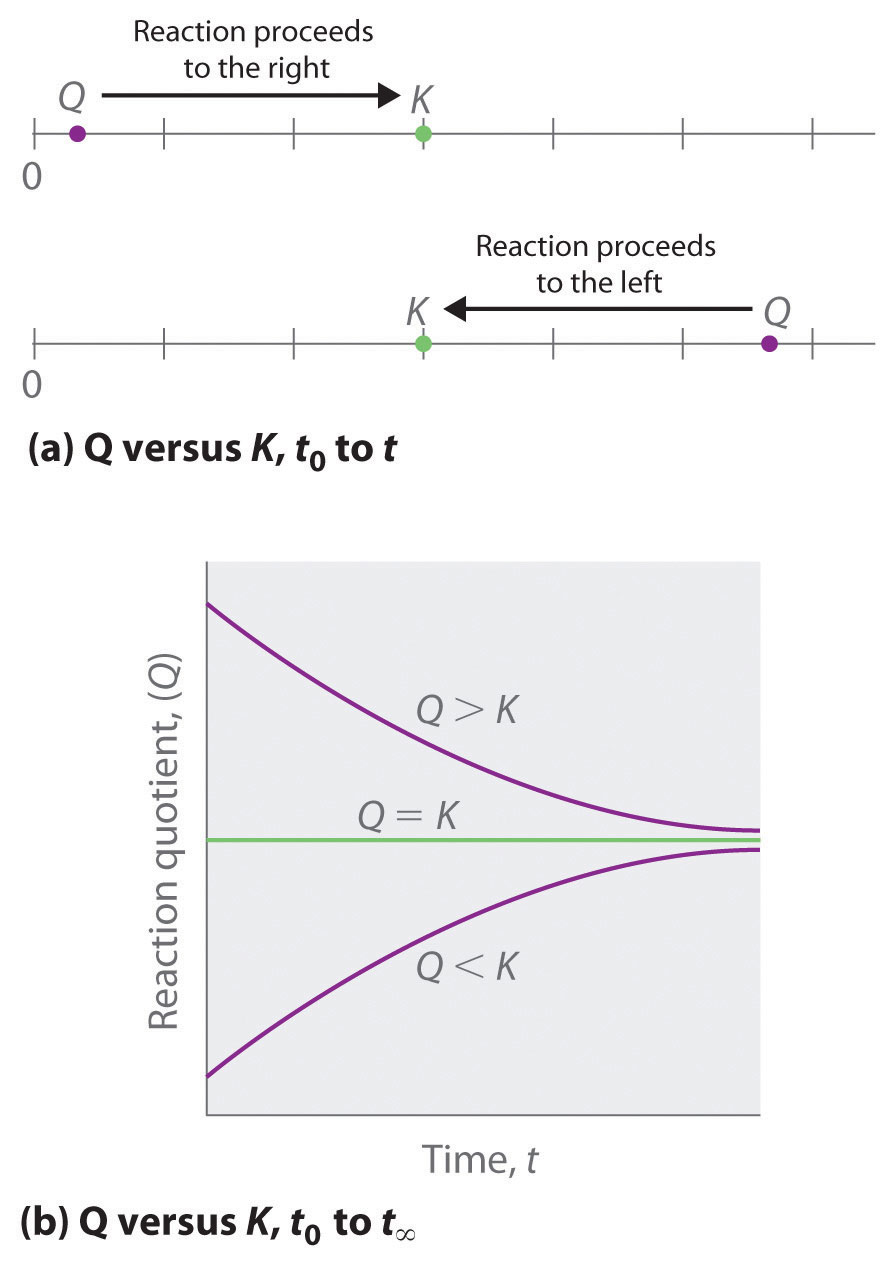
La comparación de las magnitudes de Q y K nos permite determinar si una mezcla de reacción ya está en equilibrio y, si no lo está, predecir cómo cambiará su composición con el tiempo para alcanzar el equilibrio (es decir, si la reacción procederá a la derecha o a la izquierda como está escrito). Todo lo que hay que recordar es que la composición de un sistema que no está en equilibrio cambiará de una manera que haga que Q se acerque a K. Si Q = K, por ejemplo, entonces el sistema ya está en equilibrio, y no ocurrirá ningún cambio adicional en la composición del sistema a menos que se cambien las condiciones. Si Q < K, entonces la relación de las concentraciones de productos a las concentraciones de reactivos es menor que la relación en equilibrio. Por lo tanto, la reacción procederá a la derecha tal como está escrito, formando productos a expensas de los reactivos. Por el contrario, si Q > K, entonces la relación de las concentraciones de productos a las concentraciones de reactivos es mayor que en equilibrio, por lo que la reacción procederá a la izquierda como está escrito, formando reactivos a expensas de los productos. Estos puntos se ilustran gráficamente en la Figura 15.4.1.
Figura 15.4.1 Dos formas diferentes de ilustrar cómo cambiará la composición de un sistema dependiendo de los valores relativos de Q y K (a) Tanto Q como K se trazan como puntos a lo largo de una línea numérica: el sistema siempre reaccionará en la forma en que hace que Q se acerque a K. b) Se ilustra el cambio en la composición de un sistema con el tiempo para sistemas con valores iniciales de Q > K, Q < K y Q = K.
Tenga en cuenta el patrón
Si Q < K, la reacción procederá a la derecha tal como está escrito. Si Q > K, la reacción procederá a la izquierda como está escrito. Si Q = K, entonces el sistema está en equilibrio.
Ejemplo 15.4.1
A temperaturas elevadas, el metano (CH 4) reacciona con el agua para producir hidrógeno y monóxido de carbono en lo que se conoce como reacción de reformado con vapor:
\[CH_{4(g)}+H_2O_{(g)} \rightleftharpoons CO_{(g)}+3H_{2(g)} \notag \]
K = 2.4 × 10 −4 a 900 K. Enormes cantidades de hidrógeno se producen a partir del gas natural de esta manera y luego se utilizan para la síntesis industrial de amoníaco. Si 1.2 × 10 −2 mol de CH 4, 8.0 × 10 −3 mol de H 2 O, 1.6 × 10 −2 mol de CO, y 6.0 × 10 −3 mol de H2 se colocan en un reactor de acero de 2.0 L y se calientan a 900 K, la reacción estará en equilibrio o procederá al derecho a producir CO y H 2 o a la izquierda para formar CH 4 y H 2 O?
Dado: ecuación química equilibrada, K, cantidades de reactivos y productos, y volumen
Preguntado por: dirección de reacción
Estrategia:
A Calcular las concentraciones molares de los reactivos y los productos.
B Utilice la Ecuación 15.4.1 para determinar Q. Compare Q y K para determinar en qué dirección procederá la reacción.
Solución:
A Primero debemos encontrar las concentraciones iniciales de las sustancias presentes. Por ejemplo, tenemos 1.2 × 10 −2 mol de CH 4 en un contenedor de 2.0 L, entonces
\[[CH_4]=\dfrac{1.2\times 10^{−2} mol}{2.0\; L}=6.0 \times 10^{−3} M \notag \]
Podemos calcular las otras concentraciones de manera similar:
- \([H_2O] = 4.0 \times 10^{−3} M\),
- \([CO] = 8.0 \times 10^{−3} M\), y
- \([H_2] = 3.0 \times 10^{−3} M\).
B Ahora calculamos Q y la comparamos con K:
\[Q=\dfrac{[CO][H_2]^3}{[CH_4][H_2O}=\dfrac{(8.0 \times 10^{−3})(3.0 \times 10^{−3})^3}{(6.0\times 10^{−3})(4.0 \times 10^{−3})}=9.0 \times 10^{−6} \notag \]
Debido a que K = 2.4 × 10 −4, vemos que Q < K. Así, la relación de las concentraciones de productos a las concentraciones de reactivos es menor que la relación para una mezcla de equilibrio. Por lo tanto, la reacción procederá a la derecha tal como está escrito, formando H 2 y CO a expensas de H 2 O y CH 4.
Ejercicio
En la reacción de desplazamiento agua-gas introducida en el Ejemplo 10, el monóxido de carbono producido por la reacción de reformado con vapor de metano reacciona con vapor a temperaturas elevadas para producir más hidrógeno:
\[CO_{(g)}+H_2O_{(g)} \rightleftharpoons CO_{2(g)}+H_{2(g)} \notag \]
K = 0.64 a 900 K. Si 0.010 mol tanto de CO como de H 2 O, 0.0080 mol de CO 2, y 0.012 mol de H 2 se inyectan en un reactor de 4.0 L y se calientan a 900 K, ¿procederá la reacción a la izquierda o a la derecha como está escrito?
Respuesta: Q = 0.96 (Q > K), por lo que la reacción procederá a la izquierda, y se formarán CO y H 2 O.
Predecir la dirección de una reacción con una gráfica
Al graficar algunas concentraciones de equilibrio para un sistema a una temperatura y presión dadas, podemos ver fácilmente el rango de concentraciones de reactivo y producto que corresponden a condiciones de equilibrio, para las cuales Q = K. Dicha gráfica nos permite predecir qué pasará con una reacción cuando cambien las condiciones para que Q ya no sea igual a K, como cuando se incrementa o disminuye una concentración de reactivo o una concentración de producto.
El carbonato de plomo se descompone en óxido de plomo y dióxido de carbono de acuerdo con la siguiente ecuación:
\[PbCO_{3(s)} \rightleftharpoons PbO_{(s)}+CO_{2(g)} \tag{15.4.3}\]
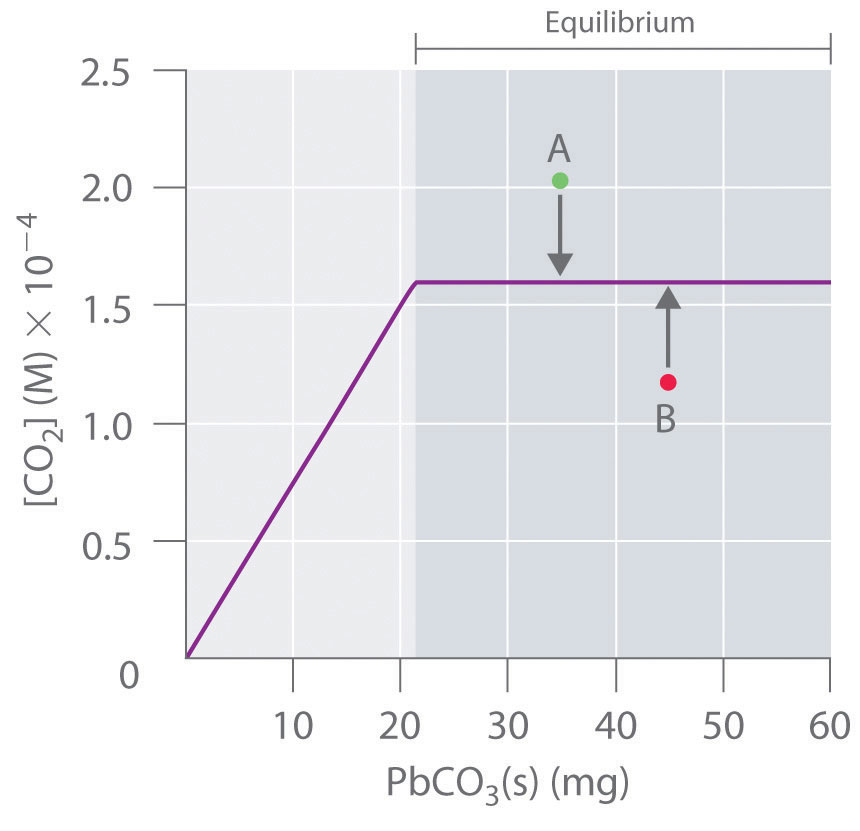
Debido a que PbCo 3 y PbO son sólidos, la constante de equilibrio es simplemente K = [CO 2]. A una temperatura dada, por lo tanto, cualquier sistema que contenga PbCO sólido 3 y PbO sólido tendrá exactamente la misma concentración de CO 2 en equilibrio, independientemente de la relación o las cantidades de los sólidos presentes. Esta situación se representa en la Figura 15.4.2, que muestra una gráfica de [CO 2] frente a la cantidad de PbCO 3 agregado. Inicialmente, el PbCO 3 agregado se descompone completamente a CO 2 debido a que la cantidad de PbCO 3 no es suficiente para dar una concentración de CO 2 igual a K. Así, la porción izquierda de la gráfica representa un sistema que no está en equilibrio porque contiene solo CO 2 (g) y PbO (s). En contraste, cuando solo se ha agregado suficiente PbCO 3 para dar [CO 2] = K, el sistema ha alcanzado el equilibrio, y agregar más PbCO 3 no tiene ningún efecto sobre la concentración de CO 2: la gráfica es una línea horizontal. Así, cualquier concentración de CO 2 que no esté en la línea horizontal representa un estado de no equilibrio, y el sistema ajustará su composición para lograr el equilibrio, siempre que estén presentes suficientes PbCO 3 y PbO. Por ejemplo, el punto etiquetado A en la Figura 15.4.2 se encuentra por encima de la línea horizontal, por lo que corresponde a un [CO 2] que es mayor que la concentración de equilibrio de CO 2 (Q > K). Para alcanzar el equilibrio, el sistema debe disminuir [CO 2], lo que solo puede hacer haciendo reaccionar CO 2 con PbO sólido para formar PbCO sólido 3. Así la reacción en la Ecuación 15.4.3 procederá a la izquierda tal como está escrito, hasta [CO 2] = K. Por el contrario, el punto etiquetado B en la Figura 15.4.2 se encuentra por debajo de la línea horizontal, por lo que corresponde a un [CO 2] que es menor que la concentración de equilibrio de CO 2 (Q < K). Para alcanzar el equilibrio, el sistema debe aumentar [CO 2], lo que solo puede hacer descomponiendo PbCO 3 sólido para formar CO 2 y PbO sólido. Por lo tanto, la reacción en la Ecuación 15.4.2 procederá a la derecha tal como está escrito, hasta [CO 2] = K.
Figura 15.4.2 La Concentración de CO 2 Gaseoso en un Sistema Cerrado en Equilibrio en Función de la Cantidad de PbCO Sólido 3 Agregado Inicialmente la concentración de CO 2 (g) aumenta linealmente con la cantidad de PbCO 3 sólido agregado, ya que PbCO 3 se descompone a CO 2 (g) y PbO sólido. Una vez que la concentración de CO 2 alcanza el valor que corresponde a la concentración de equilibrio, sin embargo, agregar más PbCO 3 sólido no tiene efecto sobre [CO 2], siempre y cuando la temperatura permanezca constante.
En contraste, la reducción de óxido de cadmio por hidrógeno da cadmio metálico y vapor de agua:
\[CdO_{(s)}+H_{2(g)} \rightleftharpoons Cd_{(s)}+H_2O_{(g)} \tag{15.4.4}\]
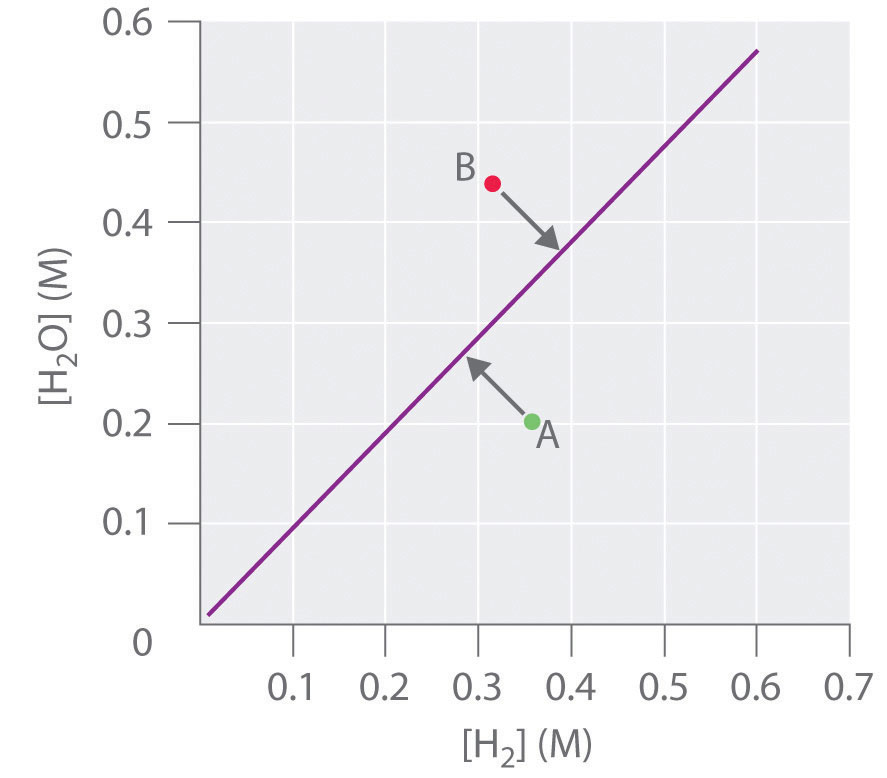
y la constante de equilibrio K es [H 2 O]/[H 2]. Si [H 2 O] se duplica en equilibrio, entonces [H 2] también se debe duplicar para que el sistema permanezca en equilibrio. Una gráfica de [H 2 O] versus [H 2] en equilibrio es una línea recta con una pendiente de K (Figura 15.4.3). Nuevamente, solo aquellos pares de concentraciones de H 2 O y H 2 que se encuentran en la línea corresponden a estados de equilibrio. Cualquier punto que represente un par de concentraciones que no se encuentre en la línea corresponde a un estado de no equilibrio. En tales casos, la reacción en la Ecuación 15.4.4 procederá en cualquier dirección que haga que la composición del sistema se mueva hacia la línea de equilibrio. Por ejemplo, el punto A de la Figura 15.4.3 se encuentra por debajo de la línea, indicando que la relación [H 2 O]/[H 2] es menor que la relación de una mezcla en equilibrio (Q < K). Así, la reacción en la Ecuación 15.4.3 procederá a la derecha tal como está escrito, consumiendo H 2 y produciendo H 2 O, lo que provoca que la relación de concentración se mueva hacia arriba y hacia la izquierda hacia la línea de equilibrio. Por el contrario, el punto B de la Figura 15.4.3 se encuentra por encima de la línea, lo que indica que la relación [H 2 O]/[H 2] es mayor que la relación de una mezcla de equilibrio (Q > K). Así, la reacción en la Ecuación 15.4.3 procederá a la izquierda tal como está escrito, consumiendo H 2 O y produciendo H 2, lo que provoca que la relación de concentración se mueva hacia abajo y hacia la derecha hacia la línea de equilibrio.
Figura 15.4.3 La Concentración de Vapor de Agua versus la Concentración de Hidrógeno para el CdO (s) + H 2 (g) Cd (s) + H 2 O (g) Sistema en Equilibrio Para cualquier concentración de equilibrio de H 2 O (g), solo hay una concentración de equilibrio de H 2 (g). Debido a que las magnitudes de las dos concentraciones son directamente proporcionales, una gran [H 2 O] en equilibrio requiere una gran [H 2] y viceversa. En este caso, la pendiente de la línea es igual a K.
En otro ejemplo, el yoduro de amonio sólido se disocia a amoníaco gaseoso y yoduro de hidrógeno a temperaturas elevadas:
\[ NH_4I_{(s)} \rightleftharpoons NH_{3(g)}+HI_{(g)} \tag{15.4.5}\]
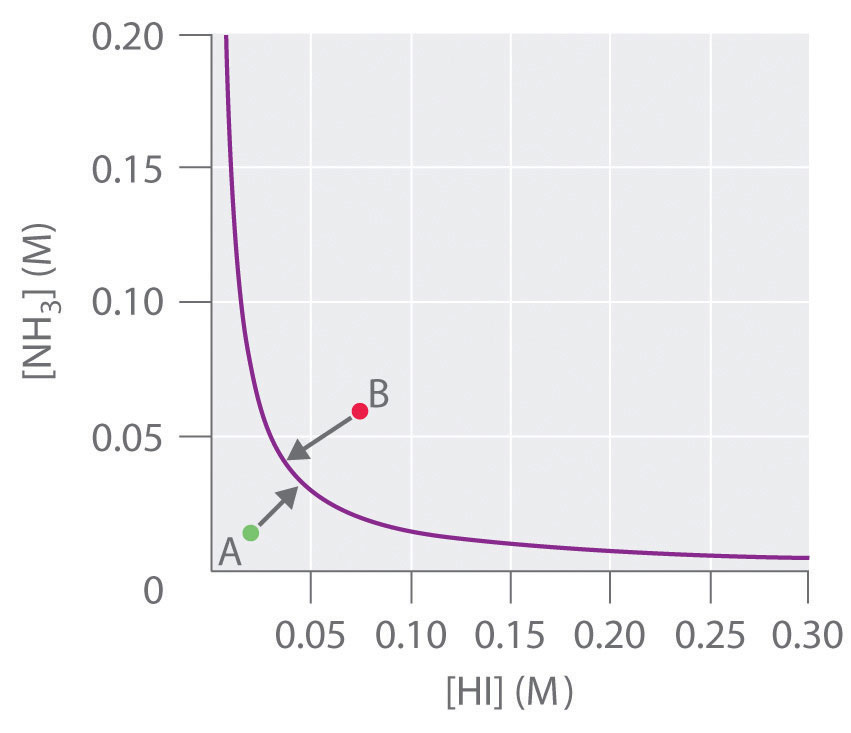
Para este sistema, K es igual al producto de las concentraciones de los dos productos: [NH 3] [HI]. Si duplicamos la concentración de NH 3, la concentración de HI debe disminuir aproximadamente en un factor de 2 para mantener el equilibrio, como se muestra en la Figura 15.4.4. Como resultado, para una concentración dada de HI o NH 3, solo es posible una única composición en equilibrio que contenga concentraciones iguales tanto de NH 3 como de HI, para lo cual [NH 3] = [HI] = K 1/2. Cualquier punto que se encuentre por debajo y a la izquierda de la curva de equilibrio (como el punto A en la Figura 15.4.4) corresponde a Q < K, y la reacción en la Ecuación 15.4.4 procederá por lo tanto a la derecha como está escrito, provocando la composición de el sistema para avanzar hacia la línea de equilibrio. Por el contrario, cualquier punto que se encuentre por encima y a la derecha de la curva de equilibrio (como el punto B en la Figura 15.4.3) corresponde a Q > K, y la reacción en la Ecuación 15.4 .4 procederá por tanto a la izquierda como está escrito, provocando de nuevo el composición del sistema para avanzar hacia la línea de equilibrio. Al graficar las concentraciones de equilibrio para un sistema dado a una temperatura y presión dadas, podemos predecir la dirección de reacción de esa mezcla cuando el sistema no está en equilibrio.
Figura 15.4.4 La Concentración de NH 3 (g) versus la Concentración de HI (g) para el NH 4 I (s) NH 3 (g) + HI (g) Sistema en Equilibrio Solo es posible una concentración de equilibrio de NH 3 (g) para cualquier dada concentración de equilibrio de HI (g). En este caso, los dos son inversamente proporcionales. Así, un [HI] grande en equilibrio requiere un pequeño [NH 3] en equilibrio y viceversa.
Principio de Le Chatelier
Cuando un sistema en equilibrio se perturbe de alguna manera, los efectos de la perturbación pueden predecirse cualitativamente utilizando el principio de Le Chatelier. Si se aplica un estrés a un sistema en equilibrio, la composición del sistema cambiará para aliviar el estrés aplicado. (llamado así por el químico francés Henri Louis Le Chatelier, 1850—1936). El nombre se pronuncia “Luh Shot-Lee-ay”. Este principio se puede afirmar de la siguiente manera: si se aplica una tensión a un sistema en equilibrio, la composición del sistema cambiará para contrarrestar la tensión aplicada. El estrés ocurre cuando cualquier cambio en un sistema afecta la magnitud de Q o K. En la Ecuación 15.4.4, por ejemplo, aumentar [NH 3] produce una tensión en el sistema que requiere una disminución en [HI] para que el sistema vuelva al equilibrio. Como ejemplo adicional, considere los ésteres, que son uno de los productos de una reacción de equilibrio entre un ácido carboxílico y un alcohol. (Para mayor información sobre este tipo de reacción, ver Sección 7.5.) Los ésteres son responsables de los aromas que asociamos con las frutas (como naranjas y plátanos), y también se utilizan como aromas en perfumes. Aplicar un estrés a la reacción de un ácido carboxílico y un alcohol cambiará la composición del sistema, conduciendo a un aumento o una disminución en la cantidad de éster producido. En la Sección 15.5 y Sección 15.6, exploramos cómo los químicos controlan las condiciones de las reacciones para afectar las concentraciones de equilibrio.
Tenga en cuenta el patrón
En todas las reacciones, si se aplica un estrés a un sistema en equilibrio, la composición del sistema cambiará para contrarrestar el estrés aplicado (principio de Le Chatelier).
Ejemplo 15.4.2
Escribe una expresión constante de equilibrio para cada reacción y usa esta expresión para predecir qué pasará con la concentración de la sustancia en negrita cuando se realice el cambio indicado si el sistema va a mantener el equilibrio.
- 2HgO (s) 2Hg (l) + O 2 (g): se duplica la cantidad de HgO.
- NH 4 HS (s) NH 3 (g) + H 2 S (g): la concentración de H 2 S se triplica.
- n-butano (g) isobutano (g): la concentración de isobutano se reduce a la mitad.
Dado: sistemas de equilibrio y cambios
Preguntado por: expresiones constantes de equilibrio y efectos de cambios
Estrategia:
Escribe la expresión constante de equilibrio, recordando que los líquidos y sólidos puros no aparecen en la expresión. A partir de esta expresión, predecir el cambio que debe ocurrir para mantener el equilibrio cuando se realizan los cambios indicados.
Solución:
- Debido a que HgO (s) y Hg (l) son sustancias puras, no aparecen en la expresión constante de equilibrio. Así, para esta reacción, K = [O 2]. La concentración de equilibrio de O 2 es una constante y no depende de la cantidad de HgO presente. De ahí que agregar más HgO no afectará la concentración de equilibrio de O 2, por lo que no es necesario ningún cambio compensatorio.
- NH 4 HS no aparece en la expresión constante de equilibrio porque es un sólido. Así K = [NH 3] [H 2 S], lo que significa que las concentraciones de los productos son inversamente proporcionales. Si la adición de H 2 S triplica la concentración de H 2 S, por ejemplo, entonces la concentración de NH 3 debe disminuir en aproximadamente un factor de 3 para que el sistema permanezca en equilibrio de manera que el producto de las concentraciones sea igual a K.
- Para esta reacción, K = [isobutano]/[n-butano], por lo que reducir a la mitad la concentración de isobutano significa que la concentración de n-butano también debe disminuir aproximadamente a la mitad si el sistema va a mantener el equilibrio.
Ejercicio
Escribir una expresión constante de equilibrio para cada reacción. ¿Qué debe pasar con la concentración de la sustancia en negrita cuando se produce el cambio indicado para que el sistema mantenga el equilibrio?
- HBr (g) + NaH (s) NaBr (s) + H 2 (g): la concentración de HBr se disminuye por un factor de 3.
- 6Li (s) + N 2 (g) 2Li 3 N (s): la cantidad de Li se triplica.
- SO 2 (g) + Cl 2 (g) SO 2 Cl 2 (l): la concentración de Cl 2 se duplica.
Responder
- K = [H 2]/[HBr]; [H 2] debe disminuir en aproximadamente un factor de 3.
- K = 1/ [N 2]; el litio sólido no aparece en la expresión constante de equilibrio, por lo que no es necesario ningún cambio compensatorio.
- K = 1/ [SO 2] [Cl 2]; [SO 2] debe disminuir aproximadamente a la mitad.
Resumen
El cociente de reacción (Q o Q p) tiene la misma forma que la expresión constante de equilibrio, pero se deriva de las concentraciones obtenidas en cualquier momento. Cuando un sistema de reacción está en equilibrio, Q = K. Las gráficas derivadas trazando algunas concentraciones de equilibrio para un sistema a una temperatura y presión dadas pueden usarse para predecir la dirección en la que procederá una reacción. Los puntos que no se encuentran en la línea o curva representan estados de no equilibrio, y el sistema se ajustará, si puede, para lograr el equilibrio. El principio de Le Chatelier establece que si se aplica un estrés a un sistema en equilibrio, la composición del sistema se ajustará para contrarrestar el estrés.
Llave para llevar
- El cociente de reacción (Q) se utiliza para determinar si un sistema está en equilibrio y si no lo está, para predecir la dirección de la reacción.
Problemas conceptuales
-
Durante un conjunto de experimentos, se dibujaron gráficas de [reactivos] versus [productos] en equilibrio. Usando la Figura 15.4.4 y la Figura 15.4.4 como guías, esboce la forma de cada gráfica utilizando las etiquetas apropiadas.
- \(H_2O_{(l)} \rightleftharpoons H_2O_{(g)}\)
- \(2MgO_{(s)} \rightleftharpoons 2Mg_{(s)}+O_{2(g)}\)
- \(2O_{3(g)} \rightleftharpoons 3O_{2(g)}\)
- \(2PbS_{(s)}+3O_{2(g)} \rightleftharpoons 2PbO_{(s)}+2SO_{2(g)}\)
-
Escribir una expresión constante de equilibrio para cada sistema de reacción. Dados los cambios indicados, ¿cómo debe cambiar la concentración de la especie en negrita para que el sistema mantenga el equilibrio?
- 2NaHCO 3 (s) Na 2 CO 3 (s) + CO 2 (g) + H 2 O (g): [CO 2] se duplica.
- N 2 F 4 (g) 2NF 2 (g): [NF] se disminuye en un factor de 2.
- H 2 (g) + I 2 (g) 2HI (g): [I 2] se duplica.
-
Escribir una expresión constante de equilibrio para cada sistema de reacción. Dados los cambios indicados, ¿cómo debe cambiar la concentración de la especie en negrita para que el sistema mantenga el equilibrio?
- CS 2 (g) + 4H 2 (g) CH 4 (g) + 2H 2 S (g): [CS 2] se duplica.
- PCl 5 (g) PCl 3 (g) + Cl 2 (g): [Cl 2] se disminuye en un factor de 2.
- 4NH 3 (g) + 5O 2 (g) 4NO (g) + 6H 2 O (g): [NO] se duplica.
Contestar
-
- \(K=\dfrac{[CH_4][H_2S]^2}{[CS_2][H_2]^4}\); duplicar\([CS_2]\) requeriría disminuir\([H_2]\) por un factor de 2√41.189.
- \(K=\dfrac{[PCl_3]}{[Cl_2][PCl_5]}\); si\([Cl_2]\) se reduce a la mitad, también se\([PCl_5]\) debe reducir a la mitad.
- \(K=\dfrac{[NO]^4[H_2O]^6}{[NH_3][O_2]^5}\); si\([NO]\) se duplica,\([H_2O]\) se multiplica por 22/31.587.
Problemas numéricos
-
Los datos de la siguiente tabla se recogieron a 450°C para la reacción
\(N_{2(g)}+3H_{2(g)} \rightleftharpoons 2NH_{3(g)}\)
Presión Parcial de Equilibrio (atm) P (atm) NH 3 N 2 H 2 30 (equilibrio) 1.740 6.588 21.58 100 15.20 19.17 65.13 600 321.6 56.74 220.8 La reacción se equilibra a una presión de 30 atm. La presión sobre el sistema se incrementa primero a 100 atm y luego a 600 atm. ¿Está el sistema en equilibrio a cada una de estas presiones más altas? Si no, ¿en qué dirección procederá la reacción para alcanzar el equilibrio?
-
Para la reacción 2A B + 3 C, K a 200°C es 2.0. Se utilizó un matraz de 6.00 L para llevar a cabo la reacción a esta temperatura. Dados los datos experimentales en la siguiente tabla, todos a 200°C, cuando se recolectaron los datos para cada experimento, ¿la reacción estaba en equilibrio? Si no estaba en equilibrio, ¿en qué dirección procederá la reacción?
Experimento A B C 1 2.50 M 2.50 M 2.50 M 2 1.30 atm 1.75 atm 14.15 atm 3 12.61 mol 18.72 mol 6.51 mol -
Las dos reacciones siguientes se llevan a cabo a 823 K:
\(CoO_{(s)}+H_{2(g)} \rightleftharpoons Co_{(s)}+H_2O_{(g)}\)con\(K=67\)
\(CoO_{(s)}+CO_{(g)} \rightleftharpoons Co_{(s)}+CO_{2(g)}\)con\(K=490\)
- Escribe la expresión de equilibrio para cada reacción.
- Calcular la presión parcial de ambos componentes gaseosos en equilibrio en cada reacción si un recipiente de reacción de 1.00 L contiene inicialmente 0.316 mol de H 2 o CO más 0.500 mol de CoO.
- Utilizando la información proporcionada, calcule K p para la siguiente reacción: \(H_{2(g)}+CO_{2(g)} \rightleftharpoons CO_{(g)}+H_2O_{(g)}\)
- Describir la forma de las gráficas de [reactivos] versus [productos] a medida que cambia la cantidad de CoO.
-
El yoduro de hidrógeno (HI) se sintetiza a través de H 2 (g) + I 2 (g) 2HI (g), para lo cual K p = 54.5 a 425°C.Dado un recipiente de 2.0 L que contiene 1.12 × 10 −2 mol de H 2 y 1.8 × 10 −3 mol de I2 en equilibrio, ¿Cuál es la concentración de HI? Se agrega hidrógeno en exceso al recipiente para que el recipiente contenga ahora 3.64 × 10 −1 mol de H 2. Calcular Q y luego predecir la dirección en la que procederá la reacción. ¿Cuáles son las nuevas concentraciones de equilibrio?
RESPUESTAS
-
No en equilibrio; en ambos casos, la suma de las presiones parciales de equilibrio es menor que la presión total, por lo que la reacción procederá a la derecha para disminuir la presión.
-
- \(K=[H_2O][H_2]\); K= [CO2] [CO]
- \(P_{H_2O} = 21.0\; atm\);\(P_{H_2} = 0.27\; atm\);\(P_{CO_2} = 21.3\; atm\);\(P_{CO} = 0.07\; atm\)
- \(K_p = 0.14\)
- La cantidad de CoO no tiene ningún efecto sobre la forma de una gráfica de productos versus reactivos siempre que esté presente algún CoO sólido.
Colaboradores
- Anonymous
Modificado por Joshua B. Halpern