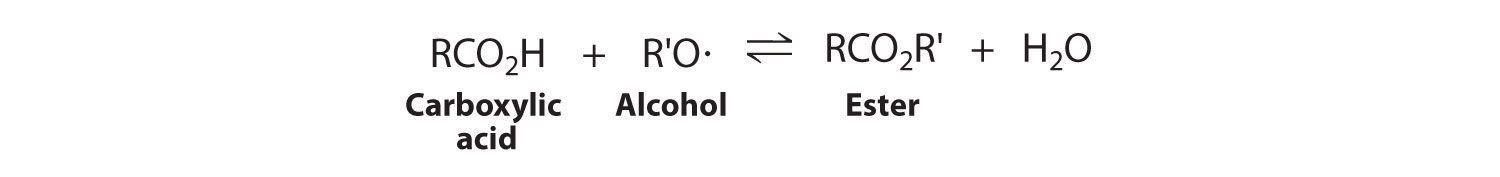15.5: Factores que afectan el equilibrio
- Page ID
- 77949
- Predecir los efectos de las tensiones en un sistema en equilibrio.
Los químicos utilizan diversas estrategias para incrementar el rendimiento de los productos deseados de las reacciones. Al sintetizar un éster, por ejemplo, ¿cómo puede un químico controlar las condiciones de reacción para obtener la máxima cantidad del producto deseado? Solo tres tipos de tensiones pueden cambiar la composición de una mezcla de equilibrio: (1) un cambio en las concentraciones (o presiones parciales) de los componentes mediante la adición o eliminación de reactivos o productos, (2) un cambio en la presión o volumen total, y (3) un cambio en la temperatura del sistema. En esta sección, exploramos cómo los cambios en las condiciones de reacción pueden afectar la composición de equilibrio de un sistema. Exploraremos cada una de estas posibilidades a su vez.
Cambios en la Concentración
Si añadimos un pequeño volumen de disolvente tetracloruro de carbono (CCl 4) a un matraz que contiene cristales de yodo, obtenemos una solución saturada de I 2 en CCl 4, junto con cristales no disueltos:
\[I_{2(s)} \rightleftharpoons I_{2(soln)}\tag{15.5.1}\]
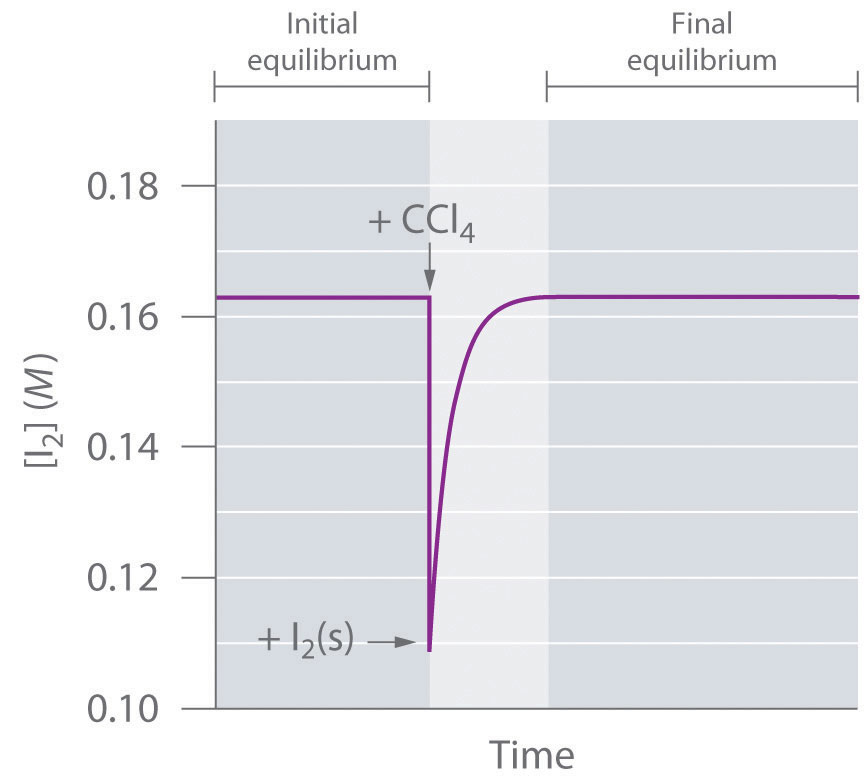
El sistema alcanza el equilibrio, con K = [I 2]. Si agregamos más CCl 4, diluyendo así la solución, Q es ahora menor que K. El principio de Le Chatelier nos dice que el sistema reaccionará para aliviar el estrés, pero ¿cómo? La adición de disolvente estresó el sistema al disminuir la concentración de I 2 disuelto. De ahí que más cristales se disolverán, aumentando así la concentración de I 2 disuelto hasta que el sistema vuelva a alcanzar el equilibrio si hay suficiente sólido I 2 disponible (Figura 15.5.1). Al agregar solvente, condujimos la reacción que se muestra en la Ecuación 15.5.1 a la derecha tal como está escrita.
Figura 15.5.1 La concentración de I 2 disuelto en función del tiempo tras la adición de más disolvente a una solución saturada en contacto con exceso de sólido I 2 La concentración de I2 disminuye inicialmente debido a la dilución pero vuelve a su valor original siempre y cuando el sólido I 2 esté presente.
Nos encontramos con un sistema más complejo en la reacción de hidrógeno y nitrógeno para formar amoníaco:
\[N_{2(g)}+3H_{2(g)} \rightleftharpoons 2NH_{3(g)} \tag{15.5.2}\]
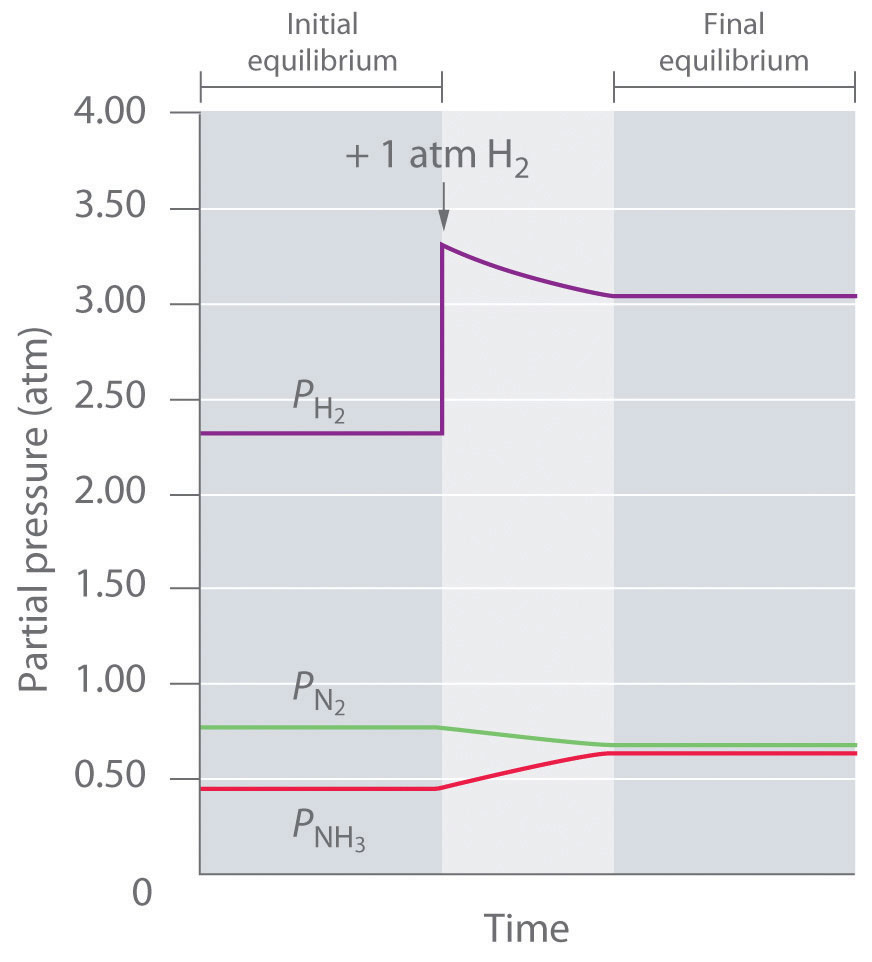
El K p para esta reacción es de 2.14 × 10 −2 a aproximadamente 540 K. Bajo un conjunto de condiciones de equilibrio, la presión parcial del amoníaco es P (NH 3) = 0.454 atm, la del hidrógeno es P (H2) = 2.319 atm, y la del nitrógeno es P (N 2) = 0.773 atm. Si se agrega 1 atm adicional de hidrógeno al reactor para dar P (H 2) = 3.319 atm, ¿cómo responderá el sistema? Debido a que la tensión es un aumento en P (H 2) el sistema debe responder de alguna manera que disminuya la presión parcial del hidrógeno para contrarrestar la tensión. Por lo tanto, la reacción procederá a la derecha tal como está escrito, consumiendo H 2 y N 2 y formando NH 3 adicional. Inicialmente, las presiones parciales de H 2 y N 2 disminuirán, y la presión parcial de NH 3 aumentará hasta que el sistema finalmente alcance una nueva composición de equilibrio, que tendrá un aumento neto en P (H 2)
Podemos confirmar que esto es efectivamente lo que sucederá evaluando Q p bajo las nuevas condiciones y comparando su valor con K p. Las ecuaciones utilizadas para evaluar K p y Q p tienen la misma forma: sustituir los valores después de agregar hidrógeno a la expresión por Q p da como resultado lo siguiente:
\[Q_p=\dfrac{(P_{NH_3})^2}{(P_{N_2})(P_{H_2})^3}=\dfrac{(0.454)^2}{(0.773)(2.319+1.00)^3}=7.29 \times 10^{-3}\]
Así Q p < K p, lo que nos dice que la relación de productos a reactivos es menor que en equilibrio. Para alcanzar el equilibrio, la reacción debe proceder a la derecha como está escrito: las presiones parciales de los productos aumentarán, y las presiones parciales de los reactivos disminuirán. Q p aumentará con ello hasta que sea igual a K p, y el sistema volverá a estar en equilibrio. Los cambios en las presiones parciales de las diversas sustancias en la mezcla de reacción (Ecuación 15.5.2) en función del tiempo se muestran en la Figura 15.5.2.
Figura 15.5.2 Las presiones parciales de H 2, N 2 y NH 3 en función del tiempo después de la adición de más H 2 a una mezcla de equilibrio Parte del hidrógeno agregado se consume al reaccionar con nitrógeno para producir más amoníaco, permitiendo que el sistema alcance una nueva composición de equilibrio.
Podemos forzar que una reacción llegue esencialmente a su finalización, independientemente de la magnitud de K, eliminando continuamente uno de los productos de la mezcla de reacción. Consideremos, por ejemplo, la reacción de metanación, en la que el hidrógeno reacciona con el monóxido de carbono para formar metano y agua:
\[CO_{(g)}+3H_{2(g)} \rightleftharpoons CH_{4(g)}+H_2O_{(g)} \tag{15.5.3}\]
Esta reacción se utiliza para la producción industrial de metano, mientras que la reacción inversa se emplea para la producción de H 2 (Ejemplo 14). La expresión para Q tiene la siguiente forma:
\[Q=\dfrac{[CH_4][H_2O]}{[CO][H_2]^3} \tag{15.5.4}\]
Independientemente de la magnitud de K, si bien H 2 O o CH 4 pueden eliminarse de la mezcla de reacción de manera que [H 2 O] o [CH 4] sea aproximadamente cero, entonces Q ≈ 0. Es decir, cuando se retira el producto, el sistema se estresa (Q << K), y se formará más producto para contrarrestar el estrés. Debido a que el agua (bp = 100°C) es mucho menos volátil que el metano, hidrógeno o monóxido de carbono (todos los cuales tienen puntos de ebullición por debajo de −100°C), pasar la mezcla de reacción gaseosa a través de un serpentín frío hará que el vapor de agua se condense en un líquido que puede ser extraído. Continuar retirando el agua del sistema obliga a la reacción a la derecha mientras el sistema intenta equilibrarse, enriqueciendo así la mezcla de reacción en metano. Esta técnica, conocida como conducir una reacción hasta su finalización, se puede utilizar para forzar una reacción a su finalización incluso si K es relativamente pequeño. Por ejemplo, los ésteres generalmente se sintetizan eliminando el agua. Aquí se muestran los productos de la reacción de condensación. En el Capítulo 19, describiremos la base termodinámica para el cambio en la posición de equilibrio causado por cambios en las concentraciones de los componentes de la reacción.
Ejemplo 15.5.1
Para cada sistema de equilibrio, prediga el efecto de la tensión indicada sobre la cantidad especificada.
- 2SO 2 (g) + O 2 (g) 2SO 3 (g):
(1) el efecto de eliminar O 2 sobre P (SO 2)
(2) el efecto de eliminar O 2 sobre P (SO 3) - CaCo 3 (s) CaO (s) + CO 2 (g):
(1) el efecto de eliminar CO 2 sobre la cantidad de CaCo 3;
(2) el efecto de agregar CaCo 3 sobre P (CO 2)
Dado: ecuaciones químicas equilibradas y cambios
Preguntado por: efectos de tensiones indicadas
Estrategia:
Use Q y K para predecir el efecto del estrés en cada reacción.
Solución:
- (1) Eliminar O 2 disminuirá P (O 2) disminuyendo así el denominador en el cociente de reacción y haciendo Q p > K p. La reacción procederá a la izquierda tal como está escrito, incrementando las presiones parciales de SO 2 y O 2 hasta que Q p una vez más sea igual a K p.
(2) Quitar O 2 disminuirá P (O 2) y así aumentará Q p, por lo que la reacción procederá a la izquierda. La presión parcial del SO 3 disminuirá. - K p y Q p son iguales a P (CO 2).
(1) Eliminar CO 2 del sistema provoca que más CaCo 3 reaccione para producir CO 2, lo que aumenta P (CO 2) a la presión parcial requerida por K p. (2) Agregar (o eliminar) CaCo sólido 3 no tiene efecto sobre P (CO 2) porque no aparece en la expresión para K p (o Q p).
Ejercicio
Para cada sistema de equilibrio, prediga el efecto que la tensión indicada tendrá sobre la cantidad especificada.
- \(H_{2(g)}+CO_{2(g)} \rightleftharpoons H_2O_{(g)}+CO_{(g)}\):
- el efecto de añadir\(CO\) sobre\([H_2]\);
- el efecto de agregar\(CO_2\)\([H_2]\)
- \(CuO_{(s)}+CO_{(g)} \rightleftharpoons Cu_{(s)}+CO_{2(g)}\):
- el efecto de agregar\(CO\) sobre la cantidad de\(Cu\);
- el efecto de agregar\(CO_2\)\([CO]\)
Contestar
- (1) [H 2] aumenta; (2) [H 2] disminuye.
- (1) la cantidad de Cu aumenta; (2) [CO] aumenta.
Cambios en la Presión Total o Volumen
Debido a que los líquidos son relativamente incompresibles, cambiar la presión por encima de una solución líquida tiene poco efecto sobre las concentraciones de sustancias disueltas. En consecuencia, los cambios en la presión externa tienen muy poco efecto en los sistemas de equilibrio que contienen solo sólidos o líquidos. En contraste, debido a que los gases son altamente compresibles, sus concentraciones varían drásticamente con la presión. De la ley de gas ideal, PV = nRT, descrita en el Capítulo 10, la concentración (C) de un gas se relaciona con su presión de la siguiente manera:
\[C=\dfrac{n}{V}=\dfrac{P}{RT} \tag{15.5.5}\]
De ahí que la concentración de cualquier reactivo gaseoso o producto sea directamente proporcional a la presión aplicada (P) e inversamente proporcional al volumen total (V). En consecuencia, las composiciones de equilibrio de los sistemas que contienen sustancias gaseosas son bastante sensibles a los cambios de presión, volumen y temperatura.
Estos principios se pueden ilustrar utilizando la disociación reversible de N 2 O 4 gaseoso a NO 2 gaseoso (Ecuación 15.2.1).
\[N_2O_4 \rightleftharpoons 2 NO_2 \tag{15.1.1} \]
La jeringa mostrada en la Figura 15.5.3 contiene inicialmente una mezcla de equilibrio de N 2 O 4 incoloro y NO 2 rojo-marrón. Disminuir el volumen en un 50% hace que la mezcla se vuelva más oscura porque todas las concentraciones se han duplicado. Disminuir el volumen también constituye un estrés, sin embargo, como podemos ver al examinar el efecto de un cambio en el volumen sobre Q. En equilibrio,
\[Q = K = \dfrac{[NO_2]^2}{[N_2O_4]} \tag{15.5.6a}\]
Si el volumen se disminuye a la mitad, las concentraciones de las sustancias en la mezcla se duplican, por lo que el nuevo cociente de reacción es el siguiente:
\[Q=\dfrac{(2[NO_2]_i)^2}{2[N_2O_4]_i}=\dfrac{4([NO_2]_i)^2}{2[N_2O_4]_i}=2K \tag{15.5.6b}\]
Debido a que Q es ahora mayor que K, el sistema ya no está en equilibrio. El estrés puede aliviarse si la reacción procede hacia la izquierda, consumiendo 2 mol de NO 2 por cada 1 mol de N 2 O 4 producido. Esto disminuirá la concentración de NO 2 e incrementará la concentración de N 2 O 4, provocando que Q disminuya hasta que una vez más sea igual a K. Así, como se muestra en la parte (c) de la Figura 15.5.3, la intensidad del color marrón debido al NO 2 disminuye con el tiempo tras el cambio de volumen.
Figura 15.5.3 El efecto de cambiar el volumen (y por lo tanto la presión) de una mezcla de equilibrio de N 2 O 4 y NO 2 a temperatura constante (a) La jeringa con un volumen total de 15 mL contiene una mezcla de equilibrio de N 2 O 4 y NO 2; el color rojo-marrón es proporcional a la concentración de NO 2. (b) Si el volumen disminuye rápidamente por un factor de 2 a 7.5 mL, el efecto inicial es duplicar las concentraciones de todas las especies presentes, incluyendo NO 2. De ahí que el color se vuelva más intenso. (c) Con el tiempo, el sistema ajusta su composición en respuesta al estrés predicho por el principio de Le Chatelier, formando N 2 O 4 incoloro a expensas del NO 2 rojo-marrón, lo que disminuye la intensidad del color de la mezcla.
Tenga en cuenta el patrón
Aumentar la presión de un sistema (o disminuir el volumen) favorece el lado de la reacción que tiene menos moléculas gaseosas y viceversa.
En general, si una ecuación química equilibrada contiene diferentes números de reactivos gaseosos y moléculas de producto, el equilibrio será sensible a los cambios de volumen o presión. Aumentar la presión sobre un sistema (o disminuir el volumen) favorecerá el lado de la reacción que tiene menos moléculas gaseosas y viceversa.
Ejemplo 15.5.2
Para cada sistema de equilibrio, escriba el cociente de reacción para el sistema si la presión disminuye en un factor de 2 (es decir, si el volumen se duplica) a temperatura constante y luego predice la dirección de la reacción.
- \(N_{2(g)}+3H_{2(g)} \rightleftharpoons 2NH_{3(g)}\)
- \(C_2H_{2(g)}+C_2H_{6(g)} \rightleftharpoons 2C_2H_{4(g)}\)
- \(2 NO_{2 (g)} \rightleftharpoons 2NO_{(g)}+O_{2(g)}\)
Dado: ecuaciones químicas balanceadas
Preguntado por: dirección de reacción si la presión se reduce a la mitad
Estrategia:
Utilice el principio de Le Chatelier para predecir el efecto del estrés.
Solución:
- Se forman dos moles de productos gaseosos a partir de 4 mol de reactivos gaseosos. Disminuir la presión provocará que la reacción se desvíe hacia la izquierda porque ese lado contiene el mayor número de moles de gas. Así la presión aumenta, contrarrestando el estrés. K para esta reacción es [NH 3] 2/[N 2] [H 2] 3. Cuando la presión disminuye en un factor de 2, las concentraciones se reducen a la mitad, lo que significa que el nuevo cociente de reacción es el siguiente:
\[Q=\dfrac{[1/2\;NH_3]^2}{[1/2\;N_2][1/2H_2]^3}=\dfrac{1/4\;[NH_3]^2}{1/16\;[N_2][H_2]^3}=4K \notag \]
- Dos moles de productos gaseosos forman a partir de 2 mol de reactivos gaseosos. Disminuir la presión no tendrá ningún efecto sobre la composición de equilibrio porque ambos lados de la ecuación química equilibrada tienen el mismo número de moles de gas. Aquí K = [C 2 H 4] 2/[C 2 H 2] [C 2 H 6]. El nuevo cociente de reacción es el siguiente:
\[Q=\dfrac{[C_2H_4]^2}{[C_2H_2][C_2H_6]}=\dfrac{[1/2C_2H_4]^2}{[1/2C_2H_2][1/2C_2H_6]}=\dfrac{1/4[C_2H_4]^2}{1/4[C_2H_2][C_2H_6]}=K \notag \]
- Se forman tres moles de productos gaseosos a partir de 2 mol de reactivos gaseosos. Disminuir la presión favorecerá el lado que contiene más moles de gas, por lo que la reacción se desplazará hacia los productos para aumentar la presión. Para esta reacción K = [NO] 2 [O 2]/[NO 2] 2. Bajo las nuevas condiciones de reacción, el cociente de reacción es el siguiente:
\[Q=\dfrac{[1/2NO]^2[1/2O_2]}{[1/2 NO_2]^2}=\dfrac{1/8[NO]^2[O_2]}{1/4[NO_2]^2}=1/2K \notag \]
Ejercicio
Para cada sistema de equilibrio, escriba un nuevo cociente de reacción para el sistema si la presión se incrementa en un factor de 2 (es decir, si el volumen se reduce a la mitad) a temperatura constante y luego predecir la dirección en la que se desplazará la reacción.
- \(H_2O_{(g)}+CO_{(g)} \rightleftharpoons H_{2(g)}+CO_{2(g)}\)
- \(H_{2(g)}+C_2H_{4(g)} \rightleftharpoons C_2H_{6(g)}\)
- \(2SO_{2(g)}+O_{2(g)} \rightleftharpoons 2SO_{3(g)}\)
Contestar
- Q = K; sin efecto
- Q = 1/2 K; a la derecha
- Q = 1/2 K; a la derecha
Cambios en la temperatura
En todos los casos que hemos considerado hasta ahora, la magnitud de la constante de equilibrio, K o K p, fue constante. Los cambios de temperatura pueden, sin embargo, cambiar el valor de la constante de equilibrio sin afectar inmediatamente el cociente de reacción (Q ≠ K). En este caso, el sistema ya no está en equilibrio; la composición del sistema cambiará hasta que Q sea igual a K a la nueva temperatura.
Para predecir cómo responderá un sistema de equilibrio a un cambio de temperatura, debemos saber algo sobre el cambio de entalpía de la reacción (Δ H rxn). Como aprendiste en el Capítulo 9, el calor se libera a los alrededores en una reacción exotérmica (Δ H rxn < 0), y el calor es absorbido del entorno en una reacción endotérmica (Δ H rxn > 0). Podemos expresar estos cambios de la siguiente manera:
- Exotérmico (ΔH<0):\[\text{reactants} \rightleftharpoons \text{products} + \text{heat} \tag{15.5.7}\]
- Endotérmica (ΔH>0):\[\text{reactants} + \text{heat} \rightleftharpoons \text{products} \tag{15.5.8}\]
Así, el calor puede considerarse como un producto en una reacción exotérmica y como un reactivo en una reacción endotérmica. Aumentar la temperatura de un sistema corresponde a agregar calor. El principio de Le Chatelier predice que una reacción exotérmica se desplazará hacia la izquierda (hacia los reactivos) si se incrementa la temperatura del sistema (se agrega calor). Por el contrario, una reacción endotérmica se desplazará hacia la derecha (hacia los productos) si se incrementa la temperatura del sistema. Si una reacción es termoquímicamente neutra (Δ H rxn = 0), entonces un cambio de temperatura no afectará la composición de equilibrio.
Podemos examinar los efectos de la temperatura sobre la disociación de N 2 O 4 a NO 2, para lo cual Δ H = +58 kJ/mol. Esta reacción se puede escribir de la siguiente manera:
\[58\; kJ+N_2O_{4(g)} \rightleftharpoons 2 NO_{2(g)} \tag{15.5.9}\]
Aumentar la temperatura (agregar calor al sistema) es una tensión que impulsará la reacción hacia la derecha, como se ilustra en la Figura 15.5.4. De esta manera, al aumentar la temperatura se incrementa la relación de NO 2 a N 2 O 4 en equilibrio, lo que aumenta K.
Figura 15.5.4 El Efecto de la Temperatura sobre el Equilibrio entre N 2 O 4 Gaseoso y NO 2 El valor de\(K\) los cambios con temperatura del mismo 99.9% puro\(NO_2/N_2O_4\) sellado en una ampolla. De izquierda a derecha -196° C, 0° C, 23° C, 35° C, 50° C. En la reacción endotérmica, la posición de equilibrio puede ser desplazada cambiando la temperatura. Cuando se agrega calor y la temperatura aumenta, la reacción se desplaza hacia la derecha y el matraz se vuelve marrón rojizo debido a un aumento de\(NO_2\). Cuando se retira el calor y la temperatura disminuye, la reacción se desplaza hacia la izquierda y el matraz se vuelve incoloro debido a un aumento de\(N_2O_4\). Esto demuestra el Principio de Le Chatelier porque el equilibrio cambia en la dirección que consume energía. Figura utilizada con permiso de Wikipedia.
El efecto de aumentar la temperatura en un sistema en equilibrio se puede resumir de la siguiente manera: aumentar la temperatura aumenta la magnitud de la constante de equilibrio para una reacción endotérmica, disminuye la constante de equilibrio para una reacción exotérmica, y no tiene ningún efecto sobre la constante de equilibrio para una reacción térmicamente neutra. El Cuadro 15.5.1 muestra la dependencia de temperatura de las constantes de equilibrio para la síntesis de amoníaco a partir de hidrógeno y nitrógeno, que es una reacción exotérmica con Δ H° = −91.8 kJ/mol. Los valores tanto de K como de K p disminuyen drásticamente con el aumento de la temperatura, como se predijo para una reacción exotérmica.
Cuadro 15.5.1 Dependencia de temperatura de K y K p para N 2 (g) + 3 H 2 (g) 2 NH 3 (g)
| Temperatura (K) | K | K p |
|---|---|---|
| 298 | 3.3 × 10 8 | 5.6 × 10 5 |
| 400 | 3.9 × 10 4 | 3.6 × 10 1 |
| 450 | 2.6 × 10 3 | 1.9 |
| 500 | 1.7 × 10 2 | 1.0 × 10 −1 |
| 550 | 2.6 × 10 1 | 1.3 × 10 −2 |
| 600 | 4.1 | 1.7 × 10 −3 |
Tenga en cuenta el patrón
Al aumentar la temperatura, las reacciones endotérmicas favorecen los productos y las reacciones exotérmicas favorecen a los reactivos.
Ejemplo 15.5.3
Para cada reacción de equilibrio, prediga el efecto de disminuir la temperatura:
- \(N_{2(g)}+3H_{2(g)} \rightleftharpoons 2NH_{3(g)}\;\;\; ΔH_{rxn}=−91.8\; kJ/mol\)
- \(CaCO_{3(s)} \rightleftharpoons CaO_{(s)}+CO_{2(g)}\;\;\; ΔH_{rxn}=178\; kJ/mol\)
Dado: ecuaciones químicas balanceadas y valores de Δ H rxn
Preguntado por: efectos de disminuir la temperatura
Estrategia:
Utilice el principio de Le Chatelier para predecir el efecto de disminuir la temperatura en cada reacción.
Solución:
- La formación de NH 3 es exotérmica, por lo que podemos ver el calor como uno de los productos: \[N_{2(g)}+3H_{2(g)} \rightleftharpoons 2NH_{3(g)}+91.8\; kJ \notag \]
- Si disminuye la temperatura de la mezcla, el calor (uno de los productos) se está retirando del sistema, lo que provoca que el equilibrio se desvíe hacia la derecha. De ahí que se favorezca la formación de amoníaco a temperaturas más bajas.
- La descomposición del carbonato de calcio es endotérmica, por lo que el calor puede verse como uno de los reactivos:
\[CaCO_{3(s)}+178 \;kJ \rightleftharpoons CaO_{(s)}+CO_{2(g)} \notag \]
Si disminuye la temperatura de la mezcla, el calor (uno de los reactivos) se está retirando del sistema, lo que provoca que el equilibrio se desvíe hacia la izquierda. De ahí que la descomposición térmica del carbonato de calcio se vea menos favorecida a temperaturas más bajas.
Ejercicio
Para cada sistema de equilibrio, prediga el efecto de aumentar la temperatura en la mezcla de reacción:
- \(2SO_{2(g)}+O_{2(g)} \rightleftharpoons 2SO_{3(g)}\)con\(ΔH_{rxn}=−198\; kJ/mol\)
- \(N_{2(g)}+O_{2(g)} \rightleftharpoons 2NO_{(g)}\)con\(ΔH_{rxn}=+181\; kJ/mol\)
Contestar
- La reacción se desplaza hacia la izquierda.
- La reacción se desplaza hacia la derecha.
Resumen
Tres tipos de tensiones pueden alterar la composición de un sistema de equilibrio: agregar o eliminar reactivos o productos, cambiar la presión o volumen total y cambiar la temperatura del sistema. Una reacción con una constante de equilibrio desfavorable puede ser conducida a su finalización eliminando continuamente uno de los productos de la reacción. Los equilibrios que contienen diferentes números de reactivos gaseosos y moléculas de producto son sensibles a los cambios de volumen o presión; presiones más altas favorecen el lado con menos moléculas gaseosas. La eliminación del calor de una reacción exotérmica favorece la formación de productos, mientras que la eliminación del calor de una reacción endotérmica favorece la formación de reactivos.
Llave para llevar
- Los equilibrios se ven afectados por cambios en la concentración, la presión o volumen total y la temperatura.
Problemas conceptuales
-
Si una reacción de equilibrio es endotérmica en la dirección hacia adelante, ¿cuál es el cambio esperado en la concentración de cada componente del sistema si se incrementa la temperatura de la reacción? ¿Si disminuye la temperatura?
-
Escriba la ecuación de equilibrio para el siguiente sistema:
\ [4NH_ {3 (g)} +5O_ {2 (g)}\ derechazarpoones 4NO_ {(g)} + 6H_2O_ {(g)}\
¿Esperaría que el equilibrio se desplazara hacia los productos o reactivos con un aumento de presión? ¿Por qué?
-
La velocidad de reacción se duplica aproximadamente por cada aumento de temperatura de 10°C. ¿Qué le pasa a K?
-
La formación de A 2 B 2 (g) a través de la reacción de equilibrio 2AB (g) A 2 B 2 (g) es exotérmica. ¿Qué pasa con la relación k f/k r si se incrementa la temperatura? ¿Si se incrementan tanto la temperatura como la presión?
-
En cada sistema, predecir el efecto que tendrá el cambio indicado sobre la cantidad especificada en equilibrio:
- \(H_{2(g)}+I_{2(g)} \rightleftharpoons 2HI_{(g)}\):
Se elimina H 2; ¿cuál es el efecto en P (I 2)?
- \(2NOBr_{(g)} \rightleftharpoons 2NO_{(g)} + Br_{2(g)}\)
Si se elimina Br 2; ¿cuál es el efecto en P NoBr?
- \(2NaHCO_{3(s)} \rightleftharpoons Na_2CO_{3(g)} + CO_{2(g)}+H_2O_{(g)}\)
Si se elimina CO 2; ¿cuál es el efecto sobre P (NaHCO 3)?
- \(H_{2(g)}+I_{2(g)} \rightleftharpoons 2HI_{(g)}\):
-
¿Qué efecto tendrá el cambio indicado sobre la cantidad especificada en equilibrio?
- \(NH_4Cl_{(s)} \rightleftharpoons NH_{3(g)}+HCl_{(g)}\)
Si se incrementa NH 4 Cl; ¿cuál es el efecto sobre P HCl?
- \(2H2O_{(g)} \rightleftharpoons 2H_{2(g)}+O_{2(g)}\)
Si se agrega O 2; ¿cuál es el efecto sobre P (H 2)? <
- \(PCl_{3(g)}+Cl_{2(g)} \rightleftharpoons PCl_{5(g)}\)
Si se elimina Cl 2; ¿cuál es el efecto sobre P (PCl 5)?
- \(NH_4Cl_{(s)} \rightleftharpoons NH_{3(g)}+HCl_{(g)}\)
Problemas numéricos
-
Para cada reacción de equilibrio, describa cómo cambian Q y K cuando se incrementa la presión, se incrementa la temperatura, se aumenta el volumen del sistema y se incrementa la (s) concentración (es) del (de los) reactivo (s).
- A (g) B (g) Δ H = −20.6 kJ/mol
- 2A (g) B (g) Δ H = −0.3 kJ/mol
- A (g) + B (g) 2C (g) Δ H = 46 kJ/mol
-
Para cada reacción de equilibrio, describa cómo cambian Q y K cuando se disminuye la presión, se incrementa la temperatura, se disminuye el volumen del sistema y se incrementa la concentración (es) del (de los) reactivo (s).
- 2A (g) B (g) Δ H = −80 kJ/mol
- A (g) 2B (g) Δ H = 0.3 kJ/mol
- 2A (g) 2B (g) + C (g) Δ H = 46 kJ/mol
-
El principio de Le Chatelier establece que un sistema cambiará su composición para contrarrestar el estrés. Para el sistema CO (g) + Cl 2 (g) COCl 2 (g), escribir la expresión constante de equilibrio K p. ¿Qué cambios en los valores de Q y K anticiparía cuando (a) se duplica el volumen, (b) se incrementa la presión en un factor de 2, y (c) se elimina el CoCl 2 del sistema?
-
Para el sistema de equilibrio 3O 2 (g) 2 O 3 (g), Δ H° = 284 kJ, escribir la expresión constante de equilibrio K p. ¿Qué sucede con los valores de Q y K si se incrementa la temperatura de reacción? ¿Qué pasa con estos valores si se incrementa tanto la temperatura como la presión?
-
El carbono y el oxígeno reaccionan para formar gas CO 2 vía C (s) + O 2 (g) CO 2 (g), para lo cual K = 1.2 × 10 69. ¿Esperaría que K aumentara o disminuyera si se triplicara el volumen del sistema? ¿Por qué?
-
La reacción CoCl 2 (g) CO (g) + Cl 2 (g) tiene K = 2.2 × 10 −10 a 100°C. Comenzando con una P inicial (CoCl 2) de 1.0 atm, se determinan los siguientes valores de P CO a tres intervalos de tiempo sucesivos: 6.32 × 10 −6 atm, 1.78 × 10 −6 atm y 1.02 × 10 −5 atm. Con base en estos datos, ¿en qué dirección procederá la reacción después de cada medición? Si se agrega gas cloro al sistema, ¿cuál será el efecto en Q?
-
La siguiente tabla enumera las presiones parciales determinadas experimentalmente a tres temperaturas para la reacción Br 2 (g) 2 Br (g)
T (K) 1123 1173 1273 P (Br 2) (atm) 3.000 0.3333 6.755 × 10 −2 P (Br) (atm) 3.477 × 10 −2 2.159 × 10 −2 2.191 × 10 −2 ¿Se trata de una reacción endotérmica o exotérmica? Explica tu razonamiento.
-
La disociación del vapor de agua procede de acuerdo con la siguiente reacción: H 2 O (g) 1/2 O 2 (g) + H 2 (g). A 1300 K, hay 0.0027% de disociación, mientras que a 2155 K, la disociación es de 1.18%. Calcular K y K p. ¿Es esta una reacción endotérmica o una reacción exotérmica? ¿Cómo se comparan las magnitudes de los dos equilibrios? ¿Aumentar la presión mejoraría el rendimiento del gas H 2 a cualquiera de las dos temperaturas? (Pista: supongamos que el sistema contiene inicialmente 1.00 mol de H 2 O en un contenedor de 1.00 L.)
-
Cuando se mezclan 1.33 mol de CO 2 y 1.33 mol de H2 en un recipiente de 0.750 L y se calientan a 395°C, reaccionan de acuerdo con la siguiente ecuación: CO 2 (g) + H 2 (g) CO (g) + H 2 O (g) Si K = 0.802, cuales son los equilibrios concentraciones de cada componente de la mezcla de equilibrio? ¿Qué sucede con K si se elimina H 2 O durante el transcurso de la reacción?
-
La reacción de equilibrio H 2 (g) + Br 2 (g) 2 HBr (g) tiene K p = 2.2 × 10 9 a 298 K. Si se inicia con 2.0 mol de Br 2 y 2.0 mol de H 2 en un recipiente de 5.0 L, cuál es la presión parcial de HBr a equilibrio? ¿Cuál es la presión parcial de H 2 en equilibrio? Si H 2 es removido del sistema, ¿cuál es el efecto en la presión parcial de Br 2?
-
El óxido de hierro (II) reacciona con monóxido de carbono de acuerdo con la siguiente ecuación: FeO (s) + CO (g) Fe (s) + CO 2 (g) A 800°C, K = 0.34; a 1000°C, K = 0.40.
- Un contenedor de 20.0 L se carga con 800.0 g de CO 2, 1436 g de FeO y 1120 g de hierro. ¿Cuáles son las concentraciones de equilibrio de todos los componentes de la mezcla a cada temperatura?
- ¿Cuáles son las presiones parciales de los gases a cada temperatura?
- Si se eliminara el CO, ¿cuál sería el efecto sobre el P (CO 2) a cada temperatura?
-
La constante de equilibrio K para la reacción C (s) + CO 2 g) >2 CO (g) es 1.9 a 1000 K y 0.133 a 298 K.
- Si se permite que el exceso de C reaccione con 25.0 g de CO 2 en un matraz de 3.00 L, ¿cuántos gramos de CO se producen a cada temperatura?
- ¿Cuáles son las presiones parciales de cada gas a 298 K? a 1000 K?
- ¿Esperaría que K aumentara o disminuyera si la presión se incrementara a temperatura y volumen constantes?
-
Los datos para la oxidación del metano, CH 4 (g) + 2 O 2 (g) CO 2 (g) + 2 H 2 O (g), en un recipiente cerrado de 5.0 L se listan en la siguiente tabla. Rellene los espacios en blanco y determine los valores faltantes de Q y K (indicado por?) ya que la reacción es conducida a su finalización.
CH 4 O 2 CO 2 H 2 O Q K inicial (moles) 0.45 0.90 0 0 ? en equilibrio 1.29 añadir 0.50 mol de metano 0.95 ? nuevo equilibrio ? eliminar agua 0 ? nuevo equilibrio 1.29
RESPUESTAS
-
K p = P (CoCl 2)/(P (CO) P (Cl 2)) P
Ninguno de los cambios afectaría a K; (a) Q se duplica; (b) Q se reduce a la mitad; Q disminuye.
-
K no cambiaría; no depende del volumen.
-
[CO] = [H 2 O] = 0.839 M, [CO 2] = [H 2] = 0.930 M; ningún efecto sobre K
-
- A 800°C, [CO] = 0.678 M, [CO 2] = 0.231 M; a 1000°C, [CO] = 0.645 M, [CO 2] = 0.264 M
- A 800°C, PCO = 59.7 atm, P (CO 2) = 20.3 atm; a 1000°C, P (CO) = 67,4 atm, P (CO 2) = 27.6 atm.
- Eliminar CO provocaría que la reacción se desplazara hacia la derecha, haciendo que el P (CO 2) disminuyera.
-
CH 4 O 2 CO 2 H 2 O Q K inicial (moles) 0.45 0.90 0 0 0 1.29 en equilibrio 0.215 0.43 0.235 0.47 K 1.29 añadir 0.50 mol de metano 0.715 0.43 0.235 0.47 0.39 1.29 nuevo equilibrio 0.665 0.33 0.285 0.57 K 1.29 eliminar agua 0.665 0.33 0.285 0 0 1.29 nuevo equilibrio 0.57 0.14 0.38 0.19 K 1.29
Colaboradores
- Anonymous
Modificado por Joshua B. Halpern