15.6: Controlar los Productos de las Reacciones
- Page ID
- 77970
- Comprender diferentes formas de controlar los productos de una reacción.
Ya sea en el laboratorio sintético o en entornos industriales, uno de los principales objetivos de la química moderna es controlar la identidad y cantidad de los productos de las reacciones químicas. Por ejemplo, un proceso dirigido a sintetizar amoníaco está diseñado para maximizar la cantidad de amoníaco producido usando una cantidad dada de energía. Alternativamente, se pueden diseñar otros procesos para minimizar la creación de productos no deseados, tales como contaminantes emitidos por un motor de combustión interna. Para lograr estos objetivos, los químicos deben considerar los efectos competitivos de las condiciones de reacción que pueden controlar.
Una forma de obtener un alto rendimiento de un compuesto deseado es hacer que la velocidad de reacción de la reacción deseada sea mucho más rápida que las velocidades de reacción de cualquier otra reacción posible que pueda ocurrir en el sistema. Alterar las condiciones de reacción para controlar las velocidades de reacción, obteniendo de esta manera un solo producto o conjunto de productos, se denomina control cinético La alteración de las condiciones de reacción para controlar las velocidades de reacción, obteniendo así un solo producto deseado o conjunto de productos. Un segundo enfoque, llamado control termodinámico. La alteración de las condiciones de reacción para que un solo producto deseado o conjunto de productos esté presente en cantidades significativas en equilibrio. , consiste en ajustar las condiciones para que en equilibrio solo los productos deseados estén presentes en cantidades significativas.
Un ejemplo de control termodinámico es el proceso Haber-Bosch. Karl Bosch (1874—1940) fue un ingeniero químico alemán que se encargó de diseñar el proceso que aprovechó los descubrimientos de Fritz Haber con respecto al equilibrio N 2 + H 2/NH 3 para hacer rentable la síntesis de amoníaco a través de esta ruta. Recibió el Premio Nobel de Química en 1931 por su trabajo. El proceso industrial se llama proceso Haber o proceso Haber-Bosch. utilizado para sintetizar amoníaco a través de la siguiente reacción:
\[N_{2(g)}+3H_{2(g)} \rightleftharpoons 2NH_{3(g)} \tag{15.6.1a}\]
con
\[ΔH_{rxn}=−91.8\; kJ/mol \tag{15.6.1b}\]
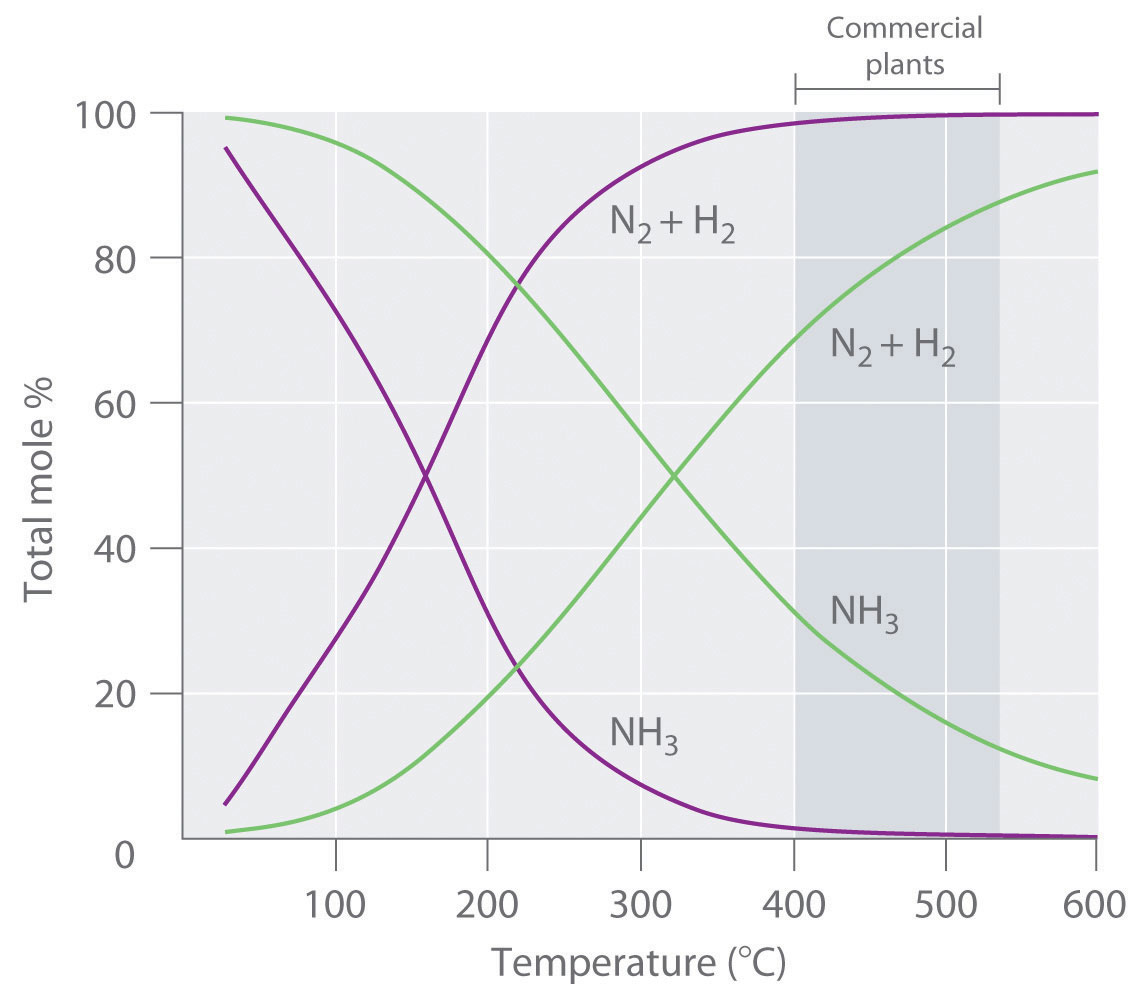
Debido a que la reacción convierte 4 mol de reactivos gaseosos en solo 2 moles de producto gaseoso, el principio de Le Chatelier predice que la formación de NH 3 se verá favorecida cuando se incremente la presión. La reacción es exotérmica, sin embargo (Δ H rxn = −91.8 kJ/mol), por lo que la constante de equilibrio disminuye con el aumento de la temperatura, lo que provoca que una mezcla de equilibrio contenga solo cantidades relativamente pequeñas de amoníaco a altas temperaturas (Figura 15.6.1). En conjunto, estas consideraciones sugieren que el rendimiento máximo de NH 3 se obtendrá si la reacción se lleva a cabo a una temperatura y una presión lo más bajas posible. Desafortunadamente, a temperaturas inferiores a aproximadamente 300°C, donde el rendimiento de equilibrio del amoníaco sería relativamente alto, la reacción es demasiado lenta para ser de cualquier uso comercial. Por lo tanto, el proceso industrial utiliza un catalizador de óxido mixto (Fe 2 O 3 /K 2 O) que permite que la reacción proceda a una velocidad significativa a temperaturas de 400°C-530°C, donde la formación de amoníaco es menos desfavorable que a temperaturas más altas.
Figura 15.6.1 Efecto de la Temperatura y Presión sobre la Composición de Equilibrio de Dos Sistemas que Originalmente Contuvieron una Mezcla 3:1 de Hidrógeno y Nitrógeno A todas las temperaturas, la presión total en los sistemas fue inicialmente de 4 atm (curvas moradas) o 200 atm (curvas verdes). Obsérvese la dramática disminución en la proporción de NH 3 en equilibrio a temperaturas más altas en ambos casos, así como el gran aumento en la proporción de NH 3 en equilibrio a cualquier temperatura para el sistema a mayor presión (verde) versus presión menor (púrpura). Las plantas comerciales que utilizan el proceso Haber-Bosch para sintetizar amoníaco a escala industrial operan a temperaturas de 400°C—530°C (indicadas por la banda gris más oscura) y presiones totales de 130—330 atm.
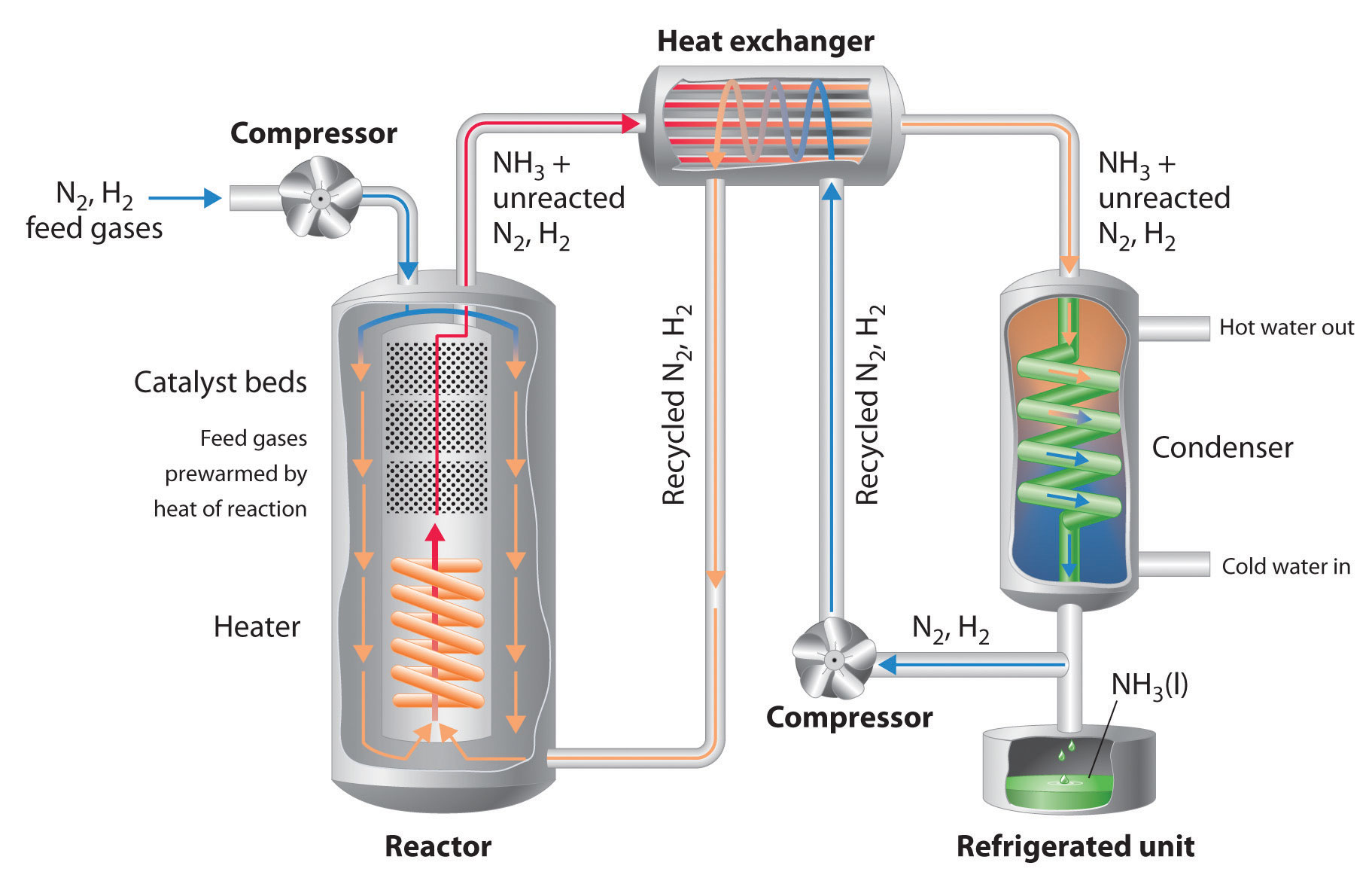
Debido al bajo valor de la constante de equilibrio a altas temperaturas (e.g., K = 0.039 a 800 K), no hay manera de producir una mezcla de equilibrio que contenga grandes proporciones de amoníaco a altas temperaturas. Sin embargo, podemos controlar la temperatura y la presión mientras se usa un catalizador para convertir una fracción del N 2 y H 2 en la mezcla de reacción a NH 3, como se hace en el proceso Haber-Bosch. Este proceso también hace uso del hecho de que el producto —el amoníaco— es menos volátil que los reactivos. Debido a que NH 3 es un líquido a temperatura ambiente a presiones mayores a 10 atm, el enfriamiento de la mezcla de reacción hace que NH 3 se condense del vapor como amoníaco líquido, el cual se separa fácilmente de N 2 y H 2 sin reaccionar. Los gases sin reaccionar se reciclan hasta que finalmente se logra la conversión completa de hidrógeno y nitrógeno en amoníaco. La Figura 15.6.2 es una disposición simplificada de una planta de proceso Haber-Bosch.
Figura 15.6.2 Un diagrama esquemático de una planta industrial para la producción de amoníaco mediante el proceso Haber-Bosch Una mezcla 3:1 de H 2 y N2 gaseosos se comprime a 130—330 atm, se calienta a 400°C-530°C, y se pasa sobre un Fe 2 O 3/K Catalizador de 2 O, lo que resulta en la conversión parcial a NH 3 gaseoso. La mezcla resultante de NH 3, H 2 y N 2 gaseosos se hace pasar a través de un intercambiador de calor, que utiliza los gases calientes para precalentar N 2 y H 2 reciclados, y un condensador para enfriar el NH 3, dando un líquido que se separa fácilmente de N 2 y H 2 sin reaccionar. (Aunque el punto de ebullición normal de NH 3 es −33°C, el punto de ebullición aumenta rápidamente al aumentar la presión, a 20°C a 8.5 atm y 126°C a 100 atm.) Los N 2 y H 2 sin reaccionar se reciclan para formar más NH 3.
El proceso de acrilonitrilo Sohio, en el que el propeno y el amoníaco reaccionan con el oxígeno para formar acrilonitrilo, es un ejemplo de una reacción cinéticamente controlada:
\[\ce{CH_2=CHCH_{3(g)} + NH_{3(g)} + 3/2 O_{2(g)} <=> CH_2=CHC≡N_{(g)} + 3H_2O_{(g)}} \tag{15.6.2}\]
Como la mayoría de las reacciones de oxidación de compuestos orgánicos, esta reacción es altamente exotérmica (Δ H° = -519 kJ/mol) y tiene una constante de equilibrio muy grande (K = 1.2 × 10 94). Sin embargo, la reacción mostrada en la Ecuación 15.43 no es la reacción que un químico esperaría que ocurriera cuando se calienta propeno o amoníaco en presencia de oxígeno. Las reacciones de combustión competitivas que producen CO 2 y N2 a partir de los reactivos, como las que se muestran en la Ecuación 15.6.3 y la Ecuación 15.6.4, son aún más exotérmicas y tienen constantes de equilibrio aún mayores, reduciendo así el rendimiento del producto deseado. acrilonitrilo:
\[ \ce{CH_2=CHCH_{3(g)} + 9/2 O_{2(g)} <=> 3CO_{2(g)} + 3H_2O_{(g)}} \tag{15.6.3a}\]
con
\[ΔH^°=−1926.1 \;kJ/mol \tag{15.6.3b}\]
y
\[K=4.5 \times 10^{338} \tag{15.6.3c}\]
\[\ce{2NH_{3(g)} + 3 O_{2(g)} <=> N_{2(g)} + 6H_2O_(g)} \tag{15.6.4a}\]
con
\[ΔH°=−1359.2 \;kJ/mol, \tag{15.6.4c}\]
y
\[K=4.4 \times 10^{234} \tag{15.6.4c}\]
De hecho, la formación de acrilonitrilo en la Ecuación 15.6.2. se acompaña de la liberación de aproximadamente 760 kJ/mol de calor debido a la combustión parcial de propeno durante la reacción.
El proceso de Sohio utiliza un catalizador que acelera selectivamente la velocidad de formación de acrilonitrilo sin afectar significativamente las velocidades de reacción de las reacciones de combustión competitivas. En consecuencia, el acrilonitrilo se forma más rápidamente que CO 2 y N 2 bajo las condiciones de reacción optimizadas (aproximadamente 1.5 atm y 450°C). La mezcla de reacción se enfría rápidamente para evitar una mayor oxidación o combustión del acrilonitrilo, que luego se lava del vapor con una pulverización de agua líquida. Así, el control de la cinética de la reacción provoca que se forme el producto deseado en condiciones en las que no se establece el equilibrio. En la industria, esta reacción se lleva a cabo a una escala enorme. El acrilonitrilo es el bloque de construcción del polímero llamado poliacrilonitrilo, que se encuentra en todos los productos denominados colectivamente como acrílicos, cuya amplia gama de usos incluye la síntesis de fibras tejidas en ropa y alfombras.
Tenga en cuenta el patrón
Controlar la cantidad de producto formado requiere que se consideren factores termodinámicos y cinéticos.
Ejemplo 15.6.1
Recordemos que la metanación es la reacción del hidrógeno con monóxido de carbono para formar metano y agua:
\[CO_{(g)} +3H_{2(g)} \rightleftharpoons CH_{4(g)}+H_2O_{(g)}\]
Esta reacción es la inversa del reformado con vapor de metano descrito en el Ejemplo 14. La reacción es exotérmica (Δ H° = −206 kJ/mol), con una constante de equilibrio a temperatura ambiente de K p = 7.6 × 10 24. Desafortunadamente, sin embargo, el CO y el H 2 no reaccionan a una velocidad apreciable a temperatura ambiente. ¿Qué condiciones seleccionaría para maximizar la cantidad de metano formado por unidad de tiempo por esta reacción?
Dado: ecuación química equilibrada y valores de Δ H° y K
Preguntado por: condiciones para maximizar el rendimiento del producto
Estrategia:
Considerar el efecto de los cambios de temperatura y presión y la adición de un catalizador efectivo sobre la velocidad de reacción y el equilibrio de la reacción. Determinar qué combinación de condiciones de reacción dará como resultado la máxima producción de metano.
Solución:
Los productos son altamente favorecidos en el equilibrio, pero la velocidad a la que se alcanza el equilibrio es demasiado lenta para ser útil. Aprendió en el Capítulo 14 que la velocidad de reacción a menudo se puede aumentar drásticamente al aumentar la temperatura de los reactivos. Desafortunadamente, sin embargo, debido a que la reacción es bastante exotérmica, un aumento en la temperatura desplazará el equilibrio hacia la izquierda, provocando que se formen más reactivos y aliviando la tensión en el sistema al absorber el calor agregado. Si aumentamos demasiado la temperatura, el equilibrio ya no favorecerá la formación de metano. (De hecho, la constante de equilibrio para esta reacción es muy sensible a la temperatura, disminuyendo a solo 1.9 × 10 −3 a 1000°C). Para aumentar la velocidad de reacción, podemos intentar encontrar un catalizador que opere a temperaturas más bajas donde el equilibrio favorezca la formación de productos. Las presiones más altas también favorecerán la formación de productos debido a que 4 moles de reactivo gaseoso se convierten en solo 2 moles de producto gaseoso. No deberían ser necesarias presiones muy altas, sin embargo, porque la constante de equilibrio favorece la formación de productos. Así, las condiciones óptimas para la reacción incluyen llevarla a cabo a temperaturas superiores a la temperatura ambiente (pero no demasiado altas), agregar un catalizador, y usar presiones mayores a la presión atmosférica.
Industrialmente, la metanación catalítica se lleva a cabo típicamente a presiones de 1-100 atm y temperaturas de 250°C—450°C en presencia de un catalizador de níquel. (A 425°C°C, K p es 3.7 × 10 3, por lo que se sigue favoreciendo la formación de productos). La síntesis de metano también se puede favorecer eliminando H 2 O o CH 4 de la mezcla de reacción por condensación a medida que se forman.
Ejercicio
Como aprendió en el Ejemplo 10, la reacción de desplazamiento agua-gas es la siguiente:
K p = 0.106 y Δ H = 41.2 kJ/mol a 700 K. ¿Qué condiciones de reacción utilizaría para maximizar el rendimiento de monóxido de carbono?
Respuesta: altas temperaturas para aumentar la velocidad de reacción y favorecer la formación del producto, un catalizador para aumentar la velocidad de reacción, y la presión atmosférica porque el equilibrio no se verá muy afectado por la presión
Resumen
El cambio de condiciones para afectar las velocidades de reacción para obtener un solo producto se denomina control cinético del sistema. En contraste, el control termodinámico es ajustar las condiciones para asegurar que solo el producto o productos deseados estén presentes en concentraciones significativas en equilibrio.
Llave para llevar
- Tanto los factores cinéticos como los termodinámicos pueden ser utilizados para controlar los productos de reacción.
Problemas conceptuales
-
Una mezcla de reacción producirá el producto A o B dependiendo de la ruta de reacción. En ausencia de catalizador, se forma el producto A; en presencia de un catalizador, se forma el producto B. ¿Qué conclusiones se pueden sacar sobre las velocidades hacia adelante y hacia atrás de la reacción que produce A versus la reacción que produce B en (a) la ausencia de un catalizador y (b) la presencia de un catalizador?
-
Describa cómo diseñaría un experimento para determinar la constante de equilibrio para la síntesis de amoníaco:
\[N_{2(g)} + 3H_{2(g)} \rightleftharpoons 2NH_{3(g)} \notag \]
La reacción directa es exotérmica (Δ H° = −91.8 kJ). ¿Qué efecto tendría un aumento de temperatura en la constante de equilibrio?
-
¿Qué efecto tiene un catalizador en cada uno de los siguientes?
- la posición de equilibrio de una reacción
- la velocidad a la que se alcanza el equilibrio
- la constante de equilibrio?
-
¿Cómo se puede usar la relación Q/K para determinar en qué dirección procederá una reacción para alcanzar el equilibrio?
-
Las reacciones industriales se realizan frecuentemente en condiciones en las que pueden ocurrir reacciones competitivas. Explicar cómo se puede usar un catalizador para lograr la selectividad de reacción. ¿La relación Q/K para la reacción seleccionada cambia en presencia de un catalizador?
Problemas numéricos
-
La oxidación del acetileno vía 2C 2 H 2 (g) + 5O 2 (g) 4 CO 2 (g) + 2 H 2 O (l) tiene Δ H° = −2600 kJ. ¿Qué estrategia utilizaría con respecto a la temperatura, el volumen y la presión para maximizar el rendimiento del producto?
-
La oxidación del monóxido de carbono vía CO (g) + 1/2 O 2 (g) CO 2 (g) tiene Δ H° = −283 kJ. Si estuviera interesado en maximizar el rendimiento de CO 2, ¿qué condiciones generales seleccionaría con respecto a temperatura, presión y volumen?
-
Te interesa maximizar el rendimiento del producto del sistema 2SO 2 (g) + O 2 (g) 2 SO 3 (g) K = 280 y Δ H° = − 158 kJ. ¿Qué condiciones generales seleccionaría con respecto a temperatura, presión y volumen? Si SO 2 tiene una concentración inicial de 0.200 M y la cantidad de O 2 es estequiométrica, ¿qué cantidad de SO 3 se produce en equilibrio?
Contestar
-
Use baja temperatura y alta presión (pequeño volumen).
Colaboradores
- Anonymous
Modificado por Joshua B. Halpern