17.2: Determinación de la solubilidad de los compuestos iónicos
- Page ID
- 78020
- Calcular la solubilidad de un compuesto iónico a partir de su K sp.
Comenzamos nuestra discusión sobre los equilibrios de solubilidad y complejación, los asociados con la formación de iones complejos, mediante el desarrollo de métodos cuantitativos para describir las reacciones de disolución y precipitación de compuestos iónicos en solución acuosa. Al igual que con los equilibrios ácido-base, podemos describir las concentraciones de iones en equilibrio con un sólido iónico usando una expresión constante de equilibrio.
El producto de solubilidad
Cuando se agrega al agua un compuesto iónico ligeramente soluble, parte del mismo se disuelve para formar una solución, estableciendo un equilibrio entre el sólido puro y una solución de sus iones. Para la disolución del fosfato de calcio, uno de los dos componentes principales de los cálculos renales, el equilibrio se puede escribir de la siguiente manera, con la sal sólida a la izquierda: Como descubrirás en la Sección 17.4 y en cursos de química más avanzados, aniones básicos, como S 2−, PO 4 3−, y CO 3 2−, reaccionan con agua para producir OH − y el anión protonado correspondiente. En consecuencia, sus molaridades calculadas, suponiendo que no hay protonación en solución acuosa, son sólo aproximadas.
\[Ca_3(PO_4)_{2(s)} \rightleftharpoons 3Ca^{2+}_{(aq)} + 2PO^{3−}_{4(aq)} \tag{17.1.1}\]
La constante de equilibrio para la disolución de una sal escasamente soluble es el producto de solubilidad (K sp) La expresión constante de equilibrio para la disolución de una sal escasamente soluble que incluye la concentración de un sólido puro, que es una constante. de la sal. Debido a que la concentración de un sólido puro como Ca 3 (PO 4) 2 es una constante, no aparece explícitamente en la expresión constante de equilibrio. (Para mayor información sobre la expresión de la constante de equilibrio, ver Sección 15.2.) Por lo tanto, la expresión constante de equilibrio para la disolución del fosfato de calcio es
\[K=\dfrac{[\mathrm{Ca^{2+}}]^3[\mathrm{PO_4^{3-}}]^2}{[\mathrm{Ca_3(PO_4)_2}]} \tag{17.1.2a}\]
\[[\mathrm{Ca_3(PO_4)_2}]K=K_{\textrm{sp}}=[\mathrm{Ca^{2+}}]^3[\mathrm{PO_4^{3-}}]^2 \tag{17.1.2b}\]
A 25°C y pH 7.00, K sp para fosfato de calcio es 2.07 × 10 −33, lo que indica que las concentraciones de iones Ca 2+ y PO 4 3− en solución que están en equilibrio con fosfato cálcico sólido son muy bajas. Los valores de K sp para algunas sales comunes se listan en la Tabla 17.1.1; muestran que la magnitud de K sp varía drásticamente para diferentes compuestos. Aunque K sp no es una función del pH en la Ecuación 17.1, los cambios en el pH pueden afectar la solubilidad de un compuesto, como descubrirás en la Sección 17.4.
Tenga en cuenta el patrón
Al igual que con K, la concentración de un sólido puro no aparece explícitamente en K sp.
Tabla 17.1.1 Productos de solubilidad para sustancias iónicas seleccionadas a 25 °C
| Sólido | Color | K sp | Sólido | Color | K sp | |
|---|---|---|---|---|---|---|
| Acetatos | Yodidos | |||||
| Ca (O 2 CCH 3) 2·3H 2 O | blanco | 4 × 10 −3 | Hg 2 I 2 * | amarillo | 5.2 × 10 −29 | |
| Bromuros | PbI 2 | amarillo | 9.8 × 10 −9 | |||
| AgBr | blanquecino | 5.35 × 10 −13 | Oxalatos | |||
| Hg 2 Br 2 * | amarillo | 6.40 × 10 −23 | Ag 2 C 2 O 4 | blanco | 5.40 × 10 −12 | |
| Carbonatos | MgC 2 O 4 ·2H 2 O | blanco | 4.83 × 10 −6 | |||
| CaCo 3 | blanco | 3.36 × 10 −9 | PbC 2 O 4 | blanco | 4.8 × 10 −10 | |
| PbCo | blanco | 7.40 × 10 −14 | Fosfatos | |||
| Cloruros | Ag 3 PO 4 | blanco | 8.89 × 10 −17 | |||
| AgCl | blanco | 1.77 × 10 −10 | Sr 3 (PO 4) 2 | blanco | 4.0 × 10 −28 | |
| Hg 2 Cl 2 * | blanco | 1.43 × 10 −18 | FePO 4 ·2H 2 O | rosa | 9.91 × 10 −16 | |
| PbCl | blanco | 1.70 × 10 −5 | Sulfatos | |||
| Cromatos | Ag 2 SO 4 | blanco | 1.20 × 10 −5 | |||
| CaCrO 4 | amarillo | 7.1 × 10 −4 | BaSO 4 | blanco | 1.08 × 10 −10 | |
| PbCRo | amarillo | 2.8 × 10 −13 | PbSO | blanco | 2.53 × 10 −8 | |
| Fluoruros | Sulfuros | |||||
| BaF 2 | blanco | 1.84 × 10 −7 | Ag 2 S | negro | 6.3 × 10 −50 | |
| PbF | blanco | 3.3 × 10 −8 | CDs | amarillo | 8.0 × 10 −27 | |
| Hidróxidos | PbS | negro | 8.0 × 10 −28 | |||
| Ca (OH) 2 | blanco | 5.02 × 10 −6 | ZnS | blanco | 1.6 × 10 −24 | |
| Cu (OH) 2 | azul pálido | 1 × 10 −14 | ||||
| Mn (OH) 2 | rosa claro | 1.9 × 10 −13 | ||||
| Cr (OH) 3 | gris-verde | 6.3 × 10 −31 | ||||
| Fe (OH) 3 | rojo rojizo | 2.79 × 10 −39 | ||||
| *Estos contienen el ion Hg 2 2+. | ||||||

Los productos de solubilidad se determinan experimentalmente midiendo directamente la concentración de uno de los iones componentes o la solubilidad del compuesto en una cantidad dada de agua. Sin embargo, mientras que la solubilidad se expresa generalmente en términos de m
cantidad de soluto por 100 mL de solvente, K sp, como K, se define en términos de las concentraciones molares de los iones componentes.
Un litiasis renal. Los cálculos renales se forman a partir de sales de calcio poco solubles y están compuestos en gran parte de Ca (O 2 CCO 2) ·H 2 O y Ca 3 (PO 4) 2.
© Thinkstock
Ejemplo 17.1.1
El oxalato de calcio monohidrato [Ca (O 2 CCO 2) ·H 2 O, también escrito como CaC 2 O 4 ·H 2 O] es una sal escasamente soluble que es el otro componente principal de los cálculos renales [junto con Ca 3 (PO 4) 2]. Su solubilidad en agua a 25°C es de 7.36 × 10 −4 g/100 mL. Calcular su K sp.
Dado: solubilidad en g/100 mL
Preguntado por: K sp
Estrategia:
A Escriba el equilibrio de disolución equilibrado y la expresión del producto de solubilidad correspondiente.
B Convertir la solubilidad de la sal en moles por litro. A partir del equilibrio de disolución equilibrado, determinar las concentraciones de equilibrio de los iones solutos disueltos. Sustituir estos valores en la expresión del producto de solubilidad para calcular K sp.
Solución:
A Necesitamos escribir la expresión del producto de solubilidad en términos de las concentraciones de los iones componentes. Para el oxalato de calcio monohidrato, el equilibrio de disolución equilibrado y la expresión del producto de solubilidad (abreviando oxalato como ox 2-) son los siguientes:
\(\mathrm{Ca(O_2CCO_2)}\cdot\mathrm{H_2O(s)}\rightleftharpoons \mathrm{Ca^{2+}(aq)}+\mathrm{^-O_2CCO_2^-(aq)}+\mathrm{H_2O(l)}\hspace{5mm}K_{\textrm{sp}}=[\mathrm{Ca^{2+}}][\mathrm{ox^{2-}}]\)
Neither solid calcium oxalate monohydrate nor water appears in the solubility product expression because their concentrations are essentially constant.
B Next we need to determine [Ca2+] and [ox2−] at equilibrium. We can use the mass of calcium oxalate monohydrate that dissolves in 100 mL of water to calculate the number of moles that dissolve in 100 mL of water. From this we can determine the number of moles that dissolve in 1.00 L of water. For dilute solutions, the density of the solution is nearly the same as that of water, so dissolving the salt in 1.00 L of water gives essentially 1.00 L of solution. Because each 1 mol of dissolved calcium oxalate monohydrate dissociates to produce 1 mol of calcium ions and 1 mol of oxalate ions, we can obtain the equilibrium concentrations that must be inserted into the solubility product expression. The number of moles of calcium oxalate monohydrate that dissolve in 100 mL of water is as follows:
The number of moles of calcium oxalate monohydrate that dissolve in 1.00 L of the saturated solution is as follows:
Because of the stoichiometry of the reaction, the concentration of Ca2+ and ox2− ions are both 5.04 × 10−5 M. Inserting these values into the solubility product expression,
\[K_{sp} = [Ca^{2+}][ox^{2−}] = (5.04 \times 10^{−5})(5.04 \times10^{−5}) = 2.54 \times 10^{−9} \notag \]
In our calculation, we have ignored the reaction of the weakly basic anion with water, which tends to make the actual solubility of many salts greater than the calculated value.
Exercise
One crystalline form of calcium carbonate (CaCO3) is the mineral sold as “calcite” in mineral and gem shops. The solubility of calcite in water is 0.67 mg/100 mL. Calculate its Ksp.
Answer: 4.5 × 10−9
Note the Pattern
The reaction of weakly basic anions with H2O tends to make the actual solubility of many salts higher than predicted.

A crystal of calcite (CaCO3), illustrating the phenomenon of double refraction. When a transparent crystal of calcite is placed over a page, we see two images of the letters.
Calcite, a structural material for many organisms, is found in the teeth of sea urchins. The urchins create depressions in limestone that they can settle in by grinding the rock with their teeth. Limestone, however, also consists of calcite, so how can the urchins grind the rock without also grinding their teeth? Researchers have discovered that the teeth are shaped like needles and plates and contain magnesium. The concentration of magnesium increases toward the tip, which contributes to the hardness. Moreover, each tooth is composed of two blocks of the polycrystalline calcite matrix that are interleaved near the tip. This creates a corrugated surface that presumably increases grinding efficiency. Toolmakers are particularly interested in this approach to grinding.
Tabulated values of Ksp can also be used to estimate the solubility of a salt with a procedure that is essentially the reverse of the one used in Example 1. In this case, we treat the problem as a typical equilibrium problem and set up a table of initial concentrations, changes in concentration, and final concentrations as we did in Chapter 15, remembering that the concentration of the pure solid is essentially constant.
Example 17.1.2
We saw that the Ksp for Ca3(PO4)2 is 2.07 × 10−33 at 25°C. Calculate the aqueous solubility of Ca3(PO4)2 in terms of the following:
- the molarity of ions produced in solution
- the mass of salt that dissolves in 100 mL of water at 25°C
Given: K sp
Asked for: molar concentration and mass of salt that dissolves in 100 mL of water
Strategy:
A Write the balanced equilibrium equation for the dissolution reaction and construct a table showing the concentrations of the species produced in solution. Insert the appropriate values into the solubility product expression and calculate the molar solubility at 25°C.
B Calculate the mass of solute in 100 mL of solution from the molar solubility of the salt. Assume that the volume of the solution is the same as the volume of the solvent.
Solution:
- A The dissolution equilibrium for Ca3(PO4)2 (Equation 17.1) is shown in the following table. Because we are starting with distilled water, the initial concentration of both calcium and phosphate ions is zero. For every 1 mol of Ca3(PO4)2 that dissolves, 3 mol of Ca2+ and 2 mol of PO43− ions are produced in solution. If we let x equal the solubility of Ca3(PO4)2 in moles per liter, then the change in [Ca2+] will be +3x, and the change in [PO43−] will be +2x. We can insert these values into the table.
Ca3(PO4)2(s) ⇌ 3Ca2+(aq) + 2PO43−(aq) Ca3(PO4)2 [Ca2+] [PO43−] initial pure solid 0 0 change — +3x +2x final pure solid 3x 2x Although the amount of solid Ca3(PO4)2 changes as some of it dissolves, its molar concentration does not change. We now insert the expressions for the equilibrium concentrations of the ions into the solubility product expression (Equation 17.1.2):
\(\begin{align}K_{\textrm{sp}}=[\mathrm{Ca^{2+}}]^3[\mathrm{PO_4^{3-}}]^2&=(3x)^3(2x)^2 \notag
\\2.07\times10^{-33}&=108x^5 \notag
\\1.92\times10^{-35}&=x^5 \notag
\\1.14\times10^{-7}\textrm{ M}&=x \notag \end{align}\)This is the molar solubility of calcium phosphate at 25°C. However, the molarity of the ions is 2x and 3x, which means that
[PO43−] = 2.28 × 10−7 and [Ca2+] = 3.42 × 10−7. - B To find the mass of solute in 100 mL of solution, we assume that the density of this dilute solution is the same as the density of water because of the low solubility of the salt, so that 100 mL of water gives 100 mL of solution. We can then determine the amount of salt that dissolves in 100 mL of water: \(\left(\dfrac{1.14\times10^{-7}\textrm{ mol}}{\textrm{1 L}}\right)\textrm{100 mL}\left(\dfrac{\textrm{1 L}}{\textrm{1000 mL}} \right )\left(\dfrac{310.18 \textrm{ g }\mathrm{Ca_3(PO_4)_2}}{\textrm{1 mol}}\right)=3.54\times10^{-6}\textrm{ g }\mathrm{Ca_3(PO_4)_2} \notag \)
Exercise
The solubility product of silver carbonate (Ag2CO3) is 8.46 × 10−12 at 25°C. Calculate the following:
- the molarity of a saturated solution
- the mass of silver carbonate that will dissolve in 100 mL of water at this temperature
Answer
- 1.28 × 10−4 M
- 3.54 mg
The Ion Product
The ion product (Q)A quantity that has precisely the same form as the solubility product for the dissolution of a sparingly soluble salt, except that the concentrations used are not necessarily equilibrium concentrations. of a salt is the product of the concentrations of the ions in solution raised to the same powers as in the solubility product expression. It is analogous to the reaction quotient (Q) discussed for gaseous equilibriums in Chapter 15. Whereas Ksp describes equilibrium concentrations, the ion product describes concentrations that are not necessarily equilibrium concentrations.
Note the Pattern
The ion product Q is analogous to the reaction quotient Q for gaseous equilibriums.
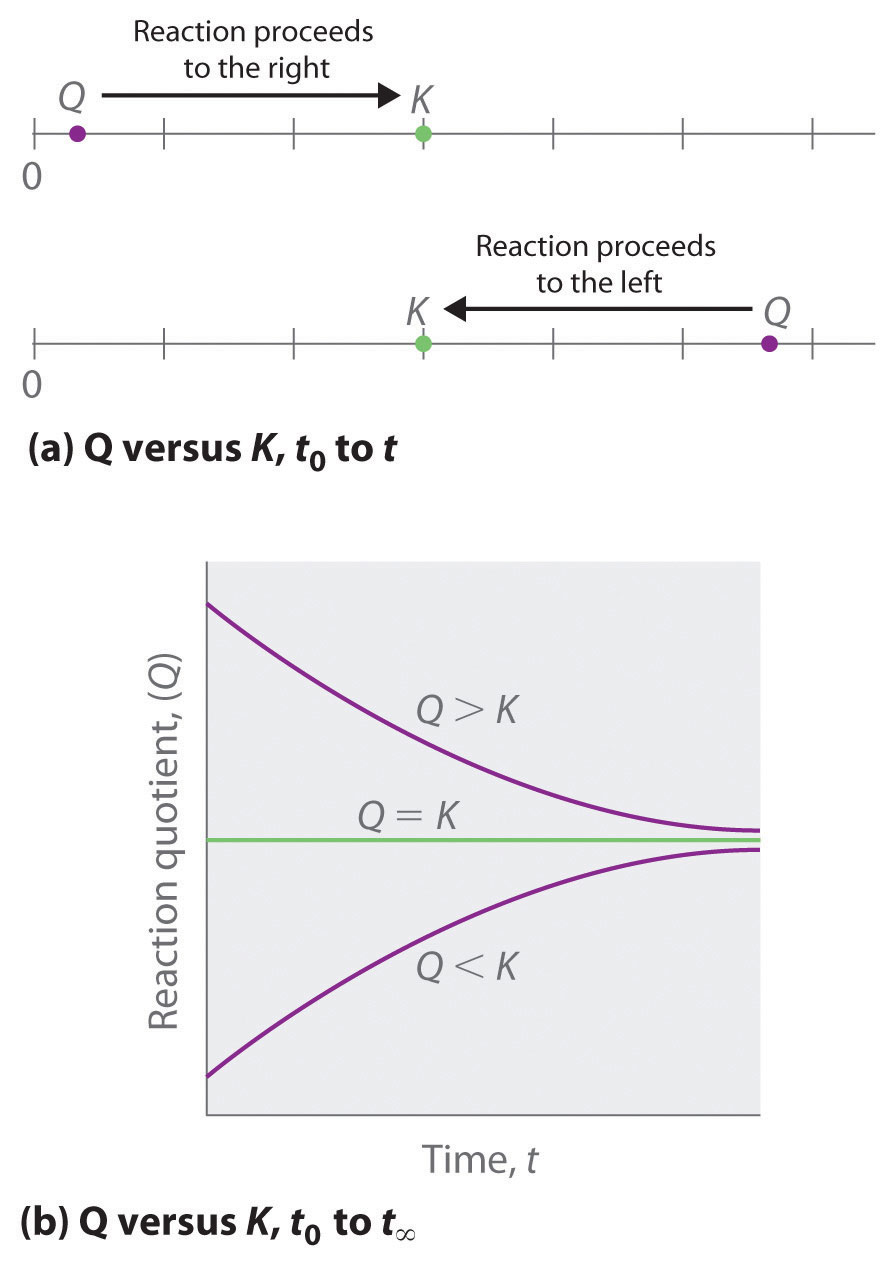
As summarized in Figure 17.1.1 , there are three possible conditions for an aqueous solution of an ionic solid:
- Q < Ksp. The solution is unsaturated, and more of the ionic solid, if available, will dissolve.
- Q = Ksp. The solution is saturated and at equilibrium.
- Q > Ksp. The solution is supersaturated, and ionic solid will precipitate.
Figura 17.1.1 La Relación entre Q y K sp Si Q es menor que K sp, la solución es insaturada y más sólida se disolverá hasta que el sistema alcance el equilibrio (Q = K sp). Si Q es mayor que K sp, la solución está sobresaturada y el sólido precipitará hasta Q = K sp. Si Q = K sp, la velocidad de disolución es igual a la velocidad de precipitación; la solución está saturada y no se producirá ningún cambio neto en la cantidad de sólido disuelto.
El proceso de calcular el valor del producto iónico y compararlo con la magnitud del producto de solubilidad es una manera sencilla de determinar si una solución está insaturada, saturada o sobresaturada. Más importante aún, el producto iónico le dice a los químicos si se formará un precipitado cuando se mezclen soluciones de dos sales solubles.
Ejemplo 17.1.3
Mencionamos que el sulfato de bario se utiliza en imágenes médicas del tracto gastrointestinal. Su producto de solubilidad es de 1.08 × 10 −10 a 25°C, por lo que es ideal para este propósito debido a su baja solubilidad cuando un paciente consume un “batido de bario”. La vía de la sal escasamente soluble se puede monitorear fácilmente por rayos X. ¿Precipitará sulfato de bario si se añaden 10.0 mL de 0.0020 M Na 2 SO 4 a 100 mL de 3.2 × 10 −4 M BaCl 2? Recordemos que el NaCl es altamente soluble en agua.
Dado: K sp y volúmenes y concentraciones de reactivos
Preguntado por: si se formará precipitado
Estrategia:
A Escriba la ecuación de equilibrio equilibrado para la reacción de precipitación y la expresión para K sp.
B Determinar las concentraciones de todos los iones en solución cuando se mezclan las soluciones y utilízalas para calcular el producto iónico (Q).
C Comparar los valores de Q y K sp para decidir si se formará un precipitado.
Solución:
A La única sal ligeramente soluble que se puede formar cuando se mezclan estas dos soluciones es BaSO 4 porque el NaCl es altamente soluble. La ecuación para la precipitación de BaSO 4 es la siguiente:
\[BaSO_{4(s)} \rightleftharpoons Ba^{2+}_{(aq)} + SO^{2−}_{4(aq)} \notag \]
La expresión del producto de solubilidad es la siguiente:
B Para resolver este problema, primero debemos calcular el producto iónico— Q = [Ba 2+] [SO 4 2−] —utilizando las concentraciones de los iones que están presentes después de mezclar las soluciones y antes de que ocurra cualquier reacción. La concentración de Ba 2+ cuando se mezclan las soluciones es el número total de moles de Ba 2+ en la solución original de 100 mL de BaCl 2 dividido por el volumen final (100 mL + 10.0 mL = 110 mL):
De manera similar, la concentración de SO 4 2− después de la mezcla es el número total de moles de SO 4 2− en la solución original de 10.0 mL de Na 2 SO 4 dividido por el volumen final (110 mL):
Ahora podemos calcular Q:
C Ahora comparamos Q con la K sp. Si Q > K sp, entonces BaSO 4 precipitará, pero si Q < K sp, no lo hará. Debido a que Q > K sp, predecimos que BaSO 4 precipitará cuando se mezclen las dos soluciones. De hecho, BaSO 4 continuará precipitando hasta que el sistema alcance el equilibrio, lo que ocurre cuando [Ba 2+] [SO 4 2−] = K sp = 1.08 × 10 −10.
Ejercicio
El producto de solubilidad del fluoruro de calcio (CaF 2) es de 3.45 × 10 −11. Si se añaden 2.0 mL de una solución 0.10 M de NaF a 128 mL de una solución 2.0 × 10 −5 M de Ca (NO 3) 2, ¿precipitará CaF 2?
Respuesta: sí (Q = 4.7 × 10 −11 > K sp)
El efecto común de iones y la solubilidad
La expresión del producto de solubilidad nos dice que las concentraciones de equilibrio del catión y el anión están inversamente relacionadas. Es decir, a medida que aumenta la concentración del anión, la concentración máxima del catión necesaria para que ocurra la precipitación disminuye, y viceversa, de manera que K sp es constante. En consecuencia, la solubilidad de un compuesto iónico depende de las concentraciones de otras sales que contienen los mismos iones. Esta dependencia es otro ejemplo del efecto iónico común discutido en la Sección 16.6: agregar un catión o anión común desplaza un equilibrio de solubilidad en la dirección predicha por el principio de Le Chatelier. Como resultado, la solubilidad de cualquier sal escasamente soluble casi siempre disminuye por la presencia de una sal soluble que contiene un ion común. Las excepciones generalmente implican la formación de iones complejos, lo cual se discute en la Sección 17.3.
Consideremos, por ejemplo, el efecto de agregar una sal soluble, como CaCl 2, a una solución saturada de fosfato de calcio [Ca 3 (PO 4) 2]. Hemos visto que la solubilidad de Ca 3 (PO 4) 2 en agua a 25°C es de 1.14 × 10 −7 M (K sp = 2.07 × 10 −33). Así, una solución saturada de Ca 3 (PO 4) 2 en agua contiene 3 × (1.14 × 10 −7 M) = 3.42 × 10 −7 M Ca 2+ y 2 × (1.14 × 10 −7 M) = 2.28 × 10 −7 M PO 4 3−, de acuerdo con la estequiometría mostrada en la Ecuación 17.1.1 (descuidando la hidrólisis para formar HPO 4 2− como se describe en el Capítulo 16). Si se agrega CaCl 2 a una solución saturada de Ca 3 (PO 4) 2, la concentración de iones Ca 2+ aumentará de tal manera que [Ca 2+] > 3.42 × 10 −7 M, haciendo Q > K sp. La única forma en que el sistema puede regresar al equilibrio es que la reacción en la Ecuación 17.1.1 proceda hacia la izquierda, dando como resultado una precipitación de Ca 3 (PO 4) 2. Esto disminuirá la concentración tanto de Ca 2+ como de PO 4 3− hasta Q = K sp.
Tenga en cuenta el patrón
El efecto iónico común generalmente disminuye la solubilidad de una sal escasamente soluble.
Ejemplo 17.1.4
Calcular la solubilidad del fosfato de calcio [Ca 3 (PO 4) 2] en 0.20 M CaCl 2.
Dado: concentración de solución de CaCl 2
Preguntado por: solubilidad de Ca 3 (PO 4) 2 en solución de CaCl 2
Estrategia:
A Escribir la ecuación de equilibrio equilibrado para la disolución de Ca 3 (PO 4) 2. Tabular las concentraciones de todas las especies producidas en solución.
B Sustituir los valores apropiados en la expresión por el producto de solubilidad y calcular la solubilidad de Ca 3 (PO 4) 2.
Solución:
A La ecuación de equilibrio equilibrado se da en la siguiente tabla. Si dejamos x igual la solubilidad de Ca 3 (PO 4) 2 en moles por litro, entonces el cambio en [Ca 2+] es una vez más +3 x, y el cambio en [PO 4 3−] es +2 x. Podemos insertar estos valores en la tabla.
| Ca 3 (PO 4) 2 (s) = 3Ca 2+ (aq) + 2PO 4 3− (aq) | |||
|---|---|---|---|
| Ca 3 (PO 4) 2 | [Ca 2+] | [PO 4 3−] | |
| inicial | sólido puro | 0.20 | 0 |
| cambiar | — | +3 x | +2 x |
| final | sólido puro | 0.20 + 3 x | 2 x |
B La expresión de K sp es la siguiente:
Debido a que Ca 3 (PO 4) 2 es una sal escasamente soluble, podemos esperar razonablemente que x << 0.20. Así, (0.20 + 3 x) M es aproximadamente 0.20 M, lo que simplifica la expresión de K sp de la siguiente manera:
\\ x^2&=6.5\ tiempos10^ {-32}\ notag
\\ x&=2.5\ tiempos10^ {-16}\ textrm {M}\ noetiqueta\ end {align}\]
Este valor es la solubilidad de Ca 3 (PO 4) 2 en CaCl 2 0.20 M a 25°C, aproximadamente nueve órdenes de magnitud menor que su solubilidad en agua pura, como cabría esperar con base en el principio de Le Chatelier. Con una excepción, este ejemplo es idéntico al Ejemplo 2; aquí el [Ca 2+] inicial fue 0.20 M en lugar de 0.
Ejercicio
Calcular la solubilidad del carbonato de plata en una solución 0.25 M de carbonato de sodio. La solubilidad del carbonato de plata en agua pura es de 8.45 × 10 −12 a 25°C.
Respuesta: 2.9 × 10 −6 M (versus 1.3 × 10 −4 M en agua pura)
Resumen
La constante de equilibrio para una reacción de disolución, llamada producto de solubilidad (K sp), es una medida de la solubilidad de un compuesto. Mientras que la solubilidad generalmente se expresa en términos de masa de soluto por 100 mL de disolvente, K sp se define en términos de las concentraciones molares de los iones componentes. En contraste, el producto iónico (Q) describe concentraciones que no son necesariamente concentraciones de equilibrio. La comparación de Q y K sp nos permite determinar si se formará un precipitado cuando se mezclen soluciones de dos sales solubles. Agregar un catión común o anión común a una solución de una sal escasamente soluble desplaza el equilibrio de solubilidad en la dirección predicha por el principio de Le Chatelier. La solubilidad de la sal casi siempre se ve disminuida por la presencia de un ion común.
Llave para llevar
- El producto de solubilidad (K sp) se utiliza para calcular las concentraciones de equilibrio de los iones en solución, mientras que el producto iónico (Q) describe concentraciones que no están necesariamente en equilibrio.
Problemas conceptuales
-
Escribir una expresión para K sp para cada sal.
- AGi
- CaF 2
- PbCl
- Ag 2 CrO 4
-
Algunas especies no están representadas en una expresión de producto de solubilidad. ¿Por qué?
-
Describir las diferencias entre Q y K sp.
-
¿Cómo se puede usar un producto iónico para determinar si una solución está saturada?
-
Cuando se usa K sp para comparar directamente las solubilidades de los compuestos, ¿por qué es importante comparar solo los valores de K sp de sales que tienen la misma estequiometría?
-
Describir el efecto de un ion común sobre la solubilidad de una sal. ¿Este efecto es similar al efecto iónico común que se encuentra en los tampones? Explica tu respuesta.
-
Explicar por qué la presencia de MgCl 2 disminuye la solubilidad molar de la sal escasamente soluble MgCO 3.
RESPUESTAS
-
- K sp = [Ag +] [I −]
- K sp = [Ca 2+] [F −] 2
- K sp = [Pb 2+] [Cl −] 2
- K sp = [Ag +] 2 [CrO 4 2−]
-
Para una sal 1:1, la solubilidad molar es simplemente\(\sqrt{K_{\textrm{sp}}}\); para una sal 2:1, la solubilidad molar es\(\sqrt[3]{K_{\textrm{sp}}/4}\) > En consecuencia, las magnitudes de K sp pueden correlacionarse con la solubilidad molar solo si las sales tienen la misma estequiometría.
-
Debido al efecto común de iones. Agregar una sal soluble de Mg 2+ aumenta [Mg 2+] en solución, y el principio de Le Chatelier predice que esto desplazará el equilibrio de solubilidad de MgCO 3 hacia la izquierda, disminuyendo su solubilidad.
Problemas numéricos
-
Predecir la solubilidad molar de cada compuesto utilizando los valores de K sp dados en la Tabla E3.
- Cd (IO 3) 2
- AgCn
- HGi 2
-
Predecir la solubilidad molar de cada compuesto usando los valores de K sp dados.
- Li 3 PO 4: 2.37 × 10 −11
- Ca (IO 3) 2: 6.47 × 10 −6
- Y (IO 3) 3: 1.12 × 10 −10
-
Un estudiante preparó 750 mL de una solución saturada de sulfato de plata (Ag 2 SO 4). ¿Cuántos gramos de Ag 2 SO 4 contiene la solución? K sp = 1.20 × 10 −5.
-
Dados los valores de K sp en la Tabla 17.1.1 y la Tabla E3, predicen la concentración molar de cada especie en una solución acuosa saturada.
- bromuro de plata
- oxalato de plomo
- carbonato de hierro (II)
- fosfato de plata
- cianuro de cobre (I)
-
Dados los valores de K sp en la Tabla 17.1.1 y la Tabla E3, predicen la concentración molar de cada especie en una solución acuosa saturada.
- cloruro de cobre (I)
- yodato de lantano (III)
- fosfato de magnesio
- cromato de plata
- sulfato de estroncio
-
El dióxido de silicio, el compuesto binario más común de silicio y oxígeno, constituye aproximadamente el 60% de la corteza terrestre. Bajo ciertas condiciones, este compuesto puede reaccionar con agua para formar ácido silícico, el cual puede escribirse como H 4 SiO 4 o Si (OH) 4. Escribir una ecuación química equilibrada para la disolución de SiO 2 en solución básica. Escribir una expresión constante de equilibrio para la reacción.
-
La K sp de Mg (OH) 2 es de 5.61 × 10 −12. Si intentaste disolver 24.0 mg de Mg (OH) 2 en 250 mL de agua y luego filtraste la solución y secaste el sólido restante, ¿cuál predecirías que sería la masa del sólido sin disolver? Descubres que solo queda 1.0 mg sin disolver. Explica la diferencia entre tu valor esperado y el valor real.
-
El K sp del carbonato de litio es 8.15 × 10 −4. Si se agitan 2.34 g de la sal con 500 mL de agua y cualquier sólido no disuelto se filtra de la solución y se seca, ¿cuál predice que sea la masa del sólido? Descubres que toda tu muestra se disuelve. Explica la diferencia entre tu valor predicho y el valor real.
-
Has calculado que 24.6 mg de BaSO 4 se disolverán en 1.0 L de agua a 25°C.Después de agregar tu cantidad calculada a 1.0 L de agua y agitar durante varias horas, notas que la solución contiene sólido sin disolver. Después de filtrar cuidadosamente la solución y secar el sólido, se encuentra que 22.1 mg no se disolvieron. Según sus mediciones, ¿cuál es la K sp del sulfato de bario?
-
En una solución saturada de cromato de plata, la solubilidad molar del cromato es de 6.54 × 10 −5. ¿Qué es la K sp?
-
Una solución saturada de cloruro de plomo (II) tiene una concentración de cloruro de 3.24 × 10 −2 mol/L ¿Cuál es la K sp?
-
A partir de los datos de solubilidad dados, calcular K sp para cada compuesto.
- AGi: 2.89 × 10 −7 g/100 mL
- SRf 2: 1.22 × 10 −2 g/100 mL
- Pb (OH) 2:78 mg/500 mL
- BiASO 4: 14.4 mg/2.0 L
-
A partir de los datos de solubilidad dados, calcular K sp para cada compuesto.
- BaCo 3: 10.0 mg/500 mL
- CaF 2: 3.50 mg/200 mL
- Mn (OH) 2: 6.30 × 10 −4 g/300 mL
- Ag 2 S: 1.60 × 10 −13 mg/100 mL
-
Dadas las siguientes solubilidades, calcular K sp para cada compuesto.
- BaCo 3: 7.00 × 10 −5 mol/L
- CaF 2: 1.70 mg/100 mL
- Pb (IO 3) 2: 2.30 mg/100 mL
- Src 2 O 4: 1.58 × 10 −7 mol/L
-
Dadas las siguientes solubilidades, calcular K sp para cada compuesto.
- Ag 2 SO 4: 4.2 × 10 −1 g/100 mL
- SrSO 4: 1.5 × 10 −3 g/100 mL
- CdC 2 O 4: 6.0 × 10 −3 g/100 mL
- Ba (IO 3) 2: 3.96 × 10 −2 g/100 mL
-
El K sp del fertilizante fosfato CaHPO 4 ·2H 2 O es 2.7 × 10 −7 a 25°C. ¿Cuál es la concentración molar de una solución saturada? ¿Qué masa de este compuesto se disolverá en 3.0 L de agua a esta temperatura?
-
El K sp de carbonato de zinc monohidrato es 5.5 × 10 −11 a 25°C. ¿Cuál es la concentración molar de una solución saturada? ¿Qué masa de este compuesto se disolverá en 2.0 L de agua a esta temperatura?
-
Anteriormente se administraban gotas oftálmicas de nitrato de plata a recién nacidos para protegerse contra las infecciones oculares contraídas durante el parto. Si bien el nitrato de plata es altamente soluble en agua, el sulfato de plata tiene una K sp de 1.20 × 10 −5 a 25°C.Si agrega 25.0 mL de 0.015 M AgnO 3 a 150 mL de 2.8 × 10 −3 M Na 2 SO 4, ¿obtendrá un precipitado? Si es así, ¿cuál será su masa?
-
Utilice los datos de la Tabla E3 para predecir si la precipitación ocurrirá cuando se mezcle cada par de soluciones.
- 150 mL de 0.142 M Ba (NO 3) 2 con 200 mL de NaF 0.089 M
- 250 mL de 0.079 M K 2 CrO 4 con 175 mL de 0.087 M CaCl 2
- 300 mL de 0.109 M MgCl 2 con 230 mL de 0.073 M Na 2 (C 2 O 4)
-
¿Cuál es el volumen máximo de 0.048 M Pb (NO 3) 2 que se puede agregar a 250 mL de nASCN 0.10 M antes de que ocurra la precipitación? K sp = 2.0 × 10 −5 para Pb (SCN) 2.
-
Dados 300 mL de una solución que es 0.056 M en nitrato de litio, ¿qué masa de carbonato de sodio sólido se puede agregar antes de que ocurra la precipitación (asumiendo que el volumen de solución no cambia después de agregar el sólido)? K sp = 8.15 × 10 −4 para Li 2 CO 3.
-
Dada la información de la siguiente tabla, se calcula la solubilidad molar de cada sal escasamente soluble en MgCl 2 0.95 M.
Solución Saturada K sp MgCo 3 ·3H 2 O 2.4 × 10 −6 Mg (OH) 2 5.6 × 10 −12 Mg 3 (PO 4) 2 1.04 × 10 −24
RESPUESTAS
-
- 1.84 × 10 −3 M
- 7.73 × 10 −9 M
- 1.9 × 10 −10 M
-
3.37 g
-
- 4.15 × 10 −4 M
- 7.26 × 10 −4 M
- 6.26 × 10 −6 M
- 6.54 × 10 −5 M
- 5.86 × 10 −4 M
-
22.4 mg; se produce una reacción secundaria, donde OH − de la disociación de la sal reacciona con H + de la disociación del agua. Esta reacción provoca una mayor disociación de la sal (principio de Le Chatelier).
-
1.2 × 10 −10
-
1.70 × 10 −5
-
- 8.8 × 10 −6
- 6.7 × 10 −9
- 9.0 × 10 −8
- 2.16 × 10 −9
-
7.4 × 10 −6 M; 2.1 mg
-
La precipitación ocurrirá en todos los casos.
-
8.27 g
Colaboradores
- Anonymous
Modificado por Joshua B. Halpern