17.3: Factores que afectan la solubilidad
- Page ID
- 78019
- Comprender los factores que determinan la solubilidad de los compuestos iónicos.
El producto de solubilidad de un compuesto iónico describe las concentraciones de iones en equilibrio con un sólido, pero ¿qué sucede si algunos de los cationes se asocian con aniones en lugar de estar completamente rodeados de disolvente? Entonces las predicciones de la solubilidad total del compuesto basadas en la suposición de que el soluto existe únicamente como iones discretos diferirían sustancialmente de la solubilidad real, al igual que las predicciones de concentraciones iónicas. En general, cuatro situaciones explican por qué la solubilidad de un compuesto puede ser distinta de la esperada: la formación de pares iónicos, la disociación incompleta de solutos moleculares, la formación de iones complejos y los cambios en el pH. Las dos primeras situaciones se describen en esta sección, la formación de iones complejos se discute en la Sección 17.3, y los cambios en el pH se discuten en la Sección 17.4.
Formación de pares de iones
Un catión de par iónico A y un anión que están en contacto íntimo en solución en lugar de separarse por disolvente. Un par de iones puede verse como una especie que es intermedia entre el sólido iónico y los iones completamente disociados en solución. consiste en un catión y un anión que están en contacto íntimo en solución, en lugar de separarse por disolvente (Figura 17.2.1). Los iones en un par de iones se mantienen unidos por las mismas fuerzas electrostáticas atractivas que discutimos en el Capítulo 4 para los sólidos iónicos. Como resultado, los iones en un par de iones migran como una sola unidad, cuya carga neta es la suma de las cargas sobre los iones. En muchos sentidos, podemos ver un par de iones como una especie intermedia entre el sólido iónico (en el que cada ion participa en muchas interacciones catión-anión que mantienen los iones en una matriz rígida) y los iones completamente disociados en solución (donde cada uno está completamente rodeado por moléculas de agua y libre de migrar independientemente).
Figura 17.2.1 Formación de pares iónicos En un par iónico, el catión y el anión están en contacto íntimo en solución y migran como una sola unidad. No están completamente disociados y rodeados individualmente por moléculas solventes, al igual que los iones hidratados, los cuales son libres de migrar independientemente.
Como se ilustra para el sulfato de calcio en la siguiente ecuación, se debe incluir un segundo equilibrio para describir la solubilidad de las sales que forman pares de iones:
\[\mathrm{CaSO_4(s)}\rightleftharpoons\mathrm{Ca^{2+}}\cdot\underset{\textrm{ion pair}}{\mathrm{SO_4^{2-}(aq)}}\rightleftharpoons \mathrm{Ca^{2+}(aq)}+\mathrm{SO_4^{2-}(aq)} \tag{17.2.1}\]
El par iónico está representado por los símbolos de los iones individuales separados por un punto, lo que indica que están asociados en solución. La formación de un par iónico es un proceso dinámico, al igual que cualquier otro equilibrio, por lo que un par de iones particular puede existir solo brevemente antes de disociarse en los iones libres, cada uno de los cuales puede asociarse posteriormente brevemente con otros iones.
La formación de pares iónicos puede tener un efecto importante en la solubilidad medida de una sal. Por ejemplo, la K sp medida para sulfato de calcio es de 4.93 × 10 −5 a 25°C; la solubilidad de CaSO 4 debería ser 7.02 × 10 −3 M si el único equilibrio involucrado fue el siguiente:
De hecho, la solubilidad medida experimentalmente del sulfato de calcio a 25°C es de 1.6 × 10 −2 M, casi el doble del valor predicho a partir de su K sp. La razón de la discrepancia es que la concentración de pares iónicos en una solución saturada de CaSO 4 es casi tan alta como la concentración de los iones hidratados. Recordemos que la magnitud de interacciones electrostáticas atractivas es mayor para iones pequeños y altamente cargados. Por lo tanto, la formación de pares iónicos es más importante para las sales que contienen iones M 2+ y M 3+, como Ca 2+ y La 3+, y es relativamente poco importante para las sales que contienen cationes monopositivos, excepto para las más pequeñas, Li +. Por lo tanto, esperamos que una solución saturada de CaSO 4 contenga una alta concentración de pares iónicos y que su solubilidad sea mayor a la predicha a partir de su K sp.
Tenga en cuenta el patrón
La formación de pares iónicos aumenta la solubilidad de una sal.
Disociación incompleta
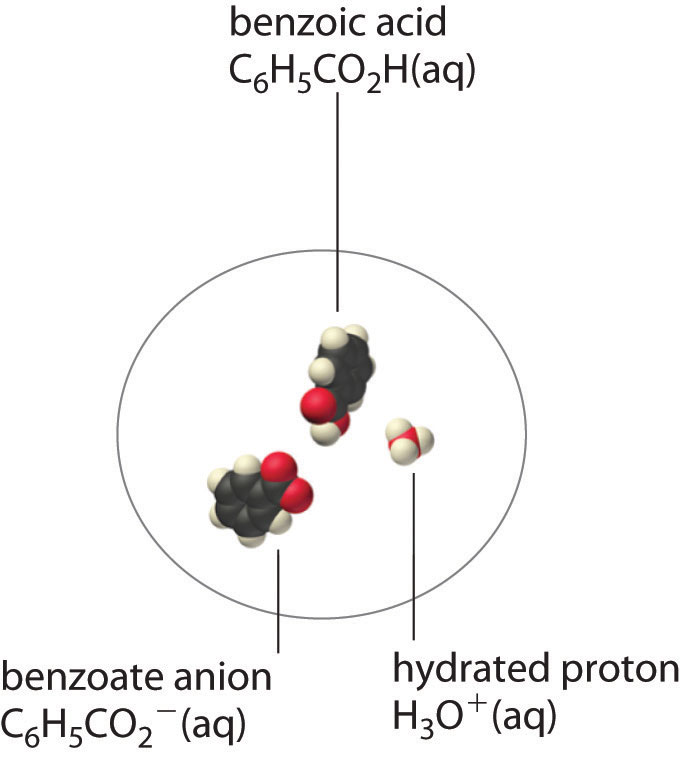
Un soluto molecular también puede ser más soluble de lo previsto por las concentraciones medidas de iones en solución debido a la disociación incompleta. Esto es particularmente común con los ácidos orgánicos débiles. (Para mayor información sobre los ácidos orgánicos débiles, ver Capítulo 16). Aunque los ácidos fuertes (HA) se disocian completamente en sus iones constituyentes (H + y A −) en agua, los ácidos débiles como los ácidos carboxílicos no lo hacen (K a = 1.5 × 10 −5). Sin embargo, la forma molecular (no disociada) de un ácido débil (HA) suele ser bastante soluble en agua; por ejemplo, el ácido acético (CH 3 CO 2 H) es completamente miscible con agua. Muchos ácidos carboxílicos, sin embargo, solo tienen solubilidad limitada en agua, como el ácido benzoico (C 6 H 5 CO 2 H), con K a = 6.25 × 10 −5. Al igual que con el sulfato de calcio, necesitamos incluir un equilibrio adicional para describir la solubilidad del ácido benzoico:
\[ C_6H_5CO_2H_{(s)} \rightleftharpoons C_6H_5CO_2H_{(aq)} \rightleftharpoons C_6H_5CO^−_{2(aq)} + H^+_{(aq)} \tag{17.2.3}\]
En un caso como este, medir solo la concentración de los iones subestima groseramente la concentración total del ácido orgánico en solución. En el caso del ácido benzoico, por ejemplo, el pH de una solución saturada a 25°C es de 2.85, correspondiente a [H +] = [C 6 H 5 CO 2 −] = 1.4 × 10 −3 M. La concentración total de ácido benzoico en la solución, sin embargo, es 2.8 × 10 −2 M. Así, aproximadamente 95% del ácido benzoico en solución está en forma de moléculas neutras hidratadas —C 6 H 5 CO 2 H (ac) —y solo aproximadamente 5% está presente como iones disociados (Figura 17.2.2).
Tenga en cuenta el patrón
La disociación incompleta de un soluto molecular que es miscible con agua puede aumentar la solubilidad del soluto.
Figura 17.2.2 Disociación incompleta de un soluto molecular En una solución saturada de ácido benzoico en agua a 25°C, solo aproximadamente el 5% de las moléculas de ácido benzoico disueltas se disocian para formar aniones benzoato y protones hidratados. El 95% restante existe en solución en forma de moléculas neutras hidratadas. (Las moléculas H 2 O se omiten para mayor claridad).
Aunque los pares de iones, como Ca 2+ ·SO 4 2−, y los electrolitos no disociados, como C 6 H 5 CO 2 H, son eléctricamente neutros, existe una diferencia importante en las fuerzas responsables de su formación. Las fuerzas de atracción electrostáticas simples entre el catión y el anión mantienen el par iónico unido, mientras que un enlace O−H covalente polar mantiene unido el electrolito no disociado.
Resumen
Hay cuatro explicaciones de por qué la solubilidad de un compuesto puede diferir de la solubilidad indicada por las concentraciones de iones: (1) formación de pares iónicos, en la que un anión y un catión están en contacto íntimo en solución y no separados por disolvente, (2) la disociación incompleta de moléculas solutos, (3) la formación de iones complejos y (4) cambios en el pH. Un par iónico se mantiene unido por fuerzas de atracción electrostática entre el catión y el anión, mientras que la disociación incompleta resulta de fuerzas intramoleculares, como los enlaces O-H covalentes polares.
Llave para llevar
- La formación de pares iónicos, la disociación incompleta de solutos moleculares, la formación de iones complejos y los cambios en el pH afectan la solubilidad.
Problemas conceptuales
-
¿Se espera que la solubilidad molar real de LaPO 4 sea mayor, igual o menor que el valor calculado a partir de su K sp? Explica tu razonamiento.
-
¿Se espera que la diferencia entre la solubilidad molar calculada y la solubilidad molar real de Ca 3 (PO 4) 2 sea mayor o menor que la diferencia en las solubilidades de Mg 3 (PO 4) 2? ¿Por qué?
-
Escribir ecuaciones químicas para describir las interacciones en una solución que contenga Mg (OH) 2, que forma pares iónicos, y en una que contenga ácido propanoico (CH 3 CH 2 CO 2 H), que forma una molécula neutra hidratada.
-
Dibujar representaciones de Ca (IO 3) 2 en solución
- como un sólido iónico.
- en forma de pares de iones.
- como iones discretos.
Problema Numérico
-
El fosfato férrico tiene una solubilidad molar de 5.44 × 10 −16 en 1.82 M Na 3 PO 4. Predecir su K sp. La K sp real es 1.3 × 10 −22. Explique esta discrepancia.
Contestar
-
9.90 × 10 −16; la solubilidad es mucho mayor de lo predicho por K sp debido a la formación de pares iónicos (y/o complejos de fosfato) en la solución de fosfato de sodio.
Colaboradores
- Anonymous
Modificado por Joshua B. Halpern