19.5: Celdas Electroquímicas y Termodinámica
- Page ID
- 78403
- Comprender la relación entre el potencial celular y la constante de equilibrio.
- Utilizar potenciales celulares para calcular concentraciones de solución.
Los cambios en las condiciones de reacción pueden tener un tremendo efecto en el curso de una reacción redox. Por ejemplo, bajo condiciones estándar, la reacción de Co (s) con Ni 2+ (aq) para formar Ni (s) y Co 2+ (aq) ocurre espontáneamente, pero si reducimos la concentración de Ni 2+ en un factor de 100, de manera que [Ni 2+] es 0.01 M, entonces ocurre la reacción inversa espontáneamente en su lugar. La relación entre voltaje y concentración es uno de los factores que deben entenderse para predecir si una reacción será espontánea.
La relación entre el potencial celular y la energía libre
Las celdas electroquímicas convierten la energía química en energía eléctrica y viceversa. La cantidad total de energía producida por una celda electroquímica y, por lo tanto, la cantidad de energía disponible para realizar un trabajo eléctrico, depende tanto del potencial celular como del número total de electrones que se transfieren del reductor al oxidante durante el transcurso de una reacción. La corriente eléctrica resultante se mide en culombios (C) La unidad de medida SI para el número de electrones que pasan un punto dado en 1 segundo; se define como 6.25×10 18 e − /s y relaciona el potencial electrónico (en voltios) con la energía (en julios): 1 J/1 V = 1 C., una unidad SI que mide el número de electrones que pasan un punto dado en 1 s. Un culombo relaciona la energía (en julios) con el potencial eléctrico (en voltios). La corriente eléctrica se mide en amperios (A) La unidad SI fundamental de corriente eléctrica; se define como el flujo de 1 C/s pasado un punto dado: 1A = 1 C/s.; 1 A se define como el flujo de 1 C/s pasado un punto dado (1 C = 1 A·s):
\( \dfrac{1\;J}{1\;V}= 1\;C=1\;A\cdot s \tag{19.4.1}\)
En las reacciones químicas, sin embargo, necesitamos relacionar el culombo con la carga sobre un mol de electrones. Multiplicar la carga en el electrón por el número de Avogadro nos da la carga sobre 1 mol de electrones, que se llama el faraday (F) La carga sobre 1 mol de electrones; se obtiene multiplicando la carga en el electrón por el número de Avogadro. , que lleva el nombre del físico y químico inglés Michael Faraday (1791-1867):
\( F= \left ( 1.60218 \times 10^{-19}\;C \right )\dfrac{6.02214\times 10^{23}}{1\;mole} \tag{19.4.2} \)
\( F= 9.64855 \times 10^{4}\;C/mole \simeq 96,486 C/\left (mol \; e^{-} \right ) \)
La carga total transferida del reductor al oxidante es por lo tanto nF, donde n es el número de moles de electrones.
Miguel Faraday (1791—1867)
Faraday fue un físico y químico británico que posiblemente fue uno de los mayores científicos experimentales de la historia. Hijo de un herrero, Faraday era autodidacta y se convirtió en aprendiz de encuadernador a los 14 años antes de dedicarse a la ciencia. Sus experimentos en electricidad y magnetismo hicieron de la electricidad una herramienta rutinaria en la ciencia y condujeron tanto al motor eléctrico como al generador eléctrico. Descubrió el fenómeno de la electrólisis y sentó las bases de la electroquímica. De hecho, la mayoría de los términos especializados introducidos en este capítulo (electrodo, ánodo, cátodo, etc.) se deben a Faraday. Además, descubrió el benceno e inventó el sistema de números de estado de oxidación que usamos hoy en día. Faraday es probablemente mejor conocido por “La historia química de una vela”, una serie de conferencias públicas sobre la química y la física de las llamas.
La cantidad máxima de trabajo que puede producir una celda electroquímica (w max) es igual al producto del potencial celular (celda E) y la carga total transferida durante la reacción (nF):
\( w_{max} = nFE_{cell} \tag{19.4.3}\)
El trabajo se expresa como un número negativo porque el trabajo está siendo realizado por un sistema (una celda electroquímica con un potencial positivo) en su entorno.
Como aprendiste en el Capítulo 18, el cambio en la energía libre (Δ G) es también una medida de la cantidad máxima de trabajo que se puede realizar durante un proceso químico (Δ G = w max). En consecuencia, debe existir una relación entre el potencial de una celda electroquímica y Δ G, la cantidad termodinámica más importante discutida en el Capítulo 18. Esta relación es la siguiente:
\( \Delta G = -nFE_{cell} \tag{19.4.4}\)
Por lo tanto, una reacción redox espontánea se caracteriza por un valor negativo de Δ G y un valor positivo de célula E, consistente con nuestras discusiones anteriores. Cuando tanto los reactivos como los productos están en sus estados estándar, la relación entre Δ G° y E° celda es la siguiente:
\( \Delta G^{o} = -nFE^{o}_{cell} \tag{19.4.5}\)
Tenga en cuenta el patrón
Una reacción redox espontánea se caracteriza por un valor negativo de Δ G°, que corresponde a un valor positivo de E° celda.
Ejemplo 19.4.1
Supongamos que desea preparar bromo elemental a partir de bromuro usando el ion dicromato como oxidante. Utilizando los datos de la Tabla 19.3.1, calcular el cambio de energía libre (Δ G°) para esta reacción redox en condiciones estándar. ¿La reacción es espontánea?
Dado: reacción redox
Preguntado por: Δ G° para la reacción y espontaneidad
Estrategia:
A A partir de las medias reacciones relevantes y los valores correspondientes de E°, escribir la reacción global y calcular E° celda usando la Ecuación 19.2.2.
B Determinar el número de electrones transferidos en la reacción global. Después usa la Ecuación 19.4.5 para calcular Δ G°. Si Δ G° es negativo, entonces la reacción es espontánea.
Solución:
A Como siempre, el primer paso es escribir las medias reacciones relevantes y utilizarlas para obtener la reacción global y la magnitud de E°. A partir de la Tabla 19.3.1, podemos encontrar las medias reacciones de reducción y oxidación y los valores correspondientes de E°:
\ (\ begin {matriz}cátodo: & Cr_ {2} O_ {7} ^ {2-}\ izquierda (aq\ derecha) + 14 H^ {+}\ izquierda (aq\ derecha) + 6e^ {-}\ fila derecha 2Cr^ {3+}\ izquierda (aq\ derecha) + 7H_ {2} O\ izquierda (l\ derecha) & E_ {cátodo} ^ {o} =1.23\; V\\
ánodo: & 2Br^ {-}\ izquierda (aq\ derecha)\ fila derecha Br_ {2}\ izquierda (aq\ derecha ) +2e^ {-} & E_ {ánodo} ^ {o} =1.09\; V
\ final {matriz}\)
Para obtener la ecuación química equilibrada global, debemos multiplicar ambos lados de la semirreacción de oxidación por 3 para obtener el mismo número de electrones que en la semirreacción de reducción, recordando que la magnitud de E° no se ve afectada:
\ (\ begin {matriz}cátodo: & Cr_ {2} O_ {7} ^ {2-}\ izquierda (aq\ derecha) + 14 H^ {+}\ izquierda (aq\ derecha) + 6e^ {-}\ fila derecha 2Cr^ {3+}\ izquierda (aq\ derecha) + 7H_ {2} O\ izquierda (l\ derecha) & E_ {cátodo} ^ {o} =1.23\; V\\
ánodo: & 6Br^ {-}\ izquierda (aq\ derecha)\ fila derecha 3Br_ {2}\ izquierda (aq\ derecha ) +6e^ {-} & E_ {ánodo} ^ {o} =1.09\; V\\
general: & Cr_ {2} O_ {7} ^ {2-}\ izquierda (aq\ derecha) + 14 H^ {+}\ izquierda (aq\ derecha) + 6Bri^ {-}\ fila derecha y E_ {celda} ^ {o} =0.14\; V\
& 2Cr^ {3+}\ izquierda (aq\ derecha) + 7H_ {2} O\ izquierda (l\ derecha) + 3Br_ {2}\ izquierda (aq\ derecha) &
\ fin {matriz}\)
B Ahora podemos calcular Δ G° usando la Ecuación 19.4.10 Debido a que se transfieren seis electrones en la reacción global, el valor de n es 6:
\ (\ begin {matrix}\ Delta G^ {o} &= -NFe_ {cell} ^ {o} & =\ left (6\;\ cancel {mol}\ right)\ left (96.468\; J/\ left (\ cancel {V}\ cdot\ cancel {mol}\ right)\ right)\ left (0.14\;\ cancel {V}\ right)\
& -8.1\ times 10^ {4}\; J\\
& & -81\; kJ/ mol\; Cr_ {2} O_ {7}
\ final {matriz}\)
Así pues, Δ G° es −81 kJ para la reacción tal como está escrita, y la reacción es espontánea.
Ejercicio
Utilice los datos de la Tabla 19.3.1 para calcular Δ G° para la reducción de ión férrico por yoduro:
2Fe 3+ (aq) + 2I − (aq) → 2Fe 2+ (aq) + I 2 (s)¿La reacción es espontánea?
Respuesta: −44 kJ/mol I 2; sí
Potenciales para las sumas de medias reacciones
Aunque en el Cuadro 19.3.1 y el Cuadro P1 se enumeran varias medias reacciones, se conocen muchas más. Cuando el potencial estándar para una media reacción no está disponible, podemos usar las relaciones entre los potenciales estándar y la energía libre para obtener el potencial de cualquier otra media reacción que pueda escribirse como la suma de dos o más medias reacciones cuyos potenciales estándar están disponibles. Por ejemplo, el potencial de reducción de Fe 3+ (aq) a Fe (s) no aparece en la tabla, pero se dan dos reducciones relacionadas:
\( Fe^{3+}\left ( aq \right ) + e^{-} \rightarrow Fe^{2+}\left ( aq \right ) \;\;\; E^{o}=0.77\;V \tag{19.4.6}\)
\( Fe^{2+}\left ( aq \right ) + 2e^{-} \rightarrow Fe\left ( aq \right ) \;\;\; E^{o}=-0.45\;V \tag{19.4.7}\)
Aunque la suma de estas dos medias reacciones da la media reacción deseada, no podemos simplemente sumar los potenciales de dos medias reacciones reductoras para obtener el potencial de una tercera semirreacción reductiva porque E° no es una función de estado. Sin embargo, debido a que Δ G° es una función de estado, la suma de los valores Δ G° para las reacciones individuales nos da Δ G° para la reacción global, que es proporcional tanto al potencial como al número de electrones (n) transferidos. Para obtener el valor de E° para la semirreacción global, primero debemos agregar los valores de Δ G° (= − NFe°) para cada semirreacción individual para obtener Δ G° para la semirreacción general:
\[ Fe^{3+}\left ( aq \right ) + e^{-} \rightarrow \cancel{Fe^{2+}\left ( aq \right )} \;\;\; \Delta G^{o}=\left (-1 \right )F \left (0.77\;V \right ) \tag{19.4.8}\]
\[ \cancel{Fe^{2+}\left ( aq \right )} + 2e^{-} \rightarrow Fe\left ( s \right ) \;\;\; \Delta G^{o}= \left (-2 \right )F \left (-0.457\;V \right ) \notag{} \]
\[ Fe^{3+}\left ( aq \right ) + e^{-} \rightarrow Fe\left ( s \right ) \;\;\; \Delta G^{o}=\left (-1 \right )F \left (0.77\;V \right )+ \left (-2 \right )F \left (-0.457\;V \right ) \notag{} \]
Resolviendo la última expresión para Δ G° para la media reacción general,
\( \Delta G^{o}=F \left [\left (-0.77\;V \right )+ \left (-2 \right )\left (-0.457\;V \right ) \right ] =F\left ( 0.13\;V \right ) \tag{19.4.9}\)
Se transfieren tres electrones (n = 3) en la reacción global (Ecuación 19.4.15), por lo que sustituyendo en la Ecuación 19.4.10 y resolviendo E° da lo siguiente:
\( \Delta G^{o}=-nFE_{cell}^{o} \)
\( F\left ( 0.13\;V \right )=-3 F E_{cell}^{o}\)
\( E_{cell}^{o}=-\dfrac{0.13\;V}{3}= -0.043\;V\)
Este valor de E° es muy diferente del valor que se obtiene simplemente sumando los potenciales para las dos medias reacciones (0.32 V) e incluso tiene el signo opuesto.
Tenga en cuenta el patrón
Los valores de E° para las medias reacciones no se pueden agregar para dar E° para la suma de las semirreacciones; solo se pueden agregar valores de Δ G° = − nFe° celda para medias reacciones.
La relación entre el potencial celular y la constante de equilibrio
Podemos usar la relación entre Δ G° y la constante de equilibrio K, definida en el Capítulo 18, para obtener una relación entre E° celda y K. Recordemos que para una reacción general del tipo a A + b B → c C + d D, el cambio estándar de energía libre y la constante de equilibrio están relacionados por la siguiente ecuación:
\( \Delta G^{o}=-RTln\;K \tag{19.4.10}\)
Dada la relación entre el cambio estándar de energía libre y el potencial celular estándar (Ecuación 19.4.9), podemos escribir
\( -nFE_{cell}^{o}=-RTln\;K \tag{19.4.11}\)
Reordenando esta ecuación,
\( E_{cell}^{o}=\left (\dfrac{RT}{nF} \right )ln\;K \tag{19.4.12}\)
Para T = 298 K, la Ecuación 19.4.12 puede simplificarse de la siguiente manera:
\( E_{cell}^{o}=\left (\dfrac{RT}{nF} \right )ln\;K =\left [ \dfrac{8.314\;\cancel{J}/\left ( \cancel{mol}\cdot \cancel{K} \right )\left ( 298\;\cancel{K} \right )}{n\left [ 96,486\; \cancel{J}/\left ( V \cdot \cancel{mol} \right ) \right ]} \right ]2.303\;log \; K = \left ( \dfrac{0.0591}{n} \right )log\; K \tag{19.4.13} \)
Así E° celda es directamente proporcional al logaritmo de la constante de equilibrio. Esto significa que las constantes de equilibrio grandes corresponden a grandes valores positivos de celda E° y viceversa.
Ejemplo 19.4.2
Utilizar los datos del Cuadro 19.3.1 para calcular la constante de equilibrio para la reacción de plomo metálico con PbO 2 en presencia de iones sulfato para dar PbSO 4 en condiciones estándar. (Esta reacción ocurre cuando se descarga la batería de un automóvil). Denuncia tu respuesta a dos cifras significativas.
Dado: reacción redox
Preguntado por: K
Estrategia:
A Escribe las medias reacciones y potenciales relevantes. A partir de estos, se obtiene la reacción global y la celda E°.
B Determinar el número de electrones transferidos en la reacción global. Utilice la Ecuación 19.4.13 para resolver para log K y luego K.
Solución:
A Las medias reacciones y potenciales relevantes de la Tabla 19.3.1 son los siguientes:
\ (\ begin {matriz}
cátodo: & PbO_ {2}\ izquierda (s\ derecha) + SO_ {4} ^ {2-}\ izquierda (aq\ derecha) + 4H^ {+}\ izquierda (aq\ derecha) + 2e^ {-}\ fila derecha PBSO_ {4}\ izquierda (s\ derecha) + 2H_ {2} O\ izquierda (l\ derecha) & E_ {cátodo} ^ {o} = 1.69\; V\\
ánodo: & Pb\ izquierda (s\ derecha) + SO_ {4} ^ {2-}\ izquierda (aq\ derecha)\ fila derecha PBSO_ {4}\ izquierda (s\ derecha) +2e^ {-} & E_ {ánodo} ^ {o} =0.36\; V\\
general: & Pb\ izquierda (s\ derecha) PbO_ {2}\ izquierda (s\ derecha) + 2SO_ {4} ^ {2-}\ izquierda (aq\ derecha) + 4H^ {+}\ izquierda (aq\ derecha)\ fila derecha 2pbSO_ {4}\ izquierda (s\ derecha) + 2H_ {2} O\ izquierda (l\ derecha) & E_ {celda} ^ {o} =2.05\; V
\ end {matriz}\)
B Dos electrones se transfieren en la reacción global, por lo que n = 2. Resolviendo la Ecuación 19.4.13 para log K e insertando los valores de n y E°,
\( ln\;K=\dfrac{nE^{o}}{0.0591\;V}=\dfrac{2\left ( 2.05\;\cancel{V} \right )}{0.0591\;\cancel{V}}=69.37 \)
\( K=2.3\times 10^{69} \)
Así el equilibrio se encuentra muy a la derecha, favoreciendo una batería descargada (como sabrá cualquiera que alguna vez haya intentado sin éxito arrancar un automóvil después de dejarlo reposar durante mucho tiempo).
Ejercicio
Utilizar los datos del Cuadro 19.3.1 para calcular la constante de equilibrio para la reacción de Sn 2+ (aq) con oxígeno para producir Sn 4+ (aq) y agua en condiciones estándar. Denuncia tu respuesta a dos cifras significativas. La reacción es la siguiente:
\( 2Sn^{2+}\left ( aq \right )+O_{2}\left ( g \right )+4H^{+}\left ( aq \right )\rightleftharpoons 2Sn^{4+}\left ( aq \right )+2H_{2}O\left ( l \right ) \)
Respuesta: 1.2 × 10 73
La Figura 19.4.1 resume las relaciones que hemos desarrollado a partir de las propiedades del sistema —es decir, con base en la constante de equilibrio, el cambio estándar de energía libre y el potencial celular estándar— y los criterios de espontaneidad (Δ G° < 0). Desafortunadamente, estos criterios se aplican únicamente a sistemas en los que todos los reactivos y productos están presentes en sus estados estándar, situación que rara vez se encuentra en el mundo real. Una relación más generalmente útil entre el potencial celular y las concentraciones de reactivo y producto, como estamos a punto de ver, utiliza la relación entre Δ G y el cociente de reacción Q desarrollado en el Capítulo 18.
Figura 19.4.1 Las relaciones entre los criterios para la espontaneidad termodinámica Las tres propiedades de un sistema que se pueden utilizar para predecir la espontaneidad de una reacción redox en condiciones estándar son K, Δ G° y E° celular. Si conocemos el valor de una de estas cantidades, entonces estas relaciones nos permiten calcular el valor de las otras dos. Los signos de Δ G° y E° celda y la magnitud de K determinan la dirección de la reacción espontánea en condiciones estándar.
El efecto de la concentración sobre el potencial celular: la ecuación de Nernst
Recordemos del Capítulo 18 que el cambio real de energía libre para una reacción en condiciones no estándar, Δ G, se da de la siguiente manera:
\( \Delta G =\Delta G^{o}+RT\;ln\;Q \tag{19.4.14}\)
También sabemos que Δ G = − celda nFe y Δ G° = − nFe° celda. Sustituyendo estas expresiones en la Ecuación 19.4.14, obtenemos
\( -nFE_{cell} =-nFE_{cell}^{o}+RT\;ln\;Q \tag{19.4.15}\)
Dividiendo ambos lados de esta ecuación por − nF,
\( E_{cell} =E_{cell}^{o}-\dfrac{RT}{nF}\;ln\;Q \tag{19.4.16}\)
La ecuación 19.4.16 se llama la ecuación de Nernst Una ecuación para calcular los potenciales celulares E celda bajo condiciones no estándar; se puede usar para determinar la dirección de reacción espontánea para cualquier reacción redox bajo condiciones: E </mo>cell = <msubsup><mi>E°− (Rt/Nf) LnQ, después del físico y químico alemán Walter Nernst (1864—1941), quien primero lo derivó. La ecuación de Nernst es posiblemente la relación más importante en electroquímica. Cuando una reacción redox está en equilibrio (Δ G = 0), la Ecuación 19.4.16 se reduce a la Ecuación 19.4.12 porque Q = K, y no hay transferencia neta de electrones (es decir, celda E = 0).
Sustituir los valores de las constantes en la Ecuación 19.4.16 con T = 298 K y convertir a logaritmos de base 10 dan la relación del potencial celular real (celda E), el potencial celular estándar (celda E°) y el reactivo y concentraciones de producto a temperatura ambiente (contenidas en Q):
\( E_{cell} =E_{cell}^{o}-\dfrac{0.0591\;V}{F}\;ln\;Q \tag{19.4.17}\)
Tenga en cuenta el patrón
La ecuación de Nernst puede ser utilizada para determinar el valor de la célula E, y así la dirección de la reacción espontánea, para cualquier reacción redox bajo cualquier condición.
La ecuación 19.4.17 permite calcular el potencial asociado a cualquier celda electroquímica a 298 K para cualquier combinación de reactivo y concentraciones de producto bajo cualquier condición. Por lo tanto, podemos determinar la dirección espontánea de cualquier reacción redox bajo cualquier condición, siempre y cuando tengamos valores tabulados para los potenciales de electrodo estándar relevantes. Observe en la Ecuación 19.4.17 que el potencial celular cambia en 0.0591/ n V por cada cambio de 10 veces en el valor de Q porque log 10 = 1.
Ejemplo 19.4.3
En el ejercicio del Ejemplo 6, determinó que la siguiente reacción procede espontáneamente en condiciones estándar porque E° celda > 0 (que ahora sabe significa que Δ G° < 0):
\( 2Ce^{4+}\left ( aq \right )+2Cl^{-}\left ( aq \right )\rightarrow 2Ce^{3+}\left ( aq \right )+ Cl_{2}\left ( g \right ) \)
Calcular E para esta reacción bajo las siguientes condiciones no estándar y determinar si ocurrirá espontáneamente: [Ce 4+] = 0.013 M, [Ce 3+] = 0.60 M, [Cl −] = 0.0030 M, Cl 2 = 1.0 atm y T = 25° C.
Dado: reacción redox equilibrada, potencial celular estándar y condiciones no estándar
Preguntado por: potencial celular
Estrategia:
Determinar el número de electrones transferidos durante el proceso redox. Luego use la ecuación de Nernst para encontrar el potencial celular bajo condiciones no estándar.
Solución:
Podemos usar la información dada y la ecuación de Nernst para calcular la celda E. Además, debido a que la temperatura es de 25°C (298 K), podemos usar la Ecuación 19.4.17 en lugar de 19.46. La reacción global implica la transferencia neta de dos electrones:
2Ce 4+ (aq) + 2e − → 2Ce 3+ (aq)
2Cl − (aq) → Cl 2 (g) + 2e −
así que n = 2. Sustituyendo las concentraciones dadas en el problema, la presión parcial de Cl 2 y el valor de E° celda en la Ecuación 19.4.17,
\( E_{cell} =E_{cell}^{o}-\dfrac{0.0591\;V}{F}\;log\;Q \)
\( \;\;\; =0.25\;V-\dfrac{0.0591\;V}{2}\;logn\;\left (\dfrac{\left [ Ce^{3+} \right ]^{2}P_{Cl_{2}}}{\left [ Ce^{4+} \right ]^{2}\left [ Cl^{-} \right ]^{2}} \right ) \)
\( \;\;\; =0.25\;V-\left [ \left ( 0.0296\;V \right ) \left ( 8.37 \right )\right ]=0.00\;V \)
Así, la reacción no ocurrirá espontáneamente bajo estas condiciones (debido a que E = 0 V y Δ G = 0). La composición especificada es la de una mezcla de equilibrio.
Ejercicio
En el ejercicio del Ejemplo 6, determinó que el oxígeno molecular no oxidará el MnO 2 a permanganato a través de la reacción
\( 4MnO_{2}\left ( s \right )+3O_{2}\left ( g \right )+4OH^{-}\left ( aq \right ) \rightarrow 4MnO_{4}^{-}\left ( aq \right )+ 2H_{2}O\left ( l \right ) \)\;\;\; E_ {celda} ^ {o} =-0.20\; V\)
Calcular la celda E para la reacción bajo las siguientes condiciones no estándar y decidir si la reacción ocurrirá espontáneamente: pH 10, P (O2) = 0.20 atm, [MNO 4 −] = 1.0 × 10 −4 M, y T = 25°C.
Respuesta: Célula E = −0.22 V; la reacción no ocurrirá espontáneamente.
Aplicar la ecuación de Nernst a una celda electroquímica simple como la celda Zn/Cu discutida en la Sección 19.2 nos permite ver cómo varía el voltaje de la celda a medida que avanza la reacción y cambian las concentraciones de los iones disueltos. Recordemos que la reacción general para esta célula es la siguiente:
\( Zn\left ( s \right )+Cu^{2+}\left ( aq \right ) \rightarrow Zn^{2+}\left ( aq \right )+ Cu\left ( s \right ) \)\;\;\; E_ {celda} ^ {o} =1.10\; V\ tag {19.4.18}\)
Por lo tanto, el cociente de reacción es Q = [Zn 2+]/[Cu 2+]. Supongamos que la celda inicialmente contiene 1.0 M Cu 2+ y 1.0 × 10 −6 M Zn 2+. El voltaje inicial medido cuando la celda está conectada puede calcularse a partir de la Ecuación 19.4.17:
\( E_{cell} =E_{cell}^{o}-\dfrac{0.0591\;V}{n}\;log \dfrac{\left [ Zn^{2+} \right ]}{\left [ Cu^{2+} \right ]} \tag{19.4.19} \)
\( E_{cell} =1.10\;V-\dfrac{0.0591\;V}{2}\;log \dfrac{1.0\times 10^{-6}}{1.0} = 1.28\;V \)
Por lo tanto, el voltaje inicial es mayor a E° porque Q < 1. A medida que avanza la reacción, [Zn 2+] en el compartimiento del ánodo aumenta a medida que el electrodo de zinc se disuelve, mientras que [Cu 2+] en el compartimiento del cátodo disminuye a medida que el cobre metálico se deposita sobre el electrodo. Durante este proceso, la relación Q = [Zn 2+]/[Cu 2+] aumenta constantemente, y el voltaje de la celda por lo tanto disminuye constantemente. Finalmente, [Zn 2+] = [Cu 2+], así que Q = 1 y E celda = E° celda. Más allá de este punto, [Zn 2+] continuará aumentando en el compartimiento del ánodo, y [Cu 2+] continuará disminuyendo en el compartimiento del cátodo. De esta manera, el valor de Q aumentará aún más, conduciendo a una disminución adicional en la celda E. Cuando las concentraciones en los dos compartimentos son opuestas a las concentraciones iniciales (es decir, 1.0 M Zn 2+ y 1.0 × 10 −6 M Cu 2+), Q = 1.0 × 10 6, y el potencial celular se reducirá a 0.92 V.
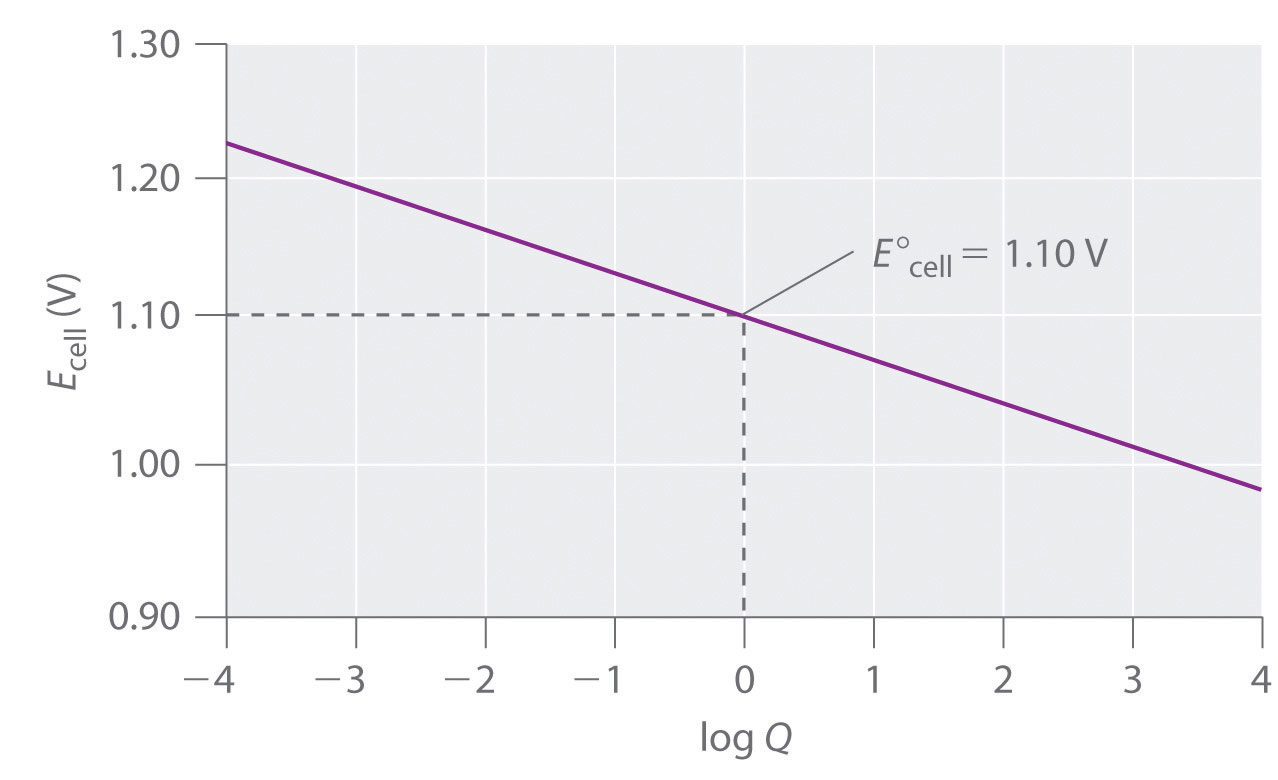
La variación de celda E con log Q sobre este rango es lineal con una pendiente de −0.0591/ n, como se ilustra en la Figura 19.4.2. A medida que la reacción avanza aún más, Q continúa aumentando y la célula E continúa disminuyendo. Si ninguno de los electrodos se disuelve completamente, rompiendo así el circuito eléctrico, el voltaje de la celda eventualmente llegará a cero. Esta es la situación que ocurre cuando una batería está “muerta”. El valor de Q cuando E celda = 0 se calcula de la siguiente manera:
\( E_{ cell} =E_{cell}^{o} - \dfrac{0.0591\;V}{n} \; log \; Q = 0 \tag{19.4.20} \)
\( E^{o}=\dfrac{0.0591\;V}{n}\;log \; Q \)
\( log \; Q )=\dfrac{E^{o} \; n}{0.0591\;V}=\dfrac{\left ( 1.10\;\cancel{V} \right )\left ( 2 \right )}{0.0591\;\cancel{V}}=37.23 \)
\( Q =10^{37.23}=1.7\times 10^{37} \)
Figura 19.4.2 La variación de la celda E con Log Q para una celda de Zn/Cu Inicialmente, log Q < 0, y el voltaje de la celda es mayor que la celda de E°. A medida que avanza la reacción, el log Q aumenta y la célula E disminuye. Cuando [Zn 2+] = [Cu 2+], log Q = 0 y E celda = E ° celda = 1.10 V. Mientras el circuito eléctrico permanezca intacto, la reacción continuará, y log Q aumentará hasta Q = K y el voltaje de la celda llega a cero. En este punto, el sistema habrá alcanzado el equilibrio.
Recordemos que en equilibrio, Q = K. Así, la constante de equilibrio para la reacción de Zn metal con Cu 2+ para dar Cu metal y Zn 2+ es 1.7 × 10 37 a 25°C.
Células de concentración
También se puede generar un voltaje construyendo una celda electroquímica en la que cada compartimento contenga la misma solución activa redox pero a diferentes concentraciones. El voltaje se produce a medida que las concentraciones se equilibran. Supongamos, por ejemplo, que tenemos una celda con 0.010 M AgnO 3 en un compartimento y 1.0 M AgnO 3 en el otro. El diagrama celular y las medias reacciones correspondientes son los siguientes:
\( Ag\left ( s \right )\mid Ag^{+}\left ( aq,\; 0.010\; M \right )\parallel Ag^{+}\left ( aq,\; 1.0 \; M \right )\mid Ag\left ( s \right ) \tag{19.4.21} \)
\( cathode: \;\; Ag^{+}\left ( aq,\; 1.0 \; M \right )+e^{-}\rightarrow Ag\left ( s \right ) \tag{19.4.22} \)
\( anode: \;\; Ag\left ( s \right )\rightarrow Ag^{+}\left ( aq,\; 0.010 \; M \right )+e^{-} \tag{19.4.23} \)
\( overall: \;\; Ag^{+}\left ( aq,\; 1.0 \; M \right )\rightarrow Ag^{+}\left ( aq,\; 0.010 \; M \right ) \tag{19.4.24} \)
A medida que avanza la reacción, la concentración de Ag + aumentará en el compartimento izquierdo (oxidación) a medida que el electrodo de plata se disuelva, mientras que la concentración de Ag + en el compartimento derecho (reducción) disminuye a medida que el electrodo en ese compartimento gana masa. Sin embargo, la masa total de Ag (s) en la celda se mantendrá constante. Podemos calcular el potencial de la celda usando la ecuación de Nernst, insertando 0 para celda E° porque E° cátodo = − E° ánodo:
\( E_{cell} =E_{cell}^{o}-\dfrac{0.0591\;V}{n}\;log Q = 0-\left ( \dfrac{0.0591\;V}{1} \right )log\dfrac{0.010}{1.0} = 0.12 \tag{19.4.25} \)
Una celda electroquímica de este tipo, en la que los compartimentos de ánodo y cátodo son idénticos a excepción de la concentración de un reactivo, se denomina celda de concentración Una celda electroquímica en la que los compartimientos de ánodo y cátodo son idénticos excepto por la concentración de un reactivo. . A medida que avanza la reacción, la diferencia entre las concentraciones de Ag + en los dos compartimentos disminuirá, al igual que la célula E. Finalmente, cuando la concentración de Ag + sea la misma en ambos compartimentos, se habrá alcanzado el equilibrio, y la diferencia de potencial medida entre los dos compartimentos será cero (celda E = 0).
Ejemplo 19.4.4
Calcular el voltaje en una celda galvánica que contiene un electrodo de manganeso sumergido en una solución 2.0 M de MnCl 2 como cátodo, y un electrodo de manganeso sumergido en una solución 5.2 × 10 −2 M de MnSO 4 como ánodo (T = 25°C).
Dado: celda galvánica, identidades de los electrodos y concentraciones de solución
Preguntado por: voltaje
Estrategia:
A Escribe la reacción general que ocurre en la celda.
B Determinar el número de electrones transferr
\( E_{cell} =E_{cell}^{o}-\dfrac{0.0591\;V}{n}\;log \;Q = 0-\left ( \dfrac{0.0591\;V}{2} \right )log\dfrac{5.2\times 10^{-2}}{2.0} = 0.047 \)
ed. Sustituya este valor en la ecuación de Nernst para calcular el voltaje.
Solución:
A Se trata de una celda de concentración, en la que los compartimentos de los electrodos contienen la misma sustancia activa redox pero a diferentes concentraciones. Los aniones (Cl − y SO 4 2−) no participan en la reacción, por lo que su identidad no es importante. La reacción global es la siguiente:
Mn 2+ (aq, 2.0 M) → Mn 2+ (aq, 5.2 × 10 −2 M)B Para la reducción de Mn 2+ (aq) a Mn (s), n = 2. Sustituimos este valor y las concentraciones dadas de Mn 2+ en la Ecuación 19.4.17:
Así, el manganeso se disolverá del electrodo en el compartimento que contiene la solución más diluida y se depositará sobre el electrodo en el compartimento que contiene la solución más concentrada.
Ejercicio
Supongamos que construimos una celda galvánica colocando dos electrodos de platino idénticos en dos vasos de precipitados que están conectados por un puente salino. Un vaso de precipitados contiene HCl 1.0 M y el otro una solución 0.010 M de Na 2 SO 4 a pH 7.00. Ambas celdas están en contacto con la atmósfera, con P (O 2) = 0.20 atm. Si la reacción electroquímica relevante en ambos compartimentos es la reducción de cuatro electrones del oxígeno al agua, O 2 (g) + 4H + (aq) + 4e − → 2H 2 O (l), ¿cuál será el potencial cuando se cierre el circuito?
Respuesta: 0.41 V
Uso de potenciales celulares para medir productos de solubilidad
Debido a que los voltajes son relativamente fáciles de medir con precisión usando un voltímetro, los métodos electroquímicos proporcionan una manera conveniente de determinar las concentraciones de soluciones muy diluidas y los productos de solubilidad (K sp) de sustancias escasamente solubles. Como aprendiste en el Capítulo 17, los productos de solubilidad pueden ser muy pequeños, con valores menores o iguales a 10 −30. Constantes de equilibrio de esta magnitud son prácticamente imposibles de medir con precisión por métodos directos, por lo que debemos usar métodos alternativos que sean más sensibles, como los métodos electroquímicos.
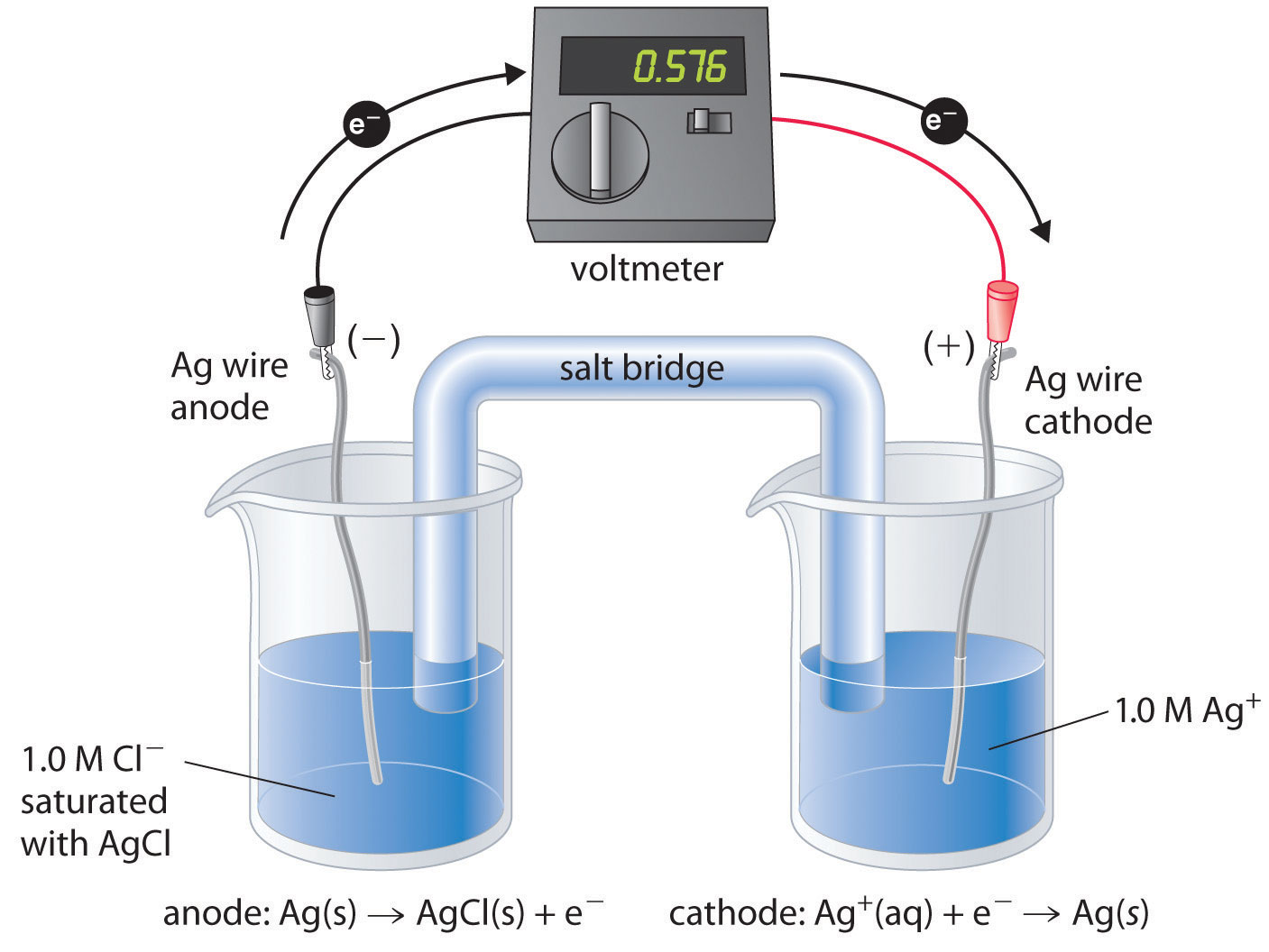
Para entender cómo se usa una celda electroquímica para medir un producto de solubilidad, considere la celda que se muestra en la Figura 19.4.3, la cual está diseñada para medir el producto de solubilidad del cloruro de plata: K sp = [Ag +] [Cl −]. En un compartimento, la celda contiene un alambre de plata insertado en una solución 1.0 M de Ag +; el otro compartimento contiene un alambre de plata insertado en una solución 1.0 M Cl − saturada con AgCl. En este sistema, la concentración de iones Ag + en el primer compartimento es igual a K sp. Podemos ver esto dividiendo ambos lados de la ecuación para K sp por [Cl −] y sustituyendo: [Ag +] = K sp/[Cl −] = K sp /1.0 = K sp. La reacción celular global es la siguiente:
Ag + (aq, concentrado) → Ag + (aq, diluido)Así, el voltaje de la celda de concentración debido a la diferencia en [Ag +] entre las dos celdas es el siguiente:
\( E_{cell} = 0-\left ( \dfrac{0.0591\;V}{1} \right )log\left (\dfrac{\left [Ag^{+} \right ]_{dilute}}{\left [Ag^{+} \right ]_{concentrated}} \right ) = -0.0591 \; V\; log\left ( \dfrac{K_{sp}}{1.0} \right )=-0.0591\; V \tag{19.4.26}\)
Figura 19.4.3. Una celda galvánica para medir el producto de solubilidad de AgCl Un compartimento contiene un alambre de plata insertado en una solución 1.0 M de Ag +, y el otro compartimento contiene un alambre de plata insertado en una solución 1.0 M Cl − saturada con AgCl. El potencial debido a la diferencia en [Ag +] entre las dos células se puede utilizar para determinar K sp.
Al cerrar el circuito, podemos medir el potencial causado por la diferencia en [Ag +] en las dos celdas. En este caso, el voltaje medido experimentalmente de la celda de concentración a 25°C es de 0.580 V. Resolviendo la Ecuación 19.4.26 para K sp,
\( log\;K_{sp} = \dfrac{-E_{cell}}{0.0591\;V } = \dfrac{-0.580\; \cancel{V}}{0.0591\;\cancel{V}} =-9.81 \tag{19.4.27}\)
\( K_{sp}=1.5\times 10^{-10}\)
Por lo tanto, una sola medición de potencial puede proporcionar la información que necesitamos para determinar el valor del producto de solubilidad de una sal escasamente soluble.
Ejemplo 19.4.5
Para medir el producto de solubilidad del sulfato de plomo (II) (PbSO 4) a 25°C, se construye una celda galvánica como la que se muestra en la Figura 19.4.3, que contiene una solución 1.0 M de una sal de Pb 2+ muy soluble [trihidrato de acetato de plomo (II)] en un compartimento que está conectado por un puente salino a una solución 1.0 M de Na 2 SO 4 saturado con PbSO 4 en el otro. Luego inserta un electrodo de Pb en cada compartimento y cierra el circuito. Tu voltímetro muestra una tensión de 230 mV. ¿Qué es K sp para PbSO 4? Denuncia tu respuesta a dos cifras significativas.
Dado: celda galvánica, concentraciones de solución, electrodos y voltaje
Preguntado por: K sp
Estrategia:
A A partir de la información dada, escriba la ecuación para K sp. Expresar esta ecuación en términos de la concentración de Pb 2+.
B Determinar el número de electrones transferidos en la reacción electroquímica. Sustituir los valores apropiados en la Ecuación 19.4.26 y resolver por K sp.
Solución:
A Se ha construido una celda de concentración, con un compartimento que contiene una solución 1.0 M de Pb 2+ y el otro conteniendo una solución diluida de Pb 2+ en 1.0 M Na 2 SO 4. En cuanto a cualquier celda de concentración, el voltaje entre los dos compartimentos se puede calcular usando la ecuación de Nernst. El primer paso es relacionar la concentración de Pb 2+ en la solución diluida con K sp:
\[ \left [ Pb^{2+} \right ]\left [ SO_{4}^{2-} \right ]=K_{sp} \]
\[ \left [ Pb^{2+} \right ]=\dfrac{K_{sp}}{\left [ SO_{4}^{2-} \right ]}=\dfrac{K_{sp}}{1.0 \; M}= K_{sp} \]
B La reducción de Pb 2+ a Pb es un proceso de dos electrones y procede de acuerdo con la siguiente reacción:
Pb 2+ (aq, concentrado) → Pb 2+ (aq, diluido)
por lo
\ (E_ {celda} =E_ {celda} ^ {o} -\ dfrac {0.0591\; V} {n}\; log\; Q =
\(0.230\;V=0-\left ( \dfrac{0.0591\;V}{2} \right )log \left (\dfrac{\left [ Pb^{2+} \right ]_{dilute}}{\left [ Pb^{2+} \right ]_{concentrated}} \right ) = -0.0296\; V\; log\left ( \dfrac{K_{sp}}{1.0} \right ) \)
\(-7.77=log \; K_{sp} \)
\(1.7\times 10^{-8} = K_{sp} \)
Ejercicio
Una celda de concentración similar a la descrita en el Ejemplo 11 contiene una solución 1.0 M de nitrato de lantano [La (NO 3) 3] en un compartimento y una solución 1.0 M de fluoruro de sodio saturada con LaF 3 en el otro. Se inserta una tira metálica La en cada compartimento, y el circuito se cierra. El potencial medido es 0.32 V. ¿Cuál es la K sp para LaF 3? Denuncia tu respuesta a dos cifras significativas.
Respuesta: 5.7 × 10 −17
Uso de potenciales celulares para medir concentraciones
Otro uso para la ecuación de Nernst es calcular la concentración de una especie dada un potencial medido y las concentraciones de todas las demás especies. Vimos un ejemplo de esto en el Ejemplo 11, en el que se definieron las condiciones experimentales de tal manera que la concentración del ión metálico fue igual a K sp. Las mediciones potenciales se pueden utilizar para obtener las concentraciones de especies disueltas también en otras condiciones, lo que explica el uso generalizado de celdas electroquímicas en muchos dispositivos analíticos. Quizás la aplicación más común está en la determinación de [H +] usando un medidor de pH, como se ilustra en el Ejemplo 12.
Ejemplo 19.4.6
Supongamos que se construye una celda galvánica con un par estándar Zn/Zn 2+ en un compartimento y un electrodo de hidrógeno modificado en el segundo compartimento (Figura 19.4.3). La presión del gas hidrógeno es de 1.0 atm, pero se desconoce [H +] en el segundo compartimento. El diagrama de celdas es el siguiente:
Zn (s) Zn 2+ (aq, 1.0 M) H + (aq,? M) H 2 (g, 1.0 atm) Pt (s)¿Cuál es el pH de la solución en el segundo compartimento si el potencial medido en la celda es de 0.26 V a 25°C?
Dado: celda galvánica, diagrama de celdas y potencial de celda
Preguntado por: pH de la solución
Estrategia:
A Escriba la reacción celular general.
B Sustituir los valores apropiados en la ecuación de Nernst y resolver −log [H +] para obtener el pH.
Solución:
A Bajo condiciones estándar, la reacción global que se produce es la reducción de protones por zinc para dar H 2 (obsérvese que Zn se encuentra por debajo de H 2 en la Tabla 19.3.1):
\( Zn\left ( s \right )+ 2H^{+}\left ( aq \right )\rightarrow Zn^{2+}\left ( aq \right )+H_{2}\left ( g \right )\;\;\; E_{o}=0.76\;V \)
B Al sustituir los valores dados en la ecuación simplificada de Nernst (Ecuación 19.64), podemos calcular [H +] bajo condiciones no estándar:
\ (E_ {celda} =E_ {celda} ^ {o} -\ dfrac {0.0591\; V} {n}\; log\ izquierda (\ dfrac {\ izquierda [Zn^ {2+}\ derecha] P_ {H_ {2}}} {\ izquierda [H^ {+}\ derecha] ^ {2}}\ derecha)
\(0.26\;V=0.76 \; V -\left ( \dfrac{0.0591\;V}{2} \right )log \left ( \dfrac{\left ( 1.0 \right )\left ( 1.0 \right )}{\left [ H^{+} \right ]^{2}} \right ) = -0.0296\; V\; log\left ( \dfrac{K_{sp}}{1.0} \right ) \)
\(16.9=log\left ( \dfrac{1}{\left [ H^{+} \right ]^{2}} \right )=log\left [ H^{+} \right ]^{-2} =-2\;log\left [ H^{+} \right ]\)
\( 8.46 = -log\left [ H^{+} \right ] \)
\(8.5 = pH \)
Así, el potencial de una celda galvánica se puede utilizar para medir el pH de una solución.
Ejercicio
Supongamos que trabaja para un laboratorio ambiental y desea utilizar un método electroquímico para medir la concentración de Pb 2+ en las aguas subterráneas. Se construye una celda galvánica usando un electrodo de oxígeno estándar en un compartimento (cátodo E° = 1.23 V). El otro compartimento contiene una tira de plomo en una muestra de agua subterránea a la que se le ha agregado suficiente ácido acético, un ácido orgánico débil, para asegurar la conductividad eléctrica. El diagrama de celdas es el siguiente”
Pb (s) Pb 2+ (aq,? M) H + (aq), 1.0 MO 2 (g, 1.0 atm) Pt (s)Cuando el circuito está cerrado, la celda tiene un potencial medido de 1.62 V. Utilice la Tabla 19.7.1 y la Tabla T1 para determinar la concentración de Pb 2+ en el agua subterránea.
Respuesta: 1.2 × 10 −9 M
Resumen
Un culombo (C) relaciona el potencial eléctrico, expresado en voltios, y la energía, expresada en julios. La corriente generada a partir de una reacción redox se mide en amperios (A), donde 1 A se define como el flujo de 1 C/s pasado un punto dado. El faraday (F) es el número de Avogadro multiplicado por la carga sobre un electrón y corresponde a la carga en 1 mol de electrones. El producto del potencial celular y la carga total es la cantidad máxima de energía disponible para realizar el trabajo, la cual está relacionada con el cambio en la energía libre que se produce durante el proceso químico. La suma de los valores Δ G para las medias reacciones da Δ G para la reacción global, que es proporcional tanto al potencial como al número de electrones (n) transferidos. Las reacciones redox espontáneas tienen un Δ G negativo y por lo tanto una célula E positiva. Debido a que la constante de equilibrio K está relacionada con Δ G, E° celda y K también están relacionados. Las constantes de equilibrio grandes corresponden a grandes valores positivos de E°. La ecuación de Nernst nos permite determinar la dirección espontánea de cualquier reacción redox bajo cualquier condición de reacción a partir de valores de los potenciales de electrodo estándar relevantes. Las celdas de concentración consisten en compartimientos anódicos y catódicos que son idénticos a excepción de las concentraciones del reactivo. Debido a que Δ G = 0 en equilibrio, el potencial medido de una celda de concentración es cero en equilibrio (las concentraciones son iguales). También se puede utilizar una celda galvánica para medir el producto de solubilidad de una sustancia escasamente soluble y calcular la concentración de una especie dada un potencial medido y las concentraciones de todas las demás especies.
Llave para llevar
- La ecuación de Nernst se puede utilizar para determinar la dirección de la reacción espontánea para cualquier reacción redox en solución acuosa.
Ecuaciones Clave
Carga sobre un mol de electrones (faraday)
Ecuación 19.4.2: F ≈ 96,486 J/ (V·mol)
Trabajo máximo desde una celda electroquímica
Ecuación 19.4.3: w max = − celda nFe
Relación entre Δ G ° y Δ E °
Ecuación 19.4.5: Δ G° = − nFe° celda
Relación entre Δ G ° y K para una reacción redox
Ecuación 19.4.10: Δ G° = − RT ln K
Relación entre Δ E ° y K para una reacción redox a 25°C
Ecuación 19.4.12:\( E_{cell}^{o}=\left (\dfrac{RT}{nF} \right ) ln\;K \)
Ecuación 19.4.13:\( E_{cell}^{o}= \left ( \dfrac{0.0591}{n} \right )log\; K \)
Relación entre Δ G ° y Q
Ecuación 19.4.14: Δ G = Δ G° + RT ln Q
Relación entre celda E y Q a 25 °C
Ecuación 19.4.17:\( E_{cell} =E_{cell}^{o}-\dfrac{0.0591\;V}{F}\;ln\;Q \)
Problemas conceptuales
-
Indique si está de acuerdo o en desacuerdo con este razonamiento y explique su respuesta: Los potenciales de electrodo estándar surgen del número de electrones transferidos. Cuanto mayor sea el número de electrones transferidos, mayor será la diferencia de potencial medida. Si 1 mol de una sustancia produce 0.76 V cuando se transfieren 2 moles de electrones, como en Zn (s) → Zn 2+ (aq) + 2e −, entonces 0.5 mol de la sustancia producirán 0.76/2 V porque solo se transfiere 1 mol de electrones.
-
¿Cuál es la relación entre el potencial celular medido y la carga total que pasa a través de una célula? ¿Cuál de estos depende de la concentración? ¿Cuál depende de la identidad del oxidante o del reductor? ¿Cuál depende del número de electrones transferidos?
-
En la ecuación w max = − nFe° cell, ¿qué cantidades son propiedades extensas y cuáles son propiedades intensivas?
-
Para cualquier reacción redox espontánea, E es positiva. Usa argumentos termodinámicos para explicar por qué esto es cierto.
-
Indique si está de acuerdo o en desacuerdo con esta afirmación y explique su respuesta: Los métodos electroquímicos son especialmente útiles para determinar la reversibilidad o irreversibilidad de las reacciones que tienen lugar en una célula.
-
Aunque la suma de dos medias reacciones da otra semirreacción, la suma de los potenciales de las dos medias reacciones no se puede utilizar para obtener el potencial de la semirreacción neta. ¿Por qué? ¿Cuándo corresponde la suma de dos medias reacciones a la reacción general? ¿Por qué?
-
Ocasionalmente, encontrará equipos electrónicos de alta calidad que tienen sus componentes electrónicos chapados en oro. ¿Cuál es la ventaja de esto?
-
Los analizadores de sangre, que miden el pH, P (CO 2) y P (O 2) se utilizan con frecuencia en urgencias clínicas. Por ejemplo, el P en sangre (CO 2) se mide con un electrodo de pH cubierto con una membrana de plástico que es permeable al CO 2. Con base en su conocimiento de cómo funcionan los electrodos, explique cómo podría funcionar dicho electrodo. Pista: CO 2 (g) + H 2 O (l) → HCO 3 − (aq) + H + (aq).
-
Las células de concentración contienen la misma especie en solución en dos compartimentos diferentes. Explique qué produce un voltaje en una celda de concentración. ¿Cuándo V = 0 en tal celda?
-
Describir cómo se puede usar una celda electroquímica para medir la solubilidad de una sal escasamente soluble.
RESPUESTAS
-
extenso: w max y n; intensivo: celda E°
-
El oro es altamente resistente a la corrosión debido a su potencial de reducción muy positivo.
Problemas numéricos
-
La ecuación química para la combustión de butano es la siguiente:
\( C_{4}H{10}\left ( g \right )+\dfrac{13}{2}O_{2}\left ( g \right )\rightarrow 2CO_{2}\left ( g \right )+5H_{2}O\left ( g \right ) \)
Esta reacción tiene Δ H° = −2877 kJ/mol. Calcular E° celda y luego determinar Δ G°. ¿Es este un proceso espontáneo? ¿Cuál es el cambio en la entropía que acompaña a este proceso a 298 K?
-
¿Cuántos electrones se transfieren durante la reacción Pb (s) + Hg 2 Cl 2 (s) → PbCl 2 (aq) + 2Hg (l)? ¿Cuál es el potencial celular estándar? ¿Es espontánea la oxidación de Pb por Hg 2 Cl 2? Calcular Δ G° para esta reacción.
-
Para la célula representada como Al (s) Al 3+ (aq) Sn 2+ (aq), Sn 4+ (aq) Pt (s), ¿cuántos electrones se transfieren en la reacción redox? ¿Cuál es el potencial celular estándar? ¿Es este un proceso espontáneo? ¿Qué es Δ G°?
-
Explicar por qué la suma de los potenciales para las medias reacciones Sn 2+ (aq) + 2e − → Sn (s) y Sn 4+ (aq) + 2e − → Sn 2+ (aq) no es igual al potencial para la reacción Sn 4+ (aq) + 4e − → Sn (s). ¿Cuál es el potencial celular neto? Comparar los valores de Δ G° para la suma de los potenciales y el potencial celular neto real.
-
Con base en el Cuadro 19.3.1 y el Cuadro P1, ¿está de acuerdo con los potenciales propuestos para las siguientes medias reacciones? ¿Por qué o por qué no?
- Cu 2+ (aq) + 2e − → Cu (s), E° = 0.68 V
- Ce 4+ (aq) + 4e − → Ce (s), E° = −0.62 V
-
Para cada reacción, calcule E° celda y luego determine Δ G°. Indicar si cada reacción es espontánea.
- 2Na (s) + 2H 2 O (l) → 2NaOH (ac) + H 2 (g)
- K 2 S 2 O 6 (aq) + I 2 (s) → 2KI (aq) + 2K 2 SO 4 (aq)
- Sn (s) + CuSO 4 (aq) → Cu (s) + SnSO 4 (aq)
-
¿Cuál es el cambio estándar en la energía libre para la reacción entre Ca 2+ y Na (s) para dar Ca (s) y Na +? ¿El signo y la magnitud de Δ G° concuerdan con lo que esperaría con base en las posiciones de estos elementos en la tabla periódica? ¿Por qué o por qué no?
-
En solución ácida, el permanganato (MnO 4 −) oxida Cl − a gas cloro, y MnO 4 − se reduce a Mn 2+ (aq).
- Escribe la ecuación química balanceada para esta reacción.
- Determinar celda E°.
- Calcular la constante de equilibrio.
-
Las titulaciones potenciométricas son un método eficiente para determinar el punto final de una valoración redox. En dicha titulación, se monitoriza el potencial de la solución a medida que se añaden volúmenes medidos de un oxidante o un reductor. Los datos para una titulación típica, la titulación potenciométrica de Fe (II) con una solución 0.1 M de Ce (IV), se dan en la siguiente tabla. El potencial inicial se ha establecido arbitrariamente igual a cero porque es el cambio de potencial con la adición del oxidante lo que es importante.
Titrante (mL) E (mV) 2.00 50 6.00 100 9.00 255 10.00 960 11.00 1325 12.00 1625 14.00 1875 - Escribir la ecuación química balanceada para la oxidación de Fe 2+ por Ce 4+.
- Trazar los datos y luego localizar el punto final.
- ¿Cuántos milimoles de Fe 2+ contenía originalmente la solución que se titulaba?
-
El potencial de electrodo estándar (E°) para la semi-reacción Ni 2+ (aq) + 2e − → Ni (s) es −0.257 V. ¿Qué pH se necesita para que esta reacción tenga lugar en presencia de 1.00 atm H 2 (g) como reductor si [Ni 2+] es 1.00 M?
-
La reducción de Mn (VII) a Mn (s) por H 2 (g) procede en cinco etapas que pueden ser seguidas fácilmente por cambios en el color de la solución. Aquí está la química redox:
- MnO 4 − (aq) + e − → MnO 4 2− (aq); E° = +0.56 V (púrpura → verde oscuro)
- MnO 4 2− (aq) + 2e − + 4H + (aq) → MnO 2 (s); E° = +2.26 V (verde oscuro → sólido marrón oscuro)
- MnO 2 (s) + e − + 4H + (aq) → Mn 3+ (aq); E° = +0.95 V (sólido marrón oscuro → rojo-violeta)
- Mn 3+ (aq) + e − → Mn 2+ (aq); E° = +1.51 V (rojo-violeta → rosa pálido)
- Mn 2+ (aq) + 2e − → Mn (s); E° = −1.18 V (rosa pálido → incoloro)
- ¿La reducción de MnO 4 − a Mn 3+ (aq) por H 2 (g) es espontánea en condiciones estándar? ¿Qué es la celda E°?
- ¿La reducción de Mn 3+ (aq) a Mn (s) por H 2 (g) es espontánea en condiciones estándar? ¿Qué es la celda E°?
-
Mn (III) puede ser desproporcionado (tanto oxidarse como reducirse) por medio de las siguientes reacciones medias:
Mn 3+ (aq) + e − → Mn 2+ (aq); E° = +1.51 V
Mn 3+ (aq) + 2H 2 O (l) → MnO 2 (s) + 4H + (aq) + e −; E° = +0.95 V
- ¿Qué es E° para la reacción de desproporción?
- ¿La desproporción se favorece más o menos termodinámicamente a pH bajo que a pH 7.0? Explica tu respuesta.
- ¿Cómo se podría evitar que ocurriera la reacción de desproporción?
-
Para la reducción de oxígeno a agua, E° = 1.23 V. ¿Cuál es el potencial de esta media reacción a pH 7.00? ¿Cuál es el potencial en una solución 0.85 M de NaOH?
-
La molécula biológica abreviada como NADH (nicotinamida adenina dinucleótido reducido) se puede formar por reducción de NAD + (nicotinamida adenina dinucleótido) a través de la media reacción NAD + + H + 2e − → NADH; E° = −0.32 V.
- ¿El NADH podría reducir el acetato a piruvato?
- ¿El NADH podría reducir el piruvato a lactato?
- ¿Qué potencial se necesita para convertir acetato en lactato?
acetato + CO 2 + 2 H + + 2e − → piruvato + H 2 O; E° = +0.70 V
piruvare + 2 H + +2e − → lactato; E° = -0.185 V
-
Dadas las siguientes medias reacciones biológicamente relevantes, ¿será el FAD (dinucleótido de flavina adenina), molécula utilizada para transferir electrones cuya forma reducida es FADH 2, un oxidante efectivo para la conversión de acetaldehído a acetato a pH 4.00?
acetato + 2 H + + 2e − → acetaldehído + H 2 O; E° = -0.58 V
FAD + 2 H + + 2e − → FADH 2; E° = -0.18 V
-
Idealmente, cualquier media reacción con E° > 1.23 V oxidará el agua como resultado de la semi-reacción O 2 (g) + 4H + (aq) + 4e − → 2H 2 O (l).
- ¿El FeO 4 2− oxidará el agua si la media reacción para la reducción de Fe (VI) → Fe (III) es FeO 4 2− (aq) + 8H + (aq) + 3e − → Fe 3+ (aq) + 4H 2 O; E° = 1.9 V?
- Cuál es el pH más alto al que esta reacción procederá espontáneamente si [Fe 3+] = [FeO 4 2−] = 1.0 M y <math display="inline” xml:id="av_1.0-19_m077"> <semantics><mrow><msub><mi>P</mi> <mrow><msub><mtext>O</mtext> <mn>2</mn> & lt; /msub></mrow></msub></mrow></semantics></math> = 1.0 atm?
-
En condiciones ácidas, idealmente cualquier media reacción con E° > 1.23 V oxidará el agua a través de la reacción
O 2 (g) + 4H + (aq) + 4e − → 2H 2 O (l).- ¿El KMnO 4 ácido acuoso evolucionará oxígeno con la formación de MnO 2?
- A pH 14.00, ¿qué es E° para la oxidación del agua por KMnO acuoso 4 (1 M) con la formación de MnO 2?
- A pH 14.00, ¿se oxidará el agua si está tratando de formar MnO 2 a partir de MnO 4 2− a través de la reacción
2MnO 4 2− (aq) + 2H 2 O (l) → 2MnO 2 (s) + O 2 (g) + 4OH − (aq)?
-
Los agentes complejantes pueden unirse a los metales y dar como resultado la estabilización neta de las especies complejadas. ¿Cuál es la energía neta de estabilización termodinámica que resulta del uso de CN − como agente complejante para Mn 3+ /Mn 2+?
Mn 3+ (aq) + e − → Mn 2+ (aq); E° = +1.51 V
Mn (CN) 6 3- (aq) + e − → Mn (CN) 6 4- (aq); E° = -0.24V
-
Se ha construido una celda con electrodos de amalgama de zinc y plomo descritos por el diagrama celular Zn (Hg) (s) Zn (NO 3) 2 (aq) Pb (NO 3) 2 (aq) Pb (Hg) (s). Si varías la concentración de Zn (NO 3) 2 y mides el potencial a diferentes concentraciones, obtienes los siguientes datos:
Zn (NO 3) 2 (M) Celda E (V) 0.0005 0.7398 0.002 0.7221 0.01 0.7014 - Escribe las medias reacciones que ocurren en esta celda.
- ¿Cuál es la reacción redox general?
- ¿Qué es la celda E°? ¿Qué es Δ G° para la reacción general?
- ¿Cuál es la constante de equilibrio para esta reacción redox?
-
El gas hidrógeno reduce Ni 2+ de acuerdo con la siguiente reacción: Ni 2+ (ac) + H 2 (g) → Ni (s) + 2H + (aq); E° celda = −0.25 V; Δ H = 54 kJ/mol.
- ¿Qué es K para esta reacción redox?
- ¿Es probable que ocurra esta reacción?
- ¿Qué condiciones se pueden cambiar para aumentar la probabilidad de que la reacción ocurra tal y como está escrito?
- ¿Es más probable que la reacción ocurra a pH mayor o menor?
-
El electrodo de plata-bromuro de plata tiene un potencial estándar de 0.07133 V. ¿Qué es K sp de AgBr?
RESPUESTAS
-
6e −; E° célula = 1.813 V; la reacción es espontánea; Δ G° = −525 kJ/mol Al.
-
sí; E° = 0.40 V
-
- sí; E° = 0.45 V
- 0.194 V
- sí; E° = 0.20 V