21.1: Los Elementos del Grupo 13
- Page ID
- 77973
- Comprender las tendencias en las propiedades y la reactividad del grupo 13 elementos.
El grupo 13 es el primer grupo que abarca la línea divisoria entre metales y no metales, por lo que su química es más diversa que la de los grupos 1 y 2, que incluyen solo elementos metálicos. A excepción del elemento más ligero (boro), los elementos del grupo 13 son todos relativamente electropositivos; es decir, tienden a perder electrones en las reacciones químicas en lugar de ganarlos. Si bien el grupo 13 incluye el aluminio, el metal más abundante de la Tierra, ninguno de estos elementos se conocía hasta principios del siglo XIX porque nunca se encuentran en la naturaleza en su estado libre. El boro elemental y el aluminio, los cuales se prepararon primero reduciendo B 2 O 3 y AlCl 3, respectivamente, con potasio, no pudieron prepararse hasta que se aisló el potasio y demostró ser un potente reductor. Indio (In) y talio (Tl) fueron descubiertos en la década de 1860 mediante técnicas espectroscópicas, mucho antes de que estuvieran disponibles métodos para aislarlos. El indio, llamado así por su línea de emisión índigo (azul-violeta profundo), se observó por primera vez en el espectro de los minerales de zinc, mientras que el talio (del tallos griego, que significa “un brote joven y verde de una planta”) recibió el nombre de su línea de emisión verde brillante. El galio (el eka-aluminio de Ga; Mendeleev) fue descubierto en 1875 por el químico francés Paul Émile Lecoq de Boisbaudran durante una búsqueda sistemática del elemento “desaparecido” de Mendeleev en el grupo 13.
Los elementos del grupo 13 nunca se encuentran en la naturaleza en su estado libre.
Preparación y Propiedades Generales del Grupo 13 Elementos
Como reductores, los elementos del grupo 13 son menos potentes que los metales alcalinos y alcalinotérreos. Sin embargo, sus compuestos con oxígeno son termodinámicamente estables y se necesitan grandes cantidades de energía para aislar incluso los dos elementos más accesibles, el boro y el aluminio, de sus minerales de óxido.
Aunque el boro es relativamente raro (es aproximadamente 10,000 veces menos abundante que el aluminio), los depósitos concentrados de bórax [Na 2 B 4 O 5 (OH) 4 ·8H 2 O] se encuentran en antiguos lechos lacustres (Figura\(\PageIndex{1}\)) y fueron utilizados en la antigüedad para hacer vidrio y vidriado de cerámica. El boro se produce a gran escala haciendo reaccionar bórax con ácido para producir ácido bórico [B (OH) 3], que luego se deshidrata al óxido (B 2 O 3). La reducción del óxido con magnesio o sodio da boro amorfo que es solo aproximadamente 95% puro:
\[\mathrm{Na_2B_4O_5(OH)_4\cdot8H_2O(s)}\xrightarrow{\textrm{acid}}\mathrm{B(OH)_3(s)}\xrightarrow{\Delta}\mathrm{B_2O_3(s)} \label{Eq1}\]
\[\mathrm{B_2O_3(s)}+\mathrm{3Mg(s)}\xrightarrow{\Delta}\mathrm{2B(s)}+\mathrm{3MgO(s)} \label{Eq2}\]
Sin embargo, el boro cristalino puro es extremadamente difícil de obtener debido a su alto punto de fusión (2300°C) y la naturaleza altamente corrosiva del boro líquido. Generalmente se prepara reduciendo BCl3 puro con gas hidrógeno a altas temperaturas o por la descomposición térmica de hidruros de boro como el diborano (B 2 H 6):
\[\mathrm{BCl_3(g)}+\frac{3}{2}\mathrm{H_2(g)}\rightarrow\mathrm{B(s)}+\mathrm{3HCl(g)} \label{Eq3}\]
\[B_2H_{6(g)} \rightarrow 2B_{(s)} + 3H_{2(g)} \label{Eq4}\]
La reacción mostrada en la Ecuación\(\ref{Eq3}\) se utiliza para preparar fibras de boro, las cuales son rígidas y ligeras. De ahí que se utilicen como materiales de refuerzo estructural en objetos tan diversos como el transbordador espacial estadounidense y los cuadros de bicicletas ligeras que se utilizan en carreras como el Tour de Francia. El boro también es un componente importante de muchas cerámicas y vidrios de borosilicato resistentes al calor, como Pyrex, que se utiliza para hornos y cristalería de laboratorio.
A diferencia del boro, abundan los depósitos de minerales de aluminio como la bauxita, una forma hidratada de Al 2 O 3. Con una conductividad eléctrica aproximadamente el doble que la del cobre sobre una base de peso por peso, el aluminio se utiliza en más del 90% de las líneas eléctricas aéreas en los Estados Unidos. Sin embargo, debido a que los compuestos de aluminio-oxígeno son estables, obtener metal de aluminio a partir de bauxita es un proceso costoso. El aluminio se extrae de minerales de óxido mediante tratamiento con una base fuerte, lo que produce el complejo de hidróxido soluble [Al (OH) 4] −. La neutralización de la solución resultante con CO 2 gaseoso da como resultado la precipitación de Al (OH) 3:
\[2[Al(OH)_4]^−_{(aq)} + CO_{2(g)} \rightarrow 2Al(OH)_{3(s)} + CO^{2−}_{3(aq)} + H_2O_{(l)} \label{Eq5}\]
La deshidratación térmica de Al (OH) 3 produce Al 2 O 3, y el aluminio metálico se obtiene mediante la reducción electrolítica de Al 2 O 3 usando el proceso Hall—Heroult. Del grupo 13 elementos, solo se utiliza aluminio a gran escala: por ejemplo, cada avión Boeing 777 es aproximadamente 50% de aluminio en masa.
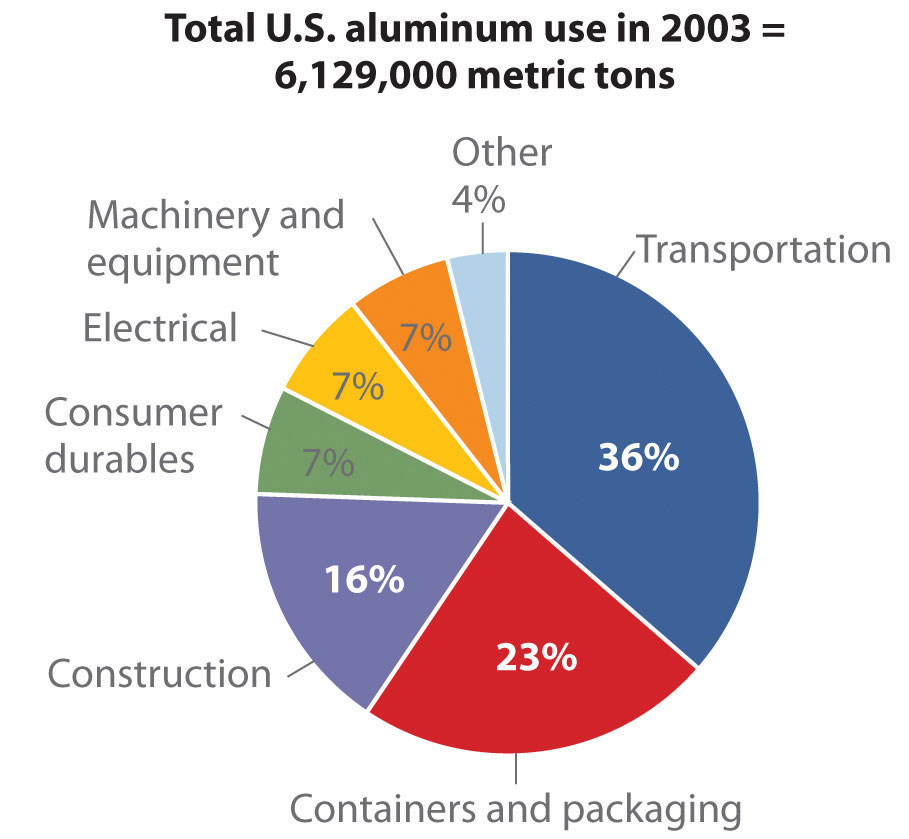
Figura\(\PageIndex{2}\): Fuente: Thomas D. Kelly y Grecia R. Matos, “Historical Statistics for Mineral and Material Commodities in the United States”, US Geological Survey Data Series 140, 2010, accessed July 20, 2011, pubs.usgs.gov/ds/2005/140/.
Los otros miembros del grupo 13 son bastante raros: el galio es aproximadamente 5000 veces menos abundante que el aluminio, y el indio y el talio son aún más escasos. En consecuencia, estos metales generalmente se obtienen como subproductos en el procesamiento de otros metales. Sin embargo, el punto de fusión extremadamente bajo del galio (29.6°C) facilita la separación del aluminio. Debido a su bajo punto de fusión y alto punto de ebullición, el galio se utiliza como líquido en termómetros que tienen un rango de temperatura de casi 2200°C. Indio y talio, el grupo más pesado 13 elementos, se encuentran como trazas de impurezas en minerales de sulfuro de zinc y plomo. El indio se utiliza como sello triturable para dispositivos criogénicos de alto vacío, y sus aleaciones se utilizan como soldaduras de bajo punto de fusión en placas de circuitos electrónicos. El talio, por otro lado, es tan tóxico que el metal y sus compuestos tienen pocos usos. Tanto los óxidos de indio como de talio se liberan en el polvo de combustión cuando los minerales de sulfuro se convierten en óxidos metálicos y SO 2. Hasta hace relativamente poco tiempo, se permitía que estos y otros elementos tóxicos se dispersaran en el aire, creando grandes “zonas muertas” a favor del viento de una fundición. Los polvos de combustión ahora están atrapados y sirven como una fuente relativamente rica de elementos como In y Tl (así como Ge, Cd, Te y As).
Cuadro\(\PageIndex{1}\) resume algunas propiedades importantes del grupo 13 elementos. Observe las grandes diferencias entre el boro y el aluminio en tamaño, energía de ionización, electronegatividad y potencial de reducción estándar, lo cual es consistente con la observación de que el boro se comporta químicamente como un no metal y el aluminio como un metal. Todos los elementos del grupo 13 tienen configuraciones de electrones de valencia ns 2 np 1, y todos tienden a perder sus tres electrones de valencia para formar compuestos en el estado de oxidación +3. Los elementos más pesados del grupo también pueden formar compuestos en el estado de oxidación +1 formados por la pérdida formal del electrón de valencia np único. Debido a que los elementos del grupo 13 generalmente contienen solo seis electrones de valencia en sus compuestos neutros, estos compuestos son todos ácidos de Lewis moderadamente fuertes.
| Propiedad | Boro | Aluminio* | Galio | Indio | Talio |
|---|---|---|---|---|---|
| *Este es el nombre usado en Estados Unidos; el resto del mundo inserta una i extra y la llama aluminio. | |||||
| † La configuración mostrada no incluye subcarcasas d y f rellenas. | |||||
| ‡ Los valores citados son para iones de seis coordenadas en el estado de oxidación más común, excepto para Al 3 +, para lo cual se da el valor para el ion de cuatro coordenadas. El ion B 3 + no es una especie conocida; el radio citado es un valor estimado de cuatro coordenadas. | |||||
| § X es Cl, Br o I. La reacción con F 2 da los trifluoruros (MF 3) para todos los elementos del grupo 13. | |||||
| símbolo atómico | B | Al | Ga | En | Tl |
| número atómico | 5 | 13 | 31 | 49 | 81 |
| masa atómica (amu) | 10.81 | 26.98 | 69.72 | 114.82 | 204.38 |
| configuración de electrones de valencia † | 2s 2 2p 1 | 3s 2 3p 1 | 4s 2 4p 1 | 5s 2 5p 1 | 6s 2 6p 1 |
| punto de fusión/punto de ebullición (°C) | 2075/4000 | 660/2519 | 29.7/2204 | 156.6/2072 | 304/1473 |
| densidad (g/cm 3) a 25°C | 2.34 | 2.70 | 5.91 | 7.31 | 11.8 |
| radio atómico (pm) | 87 | 118 | 136 | 156 | 156 |
| primera energía de ionización (kJ/mol) | 801 | 578 | 579 | 558 | 589 |
| estado de oxidación más común | +3 | +3 | +3 | +3 | +1 |
| radio iónico (pm) ‡ | −25 | 54 | 62 | 80 | 162 |
| afinidad electrónica (kJ/mol) | −27 | −42 | −40 | −39 | −37 |
| electronegatividad | 2.0 | 1.6 | 1.8 | 1.8 | 1.8 |
| potencial de reducción estándar (E°, V) | −0.87 | −1.66 | −0.55 | −0.34 | +0.741 de M 3 + (aq) |
| producto de reacción con O 2 | B 2 O 3 | Al 2 O 3 | Ga 2 O 3 | En 2 O 3 | Tl 2 O |
| tipo de óxido | ácido | anfótera | anfótera | anfótera | básico |
| producto de reacción con N 2 | BN | AlN | GaN | INn | ninguno |
| producto de reacción con X 2 § | BX 3 | Al 2 X 6 | Ga 2 X 6 | En 2 X 6 | TLx |
Los compuestos neutros de los elementos del grupo 13 son deficientes en electrones, por lo que generalmente son ácidos de Lewis moderadamente fuertes.
En contraste con los grupos 1 y 2, los elementos del grupo 13 no muestran tendencias consistentes en energías de ionización, afinidades electrónicas y potenciales de reducción, mientras que las electronegatividades en realidad aumentan del aluminio al talio. Algunas de estas anomalías, especialmente para la serie Ga, In, Tl, pueden explicarse por el aumento en la carga nuclear efectiva (Z eff) que resulta de un blindaje deficiente de la carga nuclear por las subconchas llenas (n − 1) d 10 y (n − 2) f 14. En consecuencia, aunque la carga nuclear real aumenta en 32 a medida que pasamos del indio al talio, el tamizado por las subconchas 5d y 4f llenas es tan pobre que Z eff aumenta significativamente de indio a talio. Así, la primera energía de ionización del talio es en realidad mayor que la del indio.
Las anomalías en las tendencias periódicas entre Ga, In y Tl pueden explicarse por el aumento de la carga nuclear efectiva debido a un blindaje deficiente.
Reacciones y Compuestos del Boro
El boro elemental es un semimetal que es notablemente no reactivo; en contraste, los otros 13 elementos del grupo presentan propiedades metálicas y reactividad. Por lo tanto, consideramos las reacciones y compuestos del boro por separado de los de otros elementos del grupo. Todos los elementos del grupo 13 tienen menos electrones de valencia que los orbitales de valencia, lo que generalmente resulta en enlaces metálicos deslocalizados. Con su alta energía de ionización, baja afinidad electrónica, baja electronegatividad y pequeño tamaño, sin embargo, el boro no forma una red metálica con electrones de valencia deslocalizados. En cambio, el boro forma estructuras únicas e intrincadas que contienen enlaces multicéntricos, en los que un par de electrones mantiene unidos tres o más átomos.
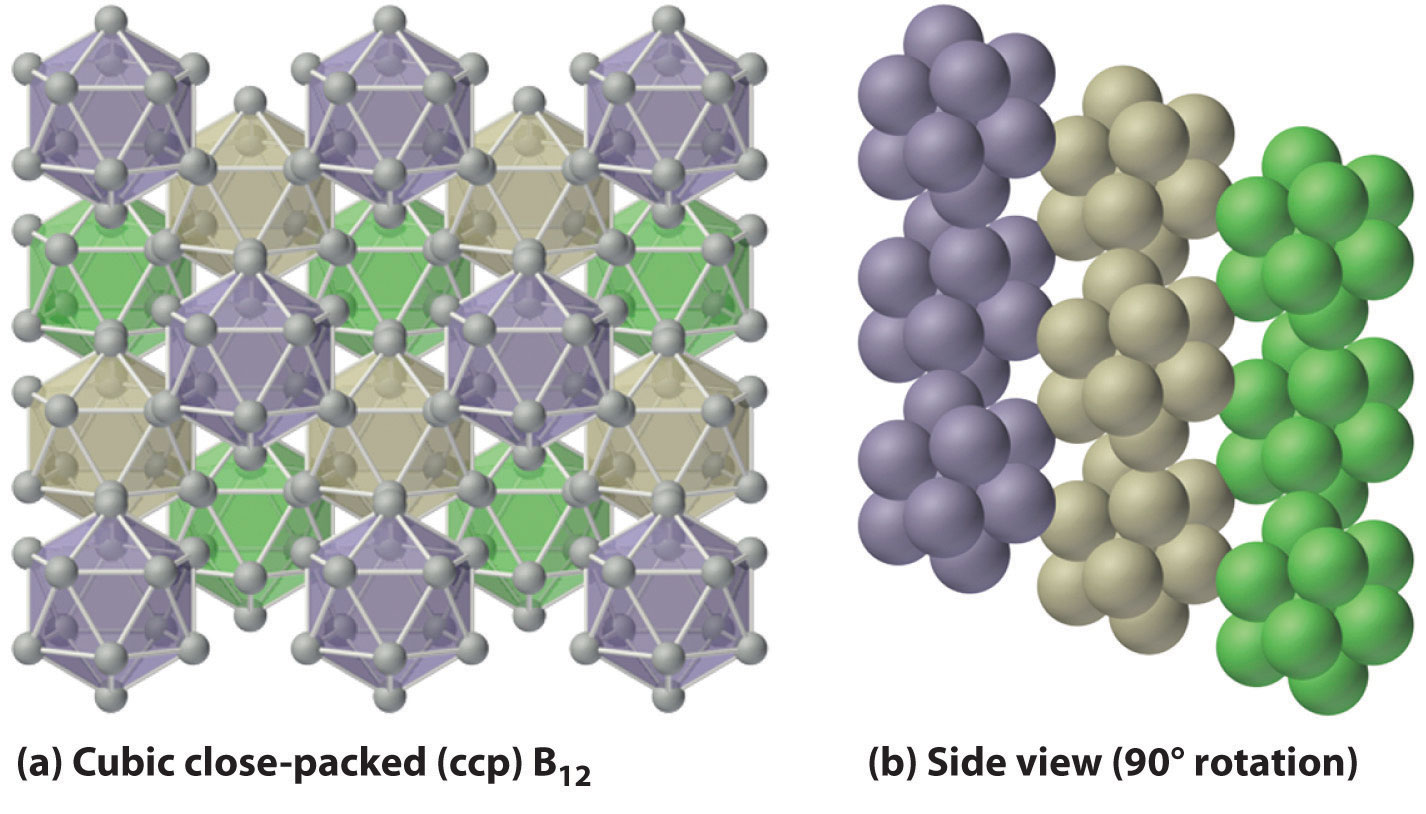
El boro elemental forma enlaces multicéntricos, mientras que el otro grupo 13 elementos exhiben unión metálica.
El componente básico del boro elemental no es el átomo de boro individual, como sería el caso de un metal, sino el icosaedro B 12. Debido a que estos icosaedros no se empaquetan muy bien, la estructura del boro sólido contiene huecos, resultando en su baja densidad (Figura\(\PageIndex{3}\)). El boro elemental puede ser inducido a reaccionar con muchos elementos no metálicos para dar compuestos binarios que tienen una variedad de aplicaciones. Por ejemplo, las placas de carburo de boro (B 4 C) pueden detener una bala perforadora de blindaje calibre 30, sin embargo, pesan 10% — 30% menos que la armadura convencional. Otros compuestos importantes del boro con no metales incluyen el nitruro de boro (BN), que se produce calentando boro con exceso de nitrógeno (Ecuación\(\ref{Eq22.6}\)); óxido de boro (B 2 O 3), que se forma cuando el boro se calienta con exceso de oxígeno (Ecuación\(\ref{Eq22.7}\)); y los trihaluros de boro (BX 3), que se forman calentando boro con exceso de halógeno (Ecuación\(\ref{Eq22.8}\)).
\[\mathrm{2B(s)}+\mathrm{N_2(g)}\xrightarrow{\Delta}\mathrm{2BN(s)} \label{Eq22.6}\]
\[\mathrm{4B(s)} + \mathrm{3O_2(g)}\xrightarrow{\Delta}\mathrm{2B_2O_3(s)}\label{Eq22.7}\]
\[\mathrm{2B(s)} +\mathrm{3X_2(g)}\xrightarrow{\Delta}\mathrm{2BX_3(g)}\label{Eq22.8}\]
Como es típico de los elementos que se encuentran cerca de la línea divisoria entre metales y no metales, muchos compuestos de boro son anfóteros, disolviéndose en ácido o base.El nitruro de boro es similar en muchos aspectos al carbono elemental. Con ocho electrones, la unidad B-N es isoelectrónica con la unidad C—C, y B y N tienen el mismo tamaño promedio y electronegatividad que C. La forma más estable de BN es similar al grafito, conteniendo anillos B 3 N 3 de seis miembros dispuestos en capas. A alta temperatura y presión, el BN hexagonal se convierte en una estructura cúbica similar al diamante, que es una de las sustancias más duras conocidas. El óxido de boro (B 2 O 3) contiene capas de grupos planos trigonales BO 3 (análogos a BX 3) en los que los átomos de oxígeno unen dos átomos de boro. Disuelve muchos óxidos metálicos y no metálicos, incluyendo SiO 2, para dar una amplia gama de vidrios de borosilicato comercialmente importantes. Una pequeña cantidad de CoO da el color azul profundo característico del vidrio “azul cobalto”.

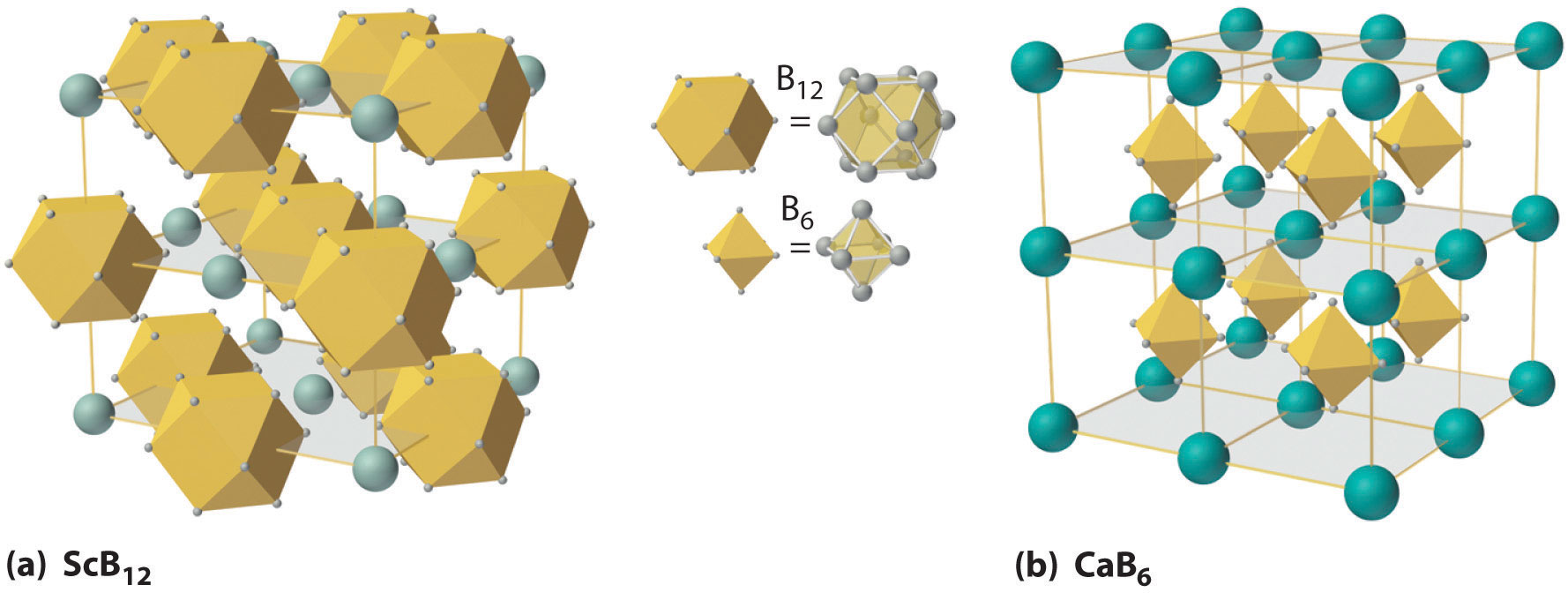
A altas temperaturas, el boro también reacciona con prácticamente todos los metales para dar boruros metálicos que contienen redes tridimensionales regulares, o agrupaciones, de átomos de boro. Las estructuras de dos boruros metálicos, SCB 12 y CaB 6, se muestran en la Figura\(\PageIndex{4}\). Debido a que los boruros ricos en metales como ZrB 2 y TiB 2 son duros y resistentes a la corrosión incluso a altas temperaturas, se utilizan en aplicaciones como palas de turbinas y boquillas de cohetes.
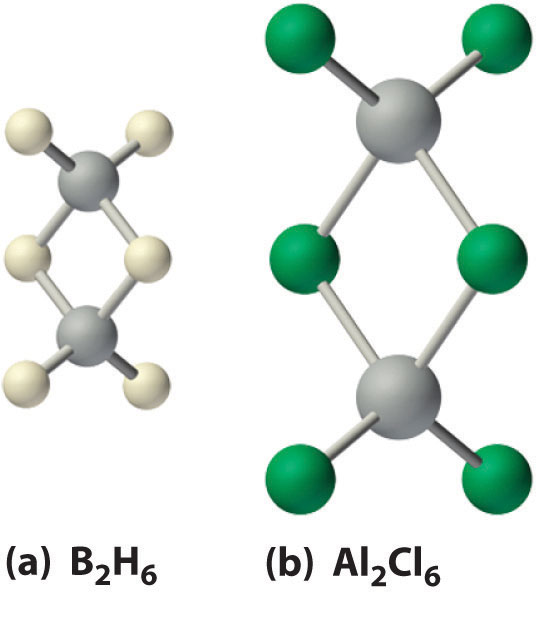
Los hidruros de boro no se descubrieron hasta principios del siglo XX, cuando el químico alemán Alfred Stock emprendió una investigación sistemática de los compuestos binarios de boro e hidrógeno, aunque los hidruros binarios de carbono, nitrógeno, oxígeno y flúor se conocen desde el siglo XVIII. Entre 1912 y 1936, Stock supervisó la preparación de una serie de compuestos de borón-hidrógeno con estructuras sin precedentes que no pudieron explicarse con simples teorías de unión. Todos estos compuestos contienen enlaces multicéntricos. El ejemplo más simple es el diborano (B 2 H 6), que contiene dos átomos de hidrógeno puente (parte (a) en la Figura\(\PageIndex{5}\). Actualmente se conoce una extraordinaria variedad de cúmulos poliédricos de borón-hidrógeno; un ejemplo es el ion B 12 H 12 2−, que tiene una estructura poliédrica similar a la unidad icosaédrica B 12 de boro elemental, con un solo átomo de hidrógeno unido a cada átomo de boro.
Una clase relacionada de cúmulos poliédricos, los carboranos, contienen unidades CH y BH; aquí se muestra un ejemplo. La sustitución de los átomos de hidrógeno unidos al carbono por grupos orgánicos produce sustancias con propiedades novedosas, algunas de las cuales actualmente están siendo investigadas por su uso como cristales líquidos y en quimioterapia contra el cáncer.

La entalpía de combustión del diborano (B 2 H 6) es de −2165 kJ/mol, uno de los valores más altos conocidos:
\[B_2H_{6(g)} + 3O_{2(g)} \rightarrow B_2O_{3(s)} + 3H_2O(l)\;\;\; ΔH_{comb} = −2165\; kJ/mol \label{Eq 22.9}\]
En consecuencia, los militares estadounidenses exploraron el uso de hidruros de boro como combustibles para cohetes en las décadas de 1950 y 1960. Este esfuerzo finalmente se abandonó debido a que los hidruros de boro son inestables, costosos y tóxicos y, lo más importante, B 2 O 3 demostró ser altamente abrasivo para las boquillas de cohetes. Las reacciones llevadas a cabo durante esta investigación, sin embargo, mostraron que los hidruros de boro presentan una reactividad inusual.
Debido a que el boro y el hidrógeno tienen electronegatividades casi idénticas, las reacciones de los hidruros de boro están dictadas por diferencias menores en la distribución de la densidad electrónica en un compuesto dado. En general, se observan dos tipos distintos de reacción: especies ricas en electrones como el ion BH 4 − son reductores, mientras que especies deficientes en electrones como B 2 H 6 actúan como oxidantes.
Para cada reacción, explique por qué se forman los productos dados.
- B 2 H 6 (g) + 3O 2 (g) → B 2 O 3 (s) + 3H 2 O (l)
- BCl 3 (l) + 3H 2 O (l) → B (OH) 3 (ac) + 3HCl (ac)
- \(\mathrm{2BI_3(s)}+\mathrm{3H_2(g)}\xrightarrow{\Delta}\frac{1}{6}\mathrm{B_{12}(s)}+\mathrm{6HI(g)}\)
Dado: ecuaciones químicas balanceadas
Preguntado por: por qué se forman los productos dados
Estrategia:
Clasificar el tipo de reacción. Usando tendencias periódicas en propiedades atómicas, termodinámica y cinética, explicar por qué se forman los productos de reacción.
Solución
- El oxígeno molecular es un oxidante. Si el otro reactivo es un reductor potencial, esperamos que se produzca una reacción redox. Aunque B 2 H 6 contiene boro en su estado de oxidación más alto (+3), también contiene hidrógeno en el estado de oxidación −1 (el ion hidruro). Debido a que el hidruro es un reductor fuerte, probablemente ocurrirá una reacción redox. Esperamos que H − se oxide a H + y O 2 se reduzca a O 2−, pero ¿cuáles son los productos reales? Una suposición razonable es B 2 O 3 y H 2 O, ambos compuestos estables.
- Ni el BCl3 ni el agua son un oxidante o reductor potente, por lo que es poco probable una reacción redox; una reacción de hidrólisis es más probable. Los haluros no metálicos son ácidos y reaccionan con agua para formar una solución del ácido hidrohalogenado y un óxido o hidróxido no metálico. En este caso, el producto que contiene boro más probable es el ácido bórico [B (OH) 3].
- Normalmente esperamos que un trihaluro de boro se comporte como un ácido de Lewis. En este caso, sin embargo, el otro reactivo es hidrógeno elemental, que suele actuar como reductor. Los átomos de yodo en BI 3 están en el estado de oxidación más bajo accesible (−1), y el boro está en el estado de oxidación +3. En consecuencia, podemos escribir una reacción redox en la que se oxida el hidrógeno y se reduce el boro. Debido a que los compuestos de boro en estados de oxidación más bajos son raros, esperamos que el boro se reduzca a boro elemental. Por lo tanto, el otro producto de la reacción debe ser HI.
Predecir los productos de las reacciones y escribir una ecuación química equilibrada para cada reacción.
- \(\mathrm{B_2H_6(g)}+\mathrm{H_2O(l)}\xrightarrow{\Delta}\)
- \(\mathrm{BBr_3(l)}+\mathrm{O_2(g)}\rightarrow\)
- \(\mathrm{B_2O_3(s)}+\mathrm{Ca(s)}\xrightarrow{\Delta}\)
Contestar
- \(\mathrm{B_2H_6(g)}+\mathrm{H_2O(l)}\xrightarrow{\Delta}\mathrm{2B(OH)_3(s)}+\mathrm{6H_2(g)}\)
- \(\mathrm{BBr_3(l)}+\mathrm{O_2(g)}\rightarrow\textrm{no reaction}\)
- \(\mathrm{6B_2O_3(s)}+18\mathrm{Ca(s)}\xrightarrow{\Delta}\mathrm{B_{12}(s)}+\mathrm{18CaO(s)}\)
Reacciones y Compuestos del Grupo Más pesado 13 Elementos
Los cuatro elementos más pesados del grupo 13 (Al, Ga, In y Tl) reaccionan fácilmente con los halógenos para formar compuestos con una estequiometría 1:3:
\[ 2M_{(s)} + 3X_{2(s,l,g)} \rightarrow 2MX_{3(s)} \text{ or } M_2X_6 \label{Eq10}\]
La reacción de Tl con yodo es una excepción: aunque el producto tiene la estequiometría TLi 3, no es yoduro de talio (III), sino más bien un compuesto de talio (I), la sal Tl+ del ion triyoduro (I 3 −). Este compuesto se forma porque el yodo no es un oxidante lo suficientemente potente como para oxidar el talio al estado de oxidación +3.
De los haluros, solo los fluoruros presentan un comportamiento típico de un compuesto iónico: tienen altos puntos de fusión (>950°C) y baja solubilidad en disolventes no polares. En contraste, los tricoridos, tribromuros y triyoduros de aluminio, galio e indio, así como TLCl 3 y TLBr 3, son de carácter más covalente y forman dímeros con puentes halógenos (parte (b) en la Figura\(\PageIndex{4}\)). Aunque la estructura de estos dímeros es similar a la del diborano (B 2 H 6), la unión puede describirse en términos de enlaces de pares de electrones en lugar del enlace deficiente de electrones deslocalizado que se encuentra en el diborano. Los haluros puente son pobres donantes de pares de electrones, por lo que los trihaluros del grupo 13 son potentes ácidos de Lewis que reaccionan fácilmente con bases de Lewis, tales como aminas, para formar un aducto ácido-base de Lewis:
\[Al_2Cl_{6(soln)} + 2(CH_3)_3N_{(soln)} \rightarrow 2(CH_3)_3N:AlCl_{3(soln)} \label{Eq11}\]
En agua, los haluros de los metales del grupo 13 se hidrolizan para producir el hidróxido metálico (\ [M (OH) _3\)):
\[MX_{3(s)} + 3H_2O_{(l)} \rightarrow M(OH)_{3(s)} + 3HX_{(aq)} \label{Eq12}\]
En una reacción relacionada, se utiliza Al 2 (SO 4) 3 para clarificar el agua potable por la precipitación de Al (OH) 3 hidratado, que atrapa partículas. Los haluros de los metales más pesados (In y Tl) son menos reactivos con el agua debido a su menor relación carga-radio. En lugar de formar hidróxidos, se disuelven para formar los iones del complejo metálico hidratado: [M (H 2 O) 6] 3+.
Del grupo 13 haluros, solo los fluoruros se comportan como compuestos iónicos típicos.
Al igual que el boro (Ecuación\(\ref{Eq22.7}\)), todos los elementos más pesados del grupo 13 reaccionan con exceso de oxígeno a temperaturas elevadas para dar el óxido trivalente (M 2 O 3), aunque Tl 2 O 3 es inestable:
\[\mathrm{4M(s)}+\mathrm{3O_2(g)}\xrightarrow{\Delta}\mathrm{2M_2O_3(s)} \label{Eq13}\]
El óxido de aluminio (Al 2 O 3), también conocido como alúmina, es un aislante duro, de alto punto de fusión, químicamente inerte utilizado como cerámica y como abrasivo en papel de lija y pasta de dientes. Reemplazar un pequeño número de iones Al 3 + en alúmina cristalina por iones Cr 3 + forma el rubí de la piedra preciosa, mientras que reemplazar Al 3 + con una mezcla de Fe 2 +, Fe 3 + y Ti 4 + produce zafiros azules. El compuesto de óxido de galio MgGa 2 O 4 da la luz verde brillante familiar a cualquiera que alguna vez haya operado una fotocopiadora xerográfica. Todos los óxidos se disuelven en ácido diluido, pero Al 2 O 3 y Ga 2 O 3 son anfóteros, lo que concuerda con su ubicación a lo largo de la línea diagonal de la tabla periódica, disolviéndose también en base acuosa concentrada para formar soluciones que contienen M (OH) 4 − iones.
Los trihaluros del grupo 13 son potentes ácidos de Lewis que reaccionan con bases de Lewis para formar un aducto ácido-base de Lewis.
Aluminio, galio e indio también reaccionan con el otro grupo 16 elementos (calcógenos) para formar calcogenidos con la estequiometría M 2 Y 3. Sin embargo, debido a que Tl (III) es un oxidante demasiado fuerte para formar un compuesto estable con aniones ricos en electrones como S2 -, Se 2− y Te 2−, el talio forma solo los calcogenuros de talio (I) con la estequiometría Tl 2 Y. Solo el aluminio, como el boro, reacciona directamente con N 2 (a temperaturas muy altas) para dar AlN, que se utiliza en transistores y dispositivos de microondas como disipador de calor no tóxico debido a su estabilidad térmica; GaN e INn se pueden preparar usando otros métodos. Todos los metales, nuevamente excepto Tl, también reaccionan con los elementos más pesados del grupo 15 (pnicogenos) para formar los llamados compuestos III-V, como los GaAs. Se trata de semiconductores, cuyas propiedades electrónicas, como sus huecos de banda, difieren de las que se pueden lograr utilizando elementos del grupo 14 puros o dopados. Por ejemplo, el arseniuro de galio dopado con nitrógeno y fósforo (GaAs 1−x−y P x N y) se utiliza en las pantallas de calculadoras y relojes digitales.
Todos los óxidos del grupo 13 se disuelven en ácido diluido, pero Al 2 O 3 y Ga 2 O 3 son anfóteros.
A diferencia del boro, los elementos más pesados del grupo 13 no reaccionan directamente con el hidrógeno. Solo se conocen los hidruros de aluminio y galio, pero deben prepararse indirectamente; el AlH 3 es un sólido polimérico insoluble que se descompone rápidamente por el agua, mientras que el Gah 3 es inestable a temperatura ambiente.
Complejos de Elementos del Grupo 13
El boro tiene una tendencia relativamente limitada a formar complejos, pero el aluminio, el galio, el indio y, hasta cierto punto, el talio forman muchos complejos. Algunos de los más simples son los iones metálicos hidratados [M (H 2 O) 6 3+], que son ácidos Brønsted-Lowry relativamente fuertes que pueden perder un protón para formar el ion M (H 2 O) 5 (OH) 2+:
\[[M(H_2O)_6]^{3+}_{(aq)} \rightarrow M(H_2O)_5(OH)^{2+}_{(aq)} + H^+_{(aq)} \label{Eq14}\]
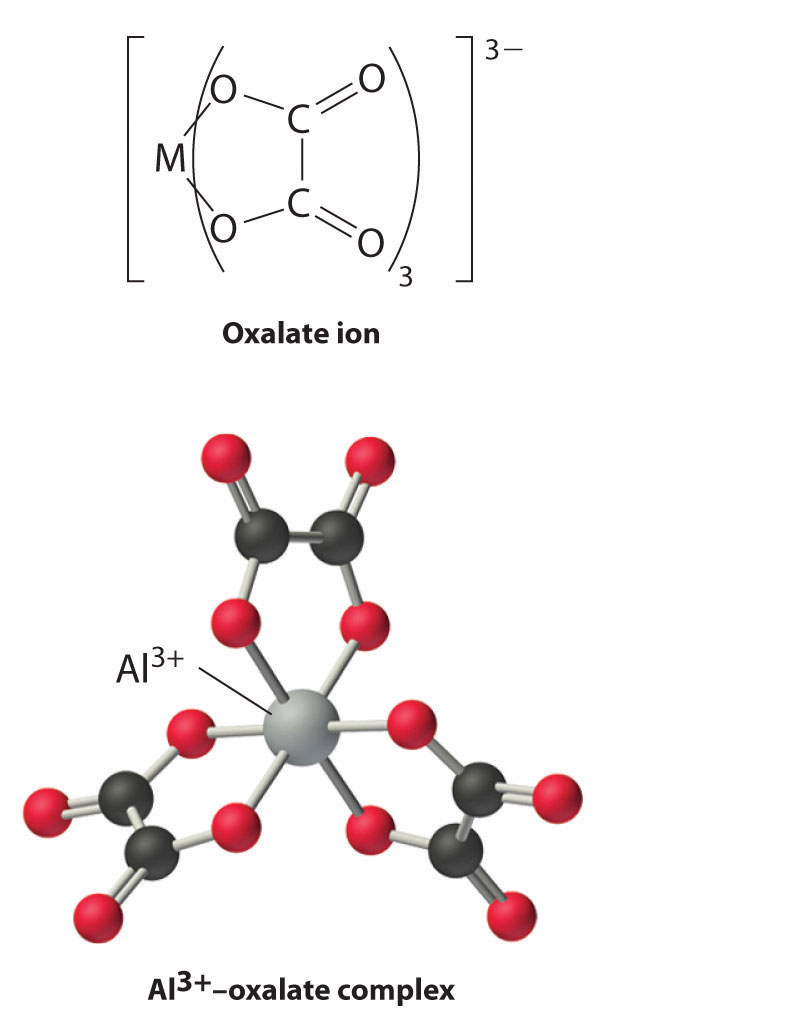
Los iones metálicos del grupo 13 también forman complejos estables con especies que contienen dos o más grupos cargados negativamente, como el ion oxalato. La estabilidad de tales complejos aumenta a medida que aumenta el número de grupos coordinantes proporcionados por el ligando.
Para cada reacción, explique por qué se forman los productos dados.
- \(\mathrm{2Al(s)} + \mathrm{Fe_2O_3(s)}\xrightarrow{\Delta}\mathrm{2Fe(l)} + \mathrm{Al_2O_3(s)}\)
- \(\mathrm{2Ga(s)} + \mathrm{6H_2O(l)}+ \mathrm{2OH^-(aq)}\xrightarrow{\Delta}\mathrm{3H_2(g)} + \mathrm{2Ga(OH)^-_4(aq)}\)
- \(\mathrm{In_2Cl_6(s)}\xrightarrow{\mathrm{H_2O(l)}}\mathrm{2In^{3+}(aq)}+\mathrm{6Cl^-(aq)}\)
Dado: ecuaciones químicas balanceadas
Preguntado por: por qué se forman los productos dados
Estrategia:
Clasificar el tipo de reacción. Usando tendencias periódicas en propiedades atómicas, termodinámica y cinética, explicar por qué se forman los productos de reacción.
Solución
- El aluminio es un metal activo y un potente reductor, y Fe 2 O 3 contiene Fe (III), un oxidante potencial. De ahí que sea probable una reacción redox, produciendo Fe metálico y Al 2 O 3. Debido a que Al es un elemento del grupo principal que se encuentra por encima del Fe, que es un elemento de transición, debería ser un metal más activo que el Fe. Por lo tanto, la reacción debe proceder a la derecha. De hecho, esta es la reacción de la termita, que es tan vigorosa que produce Fe fundido y puede ser utilizada para soldadura.
- El galio se encuentra inmediatamente debajo del aluminio en la tabla periódica y es anfótero, por lo que se disolverá ya sea en ácido o base para producir gas hidrógeno. Debido a que el galio es similar al aluminio en muchas de sus propiedades, predecimos que el galio se disolverá en la base fuerte.
- El carácter metálico del grupo 13 elementos aumenta con el aumento del número atómico. Por lo tanto, el tricloruro de indio debe comportarse como un haluro metálico típico, disolviéndose en agua para formar el catión hidratado.
Predecir los productos de las reacciones y escribir una ecuación química equilibrada para cada reacción.
- LiH (s) + Al 2 Cl 6 (soln) →
- Al 2 O 3 (s) + OH − (aq) →
- Al (s) + N 2 (g)\(\xrightarrow{\Delta}\)
- Ga 2 Cl 6 (soln) + Cl − (soln) →
Contestar
- 8LiH (s) + Al 2 Cl 6 (soln) →2LiAlH 4 (soln) + 6LiCl (s)
- Al 2 O 3 (s) + 2OH − (aq) + 3H 2 O (l) → 2Al (OH) 4 − (aq)
- 2Al (s) + N 2 (g)\(\xrightarrow{\Delta}\) 2AlN (s)
- Ga 2 Cl 6 (soln) + 2Cl − (soln) → 2GaCL 4 − (soln)
Resumen
Los compuestos del grupo 13 elementos con oxígeno son termodinámicamente estables. Muchas de las propiedades anómalas de los elementos del grupo 13 pueden explicarse por el aumento de Z eff que se mueve hacia abajo del grupo. El aislamiento de los elementos del grupo 13 requiere una gran cantidad de energía debido a que los compuestos del grupo 13 elementos con oxígeno son termodinámicamente estables. El boro se comporta químicamente como un no metal, mientras que sus congéneres más pesados exhiben un comportamiento metálico. Muchas de las inconsistencias observadas en las propiedades de los elementos del grupo 13 pueden explicarse por el incremento en Z eff que surge del mal blindaje de la carga nuclear por las subconchas rellenas (n − 1) d 10 y (n − 2) f 14. En lugar de formar una red metálica con electrones de valencia deslocalizados, el boro forma agregados únicos que contienen enlaces multicéntricos, incluyendo boruros metálicos, en los que el boro se une a otros átomos de boro para formar redes tridimensionales o agrupaciones con estructuras geométricas regulares. Todos los compuestos neutros del grupo 13 elementos son deficientes en electrones y se comportan como ácidos de Lewis. Los haluros trivalentes de los elementos más pesados forman dímeros con puentes de halógenos que contienen enlaces de pares de electrones, en lugar de los enlaces deficientes en electrones deslocalizados característicos del diborano. Sus óxidos se disuelven en ácido diluido, aunque los óxidos de aluminio y galio son anfóteros. Ninguno de los elementos del grupo 13 reacciona directamente con el hidrógeno, y la estabilidad de los hidruros preparados por otras vías disminuye a medida que bajamos del grupo. A diferencia del boro, los elementos más pesados del grupo 13 forman un gran número de complejos en el estado de oxidación +3.


