21.2: Los Elementos del Grupo 14
- Page ID
- 77961
- Comprender las tendencias en propiedades y reactividad del grupo 14 elementos.
Los elementos del grupo 14 muestran un mayor rango de comportamiento químico que cualquier otra familia en la tabla periódica. Tres de los cinco elementos —carbono, estaño y plomo— se conocen desde la antigüedad. Por ejemplo, algunos de los escritos más antiguos conocidos son jeroglíficos egipcios escritos en papiro con tinta hecha de negro de humo, un hollín de carbono finamente dividido producido por la combustión incompleta de hidrocarburos (Figura\(\PageIndex{1}\)). El carbón activado es una forma de carbono aún más finamente dividida que se produce a partir de la descomposición térmica de materiales orgánicos, como el aserrín. Debido a que adsorbe muchos compuestos orgánicos y que contienen azufre, el carbón activado se usa para decolorar alimentos, como el azúcar, y para purificar gases y aguas residuales.

Los óxidos y sulfuros de estaño y plomo se reducen fácilmente al metal calentándolos con carbón vegetal, descubrimiento que debió haber ocurrido por accidente cuando los humanos prehistóricos utilizaron rocas que contenían sus minerales para un fuego de cocción. Sin embargo, debido a que los minerales de estaño y cobre a menudo se encuentran juntos en la naturaleza, su aleación, el bronce, probablemente fue descubierta antes de cualquiera de los elementos, un descubrimiento que condujo a la Edad del Bronce. El elemento más pesado del grupo 14, el plomo, es un metal tan blando y maleable que los antiguos romanos usaban láminas delgadas de plomo como tabletas para escribir, así como utensilios de cocina de plomo y tuberías de plomo para plomería. (Recordemos que los símbolos atómicos para estaño y plomo provienen de sus nombres latinos: Sn para stannum y Pb para plumbum.)
Aunque los primeros vidrios se prepararon a partir de sílice (óxido de silicio, SiO 2) alrededor del 1500 a.C., el silicio elemental no se preparó hasta 1824 debido a su alta afinidad por el oxígeno. Jöns Jakob Berzelius finalmente pudo obtener silicio amorfo reduciendo Na 2 SiF 6 con potasio fundido. El elemento cristalino, que tiene un brillo gris azulado brillante, no se aisló hasta 30 años después. El último miembro del grupo 14 elementos por descubrir fue el germanio, el cual fue encontrado en 1886 en un mineral de color plata recién descubierto por el químico alemán Clemens Winkler, quien nombró al elemento en honor a su país natal.
Preparación y Propiedades Generales del Grupo 14 Elementos
La abundancia natural del grupo 14 elementos varía enormemente. El carbono elemental, por ejemplo, ocupa el puesto 17 en la lista de constituyentes de la corteza terrestre. El grafito puro se obtiene haciendo reaccionar coque, una forma amorfa de carbono utilizada como reductor en la producción de acero, con sílice para dar carburo de silicio (SiC). Esto se descompone térmicamente a temperaturas muy altas (2700°C) para dar grafito:
\[\mathrm{SiO_2(s)}+\mathrm{3C(s)}\xrightarrow{\Delta}\mathrm{SiC(s)}+\mathrm{2CO(g)} \label{\(\PageIndex{1}\)}\]
Un alótropo de carbono, el diamante, es metaestable en condiciones normales, con un ΔG° f de 2.9 kJ/mol versus grafito. A presiones mayores a 50,000 atm, sin embargo, se favorece la estructura de diamante y es la forma de carbono más estable. Debido a que la estructura del diamante es más compacta que la del grafito, su densidad es significativamente mayor (3.51 g/cm 3 versus 2.2 g/cm 3). Debido a su alta conductividad térmica, el polvo de diamante se utiliza para transferir calor en dispositivos electrónicos.
Las fuentes más comunes de diamantes en la Tierra son las antiguas pipas volcánicas que contienen una roca llamada kimberlita, una lava que se solidificó rápidamente desde lo profundo de la Tierra. La mayoría de las formaciones de kimberlita, sin embargo, son mucho más nuevas que los diamantes que contienen. De hecho, las cantidades relativas de diferentes isótopos de carbono en el diamante muestran que el diamante es un “fósil” químico y geológico más antiguo que nuestro sistema solar, lo que significa que los diamantes en la Tierra son anteriores a la existencia de nuestro sol. Así, lo más probable es que los diamantes se crearon en el interior de la Tierra a partir de granos primordiales de grafito presentes cuando se formó la Tierra (parte (a\(\PageIndex{2}\)) en la Figura Los diamantes de calidad Gem ahora se pueden producir sintéticamente y tienen características químicas, ópticas y físicas idénticas a las de los diamantes naturales de mayor grado.

Si bien el oxígeno es el elemento más abundante en la Tierra, el siguiente más abundante es el silicio, el siguiente miembro del grupo 14. El silicio puro se obtiene haciendo reaccionar silicio impuro con Cl 2 para dar SiCl 4, seguido de la destilación fraccionada del SiCl 4 impuro y reducción con H2:
Con este método se producen anualmente varios millones de toneladas de silicio. El silicio amorfo que contiene cantidades residuales de hidrógeno se usa en dispositivos fotovoltaicos que convierten la luz en electricidad, y las células solares a base de silicio se utilizan para alimentar calculadoras de bolsillo, barcos y señales de carreteras, donde el acceso a la electricidad por métodos convencionales es difícil o costoso. El silicio ultrapuro y el germanio forman la base de la industria electrónica moderna (parte (b) en la Figura\(\PageIndex{2}\)).
A diferencia del silicio, las concentraciones de germanio y estaño en la corteza terrestre son de solo 1—2 ppm. La concentración de plomo, que es el producto final de la desintegración nuclear de muchos radionucleidos, es de 13 ppm, lo que hace que el plomo sea, con mucho, el más abundante de los 14 elementos del grupo pesado. No se conocen minerales concentrados de germanio; al igual que el indio, el germanio generalmente se recupera de los polvos de combustión obtenidos procesando los minerales de metales como el zinc. Debido a que el germanio es esencialmente transparente a la radiación infrarroja, se usa en dispositivos ópticos.
El estaño y el plomo son metales blandos que son demasiado débiles para aplicaciones estructurales, pero debido a que el estaño es flexible, resistente a la corrosión y no tóxico, se usa como recubrimiento en el envasado de alimentos. Una “lata”, por ejemplo, es en realidad una lata de acero cuyo interior está recubierto con una capa delgada (1—2 µm) de estaño metálico. El estaño también se utiliza en imanes superconductores y aleaciones de bajo punto de fusión, como soldadura y peltre. El plomo puro se obtiene calentando galena (PbS) en aire y reduciendo el óxido (PbO) al metal con carbono, seguido de deposición electrolítica para aumentar la pureza:
\[\mathrm{PbS(s)}+\frac{3}{2}\mathrm{O_2(g)}\xrightarrow{\Delta}\mathrm{PbO(s)}+\mathrm{SO_2(g)} \label{\(\PageIndex{4}\)}\]
o
Con mucho, el mayor uso de plomo es en las baterías de almacenamiento de plomo. Todos los elementos del grupo 14 tienen configuraciones de electrones de valencia ns 2 np 2. Todos forman compuestos en los que pierden formalmente los dos electrones de valencia np y los dos ns o solo los dos electrones de valencia np, dando un estado de oxidación +4 o +2, respectivamente. Debido a que los enlaces covalentes disminuyen en fuerza al aumentar el tamaño atómico y las energías de ionización para los elementos más pesados del grupo son mayores de lo esperado debido a un mayor efecto Z, la estabilidad relativa del estado de oxidación +2 aumenta suavemente de carbono a plomo.
La estabilidad relativa del estado de oxidación +2 aumenta, y la tendencia a formar compuestos catenados disminuye, de carbono a plomo en el grupo 14.
Recordemos que muchos compuestos de carbono contienen múltiples enlaces formados por un solapamiento π de orbitales 2p ocupados individualmente en átomos adyacentes. Los compuestos de silicio, germanio, estaño y plomo con la misma estequiometría que los del carbono, sin embargo, tienden a tener diferentes estructuras y propiedades. Por ejemplo, el CO 2 es un gas que contiene moléculas discretas de O=C=O, mientras que la forma más común de SiO 2 es el sólido de alto punto de fusión conocido como cuarzo, el componente principal de la arena. En lugar de moléculas discretas de SiO 2, el cuarzo contiene una red tridimensional de átomos de silicio que es similar a la estructura del diamante pero con un átomo de oxígeno insertado entre cada par de átomos de silicio. Así, cada átomo de silicio está unido a otros cuatro átomos de silicio mediante el puente de átomos de oxígeno.
La tendencia a catenar, a formar cadenas de átomos similares, disminuye rápidamente a medida que bajamos del grupo 14 porque las energías de enlace para los enlaces E—E y E—H disminuyen con el aumento del número atómico (donde E es cualquier elemento del grupo 14). En consecuencia, insertar un grupo CH 2 en un hidrocarburo lineal como el n-hexano es exergónico (ΔG° = −45 kJ/mol), mientras que insertar un grupo SiH 2 en el análogo de silicio del n-hexano (Si 6 H 14) realmente cuesta energía (ΔG° ≈ +25 kJ/mol). Como resultado de esta tendencia, la estabilidad térmica de los compuestos catenados disminuye rápidamente de carbono a plomo.
En la Tabla\(\PageIndex{1}\) “Propiedades Seleccionadas del Grupo 14 Elementos” vemos, una vez más, que existe una gran diferencia entre el elemento más ligero (C) y los demás en tamaño, energía de ionización y electronegatividad. Al igual que en el grupo 13, los elementos segundo y tercero (Si y Ge) son similares, y hay una inversión en las tendencias para algunas propiedades, como la energía de ionización, entre el cuarto y quinto elementos (Sn y Pb). En cuanto al grupo 13, estos efectos pueden explicarse por la presencia de subcáscaras rellenas (n − 1) d y (n − 2) f, cuyos electrones son relativamente pobres en el cribado de los electrones más externos de la carga nuclear superior.
| Propiedad | Carbono | Silicio | Germanio | Estaño | Plomo |
|---|---|---|---|---|---|
| *La configuración mostrada no incluye subcarcasas d y f rellenas. | |||||
| † Los valores citados son para iones de seis coordenadas +4 en el estado de oxidación más común, excepto para C 4 + y Si 4 +, para lo cual se estiman valores para el ion de cuatro coordenadas. | |||||
| ‡ X es Cl, Br o I. La reacción con F 2 da los tetrafluoruros (EF 4) para todos los elementos del grupo 14, donde E representa cualquier elemento del grupo 14. | |||||
| símbolo atómico | C | Si | Ge | Sn | Pb |
| número atómico | 6 | 14 | 32 | 50 | 82 |
| masa atómica (amu) | 12.01 | 28.09 | 72.64 | 118.71 | 207.2 |
| configuración de electrones de valencia | 2s 2 2p 2 | 3s 2 3p 2 | 4s 2 4p 2 | 5s 2 5p 2 | 6s 2 6p 2 |
| punto de fusión/punto de ebullición (°C) | 4489 (a 10.3 MPa) /3825 | 1414/3265 | 939/2833 | 232/2602 | 327/1749 |
| densidad (g/cm 3) a 25°C | 2.2 (grafito), 3.51 (diamante) | 2.33 | 5.32 | 7.27 (blanco) | 11.30 |
| radio atómico (pm) | 77 (diamante) | 111 | 125 | 145 | 154 |
| primera energía de ionización (kJ/mol) | 1087 | 787 | 762 | 709 | 716 |
| estado de oxidación más común | +4 | +4 | +4 | +4 | +4 |
| radio iónico (pm) † | ≈29 | ≈40 | 53 | 69 | 77.5 |
| afinidad electrónica (kJ/mol) | −122 | −134 | −119 | −107 | −35 |
| electronegatividad | 2.6 | 1.9 | 2.0 | 2.0 | 1.8 |
| potencial de reducción estándar (E°, V) (para EO 2 → E en solución ácida) | 0.21 | −0.86 | −0.18 | −0.12 | 0.79 |
| producto de reacción con O 2 | CO 2, CO | SiO 2 | GeO 2 | SnO | PbO |
| tipo de óxido | ácido (CO 2) | ácido neutro (CO) | anfótero | anfótero | anfótero |
| producto de reacción con N 2 | ninguno | Si 3 N 4 | ninguno | Sn 3 N 4 | ninguno |
| producto de reacción con X 2 ‡ | CX 4 | SiX 4 | GeX 4 | SNx 4 | PBx 2 |
| producto de reacción con H 2 | CH 4 | ninguno | ninguno | ninguno | ninguno |
Los elementos del grupo 14 siguen el mismo patrón que los elementos del grupo 13 en sus propiedades periódicas.
Reacciones y Compuestos de Carbono
El carbono es el componente básico de todos los compuestos orgánicos, incluyendo biomoléculas, combustibles, productos farmacéuticos y plásticos, mientras que los compuestos inorgánicos del carbono incluyen carbonatos metálicos, que se encuentran en sustancias tan diversas como fertilizantes y tabletas antiácidas, haluros, óxidos, carburos y carboranos. Al igual que el boro en el grupo 13, la química del carbono difiere suficientemente de la de sus congéneres más pesados como para merecer una discusión separada.
Las estructuras de los alótropos del carbono —diamante, grafito, fullerenos y nanotubos— son distintas, pero todas contienen enlaces simples de pares de electrones (Figura 7.18). Si bien originalmente se creía que los fullerenos eran una nueva forma de carbono que solo se podía preparar en el laboratorio, los fullerenos se han encontrado en ciertos tipos de meteoritos. Otro posible alótropo de carbono también se ha detectado en fragmentos de impacto de un meteorito rico en carbono; parece consistir en largas cadenas de átomos de carbono unidas por enlaces simples y triples alternantes, (—C=C—C=C—) n. Los nanotubos de carbono (“buckytubes”) están siendo estudiados como bloques de construcción potenciales para detectores ultramicroscales y computadoras moleculares y como anclajes para estaciones espaciales. Actualmente se utilizan en dispositivos electrónicos, como las puntas eléctricamente conductoras de pistolas de electrones en miniatura para pantallas planas en computadoras portátiles.
Aunque todos los tetrahaluros de carbono (CX 4) son conocidos, generalmente no se obtienen por la reacción directa del carbono con los halógenos elementales (X2) sino por métodos indirectos como la siguiente reacción, donde X es Cl o Br:
\[CH_{4(g)} + 4X_{2(g)} \rightarrow CX_{4(l,s)} + 4HX_{(g)} \label{\(\PageIndex{7}\)}\]
Todos los tetrahaluros de carbono tienen la geometría tetraédrica predicha por el modelo de repulsión de pares de electrones de capa de valencia (VSEPR), como se muestra para CCl 4 y CI 4. Su estabilidad disminuye rápidamente a medida que el halógeno aumenta de tamaño debido a la mala superposición orbital y al aumento del hacinamiento. Debido a que el enlace C-F es aproximadamente 25% más fuerte que un enlace C-H, los fluorocarbonos son térmica y químicamente más estables que los hidrocarburos correspondientes, a la vez que tienen un carácter hidrófobo similar. Un polímero de tetrafluoroetileno (F 2 C=CF 2), análogo al polietileno, es el forro de teflón antiadherente que se encuentra en muchas sartenes de cocina, y se utilizan compuestos similares para hacer telas resistentes a las manchas (como Scotch-Gard) o impermeables pero transpirables (como Gore-Tex).
La estabilidad de los tetrahaluros de carbono disminuye con el aumento del tamaño del halógeno debido a la creciente superposición orbital y hacinamiento.
El carbono reacciona con el oxígeno para formar CO o CO 2, dependiendo de la estequiometría. El monóxido de carbono es un gas incoloro, inodoro y venenoso que reacciona con el hierro de la hemoglobina para formar una unidad de Fe-Co, lo que evita que la hemoglobina se una, transporte y libere oxígeno en la sangre (ver Figura 23.26). En el laboratorio, el monóxido de carbono se puede preparar a pequeña escala deshidratando ácido fórmico con ácido sulfúrico concentrado:
El monóxido de carbono también reacciona con los halógenos para formar los oxohalidos (COX 2). Probablemente el más conocido de estos es el fosgeno (Cl 2 C=O), que es altamente venenoso y fue utilizado como arma química durante la Primera Guerra Mundial:
A pesar de su toxicidad, el fosgeno es un importante químico industrial que se prepara a gran escala, principalmente en la fabricación de poliuretanos.
El dióxido de carbono se puede preparar a pequeña escala haciendo reaccionar casi cualquier sal de carbonato o bicarbonato metálico con un ácido fuerte. Como es típico de un óxido no metálico, el CO 2 reacciona con el agua para formar soluciones ácidas que contienen ácido carbónico (H 2 CO 3). A diferencia de sus reacciones con el oxígeno, la reacción del carbono con azufre a altas temperaturas produce solo disulfuro de carbono (CS 2):
También se conoce el análogo de selenio CsE 2. Ambos tienen la estructura lineal predicha por el modelo VSEPR, y ambos son líquidos volátiles de olor vil (y en el caso de CsE 2, altamente tóxicos). Los análogos de azufre y selenio del monóxido de carbono, CS y CsE, son inestables debido a que los enlaces C=Y (Y es S o Se) son mucho más débiles que el enlace C=O debido a una superposición orbital π más pobre.
\(\pi\)los enlaces entre el carbono y los calcogenidos más pesados son débiles debido a la mala superposición orbital.
Los compuestos binarios de carbono con menos elementos electronegativos se denominan carburos. Las propiedades químicas y físicas de los carburos dependen fuertemente de la identidad del segundo elemento, dando como resultado tres clases generales: carburos iónicos, carburos intersticiales y carburos covalentes. La reacción del carbono a altas temperaturas con metales electropositivos como los de los grupos 1 y 2 y el aluminio produce carburos iónicos, los cuales contienen cationes metálicos discretos y aniones de carbono. La identidad de los aniones depende del tamaño del segundo elemento. Por ejemplo, elementos más pequeños como el berilio y el aluminio dan metidos como Be 2 C y Al 4 C 3, que contienen formalmente el ion C 4− derivado del metano (CH 4) al perder los cuatro átomos de H como protones. En contraste, metales más grandes como el sodio y el calcio dan carburos con estequiometrías de Na 2 C 2 y CaC 2. Debido a que estos carburos contienen el ion C4−, que se deriva del acetileno (HC=CH) al perder tanto átomos de H como protones, se les llama más propiamente acetilidas. La reacción de carburos iónicos con ácido acuoso diluido da como resultado la protonación de los aniones para dar los hidrocarburos parentales: CH 4 o C 2 H 2. Durante muchos años, las lámparas de los mineros utilizaron la reacción del carburo de calcio con el agua para producir un suministro constante de acetileno, que se encendió para proporcionar una linterna portátil.

La reacción del carbono con la mayoría de los metales de transición a altas temperaturas produce carburos intersticiales. Debido a la naturaleza menos electropositiva de los metales de transición, estos carburos contienen interacciones covalentes metal-carbono, lo que resulta en diferentes propiedades: la mayoría de los carburos intersticiales son buenos conductores de electricidad, tienen altos puntos de fusión y se encuentran entre las sustancias más duras conocidas. Los carburos intersticiales exhiben una variedad de composiciones nominales, y a menudo son compuestos no estequiométricos cuyo contenido de carbono puede variar en un amplio rango. Entre los más importantes se encuentran el carburo de tungsteno (WC), que se utiliza industrialmente en herramientas de corte de alta velocidad, y la cementita (Fe 3 C), que es un componente importante del acero.
Elementos con una electronegatividad similar a la del carbono forman carburos covalentes, como el carburo de silicio (SiC; Ecuación\(\ref{Eq1}\)) y el carburo de boro (B 4 C). Estas sustancias son extremadamente duras, tienen altos puntos de fusión y son químicamente inertes. Por ejemplo, el carburo de silicio es altamente resistente al ataque químico a temperaturas tan altas como 1600°C. Debido a que también mantiene su resistencia a altas temperaturas, el carburo de silicio se utiliza en elementos calefactores para hornos eléctricos y en resistencias de temperatura variable.
Los carburos formados a partir de los elementos del grupo 1 y 2 son iónicos. Los metales de transición forman carburos intersticiales con interacciones covalentes metal-carbono, y los carburos covalentes son químicamente inertes.
Para cada reacción, explique por qué se forma el producto dado.
- CO (g) + Cl 2 (g) → Cl 2 C=O (g)
- CO (g) + BF 3 (g) → F 3 B:C≡ O (g)
- Sr (s) + 2C (s)\(\xrightarrow{\Delta}\) Src 2 (s)
Dado: ecuaciones químicas balanceadas
Preguntado por: por qué se forman los productos dados
Estrategia:
Clasificar el tipo de reacción. Usando tendencias periódicas en propiedades atómicas, termodinámica y cinética, explicar por qué se forman los productos de reacción observados.
Solución
- Debido a que el carbono en CO está en un estado de oxidación intermedia (+2), el CO puede ser un reductor o un oxidante; también es una base de Lewis. El otro reactivo (Cl 2) es un oxidante, por lo que esperamos que ocurra una reacción redox en la que el carbono del CO se oxida adicionalmente. Debido a que Cl 2 es un oxidante de dos electrones y el átomo de carbono del CO puede ser oxidado por dos electrones al estado de oxidación +4, el producto es fosgeno (Cl 2 C=O).
- A diferencia de Cl 2, BF 3 no es un buen oxidante, a pesar de que contiene boro en su estado de oxidación más alto (+3). Tampoco puede BF 3 comportarse como un reductor. Como cualquier otra especie con sólo seis electrones de valencia, sin embargo, sin duda es un ácido de Lewis. De ahí que una reacción ácido-base sea la alternativa más probable, especialmente porque sabemos que el CO puede usar el par solitario de electrones en el carbono para actuar como una base de Lewis. La reacción más probable es, por lo tanto, la formación de un aducto ácido-base de Lewis.
- Típicamente, ambos reactivos se comportan como reductores. A menos que uno de ellos también pueda comportarse como un oxidante, no ocurrirá ninguna reacción. Sabemos que Sr es un metal activo porque se encuentra muy a la izquierda en la tabla periódica y que es más electropositivo que el carbono. El carbono es un no metal con una electronegatividad significativamente mayor; por lo tanto, es más probable que acepte electrones en una reacción redox. Concluimos, por lo tanto, que Sr se oxidará, y el C se reducirá. El carbono forma carburos iónicos con metales activos, por lo que la reacción producirá una especie que contenga formalmente C 4− o C 2 2−. Aquellos que contienen C 4− generalmente involucran iones metálicos pequeños y altamente cargados, por lo que Sr 2 + producirá el acetiluro (SrC 2) en su lugar.
Predecir los productos de las reacciones y escribir una ecuación química equilibrada para cada reacción.
- C (s) + exceso O 2 (g)\(\xrightarrow{\Delta}\)
- C (s) + H 2 O (l) →
- NaHCO 3 (s) + H 2 SO 4 (aq) →
Contestar
- C (s) + exceso O 2 (g)\(\xrightarrow{\Delta}\) CO 2 (g)
- C (s) + H 2 O (l) → sin reacción
- NaHCO 3 (s) + H 2 SO 4 (aq) → CO 2 (g) + NaHSO 4 (aq) + H 2 O (l)
Reacciones y compuestos del grupo más pesado 14 elementos
Aunque el silicio, germanio, estaño y plomo en sus estados de oxidación +4 a menudo forman compuestos binarios con la misma estequiometría que el carbono, las estructuras y propiedades de estos compuestos suelen ser significativamente diferentes de las de los análogos de carbono. El silicio y el germanio son semiconductores con estructuras análogas al diamante. El estaño tiene dos alótropos comunes: el estaño blanco (β) tiene una celosía metálica y propiedades metálicas, mientras que el estaño gris (α) tiene una estructura similar al diamante y es un semiconductor. La forma β metálica es estable por encima de 13.2°C, y la forma α no metálica es estable por debajo de 13.2°C. El plomo es el único elemento del grupo 14 que es metálico tanto en estructura como en propiedades bajo todas las condiciones.
Con base en su posición en la tabla periódica, esperamos que el silicio sea anfótero. De hecho, se disuelve en base acuosa fuerte para producir gas hidrógeno y soluciones de silicatos, pero el único ácido acuoso con el que reacciona es el ácido fluorhídrico, presumiblemente debido a la formación del ión SiF 6 2− estable. El germanio es más metálico en su comportamiento que el silicio. Por ejemplo, se disuelve en ácidos oxidantes calientes, como HNO 3 y H 2 SO 4, pero en ausencia de oxidante, no se disuelve en base acuosa. Si bien el estaño tiene un carácter aún más metálico que el germanio, el plomo es el único elemento del grupo que se comporta puramente como metal. Los ácidos no lo atacan fácilmente porque el sólido adquiere una fina capa protectora externa de una sal Pb 2 +, como PbSO 4.
Todos los dicloruros del grupo 14 son conocidos, y su estabilidad aumenta dramáticamente a medida que aumenta el número atómico del átomo central. Así, CCl 2 es diclorocarbeno, un intermedio altamente reactivo y de corta duración que se puede preparar en solución pero que no se puede aislar en forma pura usando técnicas estándar; el SiCl 2 se puede aislar a temperaturas muy bajas, pero se descompone rápidamente por encima de -150°C, y GeCl 2 es relativamente estable a temperaturas inferiores a 20°C. En contraste, SnCl 2 es un sólido polimérico que es indefinidamente estable a temperatura ambiente, mientras que PbCl 2 es un sólido cristalino insoluble con una estructura similar a la del SnCl 2.
La estabilidad de los dicloruros del grupo 14 aumenta dramáticamente de carbono a plomo.
Aunque los primeros cuatro elementos del grupo 14 forman tetrahaluros (MX 4) con todos los halógenos, solo el flúor es capaz de oxidar el plomo al estado de oxidación +4, dando PbF 4. Los tetrahaluros de silicio y germanio reaccionan rápidamente con el agua para dar óxidos anfóteros (donde M es Si o Ge):
\[MX_{4(s,l)} + 2H_2O_{(l)} \rightarrow MO_{2(s)} + 4HX_{(aq)} \label{\(\PageIndex{1}\)1}\]
En contraste, los tetrahaluros de estaño y plomo reaccionan con el agua para dar iones metálicos hidratados. Debido a la estabilidad de su estado de oxidación +2, el plomo reacciona con oxígeno o azufre para formar PbO o PbS, respectivamente, mientras que calentar los otros elementos del grupo 14 con exceso de O 2 o S 8 da los correspondientes dióxidos o disulfuros, respectivamente. Los dióxidos del grupo 14 elementos se vuelven cada vez más básicos a medida que bajamos del grupo.
Los dióxidos del grupo 14 elementos se vuelven cada vez más básicos en el grupo.
Debido a que el enlace Si—O es aún más fuerte que el enlace C-O (~452 kJ/mol frente a ~358 kJ/mol), el silicio tiene una fuerte afinidad por el oxígeno. Las fuerzas relativas de los enlaces C—O y Si—O contradicen la generalización de que las fuerzas de enlace disminuyen a medida que los átomos unidos se hacen más grandes. Esto se debe a que hasta ahora hemos asumido que un enlace sencillo formal entre dos átomos siempre se puede describir en términos de un solo par de electrones compartidos. En el caso de los enlaces Si-O, sin embargo, la presencia de orbitales d vacíos de energía relativamente baja en pares de electrones Si y no enlazantes en los orbitales híbridos p o sp n de O da como resultado un enlace π parcial (Figura\(\PageIndex{3}\)). Debido a su carácter de doble enlace π parcial, el enlace Si—O es significativamente más fuerte y más corto de lo que se esperaría de otra manera. Una interacción similar con el oxígeno también es una característica importante de la química de los elementos que siguen al silicio en el tercer período (P, S y Cl). Debido a que el enlace Si—O es inusualmente fuerte, los compuestos de silicio-oxígeno dominan la química del silicio.
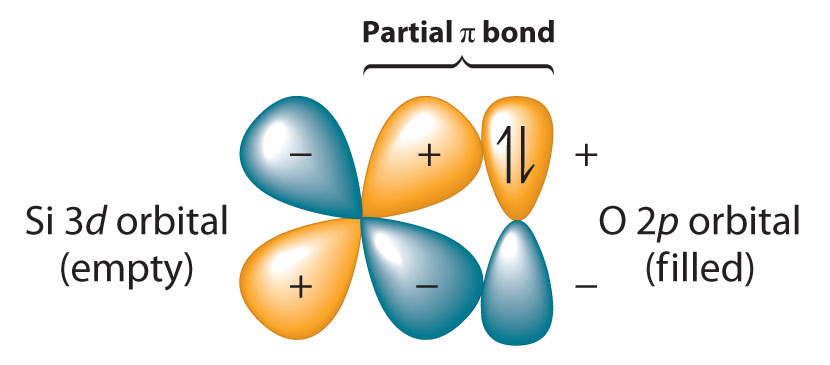
Debido a que los enlaces silicio-oxígeno son inusualmente fuertes, los compuestos de silicio-oxígeno dominan la química del silicio.
Los compuestos con aniones que contienen solo silicio y oxígeno se denominan silicatos, cuyo bloque básico es la unidad SiO 4 4−:
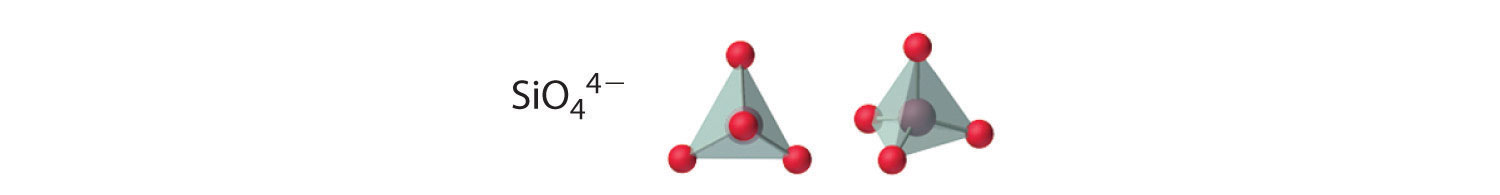
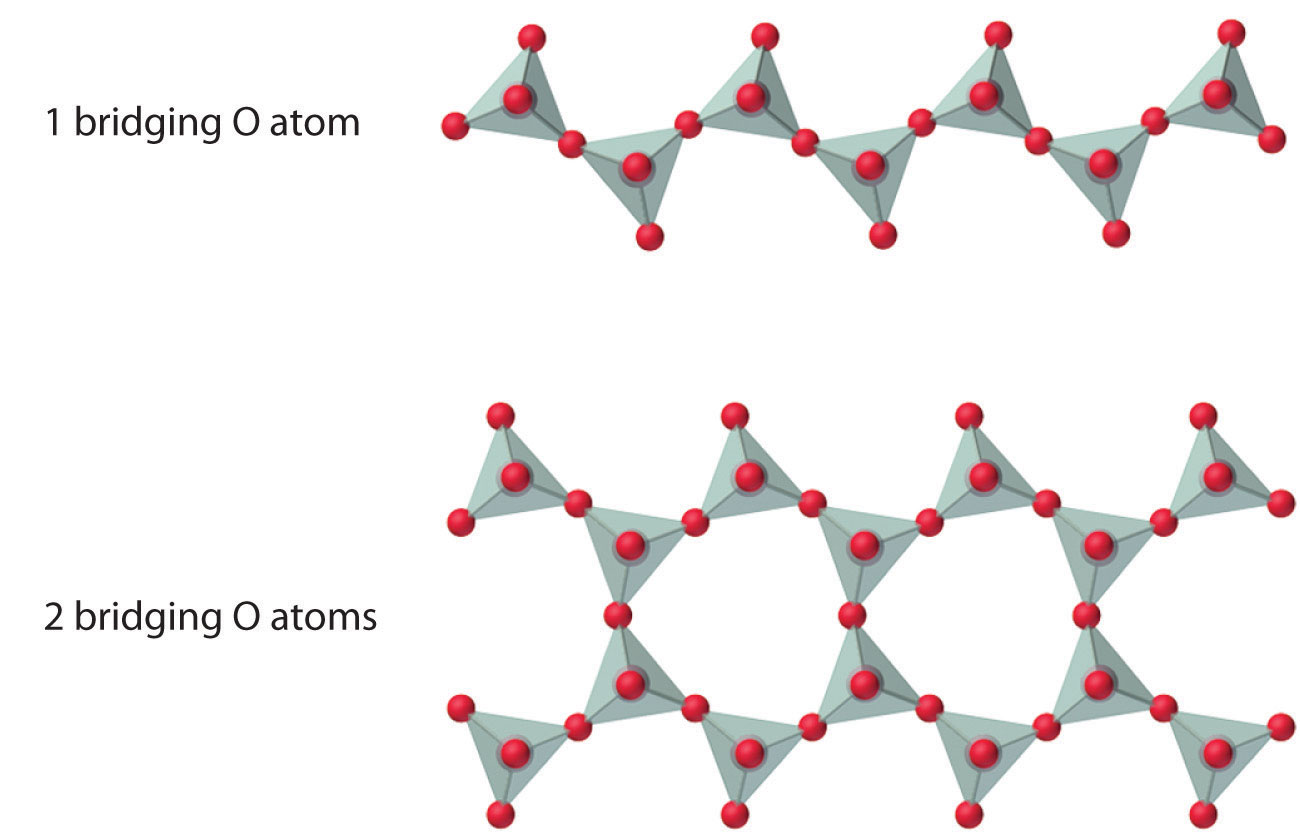
El número de átomos de oxígeno compartidos entre los átomos de silicio y la forma en que se enlazan las unidades varían considerablemente en diferentes silicatos. Convertir uno de los átomos de oxígeno de terminal a puente genera cadenas de silicatos, mientras que convertir dos átomos de oxígeno de terminal a puente genera cadenas dobles. Por el contrario, la conversión de tres o cuatro oxígenos en puentes genera una variedad de estructuras complejas en capas y tridimensionales, respectivamente.
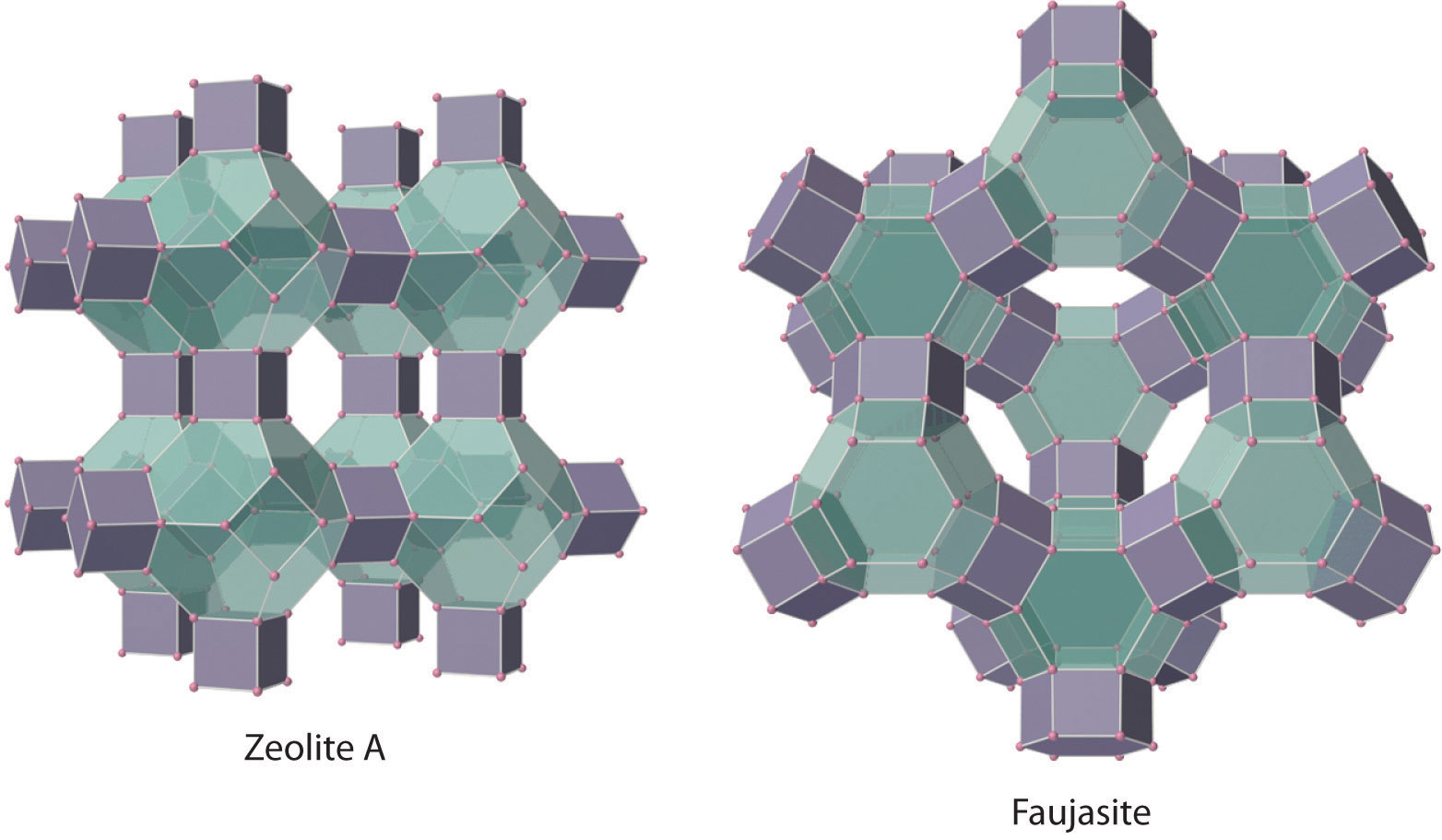
En una clase grande e importante de materiales llamados aluminosilicatos, algunos de los átomos de Si son reemplazados por átomos de Al para dar aluminosilicatos como las zeolitas, cuyas estructuras estructurales tridimensionales tienen grandes cavidades conectadas por túneles más pequeños (Figura\(\PageIndex{4}\)). Debido a que los cationes en las zeolitas se intercambian fácilmente, las zeolitas se utilizan en detergentes para lavado de ropa como agentes suavizantes del agua: los iones Na + unidos más flojamente dentro de las cavidades de la zeolita son desplazados por los iones Mg 2 + y Ca 2 + con mayor carga presentes en el agua dura, que se unen con más fuerza. Las zeolitas también se utilizan como catalizadores y para la purificación del agua.
El silicio y el germanio reaccionan con nitrógeno a alta temperatura para formar nitruros (M 3 N 4):
\[ 3Si_{(l)} + 2N_{2(g)} \rightarrow Si_3N_{4(s)} \label{\(\PageIndex{1}\)2}\]
El nitruro de silicio tiene propiedades que lo hacen adecuado para aplicaciones de ingeniería de alta temperatura: es fuerte, muy duro y químicamente inerte, y conserva estas propiedades a temperaturas de aproximadamente 1000°C.
Debido a la relación diagonal entre boro y silicio, los siliciuros metálicos y los boruros metálicos presentan muchas similitudes. Si bien los siliciuros metálicos tienen estructuras tan complejas como las de los boruros y carburos metálicos, pocos siliciuros son estructuralmente similares a los boruros correspondientes debido al tamaño significativamente mayor del Si (radio atómico 111pm versus 87 pm para B). Los siliciuros de metales activos, como Mg 2 Si, son compuestos iónicos que contienen el ion Si 4−. Reaccionan con ácido acuoso para formar hidruros de silicio tales como SiH 4:
\[Mg_2Si_{(s)} + 4H^+_{(aq)} \rightarrow 2Mg^{2+}_{(aq)} + SiH_{4(g)} \label{\(\PageIndex{1}\)3}\]
A diferencia del carbono, los hidruros de silicio catenados se vuelven termodinámicamente menos estables a medida que la cadena se alarga. Así, se conocen silanos de cadena lineal y ramificada (análogos a alcanos) hasta solo n = 10; los análogos de germanio (germanos) se conocen hasta n = 9. En contraste, el único hidruro de estaño conocido es SnH 4, y se descompone lentamente a Sn elemental y H 2 a temperatura ambiente. El hidruro de plomo más simple (PbH 4) es tan inestable que los químicos ni siquiera están seguros de que existe. Debido a que los enlaces E=E y E=E se vuelven más débiles al aumentar el número atómico (donde E es cualquier elemento del grupo 14), los análogos simples de silicio, germanio y estaño de alquenos, alquinos e hidrocarburos aromáticos son inestables (Si=Si y Ge=Ge) o desconocidos. Por lo tanto, es probable que las formas de vida basadas en silicio solo se encuentren en la ciencia ficción.
La estabilidad de los hidruros del grupo 14 disminuye en el grupo, y los enlaces E=E y E=E se vuelven más débiles.
Los únicos derivados orgánicos importantes del plomo son compuestos como el tetraetilplomo [(CH 3 CH 2) 4 Pb]. Debido a que el enlace Pb-C es débil, estos compuestos se descomponen a temperaturas relativamente bajas para producir radicales alquilo (R·), que pueden usarse para controlar la velocidad de las reacciones de combustión. Durante 60 años, cientos de miles de toneladas de plomo se quemaron anualmente en motores de automóviles, produciendo una niebla de partículas de óxido de plomo a lo largo de las carreteras que constituían un problema de salud pública potencialmente grave. (El Ejemplo 6 en la Sección 22.3 examina este problema.) El uso de convertidores catalíticos redujo la cantidad de monóxido de carbono, óxidos de nitrógeno e hidrocarburos liberados a la atmósfera a través de los escapes de los automóviles, pero no hizo nada para disminuir las emisiones de plomo. Debido a que el plomo envenena a los convertidores catalíticos, sin embargo, su uso como aditivo de gasolina ha sido prohibido en la mayor parte del mundo.
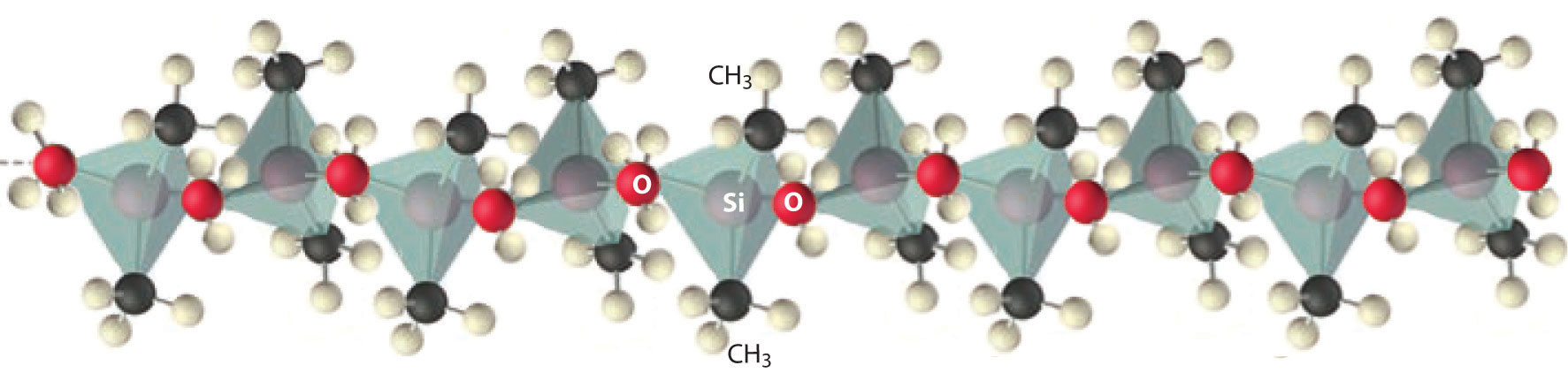
Los compuestos que contienen enlaces Si—C y Si—O son estables e importantes. Los polímeros de alta masa molecular llamados siliconas contienen una cadena principal (Si—O—) n con grupos orgánicos unidos a Si (Figura\(\PageIndex{5}\)). Las propiedades de las siliconas están determinadas por la longitud de la cadena, el tipo de grupo orgánico y el grado de reticulación entre las cadenas. Sin reticulación, las siliconas son ceras o aceites, pero la reticulación puede producir materiales flexibles utilizados en selladores, juntas, abrillantadores de automóviles, lubricantes e incluso materiales elásticos, como la sustancia plástica conocida como Silly Putty.

Para cada reacción, explique por qué se forman los productos dados.
- Pb (s) + Cl 2 (g) → PbCl 2 (s)
- Mg 2 Si (s) + 4H 2 O (l) → SiH 4 (g) + 2Mg (OH) 2 (s)
- GeO 2 (s) + 4OH − (aq) → GeO 4 4− (aq) + 2H 2 O (l)
Dado: ecuaciones químicas balanceadas
Preguntado por: por qué se forman los productos dados
Estrategia:
Clasificar el tipo de reacción. Usando tendencias periódicas en propiedades atómicas, termodinámica y cinética, explicar por qué se forman los productos de reacción observados.
Solución
- El plomo es un metal, y el cloro es un no metal que es un oxidante fuerte. Así podemos esperar que se produzca una reacción redox en la que el metal actúe como reductor. Aunque el plomo puede formar compuestos en los estados de oxidación +2 y +4, Pb 4 + es un potente oxidante (el efecto de par inerte). Debido a que el plomo prefiere el estado de oxidación +2 y el cloro es un oxidante más débil que el flúor, esperamos que el PbCl 2 sea el producto.
- Esta es la reacción del agua con un siliciuro metálico, el cual contiene formalmente el ion Si 4−. El agua puede actuar como un ácido o una base. Debido a que el otro compuesto es una base, esperamos que ocurra una reacción ácido-base en la que el agua actúe como ácido. Debido a que Mg 2 Si contiene Si en su estado de oxidación más bajo posible, sin embargo, una reacción de oxidación-reducción también es una posibilidad. Pero el agua es un oxidante relativamente débil, por lo que es más probable una reacción ácido-base. El ácido (H 2 O) transfiere un protón a la base (Si 4−), que puede aceptar cuatro protones para formar SiH 4. La transferencia de protones del agua produce el ion OH −, que se combinará con Mg 2 + para dar hidróxido de magnesio.
- Se espera que el dióxido de germanio (GeO 2) sea anfótero debido a la posición del germanio en la tabla periódica. Debe disolverse en una base acuosa fuerte para dar una especie aniónica análoga al silicato.
Predecir los productos de las reacciones y escribir una ecuación química equilibrada para cada reacción.
- PbO 2 (s)\(\xrightarrow{\Delta}\)
- GECl 4 (s) + H 2 O (l) →
- Sn (s) + HCl (ac) →
Contestar
- \(\mathrm{PbO_2(s)}\xrightarrow{\Delta}\mathrm{PbO(s)}+\frac{1}{2}\mathrm{O_2(g)}\)
- GeCl 4 (s) + 2H 2 O (l) → GeO 2 (s) + 4HCl (aq)
- Sn (s) + 2HCl (aq) → Sn 2 + (aq) + H 2 (g) + 2Cl − (aq)
Resumen
Los 14 elementos del grupo muestran la mayor diversidad en el comportamiento químico de cualquier grupo; las fuerzas de enlace covalente disminuyen al aumentar el tamaño atómico y las energías de ionización son mayores de lo esperado, aumentando de C a Pb. Los 14 elementos del grupo muestran el mayor rango de comportamiento químico de cualquier grupo en la tabla periódica. Debido a que la fuerza del enlace covalente disminuye con el aumento del tamaño atómico y las energías de ionización mayores de lo esperado debido a un aumento en Z eff, la estabilidad del estado de oxidación +2 aumenta de carbono a plomo. La tendencia a formar múltiples enlaces y a catenar disminuye a medida que aumenta el número atómico. La estabilidad de los tetrahaluros de carbono disminuye a medida que el halógeno aumenta de tamaño debido a la mala superposición orbital y el hacinamiento estérico. El carbono forma tres tipos de carburos con menos elementos electronegativos: carburos iónicos, que contienen cationes metálicos y aniones C 4− (metido) o C 2 - (acetiluro); carburos intersticiales, que se caracterizan por interacciones covalentes metal-carbono y se encuentran entre los sustancias más duras conocidas; y carburos covalentes, que tienen estructuras tridimensionales de red covalente que los hacen extremadamente duros, de alto punto de fusión y químicamente inertes. Consistente con las tendencias periódicas, el comportamiento metálico aumenta en el grupo. El silicio tiene una tremenda afinidad por el oxígeno debido a la unión parcial de Si—O π. Los dióxidos del grupo 14 elementos se vuelven cada vez más básicos en el grupo y su carácter metálico aumenta. Los silicatos contienen aniones que consisten únicamente en silicio y oxígeno. Los aluminosilicatos se forman reemplazando algunos de los átomos de Si en los silicatos por átomos de Al; los aluminosilicatos con estructuras estructurales tridimensionales se denominan zeolitas. Los nitruros formados por reacción de silicio o germanio con nitrógeno son fuertes, duros y químicamente inertes. Los hidruros se vuelven termodinámicamente menos estables en el grupo. Además, a medida que aumenta el tamaño atómico, los enlaces múltiples entre o con el grupo 14 elementos se vuelven más débiles. Las siliconas, que contienen una cadena principal Si-O y enlaces Si-C, son polímeros de alta masa molecular cuyas propiedades dependen de sus composiciones.
Colaboradores y Atribuciones
- Anonymous


