21.6: Los Elementos del Grupo 18 (Los Gases Noble)
- Page ID
- 77990
- Comprender las tendencias en propiedades y reactividad del grupo 18 elementos: los gases nobles.
Todos los gases nobles fueron aislados por primera vez en un periodo de sólo cinco años a finales del siglo XIX. Su propia existencia no se sospechó hasta el siglo XVIII, cuando los primeros trabajos sobre la composición del aire sugirieron que contenía pequeñas cantidades de gases además de oxígeno, nitrógeno, dióxido de carbono y vapor de agua. El helio fue el primero de los gases nobles en ser identificados, cuando la existencia de este elemento previamente desconocido en el sol quedó demostrada por nuevas líneas espectrales observadas durante un eclipse solar en 1868. Sin embargo, no se obtuvieron muestras reales de helio hasta casi 30 años después. En la década de 1890, el físico inglés J. W. Strutt (Lord Rayleigh) midió cuidadosamente la densidad del gas que quedó después de haber eliminado todo O 2, CO 2 y vapor de agua del aire y demostró que este gas residual era ligeramente más denso que el N 2 puro obtenido por el térmico descomposición del nitrito amónico. En 1894, él y el químico escocés William Ramsay anunciaron el aislamiento de una nueva “sustancia” (no necesariamente un nuevo elemento) del gas nitrógeno residual. Debido a que no podían obligar a esta sustancia a descomponerse o reaccionar con nada, la llamaron argón (Ar), del griego argos, que significa “perezoso”. Debido a que la masa molar medida de argón fue de 39.9 g/mol, Ramsay especuló que era miembro de un nuevo grupo de elementos ubicados en el lado derecho de la tabla periódica entre los halógenos y los metales alcalinos. También sugirió que estos elementos deberían tener una valencia preferida de 0, intermedia entre el +1 de los metales alcalinos y el −1 de los halógenos.
Lord Rayleigh fue uno de los pocos miembros de la nobleza superior británica en ser reconocido como un científico destacado. A lo largo de su juventud, su educación fue interrumpida repetidamente por su frágil salud, y no se esperaba que llegara a la madurez. En 1861 ingresó al Trinity College, Cambridge, donde sobresalió en matemáticas. Un severo ataque de fiebre reumática lo llevó al extranjero, pero en 1873 le sucedió a la baronía y se vio obligado a dedicar su tiempo a la gestión de sus fincas. Después de dejar toda la gestión a su hermano menor, Lord Rayleigh pudo dedicar su tiempo a la ciencia. Recibió títulos honoríficos en ciencias y derecho de la Universidad de Cambridge.
Señor Guillermo Ramsay (1852—1916)
Nacido y educado en Glasgow, Escocia, se esperaba que Ramsay estudiara para el ministerio calvanista. En cambio, se interesó por la química mientras leía sobre la fabricación de pólvora. Ramsay obtuvo su doctorado en química orgánica en la Universidad de Tübingen en Alemania en 1872. Cuando regresó a Inglaterra, sus intereses se volvieron primero a la química física y luego a la química inorgánica. Es mejor conocido por su trabajo sobre los óxidos de nitrógeno y por el descubrimiento de los gases nobles con Lord Rayleigh.
En 1895, Ramsey pudo obtener por primera vez una muestra terrestre de helio. Luego, en un solo año (1898), descubrió los siguientes tres gases nobles: el kriptón (Kr), del griego kriptos, que significa “oculto”, fue identificado por sus líneas de emisión naranja y verde; el neón (Ne), del griego neos, que significa “nuevo”, tenía líneas de emisión de color rojo brillante; y el xenón (Xe), del xeno griego, que significa” extraño”, tenía líneas de emisión de color azul profundo. El último gas noble fue descubierto en 1900 por el químico alemán Friedrich Dorn, quien investigaba la radiactividad en el aire alrededor de los elementos radiactivos recién descubiertos radio y polonio. El elemento se denominó radón (Rn), y Ramsay logró obtener suficiente radón en 1908 para medir su densidad (y así su masa atómica). Por su descubrimiento de los gases nobles, Rayleigh fue galardonado con el Premio Nobel de Física y Ramsay el Premio Nobel de Química en 1904. Debido a que el helio tiene el punto de ebullición más bajo de cualquier sustancia conocida (4.2 K), se utiliza principalmente como líquido criogénico. El helio y el argón son mucho menos solubles en agua (y por lo tanto en sangre) que el N 2, por lo que los buceadores suelen utilizar mezclas de gases que contienen estos gases, en lugar de N 2, para minimizar la probabilidad de las “curvas”, la formación dolorosa y potencialmente mortal de burbujas de N 2 ( g) que puede ocurrir cuando un buceador regresa a la superficie demasiado rápido.
Preparación y Propiedades Generales del Grupo 18 Elementos
La destilación fraccionada de aire líquido es la única fuente de todos los gases nobles excepto el helio. Aunque el helio es el segundo elemento más abundante del universo (después del hidrógeno), el helio originalmente presente en la atmósfera terrestre se perdió en el espacio hace mucho tiempo debido a su baja masa molecular y resultante alta velocidad media. El gas natural a menudo contiene concentraciones relativamente altas de helio (hasta 7%), sin embargo, y es la única fuente terrestre práctica.
Todos los elementos del grupo 18 tienen configuraciones de electrones de valencia de concha cerrada, ya sea ns 2 np 6 o 1s 2 para He. Consistente con las tendencias periódicas en las propiedades atómicas, estos elementos tienen altas energías de ionización que disminuyen suavemente en el grupo. A partir de sus afinidades electrónicas, los datos de la Tabla\(\PageIndex{1}\) indican que es poco probable que los gases nobles formen compuestos en estados de oxidación negativa. Se necesita un oxidante potente para oxidar los gases nobles y formar compuestos en estados de oxidación positivos. Al igual que los halógenos más pesados, el xenón y quizás el criptón deberían formar compuestos covalentes con F, O y posiblemente Cl, en los que tienen incluso estados de oxidación formales (+2, +4, +6, y posiblemente +8). Estas predicciones realmente resumen la química observada para estos elementos.
| Propiedad | Helio | Neón | Argón | Krypton | Xenon | Radón |
|---|---|---|---|---|---|---|
| *La configuración mostrada no incluye subcarcasas d y f rellenas. † Este es el punto de ebullición normal de Él. Sólido No existe a 1 atm de presión, por lo que no se puede dar ningún punto de fusión. | ||||||
| símbolo atómico | Él | Ne | Ar | Kr | Xe | Rn |
| número atómico | 2 | 10 | 18 | 36 | 54 | 86 |
| masa atómica (amu) | 4.00 | 20.18 | 39.95 | 83.80 | 131.29 | 222 |
| configuración de electrones de valencia | 1s 2 | 2s 2 2p 6 | 3s 2 3p 6 | 4s 2 4p 6 | 5s 2 5p 6 | 6s 2 6p 6 |
| punto triple/punto de ebullición (°C) | —/−269 † | −249 (a 43 kPa) /−246 | −189 (a 69 kPa) /−189 | −157/−153 | −112 (a 81,6 kPa) /−108 | −71/−62 |
| densidad (g/L) a 25°C | 0.16 | 0.83 | 1.63 | 3.43 | 5.37 | 9.07 |
| radio atómico (pm) | 31 | 38 | 71 | 88 | 108 | 120 |
| primera energía de ionización (kJ/mol) | 2372 | 2081 | 1521 | 1351 | 1170 | 1037 |
| estado (s) normal (s) de oxidación | 0 | 0 | 0 | 0 (+2) | 0 (+2, +4, +6, +8) | 0 (+2) |
| afinidad electrónica (kJ/mol) | > 0 | > 0 | > 0 | > 0 | > 0 | > 0 |
| electronegatividad | — | — | — | — | 2.6 | — |
| producto de reacción con O 2 | ninguno | ninguno | ninguno | ninguno | no directamente con oxígeno, sino que se\(\ce{XeO3}\) puede formar por la Ecuación\ ref {Eq5}. | ninguno |
| tipo de óxido | — | — | — | — | ácido | — |
| producto de reacción con N 2 | ninguno | ninguno | ninguno | ninguno | ninguno | ninguno |
| producto de reacción con X 2 | ninguno | ninguno | ninguno | KRF 2 | xEF 2, xEF 4, xEF 6 | RnF 2 |
| producto de reacción con H 2 | ninguno | ninguno | ninguno | ninguno | ninguno | ninguno |
Reacciones y Compuestos de los Gases Noble
Durante muchos años, se pensó que los únicos compuestos que podían formar los gases nobles eran los clatratos. Los clatratos son compuestos sólidos en los que un gas, el huésped, ocupa agujeros en una celosía formada por una sustancia menos volátil y químicamente diferente, el huésped (Figura\(\PageIndex{1}\)).
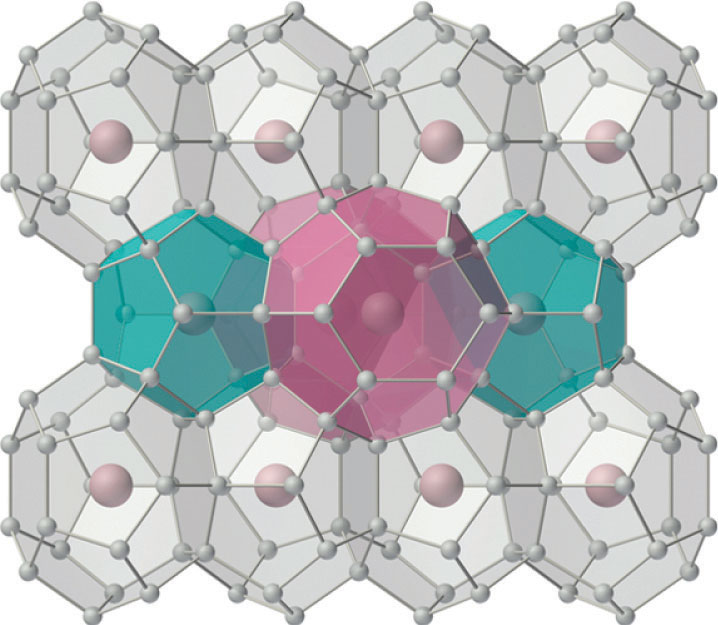
Debido a que la formación de clatratos no implica la formación de enlaces químicos entre el huésped (Xe) y las moléculas huésped (H 2 O, en el caso del hidrato de xenón), las moléculas huésped se liberan inmediatamente cuando el clatrato se funde o disuelve.
Además de los gases nobles, muchas otras especies forman clatratos estables. Uno de los más interesantes es el hidrato de metano, grandes depósitos del cual ocurren naturalmente en el fondo de los océanos. Se estima que la cantidad de metano en dichos depósitos podría tener un impacto importante en las necesidades energéticas del mundo más adelante en este siglo.


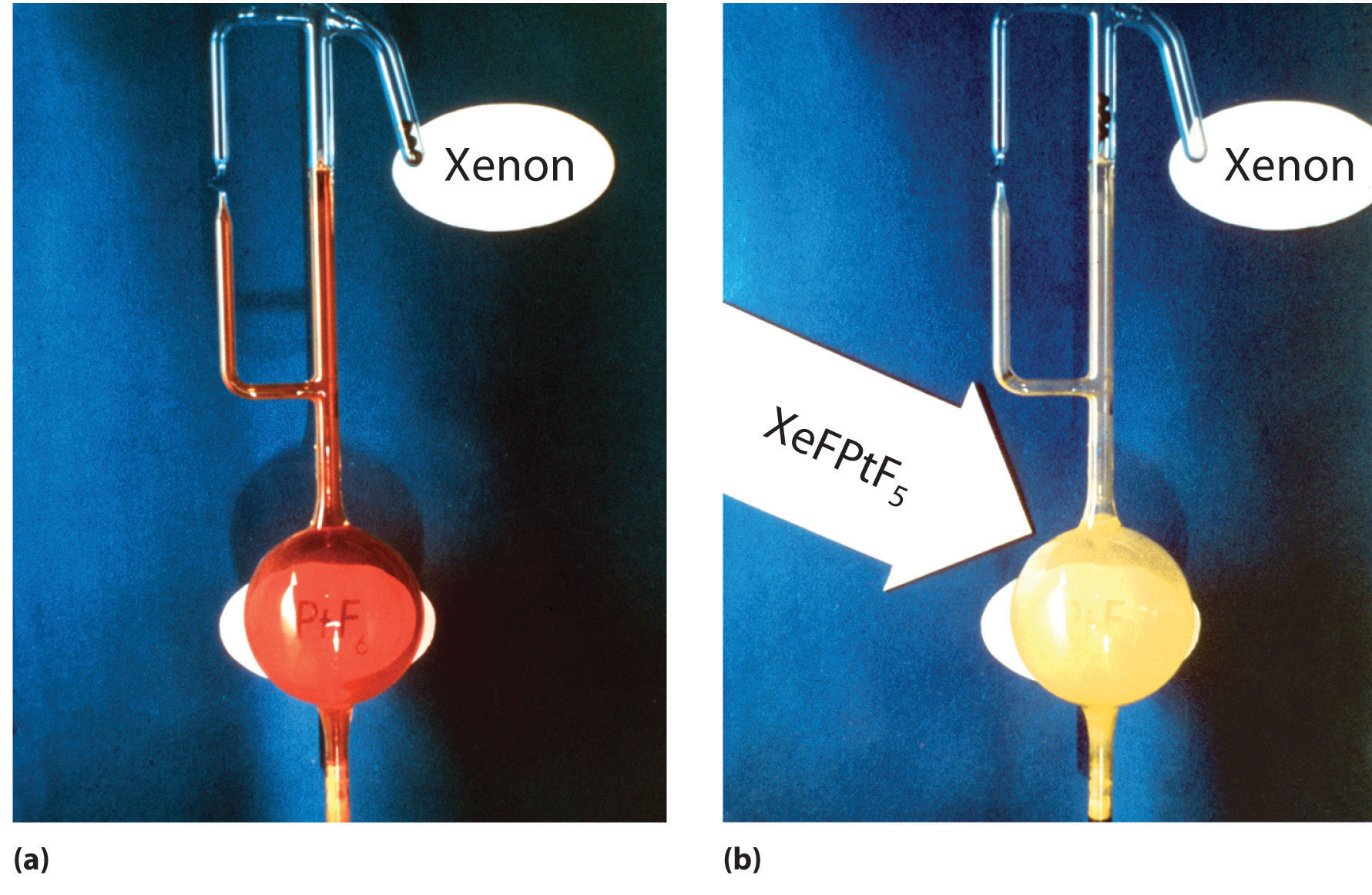
La creencia generalizada en la falta intrínseca de reactividad de los gases nobles fue cuestionada cuando Neil Bartlett, profesor británico de química en la Universidad de Columbia Británica, demostró que PtF 6, un compuesto utilizado en el Proyecto Manhattan, podría oxidar O 2. Debido a que la energía de ionización del xenón (1170 kJ/mol) es en realidad menor que la del O 2, Bartlett reconoció que PtF 6 también debería ser capaz de oxidar el xenón. Cuando mezcló gas xenón incoloro con vapor PtF 6 rojo intenso, inmediatamente se formaron cristales amarillo-naranja (Figura\(\PageIndex{3}\)). Si bien Bartlett postuló inicialmente que lo eran\(\ce{Xe^{+}PtF6^{−}}\), ahora se concuerda generalmente en que la reacción también implica la transferencia de un átomo de flúor al xenón para dar el\(\ce{XeF^{+}}\) ion:
\[\ce{Xe(g) + PtF6(g) -> [XeF^{+}][PtF5^{−}](s)} \label{Eq1}\]
Los trabajos posteriores mostraron que el xenón reacciona directamente con flúor en condiciones relativamente suaves para dar XeF 2, XeF 4 o XeF 6, dependiendo de las condiciones; una de tales reacciones es la siguiente:
\[\ce{Xe(g) + 2F2(g) -> XeF4(s)} \label{Eq2}\]
Las energías de ionización del helio, neón y argón son tan altas (Tabla\(\PageIndex{1}\)) que no se conocen compuestos estables de estos elementos. Las energías de ionización del criptón y el xenón son menores pero aún muy altas; en consecuencia, solo los elementos altamente electronegativos (F, O y Cl) pueden formar compuestos estables con xenón y criptón sin oxidarse ellos mismos. El xenón reacciona directamente con solo dos elementos: F 2 y Cl 2. Aunque\(\ce{XeCl2}\) y se\(\ce{KrF2}\) pueden preparar directamente a partir de los elementos, son sustancialmente menos estables que los fluoruros de xenón.
Las energías de ionización del helio, el neón y el argón son tan altas que no se conocen compuestos estables de estos elementos.
Debido a que los haluros de los gases nobles son poderosos oxidantes y agentes fluorantes, se descomponen rápidamente después del contacto con trazas de agua, y reaccionan violentamente con compuestos orgánicos u otros reductores. Los fluoruros de xenón también son ácidos de Lewis; reaccionan con el ion fluoruro, la única base de Lewis que no se oxida inmediatamente al contacto, para formar complejos aniónicos. Por ejemplo, la reacción de fluoruro de cesio con XeF 6 produce CSxEF 7, que da Cs 2 xeF 8 cuando se calienta:
\[\ce{XeF6(s) + CsF(s) -> CsXeF7(s)} \label{Eq3}\]
\[\ce{2CsXeF7(s) ->[\Delta] Cs2XeF8(s) + XeF6(g)} \label{Eq4}\]
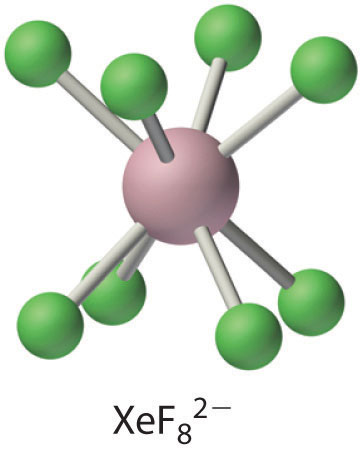
El\(\ce{XeF8^{2-}}\) ion contiene xenón de ocho coordenadas y tiene la estructura antiprismática cuadrada, que es esencialmente idéntica a la del ion IF 8 −. Cs 2 xEF 8 es sorprendentemente estable para un ion poliatómico que contiene xenón en el estado de oxidación +6, descomponiéndose solo a temperaturas superiores a 300°C Los principales factores en la estabilidad de Cs 2 xEF 8 son casi con certeza la formación de una red iónica estable y el alto número de coordinación del xenón, que protege al átomo central del ataque de otras especies. (Recordemos de que este último efecto es responsable de la extrema estabilidad del SF 6.)
Para un gas previamente “inerte”, el xenón tiene una afinidad sorprendentemente alta por el oxígeno, presumiblemente debido a la unión π entre\(O\) y\(Xe\). En consecuencia, el xenón forma una extensa serie de óxidos y sales oxoaniónicas. Por ejemplo, hidrólisis de uno\(XeF_4\) o\(XeF_6\) produce\(XeO_3\), un sólido blanco explosivo:
\[\ce{XeF6(aq) + 3H2O(l) -> XeO3(aq) + 6HF(aq)} \label{Eq5}\]
El tratamiento de una solución de XEo 3 con ozono, un oxidante fuerte, da como resultado una oxidación adicional del xenón para dar XEo 4, un gas explosivo incoloro o el ion perxenato sorprendentemente estable (XEo 6 4−), ambos contienen xenón en su mayor oxidación posible estado (+8). La química de los haluros y óxidos de xenón se entiende mejor por analogía con los correspondientes compuestos de yodo. Por ejemplo, XeO 3 es isoelectrónico con el ion yodato (IO 3 −), y xEF 8 2− es isoelectrónico con el ion IF 8 −.
El xenón tiene una alta afinidad tanto por el flúor como por el oxígeno.
Debido a que la energía de ionización del radón es menor que la del xenón, en principio el radón debería poder formar una variedad aún mayor de compuestos químicos que el xenón. Desafortunadamente, sin embargo, el radón es tan radiactivo que su química no ha sido ampliamente explorada.
En un planeta virtual similar a la Tierra, al menos un isótopo de radón no es radiactivo. Una científica exploró su química y presentó sus principales conclusiones en un artículo pionero sobre compuestos de radón, enfocándose en los tipos de compuestos formados y sus estequiometrías. A partir de tendencias periódicas, ¿cómo resumió la química del radón?
Dado: isótopo no radiactivo de radón
Preguntado por: resumen de su química
Estrategia:
Con base en la posición del radón en la tabla periódica y las tendencias periódicas en las propiedades atómicas, termodinámica y cinética, predicen las reacciones y compuestos más probables del radón.
Solución
Esperamos que el radón sea significativamente más fácil de oxidar que el xenón. Con base en su posición en la tabla periódica, sin embargo, también esperamos que sus enlaces a otros átomos sean más débiles que los formados por el xenón. El radón debería ser más difícil de oxidar a su estado de oxidación más alto posible (+8) que el xenón debido al efecto de par inerte. En consecuencia, el radón debe formar una serie extensa de fluoruros, incluyendo RnF 2, RnF 4, RnF 6 y posiblemente RnF 8 (debido a su gran radio). El ion RnF 8 2− también debería existir. Esperamos que el radón forme una serie de óxidos similares a los del xenón, incluyendo RnO 3 y posiblemente RnO 4. La mayor sorpresa en la química del radón es probable que sea la existencia de cloruros estables, como RnCl 2 y posiblemente incluso RnCl 4.
Predecir la estequiometría del producto formado haciendo reaccionar XeF 6 con una cantidad estequiométrica 1:1 de KF y proponer una estructura razonable para el anión.
- Contestar
-
\(\ce{KXeF7}\); el átomo de xenón en xEF 7 − tiene 16 electrones de valencia, que según el modelo de repulsión de pares de electrones de vaina de valencia podría dar una estructura antiprismática cuadrada con un átomo de flúor faltante o una bipirámide pentagonal si los electrones 5s 2 se comportan como un par inerte que no participa en la unión.
Resumen
Los gases nobles se caracterizan por sus altas energías de ionización y bajas afinidades de electrones. Se necesitan oxidantes potentes para oxidar los gases nobles y formar compuestos en estados de oxidación positivos. Los gases nobles tienen una configuración electrónica de valencia de caparazón cerrado. Las energías de ionización de los gases nobles disminuyen con el aumento del número atómico. Solo los elementos altamente electronegativos pueden formar compuestos estables con los gases nobles en estados de oxidación positiva sin ser oxidados ellos mismos. El xenón tiene una alta afinidad tanto por el flúor como por el oxígeno, los cuales forman compuestos estables que contienen xenón incluso en estados de oxidación hasta +8.
Colaboradores y Atribuciones
- Anonymous


