23.6: Clases Comunes de Compuestos Orgánicos
- Page ID
- 78383
- Comprender las propiedades generales de los grupos funcionales y las diferencias en su reactividad.
Las propiedades generales y reactividad de cada clase de compuestos orgánicos están determinadas en gran medida por sus grupos funcionales. En esta sección, describimos las relaciones entre estructura, propiedades físicas y reactividad para las principales clases de compuestos orgánicos. También te mostramos cómo aplicar estas relaciones para entender algunas reacciones comunes que los químicos utilizan para sintetizar compuestos orgánicos.
Alquenos, Alquenos y Alquinos
Los puntos de ebullición de los alcanos aumentan suavemente al aumentar la masa molecular. Son similares a los de los alquenos y alquinos correspondientes por similitudes en masa molecular entre estructuras análogas (Tabla\(\PageIndex{1}\)). En contraste, los puntos de fusión de alcanos, alquenos y alquinos con masas moleculares similares muestran una variación mucho más amplia porque el punto de fusión depende fuertemente de cómo se apilan las moléculas en estado sólido. Por lo tanto, es sensible a diferencias relativamente pequeñas en la estructura, como la ubicación de un doble enlace y si la molécula es cis o trans.
| Longitud de la Cadena de Carbono | |||
|---|---|---|---|
| Clase | Dos átomos de C | Tres átomos de C | Cuatro átomos de C |
| alcano | −88.6 | −42.1 | −0.5 |
| alqueno | −103.8 | −47.7 | −6.3 |
| alquino | −84.7 | −23.2 | 8.1 |
Debido a que los alcanos solo contienen enlaces C—C y C—H, que son fuertes y no muy polares (las electronegatividades de C y H son similares), no son fácilmente atacados por nucleófilos o electrófilos. En consecuencia, su reactividad es limitada, y a menudo sus reacciones ocurren solo en condiciones extremas. Por ejemplo, el craqueo catalítico se puede utilizar para convertir alcanos de cadena lineal en alcanos altamente ramificados, que son mejores combustibles para motores de combustión interna. El craqueo catalítico es un ejemplo de una reacción de pirólisis (del griego pyros, que significa “fuego” y lisis, que significa “aflojamiento”), en la que los alcanos se calientan a una temperatura suficientemente alta para inducir la escisión de los enlaces más débiles: los enlaces simples C—C. El resultado es una mezcla de radicales derivados de la escisión esencialmente aleatoria de los diversos enlaces C-C en la cadena. La pirólisis del n-pentano, por ejemplo, es inespecífica y puede producir estos cuatro radicales:
La recombinación de estos radicales (una etapa de terminación) puede producir etano, propano, butano, n-pentano, n-hexano, n-heptano y n-octano. Los radicales que se forman en la mitad de una cadena al escindir un enlace C-H tienden a producir hidrocarburos ramificados. En el craqueo catalítico, los alcanos más ligeros se eliminan de la mezcla por destilación.
También se producen radicales durante la combustión de alcanos, con CO 2 y H 2 O como productos finales. Los radicales se estabilizan por la presencia de múltiples sustituyentes de carbono que pueden donar densidad electrónica al carbono deficiente en electrones. La explicación química de los índices de octano se basa en parte en la estabilidad de los radicales producidos a partir de los diferentes combustibles hidrocarbonados. Recordemos que el n-heptano, que no quema suavemente, tiene una clasificación de octano de 0, y 2,2,4-trimetilpentano (“isooctano”), que quema bastante suavemente, tiene una calificación de 100. El isooctano tiene una estructura ramificada y es capaz de formar radicales terciarios que son comparativamente estables.
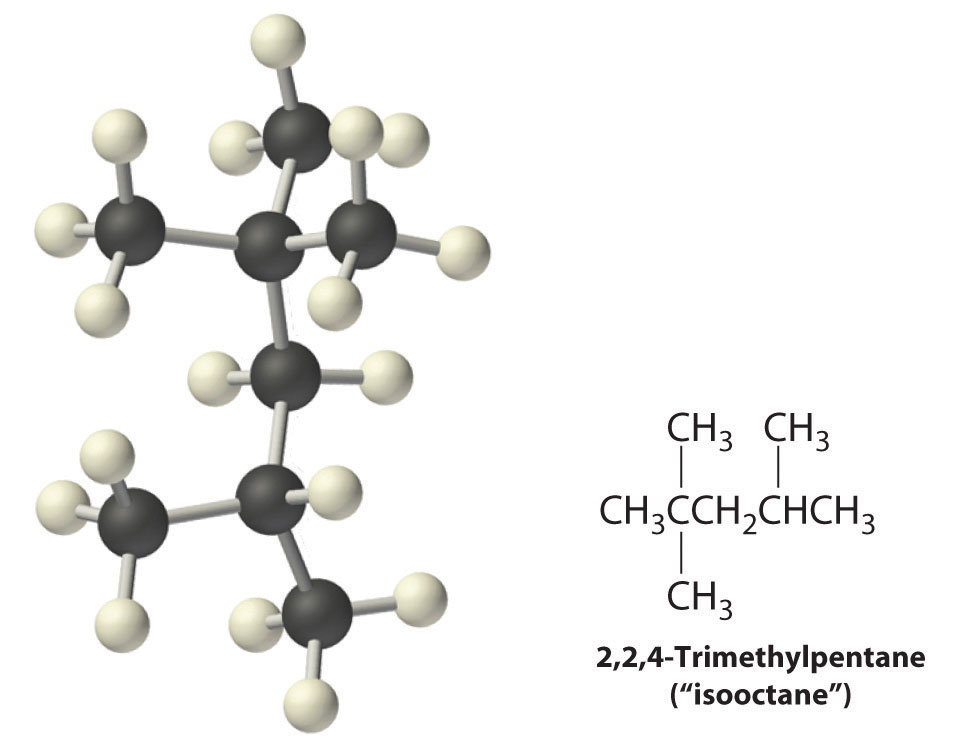
En contraste, los radicales formados durante la combustión del n-heptano, ya sean primarios o secundarios, son menos estables y por lo tanto más reactivos, lo que explica en parte por qué la quema de n-heptano provoca un encendido prematuro y un golpeteo del motor.
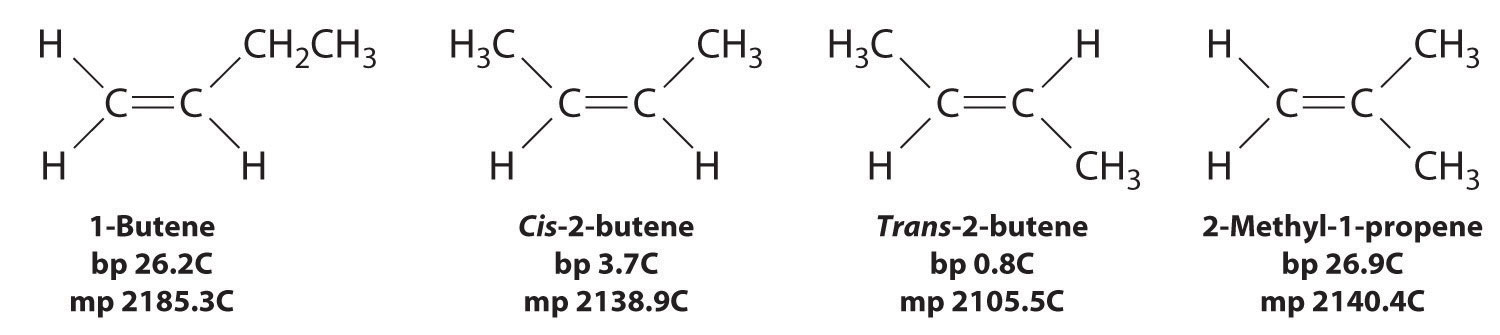
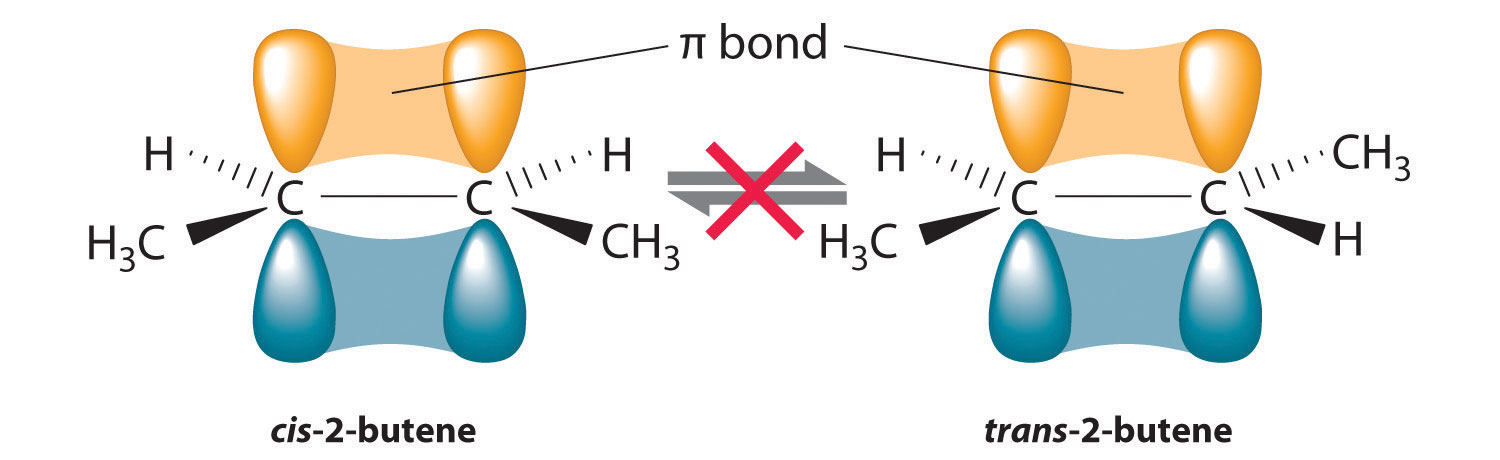
En la Sección 24.2, explicamos que la rotación alrededor de los enlaces múltiples carbono-carbono de alquenos y alquinos no puede ocurrir sin romper un enlace π, lo que por lo tanto constituye una gran barrera energética a la rotación (Figura\(\PageIndex{1}\)). En consecuencia, los isómeros cis y trans de los alquenos generalmente se comportan como compuestos distintos con diferentes propiedades químicas y físicas. Un alqueno de cuatro carbonos tiene cuatro posibles formas isoméricas: tres isómeros estructurales, que difieren en su conectividad, más un par de isómeros geométricos de un isómero estructural (2-buteno). Estos dos isómeros geométricos son cis-2-buteno y trans-2-buteno. Los cuatro isómeros tienen propiedades físicas significativamente diferentes.
Figura\(\PageIndex{1}\): Unión Carbono-Carbono en Alquenos e Interconversión de Isómeros Cis y Trans
En butano, solo hay una pequeña barrera de energía para la rotación alrededor del enlace C2-C3 σ. En la formación de cis- o trans-2-buteno a partir de butano, los orbitales p en C2 y C3 se superponen para formar un enlace π. Para convertir cis-2-buteno en trans-2-buteno o viceversa a través de la rotación alrededor del doble enlace, el enlace π debe romperse. Debido a que esta interconversión es energéticamente desfavorable, los isómeros cis y trans son compuestos distintos que generalmente tienen diferentes propiedades físicas y químicas.
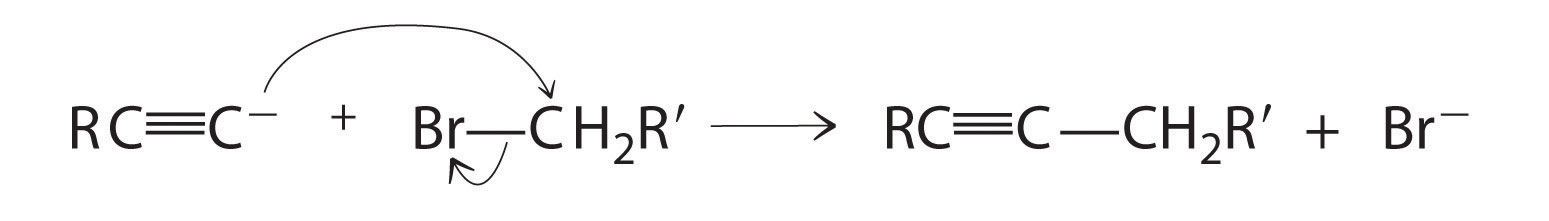
Los alquinos en los que el triple enlace se encuentra en un extremo de una cadena carbonada se denominan alquinos terminales y contienen un átomo de hidrógeno unido directamente a un carbono triplicamente enlazado: R—C=C—H. Los alquinos terminales son inusuales ya que el átomo de hidrógeno se puede eliminar con relativa facilidad como H +, formando un acetilido ion (R—C=C −). Los iones acetiluro son potentes nucleófilos que son reactivos especialmente útiles para hacer cadenas de carbono más largas mediante una reacción de sustitución nucleofílica. Como en ejemplos anteriores de tales reacciones, el nucleófilo ataca el átomo parcialmente cargado positivamente en un enlace polar, que en la siguiente reacción es el carbono del enlace Br-C:
Los alquenos y alquinos se preparan con mayor frecuencia mediante reacciones de eliminación. Un ejemplo típico es la preparación de 2-metil-1-propeno, cuyo derivado, 3-cloro-2-metil-1-propeno, se utiliza como fumigante e insecticida. El compuesto original se puede preparar a partir de 2-hidroxi-2-metilpropano o 2-bromo-2-metilpropano:
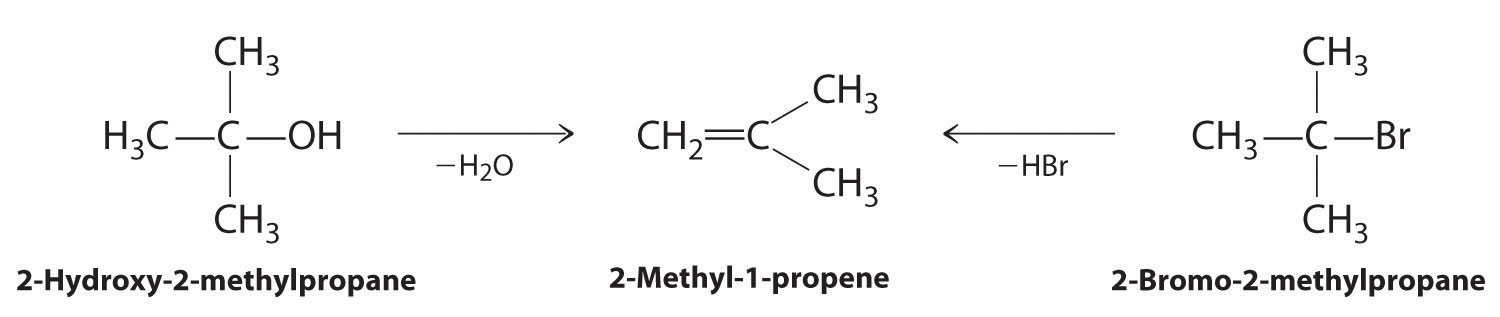
La reacción de la izquierda procede eliminando los elementos del agua (H + más OH −), por lo que es una reacción de deshidratación. Si un alcano contiene dos grupos funcionales ubicados apropiadamente, como —OH o —X, ambos pueden eliminarse como H 2 O o HX con la formación de un triple enlace carbono-carbono:
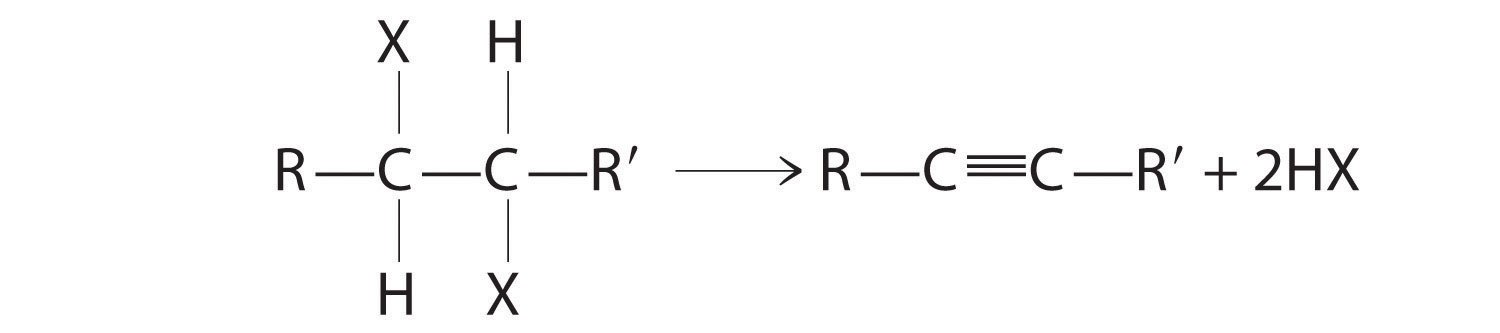
Los alquenos y alquinos se preparan con mayor frecuencia mediante reacciones de eliminación.
Arenes
La mayoría de los arenos que contienen un solo anillo de seis miembros son líquidos volátiles, como el benceno y los xilenos, aunque algunos arenos con sustituyentes en el anillo son sólidos a temperatura ambiente. En la fase gaseosa, el momento dipolar del benceno es cero, pero la presencia de sustituyentes electronegativos o electropositivos puede dar como resultado un momento dipolar neto que incrementa las fuerzas de atracción intermoleculares y eleva los puntos de fusión y ebullición. Por ejemplo, el 1,4-diclorobenceno, compuesto utilizado como alternativa al naftaleno en la producción de bolas de naftalina, tiene un punto de fusión de 52.7°C, el cual es considerablemente mayor que el punto de fusión del benceno (5.5°C).
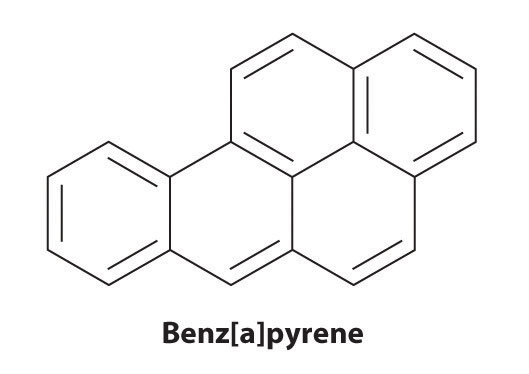
Ciertos hidrocarburos aromáticos, como el benceno y el benz [a] pireno, son potentes toxinas hepáticas y carcinógenos. En 1775, un médico británico, Percival Pott, describió la alta incidencia de cáncer de escroto entre los niños pequeños utilizados como deshollinadores y lo atribuyó a su exposición al hollín. Sus conclusiones fueron correctas: benz [a] pireno, componente de hollín de chimenea, carnes a la brasa y humo de cigarrillo, fue el primer carcinógeno químico identificado.
Aunque los arenos generalmente se dibujan con tres enlaces C=C, el benceno es aproximadamente 150 kJ/mol más estable de lo que se esperaría si tuviera tres dobles enlaces. Esta mayor estabilidad se debe a la deslocalización de la densidad de electrones π sobre todos los átomos del anillo. En comparación con los alquenos, los arenos son nucleófilos pobres. En consecuencia, no experimentan reacciones de adición como alquenos; en cambio, experimentan una variedad de reacciones de sustitución aromática electrófila que implican el reemplazo de —H en el areno por un grupo —E, como —NO 2, —SO 3 H, un halógeno, o un grupo alquilo, en un proceso de dos etapas. El primer paso implica la adición del electrófilo (E) al sistema π de benceno, formando un carbocatión. En el segundo paso, se pierde un protón del carbono adyacente en el anillo:
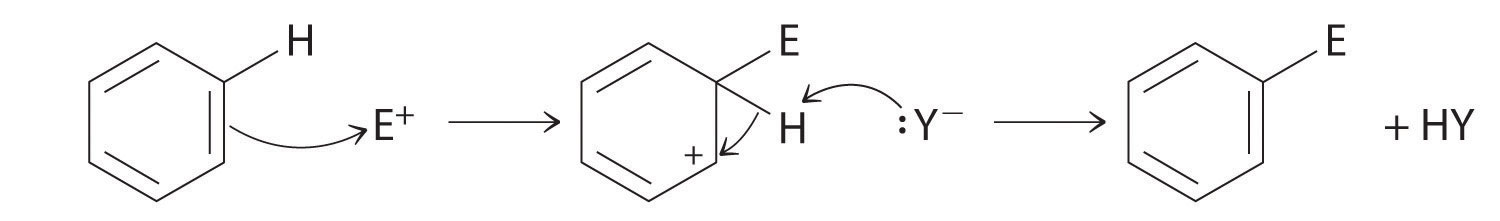
El carbocatión formado en el primer paso se estabiliza por resonancia.
Los arenos experimentan reacciones de sustitución en lugar de eliminación debido al aumento de la estabilidad que surge de la deslocalización de su densidad de electrones π.
Muchos arenos sustituidos tienen una potente actividad biológica. Algunos ejemplos incluyen medicamentos y antibióticos comunes como aspirina e ibuprofeno, drogas ilícitas como anfetaminas y peyote, el aminoácido fenilalanina, y hormonas como la adrenalina (Figura\(\PageIndex{2}\)).
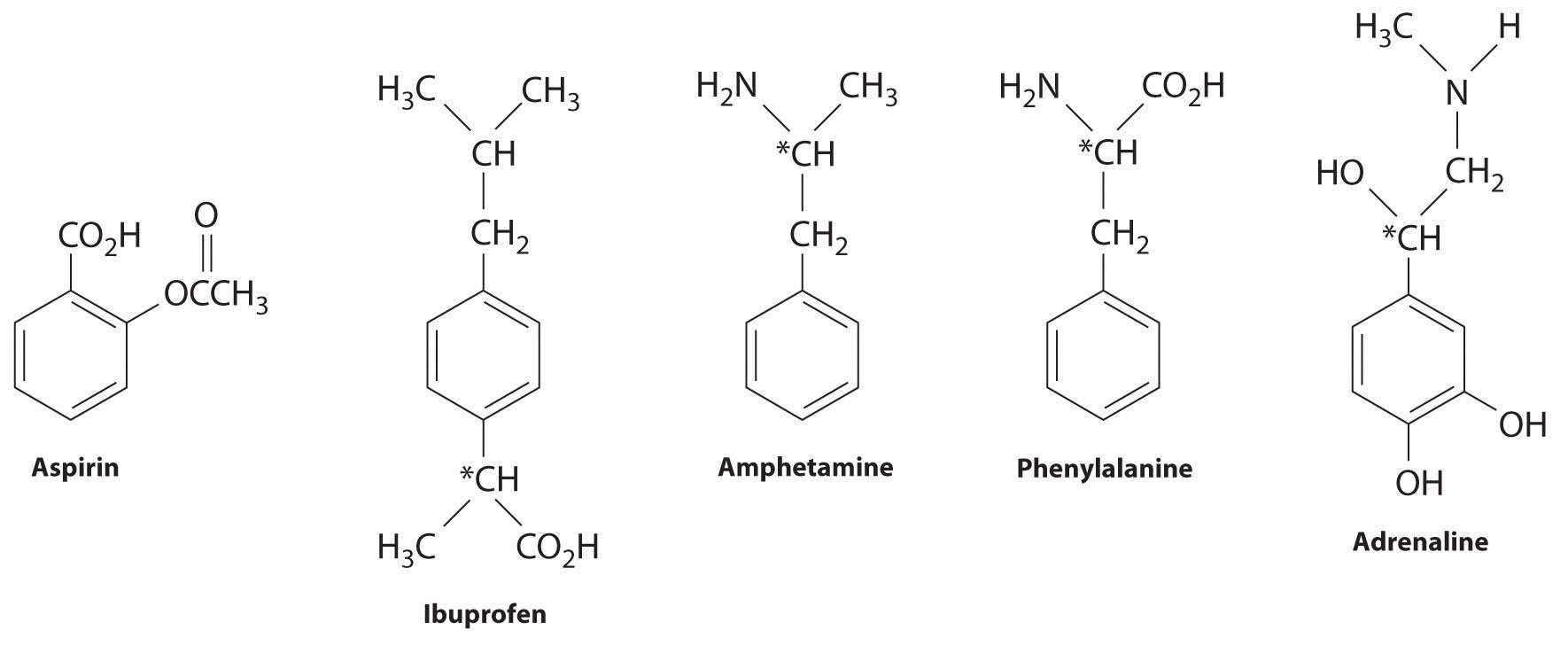
La aspirina (actividad antifebril), el ibuprofeno (actividad antifebril y antiinflamatoria) y la anfetamina (estimulante) tienen efectos farmacológicos. La fenilalanina es un aminoácido. La adrenalina es una hormona que provoca la respuesta de “lucha o huida” al estrés. Los centros quirales se indican con un asterisco.
Alcoholes y Éteres
Tanto los alcoholes como los éteres pueden considerarse derivados del agua en los que al menos un átomo de hidrógeno ha sido reemplazado por un grupo orgánico, como se muestra aquí. Debido al átomo de oxígeno electronegativo, los dipolos de enlace O-H individuales en los alcoholes no pueden cancelarse entre sí, lo que resulta en un momento dipolar sustancial que permite que los alcoholes formen enlaces de hidrógeno.
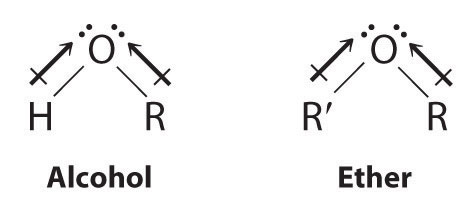
Por lo tanto, los alcoholes tienen puntos de ebullición significativamente mayores que los alcanos o alquenos de masa molecular comparable, mientras que los éteres, sin un enlace O—H polar, tienen puntos de ebullición intermedios debido a la presencia de un pequeño momento dipolar (Cuadro\(\PageIndex{2}\)). Cuanto mayor sea el grupo alquilo en la molécula, sin embargo, más “parecido a un alcano” es el alcohol en sus propiedades. Debido a su naturaleza polar, los alcoholes y éteres tienden a ser buenos solventes para una amplia gama de compuestos orgánicos.
| Nombre | Fórmula | Masa molecular (amu) | Punto de ebullición (°C) | |
|---|---|---|---|---|
| alcano | propano | C 3 H 8 | 44 | −42.1 |
| n-pentano | C 5 H 12 | 72 | 36.1 | |
| n-heptano | C 7 H 16 | 100 | 98.4 | |
| éter | éter dimetílico | (CH 3) 2 O | 46 | −24.5.1 |
| dietiléter | (CH 3 CH 2) 2 O | 74 | 34.5 | |
| di-n-propiléter | (CH 3 CH 2 CH 2) 2 O | 102 | 90.1 | |
| alcohol | etanol | CH 3 CH 2 OH | 46 | 78.3 |
| n-butanol | CH 3 (CH 2) 3 OH | 74 | 117.7 | |
| n-hexanol | CH 3 (CH 2) 5 OH | 102 | 157.6 |
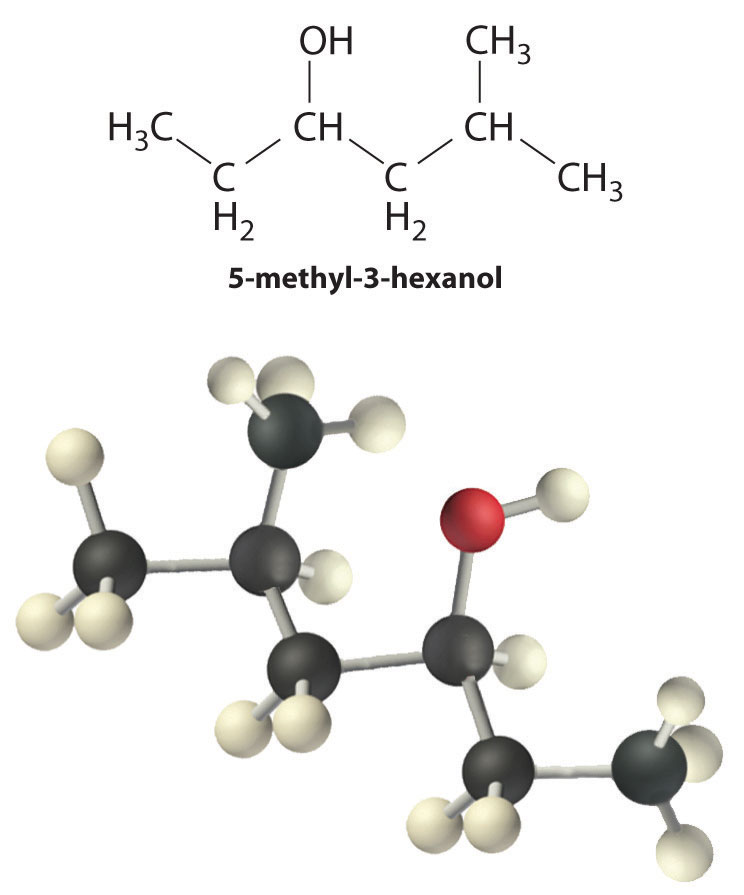
Los alcoholes generalmente se preparan añadiendo agua a través de un doble enlace carbono-carbono o mediante una reacción de sustitución nucleofílica de un haluro de alquilo usando hidróxido, un potente nucleófilo (Figura\(\PageIndex{1}\)). Los alcoholes también se pueden preparar reduciendo compuestos que contienen el grupo funcional carbonilo (C=O; parte (a) en la Figura 24.5.7). Los alcoholes se clasifican como primarios, secundarios o terciarios, dependiendo de si el grupo -OH está unido a un carbono primario, secundario o terciario. Por ejemplo, el compuesto 5-metil-3-hexanol es un alcohol secundario.
Los éteres, especialmente aquellos con dos grupos alquilo diferentes (ROR'), se pueden preparar mediante una reacción de sustitución en la que un ion alcóxido nucleófilo (RO -) ataca el átomo de carbono parcialmente cargado positivamente del enlace C-X polar de un haluro de alquilo (R'X):
Aunque tanto los alcoholes como los fenoles tienen un grupo funcional —OH, los fenoles son 10 6 —10 8 más ácidos que los alcoholes. Esto se debe en gran parte a que los alcoholes simples tienen la unidad —OH unida a un carbono hibridado sp 3, mientras que los fenoles tienen un átomo de carbono hibridado sp 2 unido al átomo de oxígeno. Por lo tanto, la carga negativa del ion fenóxido puede interactuar con los electrones π en el anillo, deslocalizando y estabilizando la carga negativa a través de resonancia. En contraste, la carga negativa sobre un ion alcóxido no puede ser estabilizada por este tipo de interacciones.
Los alcoholes experimentan dos tipos principales de reacciones: las que implican la escisión del enlace O-H y las que implican la escisión del enlace C-O. La escisión de un enlace O-H es una reacción característica de un ácido, pero los alcoholes son ácidos aún más débiles que el agua. La fuerza ácida de los fenoles, sin embargo, es aproximadamente un millón de veces mayor que la del etanol, haciendo que el pK a de fenol sea comparable a la del ion NH 4 + (9.89 versus 9.25, respectivamente):
Los alcoholes experimentan dos tipos principales de reacciones: escisión del enlace O-H y escisión del enlace C-O.
La escisión del enlace C-O en alcoholes ocurre en condiciones ácidas. El -OH se protonó primero, y la sustitución nucleofílica sigue:
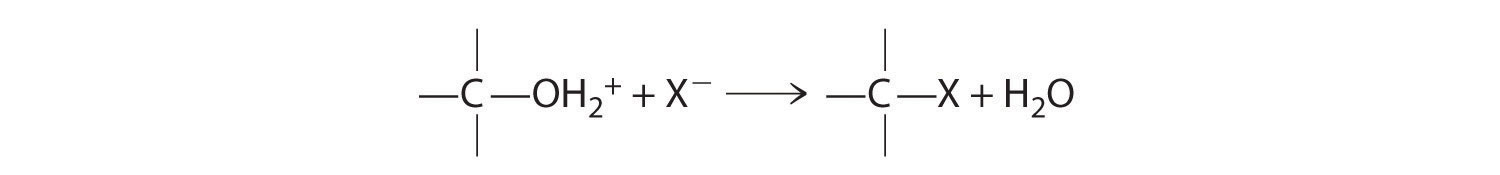
En ausencia de un nucleófilo, sin embargo, puede ocurrir la eliminación, produciendo un alqueno (Figura 24.5.6). Los éteres carecen de la unidad —OH que es central para la reactividad de los alcoholes, por lo que son comparativamente no reactivos. Su baja reactividad los hace altamente adecuados como solventes para llevar a cabo reacciones orgánicas.
Aldehídos y Cetonas
Los aldehídos aromáticos, que tienen sabores y aromas intensos y característicos, son los componentes principales de saborizantes tan conocidos como la vainilla y la canela (Figura 24.5.3). Muchas cetonas, como el alcanfor y el jazmín, también tienen aromas intensos. Las cetonas se encuentran en muchas de las hormonas responsables de la diferenciación sexual en humanos, como la progesterona y la testosterona.
En los compuestos que contienen un grupo carbonilo, el ataque nucleofílico puede ocurrir en el átomo de carbono del carbonilo, mientras que el ataque electrófilo ocurre al oxígeno.
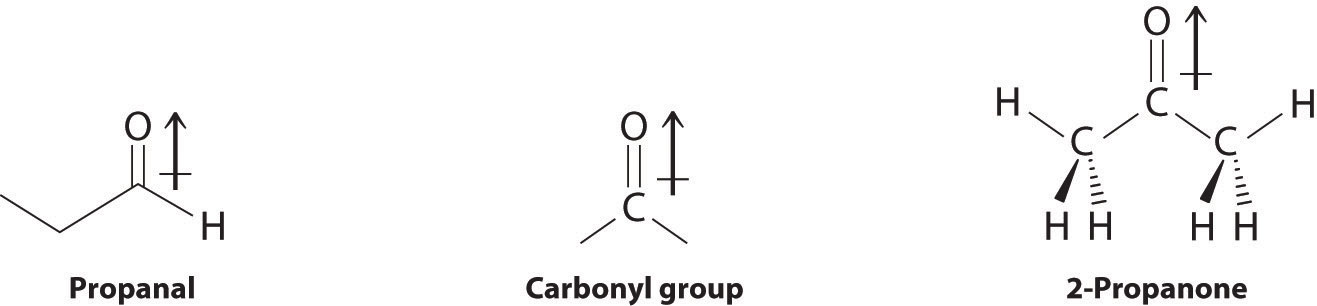
Los aldehídos y cetonas contienen el grupo funcional carbonilo, el cual tiene un momento dipolar apreciable debido al enlace polar C=O. La presencia del grupo carbonilo da como resultado fuertes interacciones intermoleculares que provocan que los aldehídos y cetonas tengan puntos de ebullición más altos que los alcanos o alquenos de masa molecular comparable (Cuadro 24.5.3). A medida que aumenta la masa de la molécula, el grupo carbonilo se vuelve menos importante para las propiedades globales del compuesto, y los puntos de ebullición se acercan a los de los alcanos correspondientes.
| Nombre | Fórmula | Masa molecular (amu) | Punto de ebullición (°C) | |
|---|---|---|---|---|
| alcano | n-butano | C 4 H 10 | 58 | −0.5 |
| n-pentano | C 5 H 12 | 72 | 36.1 | |
| aldehído | propionaldehído (propanal) | C 3 H 6 O | 58 | 48.0 |
| butiraldehído (butanal) | C 4 H 8 O | 72 | 74.8 | |
| cetona | acetona (2-propanona) | C 3 H 6 O | 58 | 56.1 |
| metil etil cetona (2-butanona) | C 4 H 8 O | 72 | 79.6 |
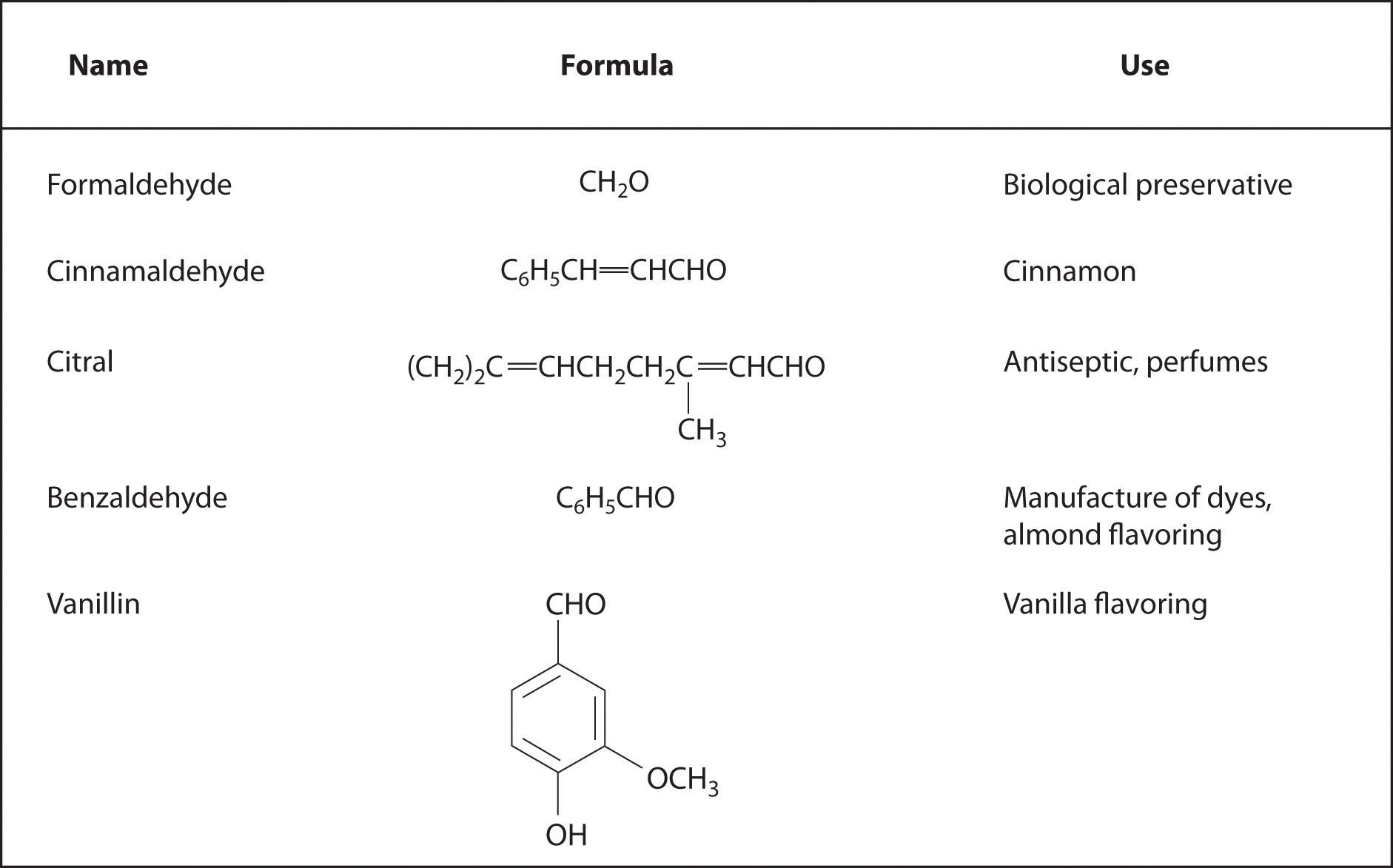
Los aldehídos y cetonas se preparan típicamente oxidando alcoholes (parte (a) en la Figura 24.5.7). En sus reacciones, el átomo de carbono parcialmente cargado positivamente del grupo carbonilo es un electrófilo que está sujeto a ataque nucleofílico. Por el contrario, los pares solitarios de electrones en el átomo de oxígeno del grupo carbonilo permiten que ocurra un ataque electrófilo. Por lo tanto, los aldehídos y las cetonas pueden sufrir tanto ataque nucleófilo (en el átomo de carbono) como ataque electrófilo (en el átomo de oxígeno).
El ataque nucleofílico ocurre en el carbono parcialmente cargado positivamente de un grupo funcional carbonilo. El ataque electrofílico ocurre en los pares solitarios de electrones en el átomo de oxígeno.
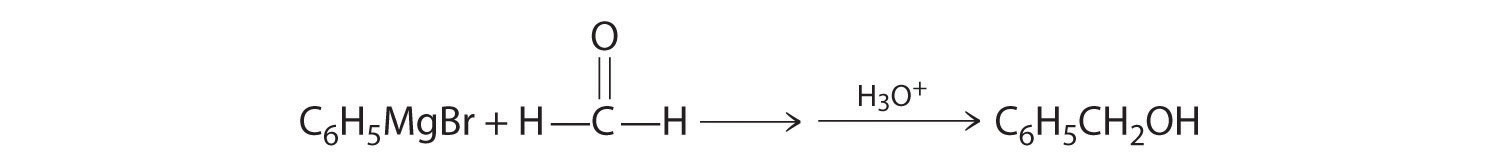
Los aldehídos y cetonas reaccionan con muchos compuestos organometálicos que contienen carbaniones estabilizados. Una de las clases más importantes de tales compuestos son los reactivos de Grignard, compuestos de organomagnesio con la fórmula rMgX (X es Cl, Br o I) que están tan fuertemente polarizados que pueden verse como que contienen R − y MgX +. Estos reactivos llevan el nombre del químico francés Victor Grignard (1871-1935), quien ganó el Premio Nobel de Química en 1912 por su desarrollo. En una reacción de Grignard, el grupo funcional carbonilo se convierte en un alcohol, y la cadena carbonada del compuesto carbonilo se alarga mediante la adición del grupo R del reactivo de Grignard. Un ejemplo es hacer reaccionar cloruro de ciclohexilmagnesio, un reactivo de Grignard, con formaldehído:
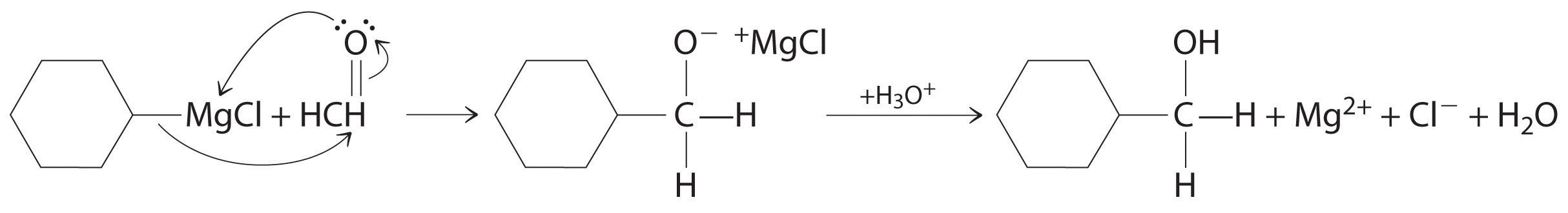
El carbanión nucleófilo del anillo ciclohexilo ataca el átomo de carbono electrófilo del grupo carbonilo. La acidificación de la solución da como resultado la protonación del intermedio para dar el alcohol. Los aldehídos también se pueden preparar reduciendo un grupo ácido carboxílico (-CO 2H) (parte (a) en la Figura 24.5.7), y las cetonas se pueden preparar haciendo reaccionar un derivado de ácido carboxílico con un reactivo de Grignard. La primera reacción requiere un potente agente reductor, tal como un hidruro metálico.
Explique cómo procede cada reacción para formar el producto indicado.
Dado: reacción química
Preguntado por: cómo se forman los productos
Estrategia:
- Identificar el grupo funcional y clasificar la reacción.
- Utilizar los mecanismos descritos para proponer los pasos iniciales en la reacción.
Solución:
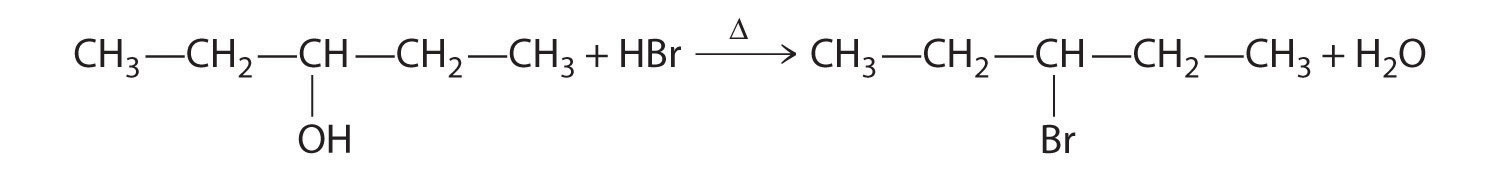
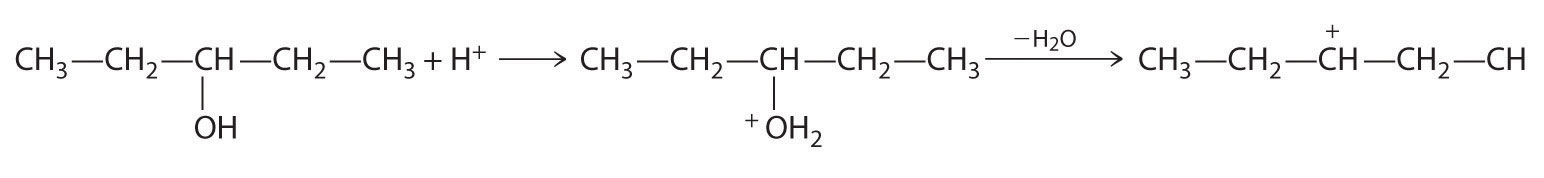
- A Un reactivo es un alcohol que se somete a una reacción de sustitución.
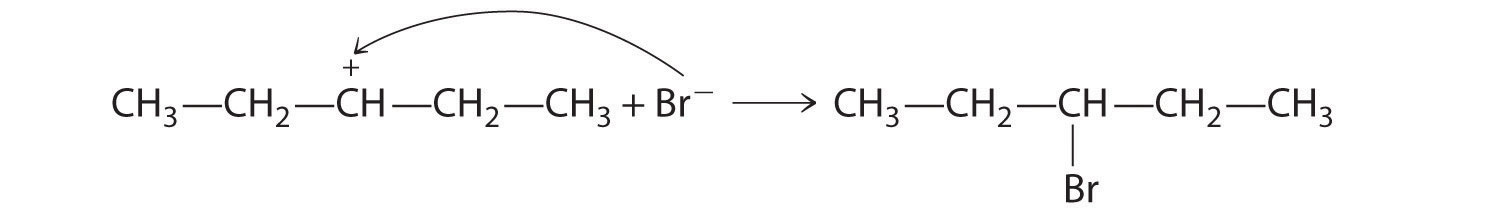
B En el producto, un grupo bromuro es sustituido por un grupo hidroxilo. Por lo tanto, el primer paso en esta reacción debe ser la protonación del grupo —OH del alcohol por H + de HBr, seguido de la eliminación del agua para dar el carbocatión:
El ion bromuro es un buen nucleófilo que puede reaccionar con el carbocatión para dar un bromuro de alquilo:
- A Un reactivo es un reactivo de Grignard, y el otro contiene un grupo funcional carbonilo. Los compuestos carbonílicos actúan como electrófilos, sufriendo ataque nucleofílico en el carbono carbonílico.
B El nucleófilo es el carbanión fenilo del reactivo de Grignard:
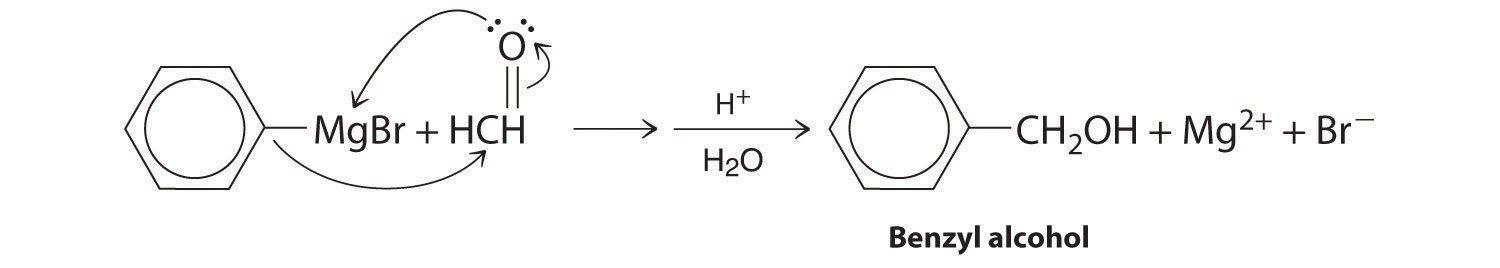
El producto es alcohol bencílico.
Predecir el producto de cada reacción.
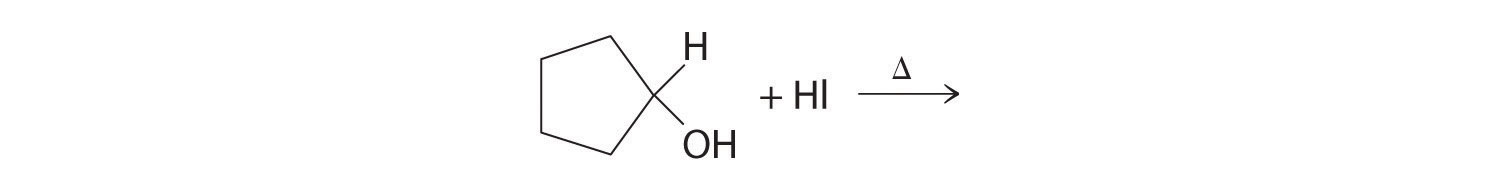
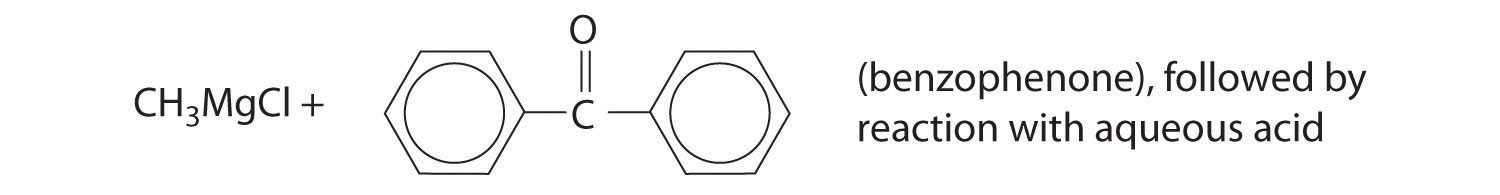
Respuesta:
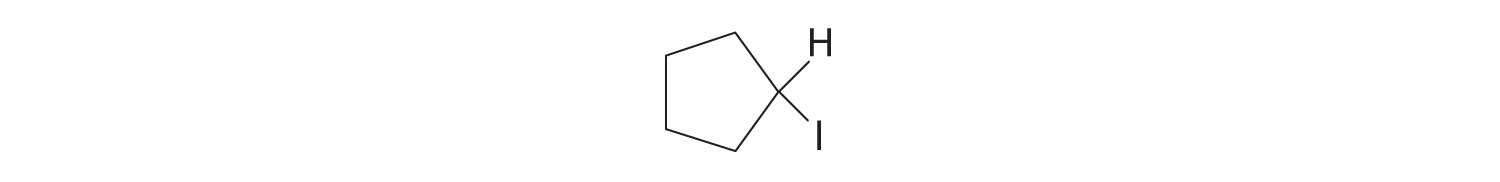
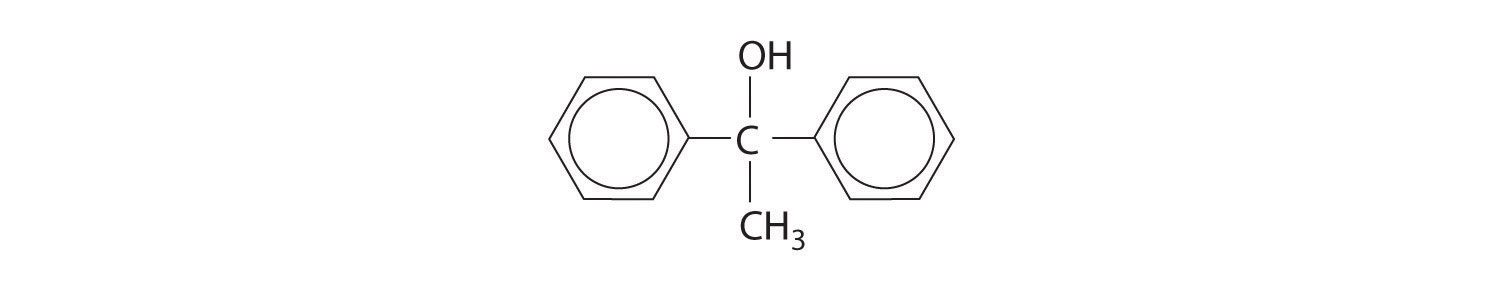
Ácidos Carboxílicos
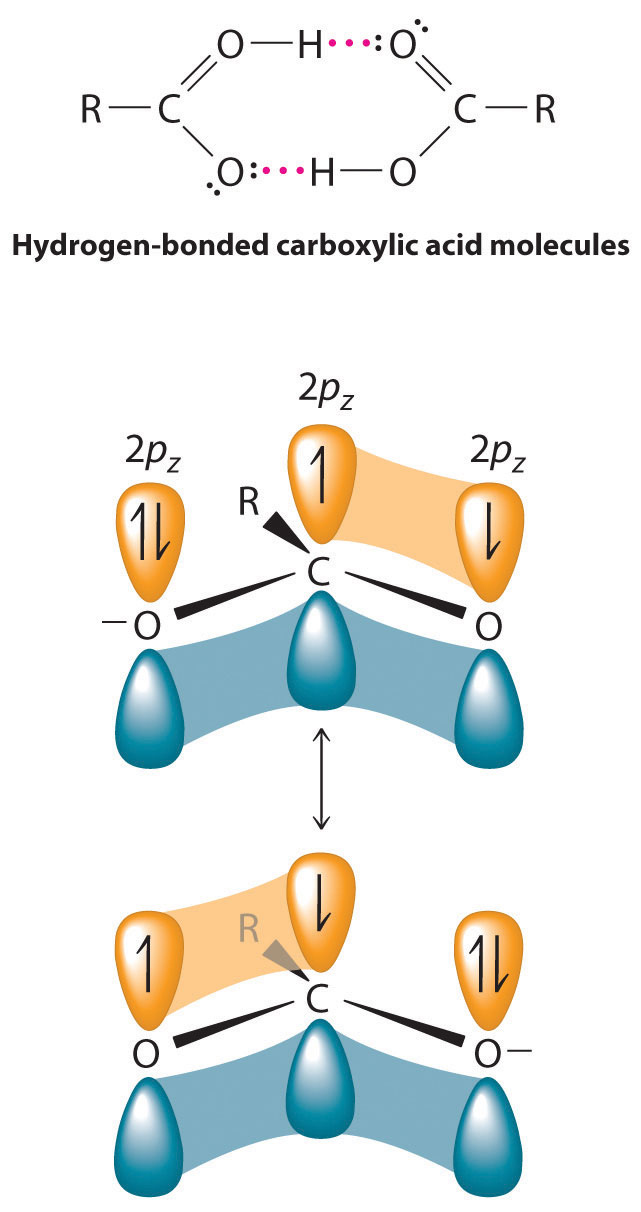
Los olores picantes de muchos ácidos carboxílicos son responsables de los olores que asociamos con fuentes tan diversas como el queso suizo, la mantequilla rancia, el estiércol, las cabras y la leche agria. Los puntos de ebullición de los ácidos carboxílicos tienden a ser algo más altos de lo que se esperaría de sus masas moleculares debido a las fuertes interacciones de enlaces de hidrógeno entre las moléculas. De hecho, la mayoría de los ácidos carboxílicos simples forman dímeros en la fase líquida e incluso en fase vapor. Los cuatro ácidos carboxílicos más ligeros son completamente miscibles con agua, pero a medida que la cadena alquílica se alarga, se vuelven más “similares a alcanos”, por lo que su solubilidad en agua disminuye.
Los compuestos que contienen el grupo funcional carboxilo son ácidos porque los ácidos carboxílicos pueden perder fácilmente un protón: la carga negativa en el ion carboxilato (RCO 2 −) se estabiliza por deslocalización de los electrones π:
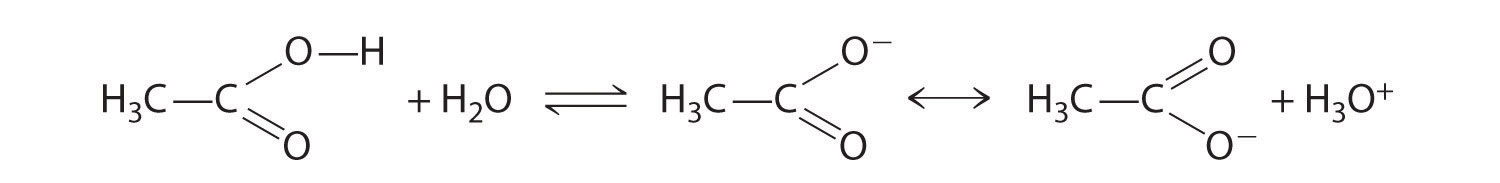
Como resultado, los ácidos carboxílicos son aproximadamente 10 veces más ácidos que los alcoholes simples correspondientes cuyos aniones (RO −) no se estabilizan por resonancia.
Los ácidos carboxílicos se preparan típicamente oxidando los alcoholes y aldehídos correspondientes (parte (a) en la Figura 24.5.7). También se pueden preparar haciendo reaccionar un reactivo de Grignard con CO 2, seguido de acidificación:
\[\mathrm{CO_2+ RMgCl \xrightarrow{H_3O^+} RCO_2H + Mg^{2+}+ Cl^-+ H_2O} \tag{24.5.2}\]
La etapa inicial en la reacción es el ataque nucleofílico por el grupo R − del reactivo de Grignard sobre el carbono electrófilo de CO 2:
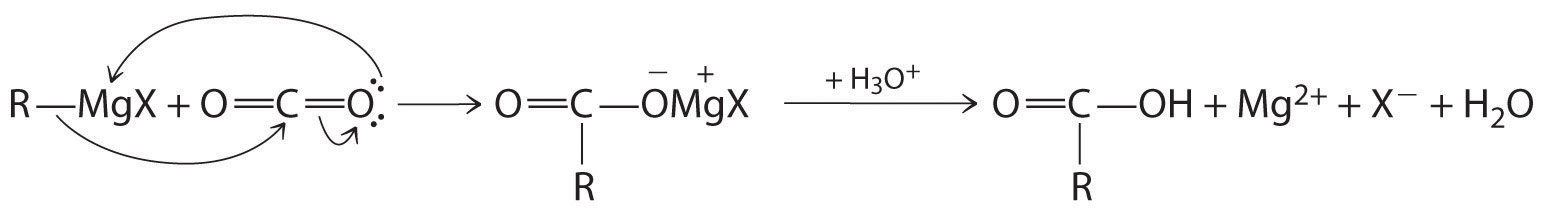
La deslocalización del enlace π sobre tres átomos (O—C—O) hace que los ácidos carboxílicos y sus derivados sean menos susceptibles al ataque nucleofílico que los aldehídos y cetonas con su enlace sencillo π. Las reacciones de los ácidos carboxílicos están dominadas por dos factores: su grupo polar —CO 2 H y su acidez. La reacción con bases fuertes, por ejemplo, produce sales de carboxilato, tales como estearato de sodio:
\[RCO_2H + NaOH \rightarrow RCO_2^−Na^+ + H_2O \tag{24.5.3}\]
donde R es CH 3 (CH 2) 16. Como aprendiste en anteriormente las sales de carboxilato de cadena larga se utilizan como jabones.
La deslocalización del enlace π sobre tres átomos hace que los ácidos carboxílicos y sus derivados sean menos susceptibles al ataque nucleofílico en comparación con aldehídos y cetonas.
Derivados de ácido carboxílico
Reemplazar el —OH de un ácido carboxílico por grupos que tienen diferentes tendencias a participar en la resonancia con el grupo funcional C=O produce derivados con propiedades bastante diferentes. Las estructuras de resonancia tienen efectos significativos sobre la reactividad de los derivados de ácidos carboxílicos, pero su influencia varía sustancialmente, siendo la menos importante para los haluros y la más importante para el nitrógeno de las amidas. En esta sección, echamos un breve vistazo a la química de dos de los derivados de ácidos carboxílicos más familiares e importantes: ésteres y amidas.
Ésteres
Los ésteres tienen la fórmula general RCO2R', donde R y R' pueden ser virtualmente cualquier grupo alquilo o arilo. Los ésteres a menudo se preparan haciendo reaccionar un alcohol (R′OH) con un ácido carboxílico (RCO 2H) en presencia de una cantidad catalítica de ácido fuerte. El propósito del ácido (un electrófilo) es protonar el átomo de oxígeno doblemente unido del ácido carboxílico (un nucleófilo) para dar una especie que es más electrófila que el ácido carboxílico parental.
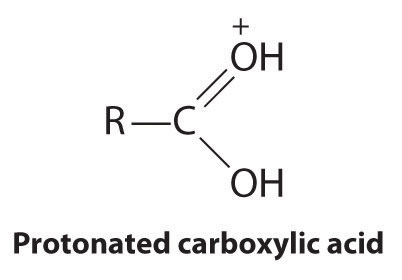
El átomo de oxígeno nucleofílico del alcohol ataca el átomo de carbono electrófilo del ácido carboxílico protonado para formar un nuevo enlace C-O. La reacción general se puede escribir de la siguiente manera:
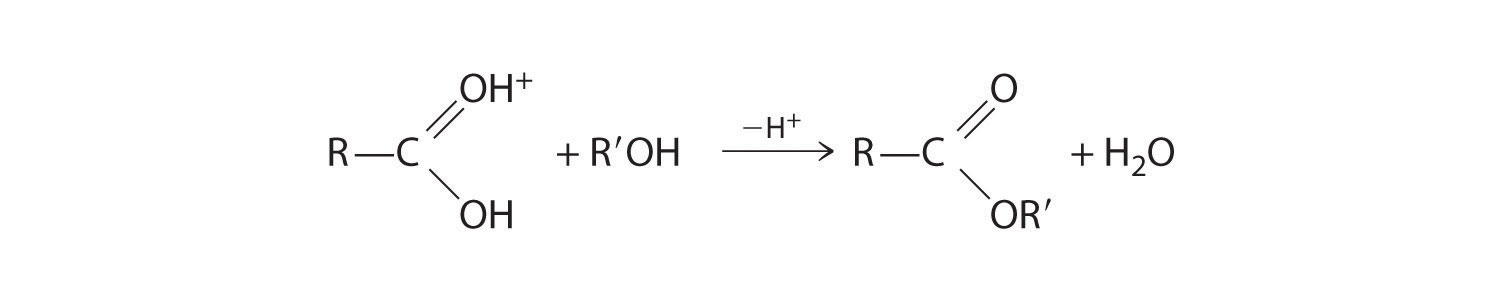
Debido a que se elimina el agua, esta es una reacción de deshidratación. Si se calienta una solución acuosa de un éster y ácido o base fuerte, se producirá la reacción inversa, produciendo el alcohol parental R′OH y bien el ácido carboxílico RCO 2H (en condiciones fuertemente ácidas) o el anión carboxilato RCO 2 − (bajo condiciones básicas).
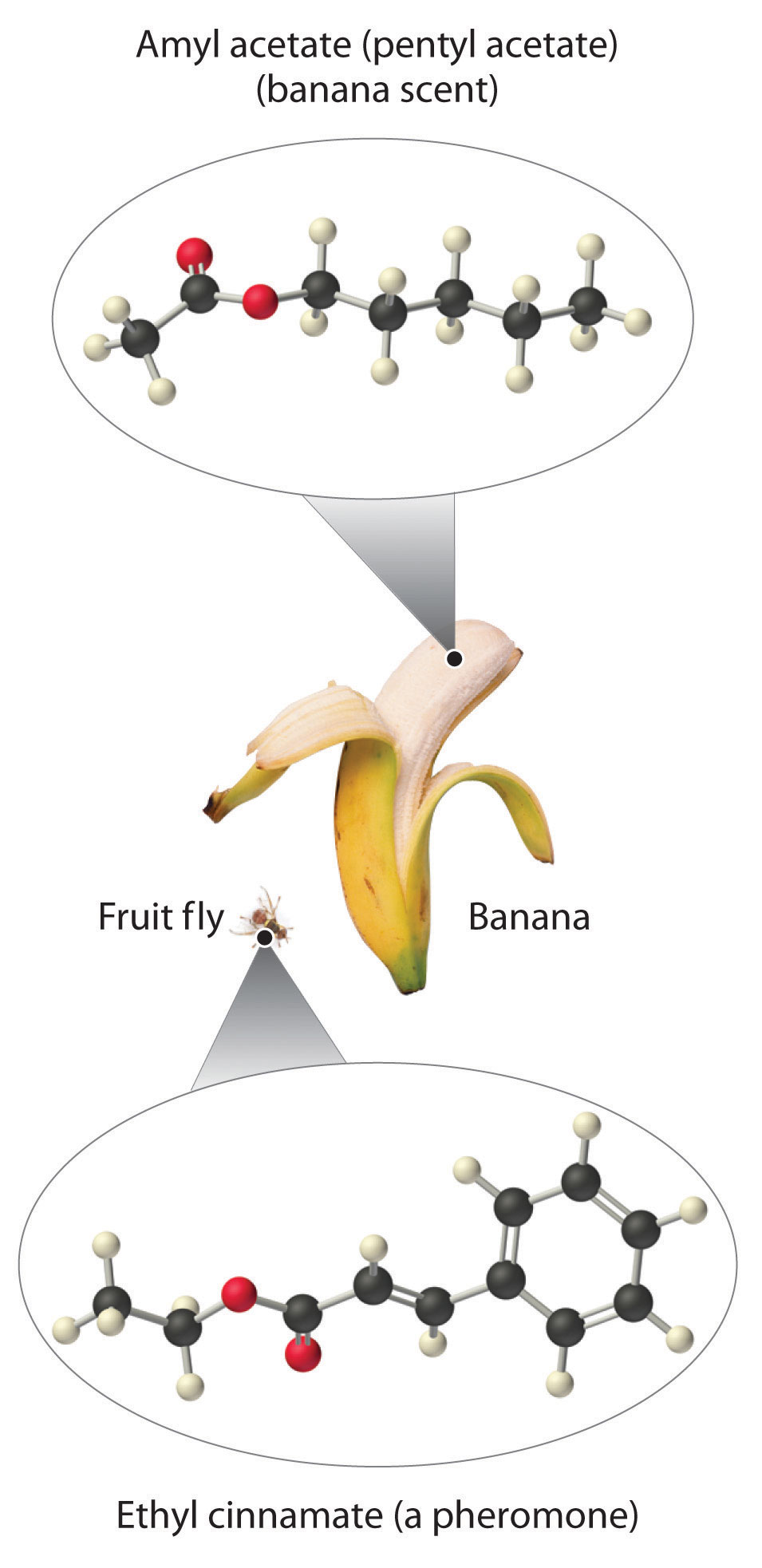
Como se indicó anteriormente, los ésteres son familiares para la mayoría de nosotros como fragancias, como el plátano y la piña. Otros ésteres con aromas intensos funcionan como atrayentes sexuales, o feromonas, como la feromona de la mosca oriental de la fruta. La investigación sobre el uso de feromonas sintéticas de insectos como una alternativa más segura a los insecticidas para el control de poblaciones de insectos, como las cucarachas, es un campo de rápido crecimiento en química orgánica.
Amidas
En la estructura general de una amida,
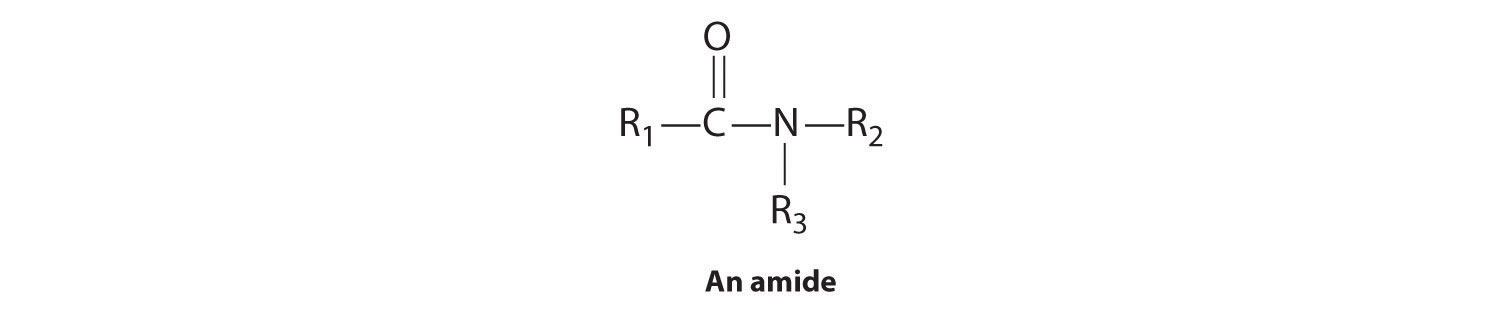
los dos sustituyentes en el nitrógeno de amida pueden ser átomos de hidrógeno, grupos alquilo, grupos arilo o cualquier combinación de esas especies. Aunque las amidas parecen derivarse de un ácido y una amina, en la práctica generalmente no se pueden preparar por esta vía sintética. En principio, podría ocurrir un ataque nucleofílico por el único par de electrones de la amina sobre el carbono del ácido carboxílico, pero debido a que los ácidos carboxílicos son ácidos débiles y las aminas son bases débiles, generalmente ocurre una reacción ácido-base en su lugar:
\[RCO_2H + R′NH_2 \rightarrow RCO_2^− + R′NH_3^+ \tag{24.5.4}\]
Por lo tanto, las amidas generalmente se preparan mediante la reacción nucleofílica de aminas con más derivados de ácido carboxílico electrófilo, tales como ésteres.
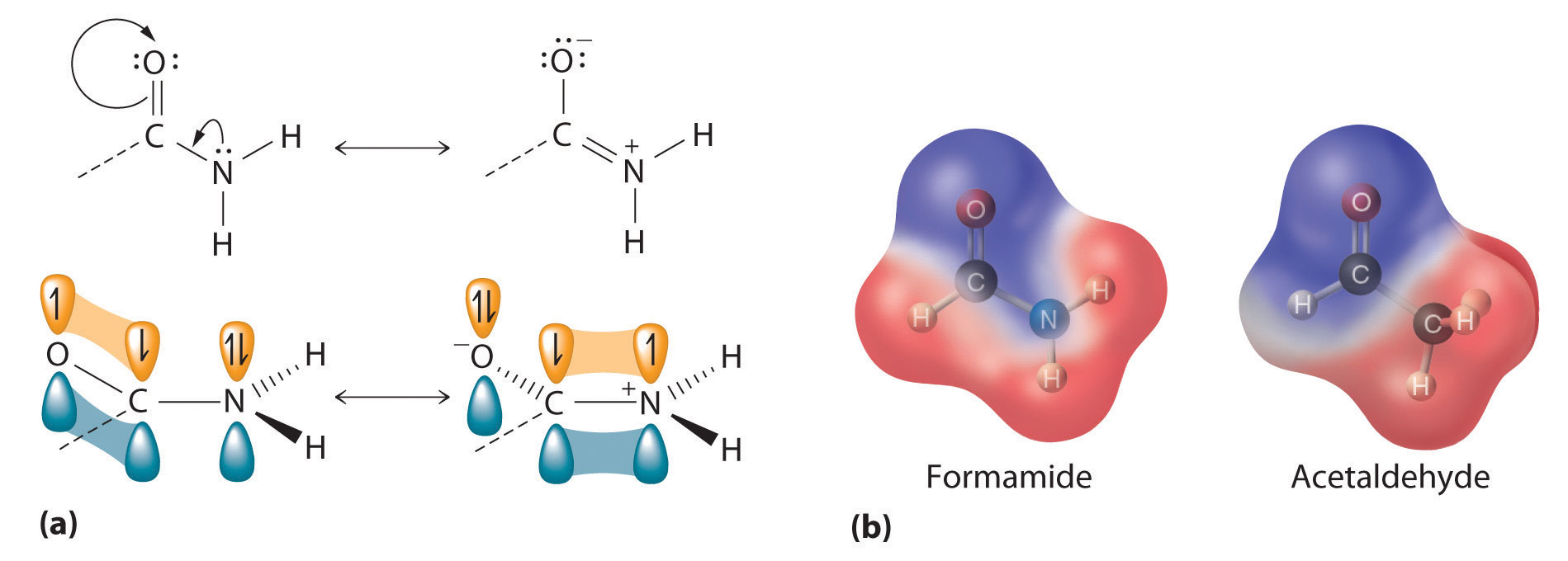
El par solitario de electrones en el átomo de nitrógeno de una amida puede participar en el enlace π con el grupo carbonilo, reduciendo así la reactividad de la amida (Figura 24.5.5) e inhibiendo la rotación libre alrededor del enlace C-N. Por lo tanto, las amidas son las menos reactivas de los derivados de ácido carboxílico. La estabilidad del enlace amida es de crucial importancia en biología porque los enlaces amida forman las cadenas principales de péptidos y proteínas. El enlace amida también se encuentra en muchas otras moléculas biológicamente activas y comercialmente importantes, incluyendo penicilina; urea, que se usa como fertilizante; sacarina, un sustituto del azúcar; y valium, un potente tranquilizante.
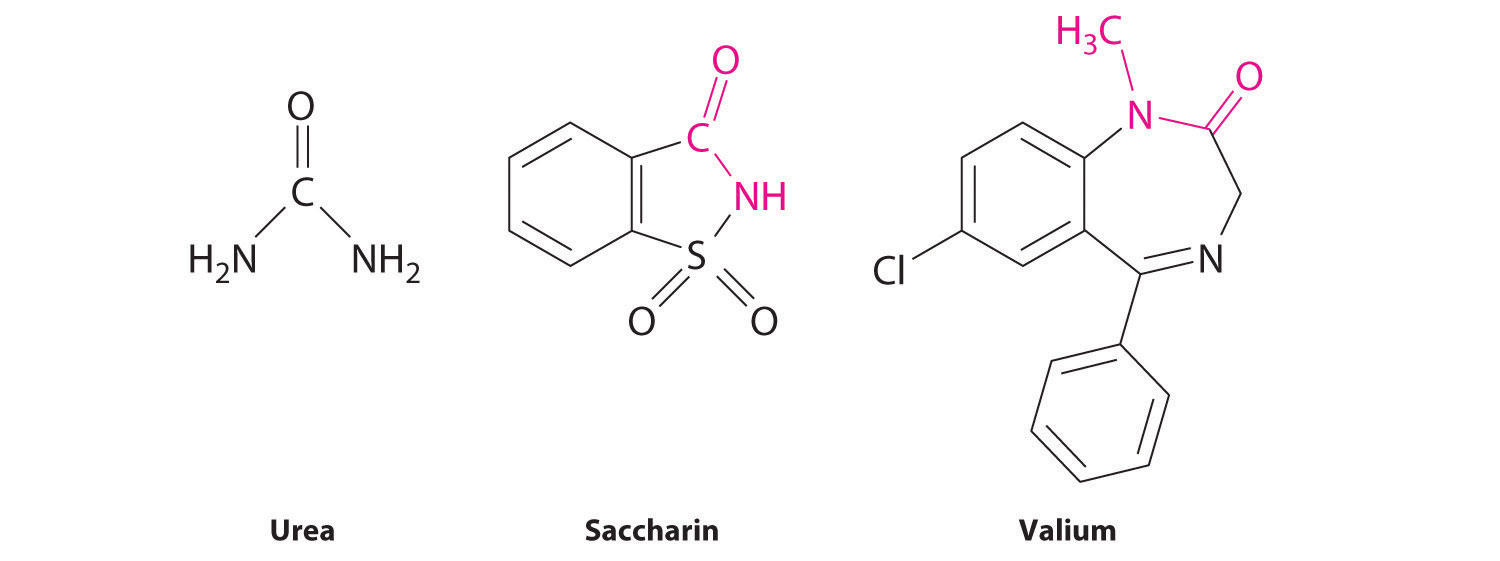
Las amidas son las menos reactivas de los derivados de ácido carboxílico porque las amidas participan en enlaces π con el grupo carbonilo.
Aaminas
Las aminas son derivados del amoníaco en los que uno o más átomos de hidrógeno han sido reemplazados por grupos alquilo o arilo. Por lo tanto, son análogos a alcoholes y éteres. Al igual que los alcoholes, las aminas se clasifican como primarias, secundarias o terciarias, pero en este caso la designación se refiere al número de grupos alquilo unidos al átomo de nitrógeno, no al número de átomos de carbono adyacentes. En las aminas primarias, el nitrógeno está unido a dos átomos de hidrógeno y un grupo alquilo; en las aminas secundarias, el nitrógeno está unido a un hidrógeno y dos grupos alquilo; y en las aminas terciarias, el nitrógeno está unido a tres grupos alquilo. Con un solo par de electrones y enlaces C-N que son menos polares que los enlaces C—O, el amoníaco y las aminas simples tienen puntos de ebullición mucho más bajos que el agua o los alcoholes con masas moleculares similares. Las aminas primarias tienden a tener puntos de ebullición intermedios entre los del alcohol y alcano correspondientes. Además, las aminas secundarias y terciarias tienen puntos de ebullición más bajos que las aminas primarias de masa molecular comparable.
Las aminas terciarias forman cationes análogos al ion amonio (NH 4 +), en los que los cuatro átomos de H son reemplazados por grupos alquilo. Dichas sustancias, llamadas sales de amonio cuaternario, pueden ser quirales si los cuatro sustituyentes son diferentes. (Las aminas con tres sustituyentes diferentes también son quirales porque el par solitario de electrones representa un cuarto sustituyente).
Las alquilaminas se pueden preparar mediante reacciones de sustitución nucleofílica de haluros de alquilo con amoníaco u otras aminas:
\[RCl + NH_3 \rightarrow RNH_2 + HCl \tag{24.5.5}\]
\[RCl + R′NH_2 \rightarrow RR′NH + HCl \tag{24.5.6}\]
\[RCl + R′R″NH \rightarrow RR′R″N + HCl \tag{24.5.7}\]
La amina primaria formada en la primera reacción (Ecuación 24.5.5) puede reaccionar con más haluro de alquilo para generar una amina secundaria (Ecuación 24.5.6), que a su vez puede reaccionar para formar una amina terciaria (Ecuación 24.5.7). En consecuencia, la mezcla de reacción real contiene aminas primarias, secundarias y terciarias e incluso sales de amonio cuaternario.
Las reacciones de las aminas están dominadas por dos propiedades: su capacidad para actuar como bases débiles y su tendencia a actuar como nucleófilos, ambas debido a la presencia del par solitario de electrones en el átomo de nitrógeno. Las aminas se comportan típicamente como bases aceptando un protón de un ácido para formar una sal de amonio, como en la reacción de trietilamina (el grupo etilo se representa como Et) con HCl acuoso (se muestra el par solitario de electrones sobre nitrógeno):
\[Et_3N:(l) + HCl{(aq)} \rightarrow Et_3NH^+Cl^−_{(aq)} \tag{24.5.8}\]
que da cloruro de trietilamonio. Las aminas pueden reaccionar con prácticamente cualquier electrófilo, incluyendo el carbono carbonílico de un aldehído, una cetona o un éster. Las aril aminas como la anilina (C 6 H 5 NH 2) son bases mucho más débiles que las alquilaminas debido a que el par solitario de electrones sobre nitrógeno interactúa con los enlaces π del anillo aromático, deslocalizando el par solitario a través de resonancia (Figura 24.5.6).
Las reacciones de las aminas están dominadas por su capacidad de actuar como bases débiles y su tendencia a actuar como nucleófilos.
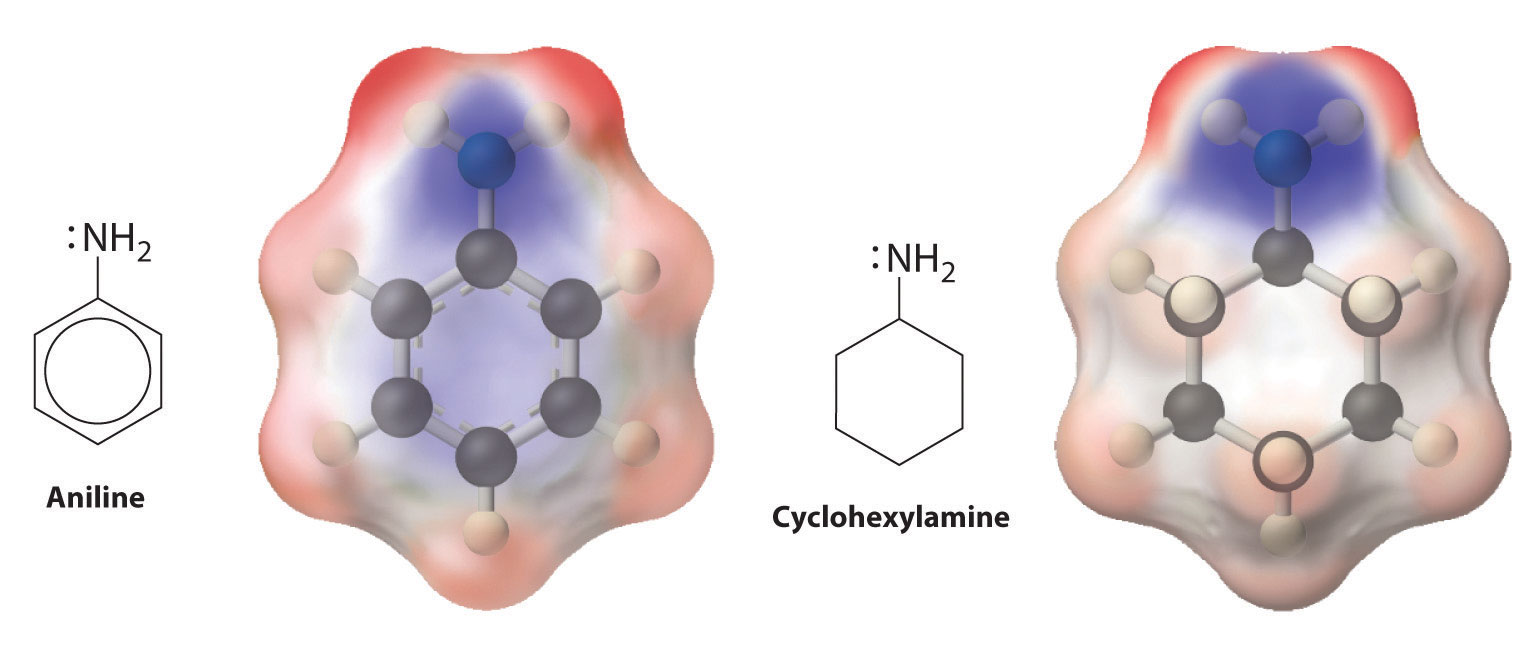
La deslocalización del par de electrones solitario en N sobre el anillo de benceno reduce la basicidad de las aril aminas, como la anilina, en comparación con la de las alquilaminas, como la ciclohexilamina. Estos mapas de potencial electrostático muestran que la densidad electrónica en el N de la ciclohexilamina está más localizada que en la anilina, lo que hace que la ciclohexilamina sea una base más fuerte.
Predecir los productos formados en cada reacción y mostrar el sitio inicial de ataque y, para la parte (b), los productos finales.
- C 6 H 5 CH 2 CO 2 H + KOH →
Dado: reactivos
Preguntado por: productos y mecanismo de reacción
Estrategia:
Utilice la estrategia esbozada en el Ejemplo 7.
Solución:
- El protón en el grupo funcional ácido carboxílico es ácido. Por lo tanto, hacer reaccionar un ácido carboxílico con una base fuerte es una reacción ácido-base, cuyos productos son una sal, en este caso, C 6 H 5 CH 2 CO 2 − K + y agua.
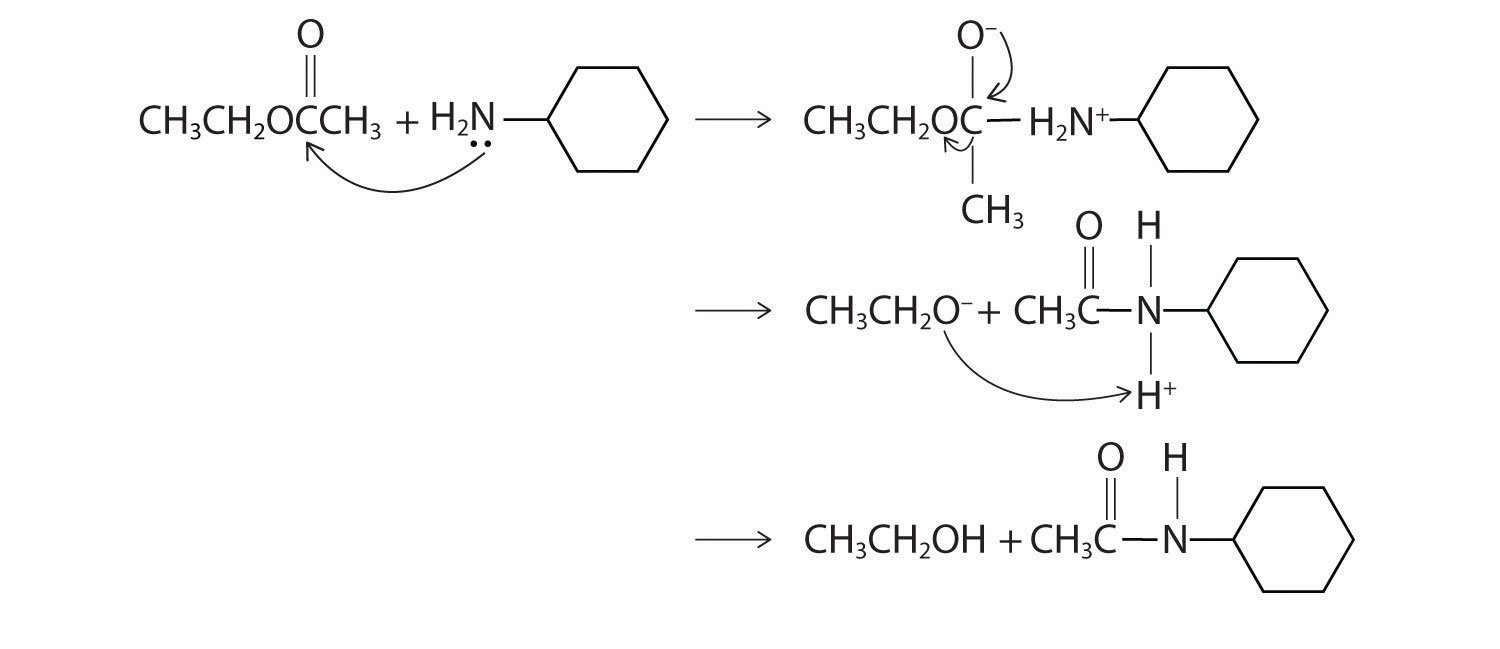
- El nitrógeno de la ciclohexilamina contiene un par solitario de electrones, lo que lo convierte en un excelente nucleófilo, mientras que el carbono carbonílico del acetato de etilo es un buen electrófilo. Por lo tanto, esperamos una reacción en la que el ataque nucleofílico sobre el carbono carbonílico del éster produzca una amida y etanol. El sitio inicial de ataque y los productos de reacción son los siguientes:
Predecir los productos de cada reacción. Anotar el lugar inicial del ataque.
- ácido acético con 1-propanol
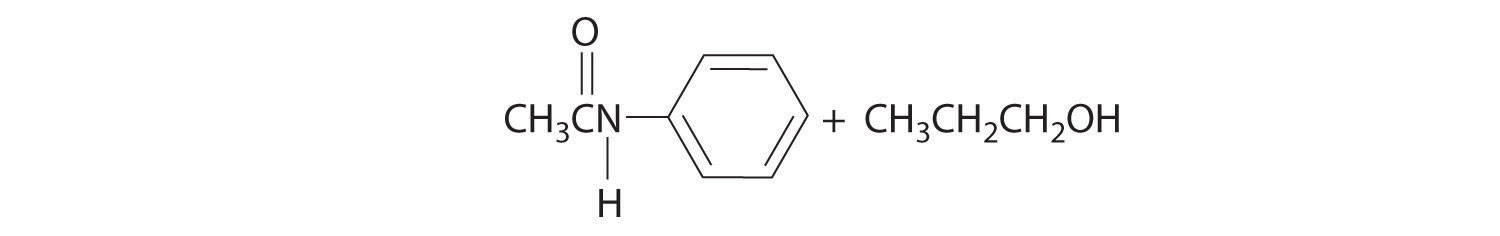
- anilina (C 6 H 5 NH 2) con acetato de propilo [CH 3 C (=O) OCH 2 CH 2 CH 3]
Respuesta:
- El ataque inicial ocurre con la protonación del oxígeno del carbonilo. Los productos son:
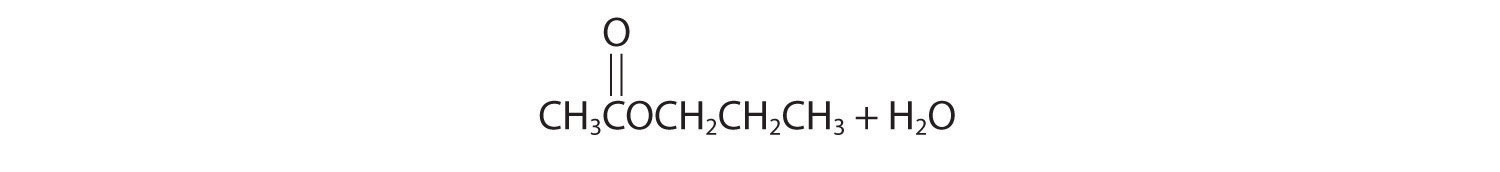
- El ataque inicial ocurre en el carbono del grupo carbonilo. Los productos son:
Las reacciones como las que hemos comentado en esta sección se utilizan para sintetizar una amplia gama de compuestos orgánicos. Sin embargo, cuando los químicos planean la síntesis de una molécula orgánica, deben tomar en consideración diversos factores, como la disponibilidad y costo de los reactivos, la necesidad de minimizar la formación de productos no deseados y la secuenciación adecuada de las reacciones para maximizar el rendimiento de la molécula diana y minimizar la formación de productos no deseados. Debido a que la síntesis de muchas moléculas orgánicas requiere múltiples pasos, en el diseño de un esquema sintético para tales moléculas, los químicos a menudo deben trabajar hacia atrás desde el producto deseado en un proceso llamado retrosíntesis. Mediante este proceso, pueden identificar las etapas de reacción necesarias para sintetizar el producto deseado a partir de los reactivos disponibles.
Resumen
- Las propiedades físicas y la reactividad de los compuestos que contienen los grupos funcionales comunes están íntimamente conectadas a sus estructuras.
Hay fuertes conexiones entre la estructura, las propiedades físicas y la reactividad para los compuestos que contienen los principales grupos funcionales. Los hidrocarburos que son alcanos se someten a craqueo catalítico, que puede convertir alcanos de cadena lineal en alcanos altamente ramificados. El craqueo catalítico es un ejemplo de una reacción de pirólisis, en la que el enlace más débil se escinde a alta temperatura, produciendo una mezcla de radicales. El enlace múltiple de un alqueno produce isómeros geométricos (cis y trans). Los alquinos terminales contienen un átomo de hidrógeno unido directamente a un carbono triplicado. La eliminación del hidrógeno forma un ion acetiluro, un potente nucleófilo utilizado para hacer cadenas de carbono más largas. Los arenos experimentan sustitución en lugar de eliminación debido a la mayor estabilidad de la deslocalización de su densidad de electrones π. Un alcohol a menudo se prepara añadiendo los elementos de agua a través de un doble enlace o mediante una reacción de sustitución. Los alcoholes experimentan dos tipos principales de reacciones: las que implican la escisión del enlace O-H y las que implican la escisión del enlace C-O. Los fenoles son ácidos debido a las interacciones π entre el átomo de oxígeno y el anillo. Los éteres son comparativamente no reactivos. Los aldehídos y cetonas generalmente se preparan oxidando alcoholes. Su química se caracteriza por el ataque nucleofílico en el átomo de carbono del grupo funcional carbonilo y el ataque electrófilo en el átomo de oxígeno. Los reactivos de Grignard (rMgX, donde X es Cl, Br o I) convierten el grupo funcional carbonilo en un alcohol y alargan la cadena de carbono. Los compuestos que contienen el grupo funcional carboxilo son débilmente ácidos debido a la deslocalización de los electrones π, lo que hace que pierdan fácilmente un protón y formen el anión carboxilato. Los ácidos carboxílicos se preparan generalmente oxidando alcoholes y aldehídos o haciendo reaccionar un reactivo de Grignard con CO 2. Los derivados de ácido carboxílico incluyen ésteres, preparados haciendo reaccionar un ácido carboxílico y un alcohol, y amidas, preparadas por la reacción nucleofílica de aminas con más derivados de ácido carboxílico electrófilo, tales como ésteres. Las amidas son relativamente poco reactivas debido a las interacciones de enlace π entre el par solitario en nitrógeno y el grupo carbonilo. Las aminas también pueden ser primarias, secundarias o terciarias, dependiendo del número de grupos alquilo unidos a la amina. Las sales de amonio cuaternario tienen cuatro sustituyentes unidos al nitrógeno y pueden ser quirales. Las aminas a menudo se preparan mediante una reacción de sustitución nucleófila entre un haluro de alquilo polar y amoníaco u otras aminas. Son nucleófilos, pero su fuerza base depende de sus sustituyentes.
Problemas conceptuales
- ¿Por qué los alcanos de cadena ramificada tienen puntos de fusión más bajos que los alcanos de cadena lineal de masa molecular comparable?
- Describir los alcanos en términos de su hibridación orbital, polaridad y reactividad. ¿Cuál es la geometría de cada carbono de un alcano de cadena lineal?
- ¿Por qué los alquenos forman isómeros cis y trans, mientras que los alcanos no? ¿Los alquinos forman isómeros cis y trans? ¿Por qué o por qué no?
- ¿Qué compuestos pueden existir como isómeros cis y trans?
- 2,3-dimetil-1-buteno
- 3-metil-1-buteno
- 2-metil-2-penteno
- 2-penteno
- ¿Qué compuestos pueden existir como isómeros cis y trans?
- 3-etil-3-hexeno
- 1,1-dicloro-1-propeno
- 1-cloro-2-penteno
- 3-octeno
- ¿Qué compuestos tienen un momento dipolo neto?
- o-nitrotolueno
- p-bromonitrobenceno
- p-dibromobenceno
- ¿Por qué el punto de ebullición de un alcohol es tanto mayor que el de un alcano de masa molecular comparable? ¿Por qué los alcoholes de baja masa molecular son razonablemente buenos solventes para algunos compuestos iónicos, mientras que los alcanos no lo son?
- ¿Un alcohol es un nucleófilo o un electrófilo? ¿Qué determina el modo de reactividad de un alcohol? ¿En qué se diferencia la reactividad de un alcohol de la de un compuesto iónico que contiene OH, como KOH?
- ¿Cómo se compara la reactividad de los éteres con la de los alcoholes? ¿Por qué? Los éteres pueden ser escindidos bajo condiciones fuertemente ácidas. Explique cómo puede ocurrir esto.
- ¿Qué grupo funcional es común a los aldehídos, cetonas, ácidos carboxílicos y ésteres? Este grupo funcional puede reaccionar tanto con nucleófilos como electrófilos. ¿Dónde ocurre el ataque nucleofílico a este grupo funcional? ¿Dónde ocurre el ataque electrofílico?
- ¿Qué característica clave de un reactivo de Grignard le permite participar en un ataque nucleofílico sobre un carbono carbonilo?
- ¿Espera que los ácidos carboxílicos sean más o menos solubles en agua que las cetonas de masa molecular comparable? ¿Por qué?
- Debido a que las amidas se derivan formalmente de un ácido más una amina, ¿por qué no pueden prepararse por la reacción de un ácido con una amina? ¿Cómo se preparan generalmente?
- ¿Es una amida susceptible al ataque nucleofílico, electrofílico o ambos? Especificar dónde ocurre el ataque.
- ¿Qué factores determinan la reactividad de las aminas?
RESPUESTAS
- c) y d)
- La presencia de un C δ− nucleofílico resultante de una interacción altamente polar con un Mg electropositivo
- Su capacidad para actuar como bases débiles y su tendencia a actuar como nucleófilos
Estructura y Reactividad
- ¿Cuál es el producto de la reacción del 2-butino con exceso de HBr?
- ¿Cuál es el producto de la reacción de 3-hexino con exceso de HCl?
- ¿Qué elementos se eliminan durante la deshidrohalogenación de un haluro de alquilo? ¿Qué productos espera de la deshidrohalogenación del 2-cloro-1-penteno?
- ¿Qué elementos se eliminan durante la deshidratación de un alcohol? ¿Qué productos esperas de la deshidratación del etanol?
- Predecir los productos de cada reacción.
- fenóxido de sodio con cloruro de etilo
- 1-cloropropano con NaOH
- Mostrar el mecanismo y predecir el producto orgánico de cada reacción.
- 2-propanol + HCl
- ciclohexanol + H 2 SO 4
- Se puede usar un reactivo de Grignard para generar un ácido carboxílico. Mostrar el mecanismo para el primer paso en esta reacción usando CH 3 CH 2 MgBr como reactivo de Grignard. ¿Cuál es la geometría sobre el carbono del —CH 2 de las especies intermedias formadas en este primer paso?
- Dibuje una imagen orbital molecular que muestre la unión en una amida. ¿Qué orbital se utiliza para el par solitario de electrones sobre nitrógeno?
- Cuál es el producto de la reacción de
- ácido acético con amoníaco?
- acetato de metilo con etilamina, seguido de calor?
- Desarrollar un esquema sintético para generar
- 1,1-dicloroetano de 1,1-dibromoetano.
- 2-bromo-1-hepteno de 1-bromopentano.
RESPUESTAS
- 2,2-dibromobutano
- C 6 H 5 OC 2 H 5 + NaCl
- 1-propanol + NaCl
- CH 3 CO 2 − NH 4 + (una reacción ácido-base)
- CH 3 CONHC 2 H 5 + CH 3 OH


