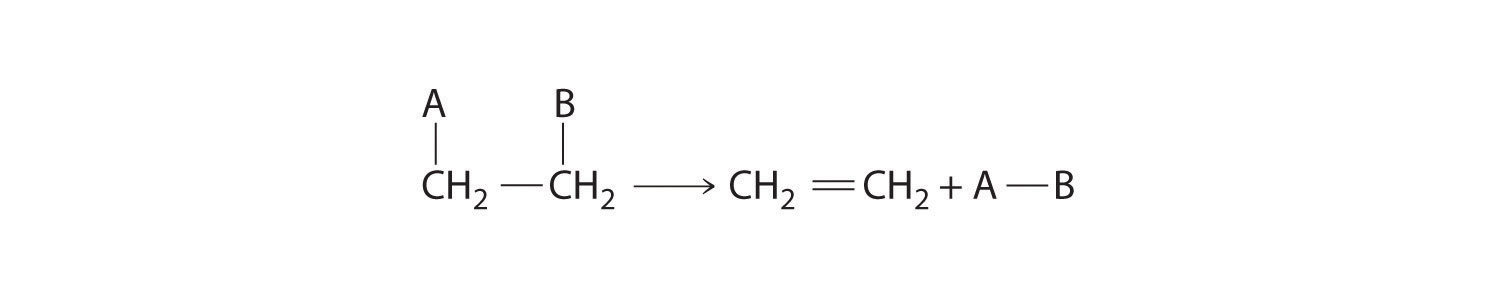23.5: Clases Comunes de Reacciones Orgánicas
- Page ID
- 78377
- Familiarizarse con las clases comunes de reacciones orgánicas.
Ciertos patrones se encuentran repetidamente en reacciones orgánicas, muchos de ellos reflejando las interacciones de nucleófilos y electrófilos. En esta sección, discutimos cinco tipos comunes de reacciones orgánicas: reacciones de sustitución, reacciones de eliminación, reacciones de adición, reacciones radicales y reacciones de oxidación-reducción. Anteriormente se han encontrado muchos de estos tipos de reacciones, como la formación de péptidos mediante la eliminación del agua, las reacciones de oxidación-reducción que generan voltaje en las baterías y las reacciones en cadena que involucran radicales orgánicos. (Para mayor información sobre la formación de péptidos, consulte la Sección 12.8. Para obtener más información sobre las baterías, consulte el Capítulo 19. Para mayor información sobre los radicales, consulte la Sección 14.6.) En esta sección, ampliamos nuestra discusión para incluir algunos de los mecanismos detrás de estas reacciones.
Sustitución
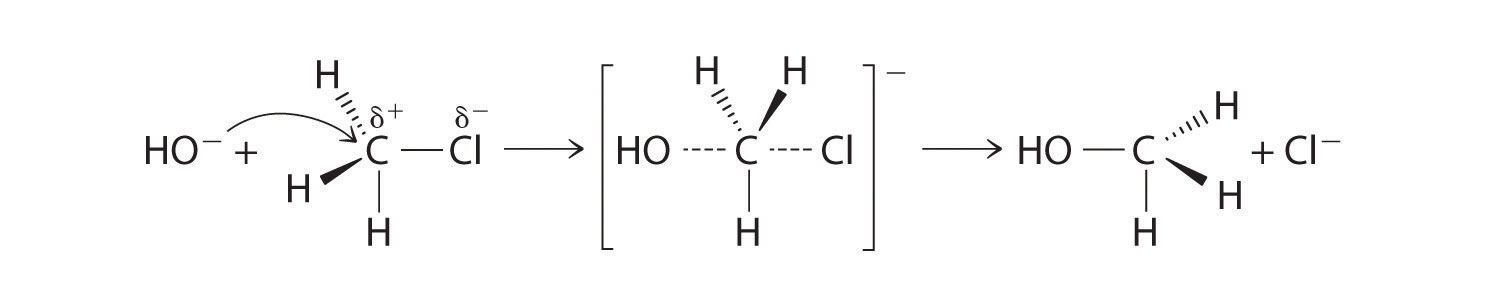
En una reacción de sustitución Una reacción química en la que un átomo o un grupo de átomos en una sustancia es reemplazado por otro átomo o un grupo de átomos de otra sustancia. , un átomo o un grupo de átomos en una sustancia es reemplazado por otro átomo o grupo de átomos de otra sustancia. Una reacción de sustitución típica es hacer reaccionar el ion hidróxido con cloruro de metilo:
\( CH_{3}Cl + OH^{-} \rightarrow CH_{3}OH + Cl^{-} \tag{23.4.1} \)
El cloruro de metilo tiene un enlace C—Cl polar, teniendo el átomo de carbono una carga positiva parcial. En la Ecuación 24.1, el átomo de Cl electronegativo es reemplazado por otra especie electronegativa que es un nucleófilo más fuerte, en este caso OH −. Las reacciones de este tipo se denominan reacciones de sustitución nucleofílica. Para que ocurra este tipo de reacción, el reactivo nucleófilo debe poseer un par de electrones y tener una mayor afinidad por el átomo de carbono electropositivo que el sustituyente original.
Un tipo de reacción de sustitución nucleofílica se muestra en la Ecuación 24.1. Procede por un mecanismo en el que el par solitario de electrones en el nucleófilo entrante (OH −) ataca el átomo de carbono parcialmente cargado positivamente del enlace polar C—Cl, haciendo que el enlace C—Cl se debilite y rompa:
Tenga en cuenta el patrón
En las reacciones de sustitución nucleofílica, el nucleófilo debe poseer un par de electrones y tener una mayor afinidad por las especies electropositivas que el sustituyente original.
La convención para escribir tal mecanismo es dibujar flechas que muestren la dirección del flujo de electrones, es decir, desde el centro rico en electrones (el nucleófilo) hasta el centro pobre en electrones (el electrófilo). La especie intermedia, encerrada entre corchetes, representa una disposición transitoria de átomos que solo se postula que existe. Si el átomo bajo ataque (en este caso, el átomo de carbono parcialmente cargado positivamente) tuviera grupos —CH 3 unidos a él en lugar de átomos de H, los grupos metilo voluminosos interferirían con el ataque de OH −, haciendo que la reacción se viera impedida estericamente. La reacción procedería entonces en dos etapas discretas en un segundo tipo de reacción de sustitución: el enlace C—Cl se rompería, formando el carbocatión (CH 3) 3 C+ (el electrófilo), que luego reaccionaría con hidróxido (el nucleófilo) en una etapa separada para dar el producto, (CH 3) 3 COH.
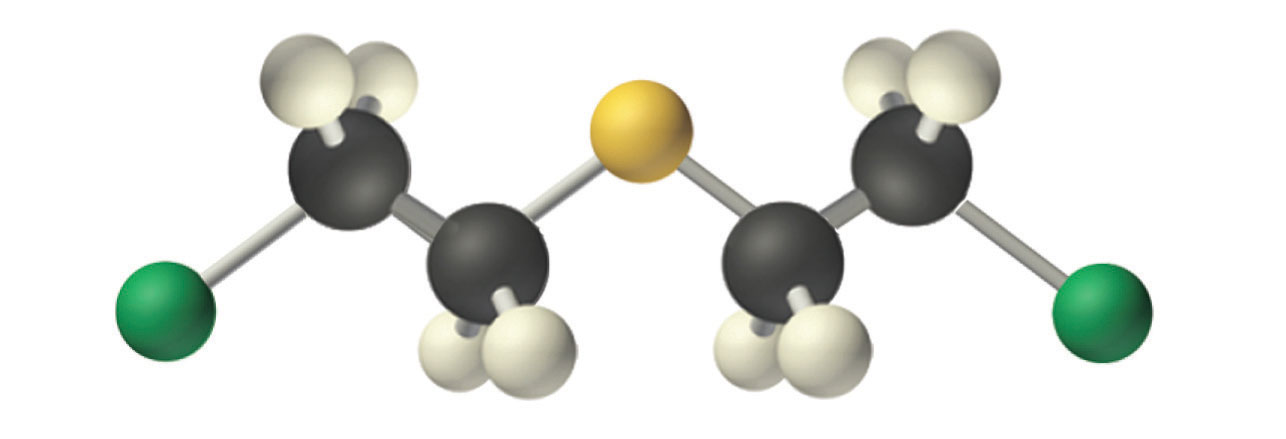
Gas mostaza.
Un ejemplo de una reacción de sustitución nucleofílica involucra al agente de guerra química conocido como gas mostaza [(ClCH 2 CH 2) 2 S], que causó alrededor de 400,000 bajas durante la Primera Guerra Mundial El gas mostaza es tóxico porque contiene un cloruro que puede ser desplazado por grupos amino nucleofílicos en proteínas, permitiendo así que la molécula se una irreversiblemente a una proteína. Debido a que el otro producto de la reacción es el HCl, el gas mostaza provoca quemaduras graves en las membranas mucosas del tracto respiratorio. Si el gas mostaza reacciona con el ADN (ácido desoxirribonucleico), se produce la reticulación de las cadenas de ADN a través del azufre, lo que da como resultado errores de codificación, la inhibición de la replicación y la alteración de otras funciones del ADN. Si el gas mostaza reacciona con ARN (ácido ribonucleico), se altera la síntesis de proteínas (ver Sección 22.6).
Eliminación
Algunas reacciones implican la eliminación, o “eliminación”, de átomos adyacentes de una molécula. Esto da como resultado la formación de un enlace múltiple y la liberación de una molécula pequeña, por lo que se denominan reacciones de eliminación Una reacción química en la que los átomos adyacentes se eliminan, o “eliminan”, de una molécula, dando como resultado la formación de un enlace múltiple y una molécula pequeña. . Tienen la forma general
y son similares a las reacciones de escisión en compuestos inorgánicos. (Para mayor información sobre las reacciones de escisión, consulte la Sección 7.5.) Un ejemplo típico es la conversión de cloruro de etilo en etileno:
\( CH_{3}CH_{2}Cl \rightarrow CH_{2}=CH_{2} +HCl \tag{23.4.2} \)
Tenga en cuenta el patrón
Las reacciones de eliminación son similares a las reacciones de escisión en compuestos inorgánicos.
Gran parte de los aproximadamente 26 millones de toneladas de etileno que se producen al año en Estados Unidos se utilizan para sintetizar plásticos, como el polietileno. En la Ecuación 23 .4.2, la molécula A—B eliminada es HCl, cuyos componentes se eliminan como H + del átomo de carbono de la izquierda y Cl − del carbono de la derecha. Cuando se produce un ácido, como ocurre aquí, la reacción generalmente se lleva a cabo en presencia de una base (como NaOH) para neutralizar el ácido.
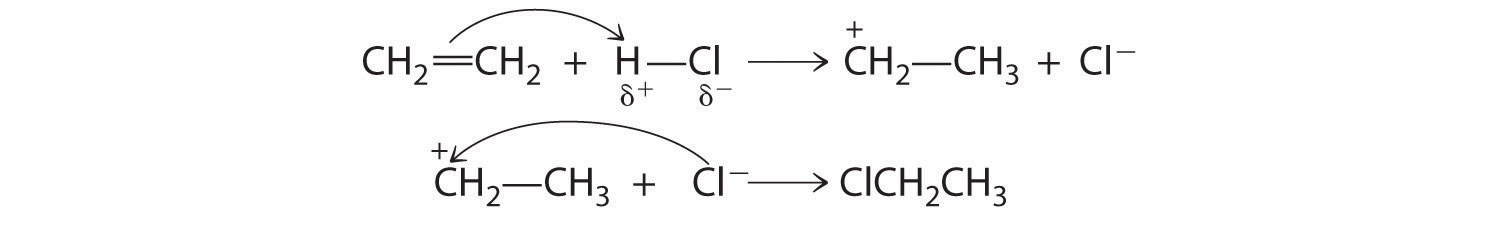
Adición
Una reacción en la que los componentes de una especie A—B se agregan a átomos adyacentes a través de un enlace múltiple carbono-carbono se denomina reacción de adición Una reacción química en la que los componentes de una especie A—B se agregan a átomos adyacentes a través de un enlace múltiple carbono-carbono. . Un ejemplo es el reverso de la reacción mostrada en la Ecuación 24.2, haciendo reaccionar HCl con etileno para dar cloruro de etilo:
\( CH_{2}=CH_{2} +HCl \rightarrow CH_{3}CH_{2}Cl \tag{23.4.3} \)
Tenga en cuenta el patrón
Una reacción de adición es la inversa de una reacción de eliminación.
Aunque un enlace múltiple es más fuerte que un enlace sencillo, los enlaces π del enlace múltiple son más débiles que el enlace σ. La alta densidad de electrones ubicada entre los átomos de carbono unidos multiplicadamente, sin embargo, hace que los alquenos y alquinos se comporten como nucleófilos, donde el ataque nucleofílico ocurre a partir de los electrones π más débilmente unidos. De ahí que los alquenos y alquinos sean considerados como grupos funcionales. El ataque nucleofílico ocurre en el átomo H δ+ del enlace HCl polar, produciendo inicialmente una especie con un carbono que solo tiene tres enlaces, un carbocatión. En un segundo ataque nucleofílico, Cl −, el electrófilo en la Ecuación 23.4.3 ataca el carbocatión:
Los alcoholes, una clase importante de compuestos orgánicos, a menudo se producen por reacciones de adición. El ataque inicial por el enlace π de un alqueno sobre un H δ+ de H 3 O + produce un carbocatión. El carbocatión sufre entonces ataque nucleofílico por un par solitario de electrones de H 2 O seguido de la eliminación de H + para formar el alcohol.
Reacciones radicales
Muchas reacciones orgánicas importantes involucran radicales, como la combustión de combustibles. Probablemente el más conocido es hacer reaccionar un hidrocarburo saturado, como el etano, con un halógeno, como Br 2. La reacción global es la siguiente:
\( CH_{3}CH_{3} +Br_{2} \xrightarrow[or h\nu ]{400^{o}C} CH_{3}CH_{2}Br + HBr \tag{23.4.4} \)
Las reacciones radicales en cadena ocurren en tres etapas: iniciación, propagación y terminación. (Para mayor información sobre los radicales, consulte la Sección 14.6.) A alta temperatura o en presencia de luz, el enlace Br-Br relativamente débil se rompe en una etapa de iniciación que produce un número apreciable de átomos de Br (Br·). Durante la propagación, un átomo de bromo ataca el etano, produciendo un radical, que luego reacciona con otra molécula de bromo para producir bromuro de etilo:
\ (\ comenzar {matriz}
\ cancelar {Br\ cdot} + CH_ {3} CH_ {3} &\ fila derecha\ cancelar {CH_ {3} CH_ {2}\ cdot} + HBr\
\ cancelar {CH_ {3} CH_ {2}\ cdot} + Br_ {2} &\ fila derecha CH_ {3} CH_ {2} Br +\ cancel {Br\ cdot}\\
— & —\\
Br_ {2} + CH_ {3} CH_ {3} &\ fila derecha CH_ {3} CH_ {2} Br + HBr
\ final {matriz}\ tag {23.4.5}\)
La suma de los dos pasos de propagación corresponde a la ecuación química equilibrada para la reacción global. Existen tres posibles etapas de terminación: la combinación de (1) dos átomos de bromo, (2) dos radicales etilo, o (3) un radical etilo y un radical bromo:
\ (\ comenzar {matriz}
Br\ cdot + Br\ cdot &\ fila derecha Br_ {2}\\
CH_ {3} CH_ {2}\ cdot +\ cdot CH_ {2} CH_ {3} &\ fila derecha CH_ {3} CH_ {2} CH_ {2} CH_ {3}
CH_ {3} CH_ {2}\ punto + Br\ cdot &\ fila derecha CH_ {3} CH_ {2} Br
\ final {matriz}\ tag {23.4.6}\)
Debido a que los radicales son potentes nucleófilos y por lo tanto altamente reactivos, tales reacciones no son muy selectivas. Por ejemplo, la cloración del n-butano da una mezcla aproximadamente 70:30 de 2-clorobutano, formada a partir del radical más estable al hacer reaccionar un carbono secundario y 1-clorobutano.
Tenga en cuenta el patrón
Debido a que los radicales son altamente reactivos, las reacciones radicales no suelen ser muy selectivas.
Reacciones de oxidación-reducción
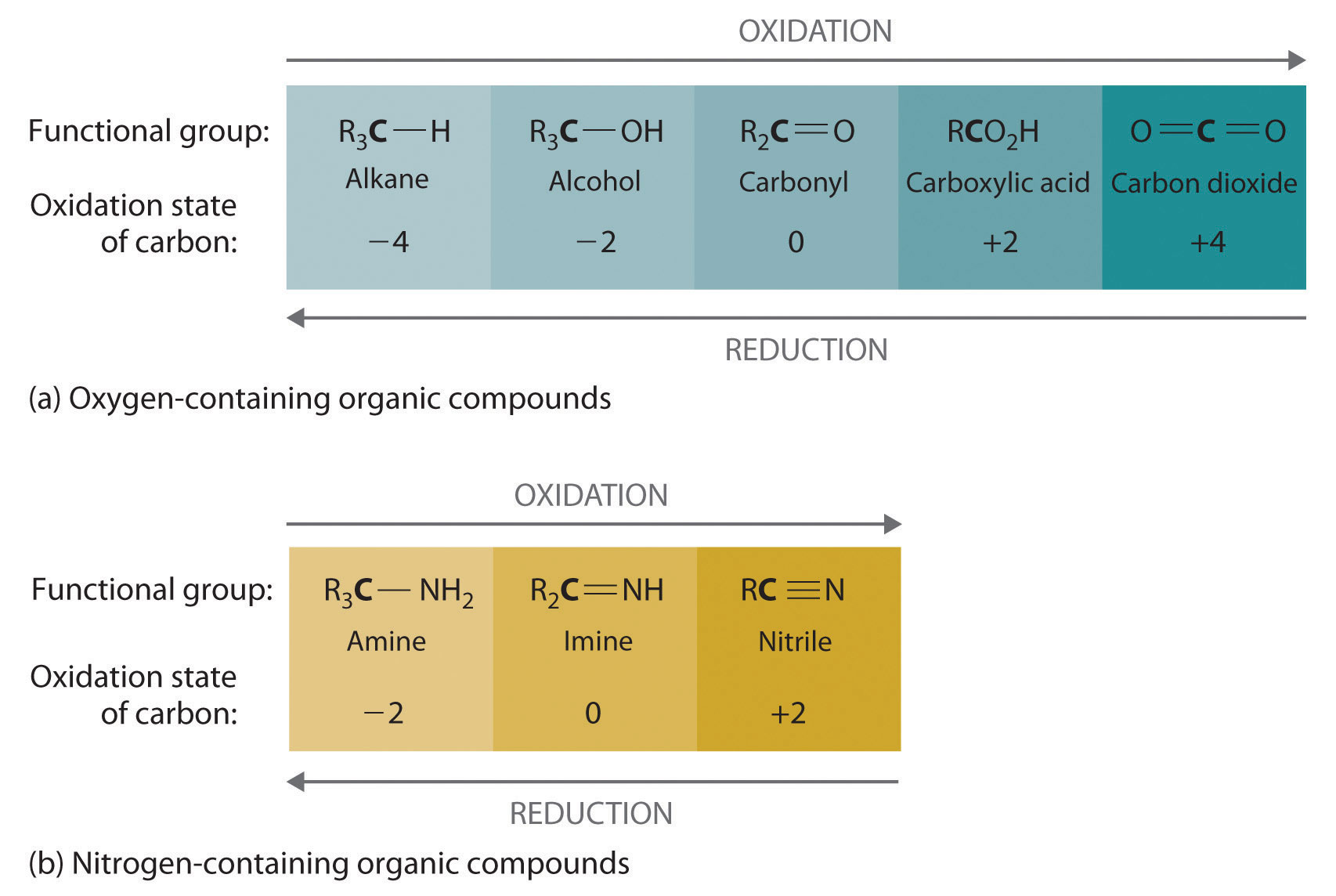
Las reacciones de oxidación-reducción, que son comunes en la química orgánica, a menudo se pueden identificar por cambios en el número de átomos de oxígeno en una posición particular en el esqueleto del hidrocarburo o en el número de enlaces entre el carbono y el oxígeno en esa posición. Un incremento en cualquiera corresponde a una oxidación, mientras que una disminución corresponde a una reducción. Por el contrario, un aumento en el número de átomos de hidrógeno en un hidrocarburo suele ser un indicio de una reducción. Podemos ilustrar estos puntos considerando cómo cambia el estado de oxidación del átomo de carbono en la serie de compuestos, lo que se muestra en la parte (a) en la Figura 23.4.3. (Para una revisión de estados de oxidación y cambios formales, ver Sección 7.5, y Sección 8.10). El número de átomos de oxígeno o el número de enlaces al oxígeno cambia a lo largo de la serie. De ahí que la conversión de metano en ácido fórmico sea una oxidación, mientras que la conversión de dióxido de carbono en metanol es una reducción. Además, el número de átomos de hidrógeno aumenta al pasar del compuesto más oxidado al menos oxidado. Como era de esperar, a medida que aumenta el estado de oxidación del carbono, el carbono se convierte en un electrófilo más potente. Así, el carbono del CO 2 es un electrófilo más fuerte (es decir, más susceptible al ataque nucleofílico) que el carbono de un alcano como el metano.
Figura 23.4.3 El estado de oxidación del carbono en los grupos funcionales que contienen oxígeno y nitrógeno (a) En un hidrocarburo, la oxidación se indica por un aumento en el número de átomos de oxígeno o enlaces carbono-oxígeno o una disminución en el número de átomos de hidrógeno. b) En los compuestos que contienen nitrógeno, el número de enlaces carbono-nitrógeno cambia con el estado de oxidación del carbono.
De manera similar, en compuestos con un enlace carbono-nitrógeno, el número de enlaces entre los átomos de C y N aumenta a medida que aumenta el estado de oxidación del carbono (parte (b) en la Figura 23.4.3). En un nitrilo, que contiene el grupo —C=N, el carbono tiene el mismo estado de oxidación (+2) que en un ácido carboxílico, caracterizado por el grupo —CO 2H. Por lo tanto, esperamos que el carbono de un nitrilo sea un electrófilo bastante fuerte.
Ejemplo 23.4.1
Escribe una ecuación para describir cada reacción. Identificar el electrófilo y el nucleófilo en cada reacción.
- la reacción de sustitución nucleofílica de cianuro potásico con 1-cloropropano para dar CH 3 CH 2 CH 2 CN (butirnitrilo)
- la reacción de adición electrófila de HBr con cis-2-buteno
Dado: reactivos, productos y mecanismo de reacción
Preguntado por: ecuación e identificación de electrófilo y nucleófilo
Estrategia:
Utilizar los mecanismos descritos para mostrar cómo se forman los productos indicados a partir de los reactivos.
Solución:
- El ion CN − de KCN es un potente nucleófilo que puede desplazar el átomo de cloro del 1-cloropropano, liberando un ion cloruro. La sustitución da como resultado la formación de un nuevo enlace C-C:
\( CN^{-}+\underset{1-chloropropane}{CH_{3}CH_{2}CH_{2}Cl}\rightarrow \underset{butylnitrile}{CH_{3}CH_{2}CH_{2}CN} + Cl^{-} \)
El carbono unido al cloro es un electrófilo debido al enlace C—Cl altamente polar.
- En la adición electrófila de un haluro de hidrógeno a un alqueno, la reacción es como sigue:
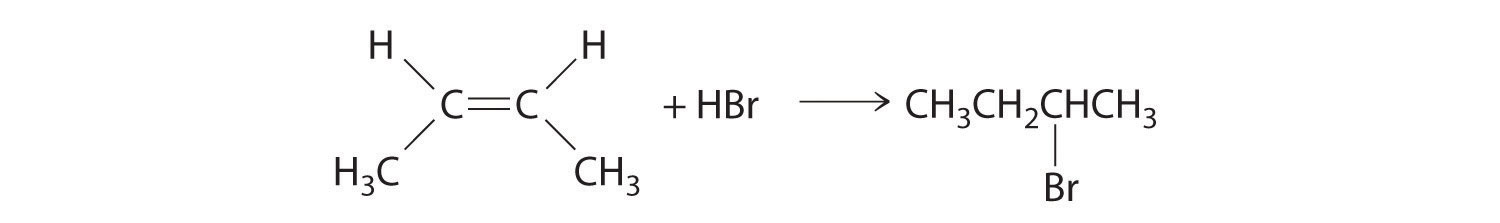
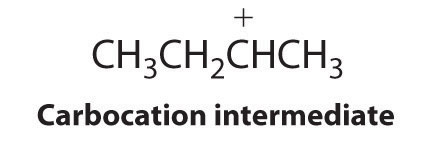
El primer paso es el ataque nucleofílico de los electrones π del doble enlace sobre el hidrógeno electrófilo del enlace polar H-Br para generar el carbocatión transitorio, seguido del ataque nucleófilo por el haluro para dar el producto. Así el alqueno es el nucleófilo, y el protón del ácido es el electrófilo.
Ejercicio
Escribe una ecuación para describir cada reacción. En cada reacción, identificar el electrófilo y nucleófilo.
- la reacción de sustitución nucleófila de metóxido de sodio (NaOCh 3) con bromuro de bencilo (C 6 H 5 CH 2 Br)
- la reacción de adición electrófila catalizada por ácido de agua con ciclopenteno
Contestar
- OCH 3 − (ion metóxido) + C 6 H 5 CH 2 Br (bromuro de bencilo) → C 6 H 5 CH 2 OCH 3 (éter bencilmetílico) + Br; OCH 3 — es el nucleófilo, y C 6 H 5 CH 2 Br es el electrófilo.
-
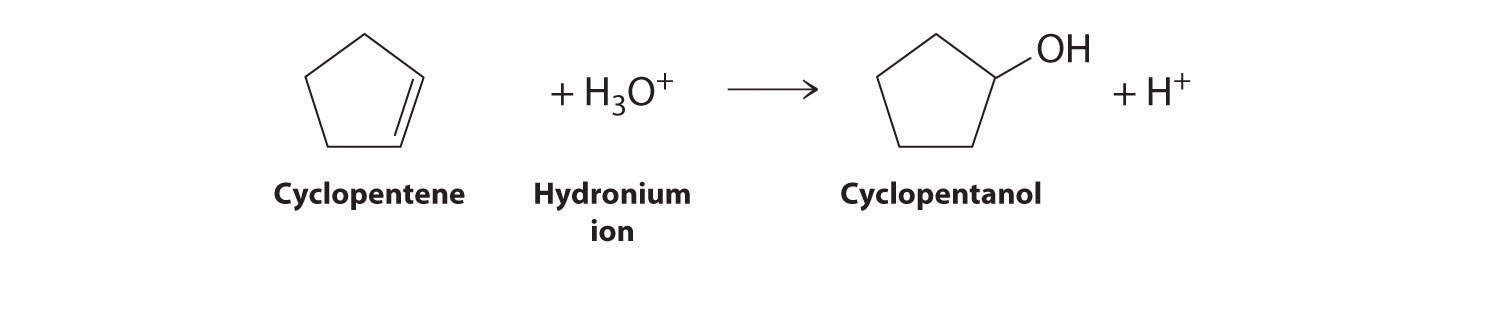
El ciclopenteno es el nucleófilo y H 3 O + es el electrófilo.
Resumen
Existen patrones comunes de cómo ocurren las reacciones orgánicas. En una reacción de sustitución, un átomo o un grupo de átomos en una sustancia es reemplazado por otro átomo o un grupo de átomos de otra sustancia. Los grupos voluminosos que previenen el ataque provocan que la reacción se vea impedida estéricamente. En una reacción de eliminación, los átomos adyacentes se eliminan con la posterior formación de un enlace múltiple y una molécula pequeña. Una reacción de adición es la inversa de una reacción de eliminación. Las reacciones radicales no son muy selectivas y ocurren en tres etapas: iniciación, propagación y terminación. Las reacciones de oxidación-reducción en la química orgánica se identifican por el cambio en el número de oxígenos en el esqueleto hidrocarbonado o el número de enlaces entre carbono y oxígeno o carbono y nitrógeno.
Llave para llevar
- Las clases comunes de reacciones orgánicas —sustitución, eliminación, adición, oxidación-reducción y radicales— implican reaccionar electrófilos con nucleófilos.
Problemas conceptuales
-
Identificar el nucleófilo y el electrófilo en la reacción de sustitución nucleofílica de 2-bromobutano con KCN.
-
Identificar el nucleófilo y el electrófilo en la reacción de sustitución nucleofílica de 1-cloropentano con metóxido de sodio.
-
¿Esperas que una reacción de eliminación sea favorecida por una base fuerte o débil? ¿Por qué?
-
¿Por qué las moléculas con enlaces π se comportan como nucleófilos cuando se mezclan con electrófilos fuertes?
Contestar
-
CN − es el nucleófilo, y C 2 H 5 C δ+ HBrCH 3 es el electrófilo.
Estructura y Reactividad
-
Esbozar el mecanismo para la reacción de sustitución nucleofílica de cianuro de potasio con yodoetano.
-
Esbozar el mecanismo para la reacción de sustitución nucleofílica de NaSH con 1-bromopropano.
-
Esbozar el mecanismo para la reacción de eliminación de cloruro de ciclohexilo con etóxido de potasio. Identificar el electrófilo y el nucleófilo en esta reacción.
-
¿Cuál es el producto de la reacción de eliminación del 1-bromo-2-metilpropano con etóxido de sodio?
-
Escribir la estructura del producto esperada de la adición electrófila de HBr a cis-3-hexeno.
-
Escribir la estructura del producto esperada de la adición electrófila de 1-metilciclopenteno a HBr. Identificar el electrófilo y el nucleófilo, y luego escribir un mecanismo para esta reacción.
-
Escribir un esquema sintético para hacer propeno a partir de propano. Después de sintetizar propeno, ¿cómo harías 2-bromopropano?
-
Escriba un esquema sintético para hacer etileno a partir de etano. Después de sintetizar etileno, ¿cómo harías yodoetano?
-
De la reacción a alta temperatura del Br 2 con 3-metilpentano, ¿cuántos isómeros monobrominados esperaría que se produjeran? ¿Qué isómero se produce a partir del radical más estable?
-
Para la reacción fotoquímica de Cl 2 con 2,4-dimetilpentano, ¿cuántos isómeros monoclorados diferentes esperaría que se produjeran? ¿Qué isómero se produce a partir del radical precursor más estable?
-
¿Cuántos radicales diferentes se pueden formar a partir de la reacción fotoquímica de Cl 2 con 3,3,4-trimetilhexano?
-
¿Cuántos isómeros monobrominados esperaría de la reacción fotoquímica de Br 2 con
- ¿isobuteno?
- 2,2,3-trimetilpentano?
-
Organizar acetona, etano, dióxido de carbono, acetaldehído y etanol en orden de aumentar el estado de oxidación del carbono.
-
¿Qué producto (s) espera de la reducción de una cetona? la oxidación de un aldehído?
-
¿Qué producto (s) espera de la reducción del formaldehído? la oxidación del etanol?
RESPUESTAS
-
cuatro; 3-bromo-3-metilpentano
-
siete
-
metanol; acetaldehído, seguido de ácido acético y finalmente CO 2
Colaboradores
- Anonymous
Modificado por Joshua B. Halpern