1.6: El átomo divisible
- Page ID
- 76644
Lo contrario de una afirmación correcta es una declaración falsa. Pero lo contrario de una verdad profunda bien puede ser otra verdad profunda. Neils Bohr (1865—1962)
La teoría de Dalton sobre los átomos como objetos indivisibles, indestructibles, de diferentes tamaños, pesos y tal vez formas, dependiendo del elemento, se mantuvo durante casi 100 años, aunque hubo considerable disidencia sobre si realmente existían átomos, particularmente entre los filósofos. Para 1900 la teoría atómica era casi universalmente aceptada por los químicos. Más evidencia comenzó a acumularse, se descubrieron más elementos, e incluso se hizo posible calcular el número de átomos en una muestra en particular. El primer paso, en esta dirección, lo realizó Amedeo Avogadro (1776—1856). En 1811 propuso que, en condiciones de igual temperatura y presión, volúmenes iguales de gases contenían igual número de partículas (moléculas) y que las densidades de los gases, es decir, su peso dividido por su volumen, fueran proporcionales al peso de las moléculas individuales. Esto fue ampliado por el maestro austríaco de secundaria Josef Loschmidt (1821-1895) quien, en 1865, combinó la conclusión de Avogadro con la suposición de que los átomos y las moléculas se mueven mucho como objetos elásticos, piensan en las bolas de billar. Esto le permitió calcular la fuerza que una molécula ejercería al viajar a una velocidad determinada, algo difícil de medir, y relacionarla con la presión, algo que se mide fácilmente. De hecho, esta suposición permitió a los físicos deducir que la temperatura de un gas está relacionada con la energía cinética promedio de las moléculas dentro de él, concepto al que volveremos en breve.
Sondeo de la Subestructura de los Átomos
La suposición griega inicial era que los átomos eran indivisibles, esencialmente inmutables desde su creación inicial. Sin embargo, poco a poco comenzaron a acumularse pruebas de que los átomos no eran indivisibles ni indestructibles. La evidencia de la existencia de partículas más pequeñas que los átomos se había ido acumulando desde hace algún tiempo, aunque no se reconoció como tal. Por ejemplo, el bien reconocido fenómeno de la electricidad estática se conocía desde los antiguos griegos. El nombre electricidad proviene del latín electricus, que significa amber-like. Frotar el ámbar con pelaje genera electricidad estática, el mismo tipo de chispa que salta del dedo al pomo de una puerta u otra persona en condiciones secas. A finales del siglo XVIII Luigi Galvani (1737—1798) descubrió que los animales pueden producir y responder a la electricidad, quizás el ejemplo más dramático son las anguilas eléctricas y los rayos que aturden a sus presas a través de descargas eléctricas. El descubrimiento de la bioelectricidad fue explotado en muchas novelas y películas, comenzando con la novela Frankenstein de Mary Shelly (1797—1851) y continuando por la película cómica de Mel Brook (n. 1926), Young Frankenstein. Galvani descubrió que la pierna de una rana muerta se estrecharía en respuesta a la exposición a la electricidad estática; parecía volver a la vida, al igual que el monstruo de Frankenstein. Asumió, correctamente resulta, que la actividad eléctrica estuvo involucrada en el movimiento normal de los animales. Pensó que una forma específica de electricidad, la bioelectricidad, se transportaba en el fluido dentro de los músculos y era un producto único de los sistemas biológicos, un tipo de fuerza específica para la vida. Ahora reconocemos que una serie de fenómenos biológicos, como la contracción muscular y la actividad cerebral, son iniciados por cambios en los campos eléctricos (a través de las membranas) y que los principios fisicoquímicos subyacentes son similares a los que tienen lugar en sistemas no biológicos.
La emoción por la electricidad y sus posibles usos impulsaron a Alessandro Volta (1745—1827) a desarrollar la primera batería moderna, ahora conocida como pila voltaica. Alternó láminas de dos metales diferentes, como el zinc y el cobre, con discos empapados en agua salada (salmuera). Produjo la primera corriente eléctrica constante que, al aplicarse a los músculos de las ranas, provocó que se contrajeran. Dichas observaciones indicaron que los sistemas biológicos pueden generar y responder a las corrientes eléctricas, lo que sugiere que la bioelectricidad no era diferente a cualquier otra forma de electricidad. Lo que ni Volta ni Galvani sabían era la naturaleza de la electricidad. ¿Qué era exactamente y cómo fluía de un lugar a otro? ¿Qué había en la chispa que saltó del dedo al pomo de puerta de metal, o de la cuerda de cometa de Benjamin Franklin (1705—1790) a su dedo? ¿De qué estaba hecho este “fluido eléctrico”?
Los avances en la comprensión de la naturaleza y el comportamiento de la electricidad continuaron a lo largo del siglo XIX y se aprovechó el poder de la electricidad para producir cambios dramáticos en la forma en que las personas vivían y trabajaban, alimentando fábricas, alumbrando casas y calles, etc. Sin embargo, no había una comprensión profunda en cuanto a la naturaleza física de la electricidad. Se sabía que la carga eléctrica venía en dos formas, positiva y negativa, y que estas cargas se conservaban; es decir, no podían crearse ni destruirse, ideas propuestas por primera vez por Franklin. La naturaleza eléctrica (cargada) de la materia estaba bien establecida, pero no de dónde provenían esos cargos ni cuáles eran.
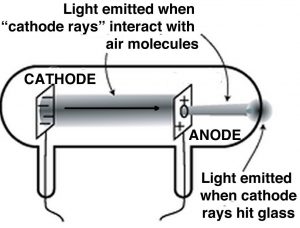
Un paso clave para entender la electricidad implicó desentrañar la idea del átomo indivisible e involucró una serie de experimentos de J. J. Thompson (1856—1940), otro mancuniano. [14] Aunque la idea de la electricidad era ahora bien apreciada, Thompson y otros científicos querían estudiarla de una manera más controlada. Utilizaron lo que eran, y son ahora, conocidos como tubos de rayos catódicos (CRT). Una vez comunes en los televisores, estos ahora han sido reemplazados por varios dispositivos de pantalla plana. Los CRT son tubos de vidrio con cables incrustados en ellos; estos cables están conectados a discos metálicos. El interior del tubo está recubierto con un químico que brilla (fluoresce) en respuesta a la electricidad. Generalmente tienen puertos en las paredes que se pueden conectar a una bomba de vacío, de manera que la mayor parte del aire dentro del tubo se puede eliminar, típicamente los puertos son luego sellados. Cuando se conecta a una fuente de electricidad, como una pila voltaica, el material fluorescente en un extremo del tubo brilla. En una serie de experimentos (1897) Thomson pudo demostrar que:
- Los rayos emergieron de un disco (el cátodo) y se trasladaron al otro (el ánodo).
- Los rayos “catódicos” fueron desviados por campos eléctricos en una dirección que indicaba que estaban cargados negativamente.
- Los rayos también podrían ser desviados por campos magnéticos. [15]
- Los rayos llevaban la carga eléctrica; es decir, si el rayo estaba doblado, por ejemplo por un campo magnético, la carga iba con él.
- El metal del que estaba hecho el cátodo no afectó el comportamiento del rayo; así que cualquiera que sea la composición del rayo, parecía ser independiente del elemento del que provenía.
En todos estos experimentos, hay que destacar que “positivo” y “negativo” pretenden indicar lo contrario y son asignados por convención. Eso significa que mañana podríamos decidir que positivo era negativo, y negativo positivo, y nada cambiaría, siempre y cuando fuéramos consistentes. De estos experimentos, Thompson concluyó que los rayos “catódicos” eran transportados por partículas discretas cargadas, las llamó corpúsculos, y asignó a estas partículas una carga negativa. Pero la conclusión verdaderamente sorprendente a la que llegó fue que estas partículas deben provenir del interior de los átomos del cátodo metálico. Debido a que el tipo de metal no afectó la naturaleza o el comportamiento de los rayos catódicos, asumió que estas partículas no eran de nueva creación sino que debían preexistir dentro de los átomos del cátodo. Además, planteó la hipótesis de que las partículas idénticas deben estar presentes en todos los átomos, no sólo en los átomos de un metal en particular. ¿Ves cómo salta de resultados experimentales usando algunos metales a todos los elementos y todos los átomos? Por supuesto, ahora conocemos estas partículas como electrones pero es difícil imaginar el enorme impacto que esta nueva teoría tuvo en los científicos en su momento.
Dado que los electrones pueden ser producidos por todos los elementos químicos, debemos concluir que entran en la constitución de todos los átomos. Así, hemos dado nuestro primer paso para comprender la estructura del átomo. —J. J. Thomson, La teoría atómica, 1914 [16]
El descubrimiento del electrón hizo obsoleta la vieja idea de un átomo como objetos poco indestructibles en forma de bola de billar y requirió un nuevo modelo. Es un ejemplo de un cambio de paradigma [17] —un cambio fundamental en el pensamiento científico impulsado por nuevas evidencias. La primera versión de Thompson de este nuevo modelo se conoció como el modelo de pudín de ciruela. [18] Su idea básica era que el átomo es una bola de materia cargada positivamente, pero aparentemente amorfa, con electrones tachonados aquí y allá, como las pasas en un pudín. Debido a que contenía el mismo número de cargas positivas y negativas, la estructura general era eléctricamente neutra. El trabajo posterior de Thompson y Robert A. Millikan (1868—1953) estableció que todos los electrones son idénticos, cada uno con la misma masa muy pequeña y carga negativa. La masa de un electrón es menor que\(\frac{1}{1000\mathrm{th}}\) la masa de un átomo de hidrógeno.
El modelo de pudín de ciruela propuesto por Thompson del átomo estimuló mucho trabajo experimental y teórico y condujo a un número notable de descubrimientos posteriores. Por ejemplo, pronto se reconoció que las\(\beta\) partículas emitidas por algunos minerales y elementos radiactivos, eran, de hecho, electrones. Otros estudios encontraron que el número de electrones presentes en los átomos de un elemento en particular era aproximadamente proporcional a la mitad del peso atómico del elemento, aunque no estaba claro por qué este debería ser el caso.
Sin embargo, a medida que más y más datos comenzaron a acumularse, el modelo de pudín de ciruela tuvo que abandonarse porque simplemente no podía explicar lo que se estaba observando. El experimento clave que condujo a un nuevo modelo del átomo fue llevado a cabo en 1908 por Ernest Rutherford (1871-1937). Como ya habrás adivinado, estaba trabajando en la Universidad de Manchester. En este experimento, examinó cómo las partículas alfa (\(\alpha\)), que sabía que eran partículas cargadas positivamente hechas del elemento helio sin sus electrones, se comportaban cuando se disparaban contra una lámina de metal muy delgada, como el oro o el platino. En el experimento se dirigió un haz paralelo estrecho de partículas α a una delgada lámina de oro y se detectaron los ángulos en los que se dispersaron las partículas desviadas. El resultado observado fue completamente inesperado. En lugar de pasar recto a través de la delgada lámina de papel de aluminio, encontró que algunas partículas fueron desviadas, algunas de ellas en grandes ángulos. Rutherford escribió: “Es como si hubiera disparado una bola de cañón a un trozo de papel de tejido, y rebotó de inmediato”. Aquí nuevamente, vemos un aspecto particular de la empresa científica, a saber, que a pesar de que solo unas pocas partículas alfa se recuperaron, todavía necesitamos explicar cómo podría ocurrir esto. No podíamos simplemente decir: “Sólo unas pocas partículas fueron rebotadas así que no importa”; tenemos que proporcionar un escenario plausible para explicar la observación. A menudo se trata de prestar atención, y tomar en serio, el resultado inesperado que lleva a los descubrimientos más profundos.
Con base en estos resultados experimentales Rutherford razonó que las partículas α cargadas positivamente estaban siendo repelidas por partes positivas del átomo. Debido a que solo un porcentaje muy pequeño de partículas alfa fueron desviadas, solo una región muy pequeña de cada átomo pudo estar cargada positivamente. Es decir, la carga positiva en un átomo no podía extenderse de manera más o menos uniforme, como suponía el modelo de pudín de ciruela; en cambio, debía concentrarse en una región muy pequeña. Esto implicaba que la mayor parte del átomo está vacío (¿recuerdas el vacío de los antiguos griegos?) u ocupado por algo que plantea poca o ninguna resistencia al paso de las partículas α. Lo que dejó sin explicar fue por qué las partículas cargadas positivamente (que ahora conocemos como protones) concentradas en un volumen tan pequeño, no se repelían entre sí —cuya respuesta tuvo que esperar al descubrimiento de la fuerte fuerza nuclear (ver más abajo). Nuevamente vemos a un científico dando un enorme salto intuitivo de la observación experimental a una hipótesis que fue consistente con esa evidencia y que hace predicciones específicas que pueden ser confirmadas o falsificadas mediante experimentos y observaciones posteriores. El modelo de Rutherford, que se conoció como el modelo planetario, postuló un núcleo muy, muy pequeño donde se ubicaba toda la carga positiva y casi toda la masa del átomo; este núcleo estaba rodeado por electrones. En 1920 Rutherford pasó a identificar la unidad de carga positiva y la llamó el protón. En 1932 James Chadwick (1891-1974) (quien co-incidentalmente estudió en la Universidad de Manchester) identificó un segundo componente del núcleo, el neutrón. Los neutrones son pesados, como protones. De hecho son un poco más pesados que los protones, pero no tienen cargo alguno. La identidad del elemento depende del número de protones, sin embargo el número de neutrones puede ser diferente en diferentes átomos del mismo elemento. Por ejemplo un átomo de carbono siempre tiene seis protones, pero puede tener diferentes números de neutrones. La mayoría de los átomos de carbono tienen seis neutrones (\(\mathrm{C-} 12\)), pero algunos tienen siete (\(\mathrm{C-} 13\)) y otros tienen ocho (\(\mathrm{C-} 14\)).
Preguntas para más tarde
- Si los átomos son en su mayoría espacios vacíos, ¿por qué no podemos atravesar las paredes?
- ¿Qué es la radiación?
- ¿Cómo cambia un átomo cuando emite una partícula alfa? ¿O una partícula/electrón beta?
Preguntas para reflexionar
- Si los descubridores originales de la electricidad hubieran decidido que los electrones tienen una carga positiva, ¿eso habría hecho una diferencia en nuestra comprensión de la electricidad?
- ¿Por qué crees que los electrones fueron las primeras partículas subatómicas en ser descubiertas?
- ¿Cómo detectó exactamente Rutherford las partículas alfa?
- ¿Se te ocurre un modelo alternativo del átomo basado en las observaciones de Rutherford?
- ¿Cómo cambiaría el experimento si hubiera usado electrones o neutrones?


