3.2: Elementos y sus interacciones
- Page ID
- 76488
“A partir de los 115 elementos se puede construir una infinidad cercana de moléculas, de cualquier tipo que necesite, para obtener toda la diversidad estructural y funcional que pueda pedir. Hay al menos 100 mil moléculas diferentes en el cuerpo humano. Se han encontrado en el vino unos 900 componentes volátiles del aroma. La química son moléculas. Somos moléculas. La química es una ciencia verdaderamente antrópica”.
— Roald Hoffman (1937) citado por Natalie Angier en The Canon
En este punto, probablemente tengas alguna idea o imagen mental de la estructura básica (baja resolución) de los átomos. Por lo tanto, volveremos a algunas preguntas que quedaron sin respuesta al final del Capítulo\(1\). ¿Por qué es que dos átomos de hidrógeno forman un fuerte enlace estable (covalente), un enlace que requiere temperaturas superiores\(5000 \mathrm{~K}\) para romperse, mientras que dos átomos de helio y dos moléculas de hidrógeno tienen solo una atracción débil (fuerzas de dispersión de Londres) entre sí que se rompe a temperaturas muy bajas (\(4–20 \mathrm{~K}\))? Debido a que la temperatura es una medida de la energía cinética presente en el sistema tenemos que preguntarnos, ¿qué da lugar a esta enorme diferencia? ¿Está pasando algo fundamentalmente diferente en estas situaciones? También pueden venir a la mente otras preguntas potencialmente preocupantes, en particular, ¿cómo pueden ser tan diferentes las muestras puras de diferentes elementos? ¿Por qué el carbono es negro (grafito) o transparente (diamante)? ¿Por qué el oro es brillante y amarillo, mientras que el azufre es opaco y amarillo? ¿Por qué la mayoría de los metales, pero no el oro o el cobre, son brillantes, sólidos e incoloros, mientras que el mercurio es brillante, incoloro y líquido? ¿Por qué algunos elementos son más o menos inertes (como el oro, que no se empaña) mientras que otros, como el hierro (que se oxida) y el fósforo (que estalla en llamas) son altamente reactivos? Responder a estas preguntas conducirá a una comprensión de los fundamentos de la química o cómo los átomos interactúan entre sí bajo diversas condiciones. Abordaremos las respuestas de manera paso a paso. En algunos casos donde las respuestas son muy complejas (como es el caso de por qué el oro es amarillo y el mercurio es un líquido), esbozaremos la respuesta pero probablemente no brindaremos una explicación satisfactoria. Por suerte, ¡la mayor parte de la química que necesitamos abordar no es tan arcana!
Antes de considerar estas y otras preguntas, recapitulemos lo que creemos saber sobre átomos y electrones. La mayor parte de la masa de un átomo se localiza en una región muy pequeña, el núcleo, rodeada de electrones que ocupan la mayor parte del volumen del átomo. Los electrones tienen una serie de propiedades extrañas porque son partículas mecánicas cuánticas. Esto significa que bajo algunas condiciones su comportamiento se describe mejor considerándolas como partículas cargadas negativamente, y bajo otras condiciones es más útil considerarlas como ondas; en realidad son ambas (y ninguna). Debido al principio de incertidumbre cuando conocemos la energía de cada electrón con bastante precisión no sabemos (y no podemos) saber dónde, exactamente, se encuentra un electrón en particular en un momento determinado en el tiempo. De hecho, porque todos los electrones son idénticos, si tuviéramos dos electrones y nos alejáramos de ellos no podíamos decir cuál era cuál cuando volteamos hacia atrás. Dentro de un átomo cada electrón tiene una energía discreta y se caracteriza por su conjunto de números cuánticos; no hay dos electrones en un átomo que tengan el mismo conjunto de números cuánticos. Quizás se sienta decepcionado (o tal vez complacido) al saber que un riguroso tratamiento cuántico mecánico (y relativista) de los átomos y sus interacciones está más allá del alcance de este libro. [9] Dicho esto, podemos dar una visión razonable de cómo se puede explicar el comportamiento de los átomos en términos de orbitales de electrones atómicos y moleculares. También indicaremos dónde nuestra descripción es una simplificación excesiva.
Vale la pena recordar que hay muy pocos (si los hay) instancias cuando nos encontramos con átomos aislados. Aunque a menudo describimos la materia como compuesta de átomos, eso es un poco de abstracción; la mayoría de los átomos están pegados a otros átomos por enlaces e interacciones. Como se mencionó anteriormente, esto conduce a propiedades emergentes que son bastante distintas de las de los átomos aislados de los que están compuestos. Son las interacciones entre átomos y moléculas las que hacen que las superficies sean sólidas.
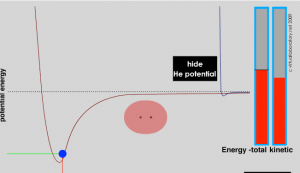
Si los átomos aislados son raros, la pregunta obvia es, ¿por qué son raros? ¿Qué determina cuándo y cómo interactúan los átomos? La respuesta es simple realmente y basada en un principio que ya nos hemos encontrado (y al que volveremos una y otra vez): los sistemas adoptarán el estado energético más bajo accesible para ellos. La razón es que en el estado energético más bajo accesible, se equilibran las fuerzas de atracción y repulsión. Se necesitaría más energía para mover los componentes del sistema (es decir, los átomos en las moléculas, o los electrones en los átomos) porque las fuerzas que actúan sobre ellos aumentarían. Las interacciones y la formación de enlaces conducen a una menor energía potencial. Si el sistema unido es estable dependerá entonces de la fuerza de la interacción/enlace y de las fuerzas que impactan a la molécula. Por ejemplo, las moléculas/átomos circundantes con un rango de energías cinéticas pueden colisionar con la molécula. Si esta energía cinética de la partícula impactante es mayor que la energía de interacción/enlace, la colisión puede interrumpir la interacción o romper el enlace o enlaces entre ellos; si no, la interacción/enlace será estable. Al mismo tiempo, debe haber principios generales que rijan qué interacciones ocurren y cuáles no; de lo contrario, todo se agruparía, lo que sería desordenado y no particularmente interesante. Estos principios surgen de la forma en que los electrones se organizan en diferentes tipos de átomos.
Pensando en la naturaleza del enlace químico
No hay una explicación única que capture todas las propiedades observadas cuando los átomos interactúan para formar un enlace. [10] En su lugar utilizamos una gama de modelos de unión. Ahora bien, ¿a qué nos referimos con modelo? Los modelos son mucho más limitados que las teorías, que tienen aplicación global y pueden probarse erróneamente a través de la observación y los datos experimentales. Los modelos son más como estrategias que simplifican el trabajo y la realización de predicciones sobre sistemas complejos. Un modelo a menudo se aplica solo a situaciones muy específicas. Por ejemplo, el modelo Bohr del átomo se aplica sólo al hidrógeno y luego sólo bajo circunstancias bastante específicas. Vamos a considerar una variedad de modelos de unión, algunos de los cuales quizás ya estés familiarizado, pero es importante que recuerdes que se utilizan diferentes modelos dependiendo de qué propiedades quieras predecir y explicar.
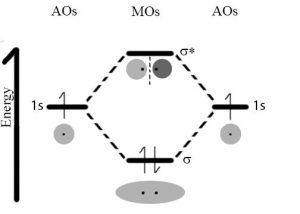
Así que volvamos a nuestro dilema original, es decir, ¿por qué es que la interacción entre dos átomos de hidrógeno es mucho más fuerte que la que existe entre dos átomos de helio? Un modelo útil de unión utiliza la idea de que los electrones pueden describirse en términos de orbitales. [11] Cada orbital puede contener un máximo de dos electrones (con espines opuestos). Recordemos que en un átomo aislado, los electrones son descritos por orbitales atómicos; por lo tanto, cuando están en moléculas, son descritos por orbitales moleculares (\(\mathrm{MOs}\)). Cuando los átomos se acercan entre sí, los orbitales atómicos que contienen sus electrones más externos, conocidos como los electrones de valencia, comienzan a interactuar. Debido a la naturaleza ondulada del electrón, estas interacciones pueden ser constructivas o destructivas. Si interactúan de manera constructiva, la interacción se estabiliza, lo que significa que la energía potencial disminuye y (si esa energía se libera al sistema circundante) los dos átomos adoptan una configuración más estable; forman un enlace que los mantiene unidos. Si la interacción es destructiva, no hay interacción estabilizadora. En el caso del hidrógeno cada átomo tiene un solo (\(1\mathrm{s}\)) orbital ocupado por un solo electrón. A medida que los átomos se acercan entre sí, estos orbitales\(1\mathrm{s}\) atómicos interactúan para formar dos posibles\(\mathrm{MOs}\): una energía menor, constructiva o de unión\(\mathrm{MO}\), y una energía superior, destructiva o antienlace\(\mathrm{MO}\). Observe que el enlace\(\mathrm{MOs}\), un denominado orbital\(\sigma 1\mathrm{s}\) (sigma), tiene densidad de electrones (es decir, una alta probabilidad de que los electrones se encuentren ahí si miramos) entre los dos núcleos de hidrógeno. En el antienlace\(\mathrm{MO}\), conocido como\(\sigma^{\star} 1 \mathrm{s}\), los electrones en su mayoría no están entre los núcleos. Una forma de pensar sobre esto es que en el orbital de enlace los protones en los núcleos de hidrógeno están atrayendo a ambos electrones (uno de cada átomo) y es esta fuerza de atracción común entre electrones y núcleos la que mantiene unidos a los dos átomos de hidrógeno. En contraste, en el orbital antienlace hay poca densidad de electrones entre los dos núcleos y cualquier electrón en ese orbital en realidad está desestabilizando el sistema al mejorar las interacciones repulsivas entre los núcleos. (¿Puede proporcionar una breve razón por la que este sería el caso?)
Al igual que un orbital atómico cada uno\(\mathrm{MO}\), tanto de unión como de antienlace, puede contener dos electrones. En el caso de dos hidrógenos que se aproximan sólo hay dos electrones presentes en el sistema y el estado de menor energía los tendría ambos en el orbital de unión. Por lo general, ambos electrones en una\(\mathrm{H–H}\) molécula se encuentran en el orbital de\(\sigma 1\mathrm{s}\) enlace de menor energía (más estable). Esta disposición de electrones se conoce como un enlace covalente; este es el arreglo que requiere temperaturas de\(\sim 5000 \mathrm{~K}\) para romperse, lo que significa que requiere mucha energía para romper un enlace covalente.
Ahora echemos un vistazo a lo que sucede cuando se acercan dos átomos de helio. Cada átomo de He tiene dos electrones en su\(1\mathrm{s}\) orbital. A medida que los orbitales se acercan interactúan y vuelven a producir dos\(\mathrm{MOs}\), el\(\sigma 1\mathrm{s}\) orbital de unión y el\(\sigma^{\star} 1 \mathrm{s}\) orbital antienlace. El no\(\sigma^{\star} 1 \mathrm{s MO}\) tiene densidad electrónica entre los dos núcleos de He y tiene una energía considerablemente mayor que los orbitales atómicos de los átomos aislados. Ya que hay 4 electrones presentes en los dos átomos de He y sólo dos pueden ocupar el orbital de\(\sigma 1 \mathrm{s}\) enlace; los otros dos tienen que entrar en el orbital\(\sigma^{\star} 1 \mathrm{s}\) antienlace. El resultado final es que la disminución de la energía potencial (mayor estabilidad) asociada con la ocupación del orbital de unión está más que desplazada por el aumento de la energía asociada con la ocupación del orbital\(\sigma^{\star} 1 \mathrm{s}\) antienlace. Entonces, el resultado final es no estabilización general ni disminución de energía asociada con la formación de enlaces; no se forma ningún enlace covalente. Las únicas interacciones entre los átomos de helio son las interacciones de van der Waals que ocurren entre los dos átomos que dependen exclusivamente de las fuerzas de dispersión de Londres, como se discute en el Capítulo\(1\).
La interacción entre dos átomos de helio es muy similar a la que existe entre dos\(\mathrm{H}_{2}\) moléculas. No hay posibilidad de estabilizarse\(\mathrm{MOs}\) formando y, como en el caso de los átomos de helio, las moléculas de hidrógeno (\(\mathrm{H–H}\)o\(\mathrm{H}_{2}\)) interactúan exclusivamente a través de las fuerzas de dispersión de Londres (\(\mathrm{LDFs}\)). El\(\mathrm{LDFs}\) será algo más fuerte entre las moléculas de hidrógeno que entre los átomos de helio, sin embargo, debido a que existe una mayor superficie sobre la que pueden interactuar.
La idea de que, siendo todas las demás cosas iguales, el sistema se moverá al estado energético más bajo accesible (perdiendo el exceso de energía a su entorno), donde las fuerzas de atracción y repulsión son iguales, es aplicable a una amplia gama de situaciones. La energía potencial del sistema disminuye a medida que la distancia entre los átomos disminuye hasta que el sistema alcanza un equilibrio entre la interacción estabilizadora de la formación de enlaces y la repulsión desestabilizadora de los dos núcleos. La diferencia de energía entre los átomos separados y la energía mínima se llama energía de enlace y esta cantidad de energía debe ser suministrada al sistema para romper los dos átomos de nuevo. La distancia entre los núcleos cuando la energía de enlace está en su mínimo es la longitud del enlace. Cuando se forma un enlace entre dos átomos, la energía siempre se libera al entorno y el nuevo material siempre es más estable que los dos átomos separados. Debido a que la energía se conserva, no se puede formar un enlace a menos que esta energía de enlace se transfiera de los átomos que interactúan al resto del sistema (generalmente colisionando con otros átomos y transfiriendo energía). Hacer enlaces siempre es exotérmico (es decir, que la energía se libera no se absorbe). Esto implica que la energía (del sistema circundante) siempre es necesaria para romper un vínculo. Para romper un enlace se debe transferir la energía del entorno. La ruptura de enlaces es endotérmica, lo que significa que requiere energía del mundo externo, normalmente entregada a través de colisiones con otras moléculas.
Cuando consideramos reacciones químicas más complejas, encontraremos que generalmente implican tanto la ruptura del enlace como la formación de enlaces; la reacción general será exotérmica cuando se libere más energía de la formación de enlaces que la que se usa para la ruptura del enlace. Por el contrario, una reacción es endotérmica (es decir, usa energía) si se requiere más energía para romper los enlaces de la que se libera en la formación de enlaces. El punto importante es que hay que considerar el sistema como un todo, incluyendo todos los vínculos formados y rotos. Volveremos a este tema (con mucha mayor profundidad) en Capítulos\(5\) y\(7\).
Moléculas discretas versus continuas
Habiendo considerado la situación de enlace con hidrógeno y helio, los dos elementos más simples, ahora podemos pasar a considerar otros elementos y los tipos de moléculas que forman. En esta discusión, comenzamos con moléculas compuestas por un solo tipo de átomo. Moléculas más complejas hechas de átomos de múltiples elementos serán consideradas en los capítulos siguientes y subsiguientes. A medida que aumenta el número de protones en el núcleo de los átomos de un elemento, desde\(1\) el hidrógeno hasta\(10\) el neón, encontramos cambios dramáticos en las propiedades físicas que se correlacionan con si la forma elemental es discreta o continua. Las formas discretas son monoatómicas, lo que significa que existen como átomos separados (como\(\mathrm{He}\) y\(\mathrm{Ne}\)) sin enlaces covalentes entre ellas (aunque interactúan a través de interacciones de van der Waals), o moléculas diatómicas (como\(\mathrm{H}_{2}\),\(\mathrm{N}_{2}\), y\(\mathrm{F}_{2}\))\(\mathrm{O}_{2}\), lo que significa que existen como moléculas que tienen sólo dos átomos. Los elementos que existen como moléculas pequeñas tienen puntos de fusión muy bajos (las temperaturas a las que cambian de sólido a líquido) y bajos puntos de ebullición (las temperaturas a las que cambian de un líquido a un gas). Pero no confundas estas transiciones de fase con la ruptura de una molécula diatómica en átomos separados. Las transiciones de fase, que discutiremos con mayor detalle más adelante, implican la interrupción de las interacciones entre moléculas (fuerzas intermoleculares), como las fuerzas de dispersión de Londres, en lugar de interacciones dentro de las moléculas, es decir, enlaces covalentes.
Tabla\(3.2.1\) Los primeros 10 elementos en su estado elemental natural
| Forma Elemental | \(\mathrm{H}_{2}\)
molecular |
\(\mathrm{He}\)
atómico |
\(\mathrm{Li}\)
continuo |
\(\mathrm{Be}\)
continuo |
\(\mathrm{B}\)
continuo |
\(\mathrm{C}\)
continuo |
\(\mathrm{N}_{2}\)
molecular |
\(\mathrm{O}_{2}\)
molecular |
\(\mathrm{F}_{2}\)
molecular |
\(\mathrm{Ne}\)
atómico |
| Punto de fusión | \(13.81 \mathrm{~K}\) | \(0.00 \mathrm{~K}\) | \(453.65 \mathrm{~K}\) | \(1560 \mathrm{~K}\) | \(2348 \mathrm{~K}\) | \(3823 \mathrm{~K}\) | \(63.15 \mathrm{~K}\) | \(54.36 \mathrm{~K}\) | \(53.53 \mathrm{~K}\) | \(24.56 \mathrm{~K}\) |
| Punto de ebullición | \(20.28 \mathrm{~K}\) | \(4.22 \mathrm{~K}\) | \(1615 \mathrm{~K}\) | \(2744 \mathrm{~K}\) | \(4273 \mathrm{~K}\) | \(4098 \mathrm{~K}\) | \(77.36 \mathrm{~K}\) | \(90.20 \mathrm{~K}\) | \(85.03 \mathrm{~K}\) | \(27.07 \mathrm{~K}\) |
| Bp-Mp (*) | \(6.47 \mathrm{~K}\) | \(3.27 \mathrm{~K}\) | \(1161 \mathrm{~K}\) | \(1184 \mathrm{~K}\) | \(1925 \mathrm{~K}\) | \(275 \mathrm{~K}\) | \(14.21 \mathrm{~K}\) | \(35.84 \mathrm{~K}\) | \(31.5 \mathrm{~K}\) | \(2.51 \mathrm{~K}\) |
| Nombre | hidrógeno | helio | Litio | berilio | boro | carbono | nitrógeno | oxígeno | flúor | neón |
* Punto de ebullición (Bp) menos punto de fusión (Mp).
En contraste con los elementos que forman moléculas discretas, los átomos de los otros elementos que estamos considerando (es decir\(\mathrm{Li}\)\(\mathrm{Be}\),\(\mathrm{B}\),,\(\mathrm{C}\)) interactúan entre sí de manera continua. En lugar de formar moléculas discretas, estos elementos pueden formar conjuntos de átomos en los que el número de átomos puede variar desde lo pequeño (unos pocos miles de millones) hasta lo astronómico (muy, muy grande). Ya sea que los materiales estén a nivel nano o macroscópico, los átomos en estos conjuntos se mantienen unidos por enlaces que son muy difíciles de romper, como el enlace en\(\mathrm{H-H}\). Es decir, se debe poner mucha energía en el sistema para separar los átomos componentes. Sin embargo, a diferencia del hidrógeno, los átomos que forman estas estructuras deben formar enlaces con más de otro átomo.
Una consecuencia de esta diferencia en la organización es un aumento dramático tanto en los puntos de fusión como de ebullición en comparación con las especies atómicas (\(\mathrm{He}\)\(\mathrm{H}_{2}\),\(\mathrm{Ne}\)) y moleculares (\(\mathrm{N}_{2}\)\(\mathrm{O}_{2}\),, y\(\mathrm{F}_{2}\)) (Tabla\(3.2.1\)). La razón es que cuando una sustancia cambia de sólida a líquida (en el punto de fusión) las partículas componentes tienen que ser capaces de moverse unas con respecto a otras. Cuando la sustancia cambia de un líquido a un gas (en el punto de ebullición) las partículas tienen que separarse por completo. En consecuencia, la magnitud de los puntos de fusión y ebullición nos da una estimación relativa de cuán fuertemente se mantienen unidas las partículas en los estados sólido y líquido. Como ya hemos visto, la temperatura es una medida de la energía cinética promedio de las moléculas en un sistema. Para los elementos que existen como átomos discretos o moléculas las únicas fuerzas que mantienen unidas estas partículas son las fuerzas de dispersión de Londres, que son relativamente débiles en comparación con los enlaces covalentes. En contraste, los elementos que existen como redes extensas de átomos unidos por enlaces requieren mucha más energía para romperse a medida que el material pasa de sólido a líquido a gas.
Preguntas para reflexionar
- ¿Todos los bonos son iguales?
- ¿Qué factores podrían influir en la fuerza de unión?
- ¿Por qué son diferentes las propiedades de los átomos y las moléculas?
Preguntas para responder
- ¿Dónde están los electrones\(\mathrm{H}_{2}\) cuando la temperatura es mayor que\(5000 \mathrm{~K}\)?
- ¿Qué pasaría si pudieras formar un\(\mathrm{He-He}\) sistema con 3 electrones (en lugar de 4)?
- ¿Cómo sería una imagen a nivel molecular de\(\mathrm{H}_{2}\) (g)?
- ¿Cómo sería una imagen a nivel molecular de\(\mathrm{H}\) (g)?
- ¿De dónde viene la energía para romper un vínculo?
- ¿A dónde va la energía liberada tras la formación de enlaces?
- El punto de fusión del hidrógeno molecular (\(\mathrm{H}_{2}\)) es\(\sim 14 \mathrm{~K} (-259^{\circ} \mathrm{~C})\). Dibuje una imagen a nivel molecular de cómo se ve el hidrógeno molecular por debajo de esta temperatura (como un sólido). ¿Por qué se pegan las moléculas de hidrógeno?
- El punto de ebullición del hidrógeno molecular (\(\mathrm{H}_{2}\)) es\(\sim 20 \mathrm{~K} (-253^{\circ} \mathrm{~C})\). Dibuje una imagen a nivel molecular de cómo se ve el hidrógeno molecular por encima de esta temperatura (como gas).
- El hidrógeno molecular se disocia a altas temperaturas (\(> 6000 \mathrm{~K}\)). Haz una imagen de lo que imaginas que podría ser esto. ¿Por qué crees que se necesita una temperatura tan alta para lograr este cambio?


