3.3: Carbono: Un elemento increíblemente alotrópico
- Page ID
- 76460
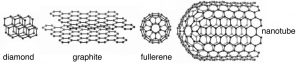
Para darle una idea de algunos de los diferentes tipos de vínculos que se forman entre elementos, vamos a considerar varios elementos representativos de diferentes áreas de la tabla periódica. Para empezar, echemos un vistazo al carbono. El carbono (\(\mathrm{C}\)) pertenece a la familia de elementos conocidos como no metales. La unión entre\(\mathrm{C}\) átomos (y a otros tipos de átomos) se describe típicamente como enlace covalente donde cada enlace involucra dos electrones (uno de cada uno de los átomos unidos). Si bien este es el modelo más común veremos que no es el único posible; introduciremos otros modelos según sean necesarios. Diamante es el nombre que se le da a una de las formas naturales (conocidas como alótropos) de puro\(\mathrm{C}\); los otros alótropos de carbono son grafito, grafeno y diversos fullerenos (\(\downarrow\)), a los que volveremos más adelante. La pregunta importante es: ¿Cómo pueden estas sustancias tener propiedades tan diferentes, pero estar compuestas por los mismos tipos de átomos? Por ejemplo: el diamante es duro, incoloro, brillante y no conduce electricidad, pero el grafito es suave, gris, brillante y sí conduce electricidad. La respuesta radica en la estructura a nivel molecular de estos alótropos de carbono.
Los diamantes se forman a partir de materiales ricos en carbono sometidos a muy alta presión (\(45,000–60,000\)atmósferas) pero a temperaturas relativamente bajas (\(900–1300 { }^{\circ}\mathrm{C}\)). [12] Tales condiciones se pueden encontrar\(100\) a unos kilómetros bajo la corteza terrestre, la región conocida como la litosfera. También se han encontrado diamantes en asteroides, que se originan desde fuera de la Tierra. Los diamantes son muy valorados porque son raros, brillantes, duros y casi completamente inertes. Es muy difícil hacer que los diamantes hagan cualquier cosa excepto sentarse ahí y brillar; no se disuelven en agua y se derriten solo a temperaturas muy altas (\(\mathrm{mp } = 3330^{\circ}\mathrm{C}\)). El diamante tiene el punto de fusión más alto de cualquier sustancia conocida, tan alto que estas mediciones se realizan en realidad bajo alta presión y luego se calculan para estimar cuál sería el valor a presión atmosférica. Además, cuando el diamante se funde se descompone. Cuando se calienta en una atmósfera de oxígeno reacciona para producir dióxido de carbono; cuando el oxígeno está ausente se transforma en grafito. No existe tal cosa como el diamante fundido. Los diamantes son extremadamente duros (la sustancia natural más dura) y no conducen electricidad en absoluto (como veremos, para conducir electricidad, los electrones deben poder fluir a través del material). Esto sugiere que la estructura a nivel molecular del diamante es bastante diferente a la que se encuentra en los metales (que veremos son maleables y conducen electricidad). Cualquier modelo útil de la estructura del diamante debe explicar cómo estas propiedades surgen de las interacciones atómicas.
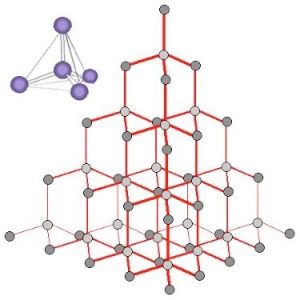
Demos un paso atrás y veamos las propiedades del diamante y veamos si podemos darles sentido. Para ser tan estable (químicamente inerte) el diamante debe tener enlaces muy fuertes que requieren mucha energía para romperse. El hecho de que no conduzca electricidad indica que los electrones no deben ser libres para moverse dentro de un diamante. Un diamante pulido es brillante porque algo de luz se refleja desde la superficie y algo de luz pasa a través de él, haciéndolo transparente. Si el diamante no se cortara con tantas facetas permitiría que la mayor parte de la luz pasara a través de él.
Cuando observamos una estructura de diamante basada en difracción de rayos X [13], encontramos que cada átomo de carbono está rodeado por otros cuatro átomos de carbono situados a distancias iguales y ángulos iguales entre sí. En este contexto, el modelo más útil de unión implica pensar que cada átomo de carbono forma cuatro enlaces covalentes (electrón-compartición), todos dispuestos de manera que los pares de electrones estén lo más separados posible. Esto coloca los cuatro átomos unidos en las esquinas de un tetraedro, con un átomo de carbono central. Cada uno de estos átomos de esquina está en sí mismo en el centro de un tetraedro similar de carbonos (ver Figura). La evidencia experimental indica que todos los enlaces, longitudes de enlace y ángulos de enlace en el diamante son idénticos; los ángulos de\(\mathrm{C–C–C}\) enlace son\(\sim 109^{\circ}\). Un diamante puede considerarse como una molécula enorme conectada por una red de enlaces carbono-carbono.
¿Cómo explicamos este arreglo en términos de lo que sabemos sobre la estructura electrónica de los átomos de carbono? La respuesta es que la estructura electrónica de los átomos de carbono se reorganiza para formar orbitales de unión. En el caso del carbono, cada átomo puede formar cuatro orbitales de unión que se orientan lo más lejos posible. Existen varios modelos para explicar cómo ocurre esto, pero es importante recordar que todos son modelos, diseñados para ayudarnos a entender las propiedades del diamante.
El modelo orbital híbrido
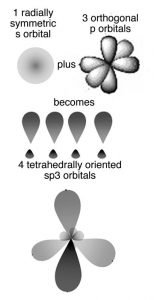
En este modelo los orbitales involucrados en la unión carbono-carbono se consideran híbridos o mezclas de orbitales atómicos. Si el carbono forma cuatro enlaces (y lo hace) entonces se necesitan cuatro orbitales de unión. El carbono tiene orbitales disponibles en la segunda (\(n = 2\)) capa cuántica: la\(2\mathrm{s}\)\(2\mathrm{p}_{\mathrm{x}}\),\(2\mathrm{p}_{\mathrm{y}}\),, y\(2\mathrm{p}_{\mathrm{z}}\) En un átomo de carbono aislado hay un\(2\mathrm{s}\) orbital completo y dos\(\mathrm{p}\) orbitales medio llenos. Cuando los átomos de carbono forman un enlace, estos orbitales se transforman de alguna manera misteriosamente en cuatro nuevos orbitales de unión, que se denominan orbitales\(\mathrm{sp}^{3}\) híbridos porque son una mezcla de\(\mathrm{p}\) orbitales a\(\mathrm{s}\) y tres. Estos\(\mathrm{sp}^{3}\) orbitales existen solo en el contexto del carbono enlazado; no están presentes en átomos de carbono aislados. Ellos brotan a la existencia cuando un átomo de carbono interactúa con otro átomo para formar un enlace; se generan a través de la interacción. En el caso del carbono las cuatro nubes de electrones (enlaces) se mueven lo más lejos posible para minimizar las repulsiones entre ellas, adoptando una configuración tetraédrica (\ fila derecha).
El modelo orbital molecular
Otra forma de considerar cómo se forman estos enlaces es similar a la forma en que abordamos el hidrógeno molecular. Es decir, consideramos que cuando se forman enlaces carbono-carbono (\(\mathrm{C–C}\)), los orbitales atómicos se transforman en orbitales moleculares (\(\mathrm{MOs}\)). Para cada orbital de unión estabilizadora, también se forma un orbital antiadhesión desestabilizante. Usando el enfoque orbital molecular, podemos modelar el enlace en el diamante como átomos de carbono formando una red tridimensional unida por estos orbitales de enlace molecular. \(\mathrm{C–C}\)los enlaces son muy estables porque existe una gran brecha de energía entre los orbitales de unión y los orbitales antiadherentes de alta energía. Los orbitales moleculares de unión están ocupados mientras que los orbitales moleculares antiadherentes están desocupados. Debido a este gran espacio entre el enlace lleno y los orbitales antiadherentes vacíos, es difícil eliminar un electrón de un\(\mathrm{C–C}\) enlace\(\mathrm{MO}\). Los electrones no son libres de moverse entre niveles de energía. Dado que la conducción eléctrica depende del movimiento relativamente libre de los electrones, no es sorprendente que los diamantes no conduzcan la electricidad. Pero, ¿por qué, podría preguntarse, es un diamante transparente, más que opaco, como un bloque de grafito, que también está compuesto solo por átomos de carbono? Para que un objeto sea transparente la mayor parte de la luz que lo golpea debe pasar a través de él; la luz no puede ser reflejada ni absorbida. Para que un diamante absorba la luz, un fotón necesitaría mover un electrón de un enlace de baja energía\(\mathrm{MO}\) a un orbital antienlace de alta energía. Sin embargo, la luz visible no tiene suficiente energía para cerrar la brecha de energía entre los orbitales de unión y antiadhesión. A partir de este pensamiento concluimos que hay algo diferente entre los enlaces que mantienen unidos los átomos de C en el diamante de los enlaces que mantienen los\(\mathrm{C}\) átomos juntos en el grafito a pesar de que no sabemos, en este momento, lo que podría ser.
Un punto importante a considerar aquí es que hemos descrito la unión en carbono utilizando dos modelos diferentes: el orbital híbrido (enlace de valencia) y los modelos orbitales moleculares. Aunque esto puede ser (¡un poco!) confuso, y puede tomar algún tiempo acostumbrarse, es bastante común describir fenómenos químicos y físicos usando diferentes modelos. Normalmente utilizamos el modelo más simple que nos permitirá explicar y predecir el fenómeno que nos interesa. Por lo general, la unión en carbono se describe utilizando el modelo orbital híbrido, porque es altamente predictivo y más fácil de usar en la práctica.
Grafito
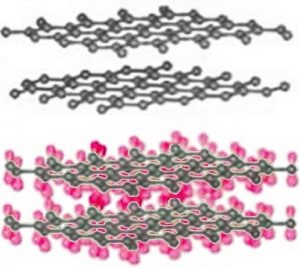
Como ya hemos mencionado, diferentes alótropos (diferentes formas del mismo elemento) pueden tener propiedades bastante diferentes. El grafito alótropo de carbono es suave, gris/negro, opaco, conduce la electricidad y resbaladizo, es un buen lubricante. [14] El diamante es duro, transparente y no conduce electricidad. ¿Cómo puede ser esto posible si ambos son carbono puro? La respuesta radica en cómo se organizan los átomos de carbono unos con respecto a otros. Mientras que los átomos de carbono en el diamante forman una red tridimensional, en el grafito, los átomos están organizados en láminas bidimensionales que se apilan una encima de la otra. Dentro de cada lámina bidimensional, los átomos de carbono están unidos por enlaces covalentes en una matriz extendida de anillos de seis miembros. Esto significa que las láminas de carbono están muy fuertemente unidas, pero las interacciones entre las láminas son mucho más débiles. Aunque no existen enlaces covalentes entre las láminas, los átomos de las láminas sí interactúan a través de las fuerzas de dispersión londinenses, muy parecidas a las interacciones que mantienen unidos los átomos de helio. Debido a que las láminas interactúan sobre áreas de superficie mucho más grandes (\ (\ fila derecha), sin embargo, estas interacciones son mucho más fuertes que las del helio. Otro alótropo de carbono, el grafeno, consiste en una sola lámina de átomos de carbono. [15] Estas láminas se pueden enrollar en tubos para formar nanotubos que son objeto de intenso interés de investigación debido a su resistencia a la tracción inherentemente alta. Los átomos de carbono también pueden formar moléculas esféricas, conocidas como buckminsterfullerenos o buckyballs. [16]
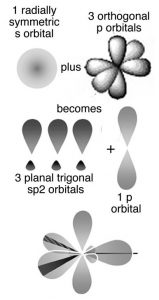
La pregunta obvia es, ¿por qué no se forman enlaces covalentes entre las láminas de grafito? ¿Por qué los patrones de unión covalente son tan diferentes: tridimensionales (tetraédricos) en diamante, con cada carbono unido a otros cuatro, y bidimensional (plano) en grafito y grafeno, con cada átomo de carbono unido a solo otros tres? Una forma de describir la estructura molecular es usar el modelo de enlace orbital híbrido. Como discutimos anteriormente, para formar los cuatro enlaces unidos a cada átomo de carbono en el diamante, necesitábamos hibridar cuatro orbitales atómicos para formar cuatro orbitales de enlace. Podríamos pensar que solo necesitamos tres enlaces en grafito/grafeno porque cada carbono solo está conectado a otros tres. Esto no es exactamente cierto. En grafito y grafeno utilizamos un modelo en el que solo se hibridan tres orbitales atómicos, un s y dos\(2\mathrm{p}\) orbitales para formar tres orbitales de\(\mathrm{sp}^{2}\) unión. Estos orbitales unen cada átomo de carbono a otros tres átomos. Al igual que en el diamante, los tres enlaces asociados a cada átomo de carbono en grafito/grafeno se mueven lo más lejos posible para minimizar la repulsión de pares de electrones; se encuentran en los puntos de un triángulo (en lugar de un tetraedro). Esta geometría se llama plano trigonal y el ángulo de\(\mathrm{C–C–C}\) unión es\(120^{\circ}\) (\(\rightarrow\)).
Todo bien y bien, pero esto realmente no explica por qué los carbonos en grafito/grafeno están unidos a otros tres átomos de carbono, mientras que en el diamante cada carbono está unido a otros cuatro. Quizás sorprendentemente no hay una buena respuesta de por qué el carbono toma diferentes formas, excepto que puede. Pero, de hecho, el carbono forma cuatro enlaces en el grafito (el carbono casi siempre forma cuatro enlaces, un principio central de la química orgánica). El truco es que los cuatro enlaces no siempre son equivalentes; en el grafito el cuarto enlace no está formado por los orbitales de\(\mathrm{sp}^{2}\) unión sino que involucra un orbital\(2\mathrm{p}\) atómico no hibridado. Estos orbitales p se proyectan en ángulo recto con la hoja y pueden superponerse con\(\mathrm{p}\) orbitales de carbonos adyacentes en la misma hoja (ver Figura). Recuerde que\(\mathrm{p}\) los orbitales tienen dos regiones de densidad electrónica. Para explicar el hecho de que el grafito conduce la electricidad, utilizamos una idea de la teoría molecular orbital (\(\mathrm{MO}\)), a saber, que la unión y la antiadhesión\(\mathrm{MOs}\) se forman a partir de los\(\mathrm{p}\) orbitales adyacentes que se extienden sobre la superficie de la lámina. La energía diferente entre estos orbitales no es grande y los electrones pueden moverse de uno a otro, permitiendo el movimiento de electrones a lo largo de toda la lámina de grafito, lo que le da muchas de las propiedades que asociamos con los metales. Tenga en cuenta que utilizamos tanto el modelo de hibridación, que explica el marco plano de\(\mathrm{C-C}\) los enlaces en el grafito, como la teoría orbital molecular, que explica la conductividad eléctrica del grafito. Entonces, antes de profundizar en las propiedades asociadas con el grafito, echemos un vistazo a la unión en los metales.
Preguntas para responder
- El diamante y el grafito parecen ser sustancias bastante diferentes, pero ambos contienen solo átomos de carbono. ¿Por qué las propiedades observables del diamante y el grafito son tan diferentes cuando están hechos de la misma sustancia?
- La configuración electrónica de\(C\) es\(1\mathrm{s}^{2}2\mathrm{s}^{2}2\mathrm{p}^{2}\). Usando la idea de que cada átomo proporciona un electrón a un enlace, si el carbono usara orbitales atómicos para enlazar, ¿cuántos enlaces formaría? ¿Serían todos iguales? ¿Cuáles serían los ángulos de unión si esto sucediera? (Dibuja una imagen de cómo se vería esto.)
- La configuración electrónica de\(C\) es\(1\mathrm{s}^{2}2\mathrm{s}^{2}2\mathrm{p}^{2}\) esto significa que el carbono tiene 6 electrones. ¿Por qué no forma 6 bonos?
- Hemos visto que el carbono puede formar materiales en los que se une a otros 4 átomos (\(\mathrm{sp}^{3}\)hibridación) o a otros tres átomos (\(\mathrm{sp}^{2}\)hibridación). ¿Cuál sería la hibridación para un carbono que solo estaba unido a dos átomos? ¿Cómo influirían los otros\(\mathrm{p}\) orbitales (no hibridados) en el comportamiento de dicho material (asumiendo que podría formarse)?
Preguntas para reflexionar
- ¿Podría el carbono formar una estructura tridimensional uniéndose a otros dos átomos de carbono?
- ¿Crees que los diamantes son transparentes a todas las formas de luz, como los rayos X?
- ¿Qué implica el color del grafito sobre las energías de los fotones que absorbe?


