3.4: Metales
- Page ID
- 76476

Los metales tienen una gama bastante amplia de propiedades a temperaturas normales, desde líquidos (como el mercurio) hasta extremadamente duros (como el tungsteno). La mayoría son brillantes pero no todos son incoloros. Por ejemplo, el oro y el cobre tienen colores distintos. Todos los metales conducen la electricidad pero no todos por igual. ¿Cómo podemos explicar todas estas propiedades? Usemos el aluminio (\(\mathrm{Al}\)) como ejemplo porque la mayoría de nosotros tenemos algo hecho de aluminio como una sartén o papel de aluminio. Con la instrumentación moderna es bastante fácil visualizar átomos y se han utilizado diversas técnicas para visualizar dónde están los átomos de aluminio en la estructura sólida. Lo que emerge es una imagen de núcleos de aluminio y sus electrones centrales, empaquetados como esferas donde una capa de esferas descansa en los intersticios de las capas subyacentes y superpuestas; donde las posiciones de los electrones están dentro de esta estructura no bien definidas.
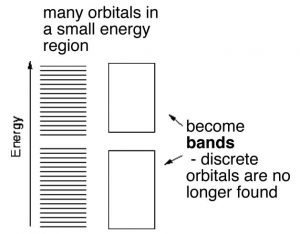
En\(\mathrm{H-H}\) o diamante los electrones involucrados en la unión se localizan (muy probablemente) entre los dos núcleos. En contraste en el aluminio y otros metales los electrones de valencia no están estrechamente asociados con cada núcleo. En cambio, se dispersan sobre toda la pieza macroscópica de metal. Imagínese que en lugar de combinar dos o tres o cuatro orbitales atómicos para formar\(\mathrm{MOs}\), se combinaron un topo (\(6 \times 10^{23}\)) de orbitales atómicos para producir un topo de\(\mathrm{MOs}\). A medida que\(\mathrm{MOs}\) se forman más y más las energías entre ellas se hacen cada vez más pequeñas. Para una pieza macroscópica de metal (una se puede ver) la brecha de energía entre la unión individual\(\mathrm{MOs}\) será insignificante para todos los efectos y propósitos. Estos orbitales producen lo que es esencialmente una banda continua de unión (de baja energía)\(\mathrm{MOs}\) y una banda continua de antiunión (de mayor energía)\(\mathrm{MOs}\). La brecha de energía entre los orbitales de unión y antiunión se llama banda prohibida y en un metal esta banda prohibida es bastante pequeña (recordemos que la brecha entre la unión y la antiunión\(\mathrm{MOs}\) en el diamante es muy grande). Además, en los metales la unión\(\mathrm{MOs}\) (conocida como la banda de valencia) son capaces de acomodar más electrones. Esto se debe a que en los metales normalmente hay menos electrones que orbitales atómicos. Considera el aluminio: tiene tres electrones de valencia y en el estado de tierra (energía más baja) tiene una configuración de electrones de\(3\mathrm{s}^{2} 3\mathrm{p}^{1}\). Esto sugiere que tiene dos\(3\mathrm{p}\) orbitales desocupados. Podemos considerar que la unión\(\mathrm{MOs}\) en aluminio se forma a partir de todos los orbitales atómicos disponibles, lo que significa que hay muchos enlaces\(\mathrm{MOs}\) que no están ocupados por electrones. Las consecuencias físicas de esto son que los electrones de valencia pueden moverse con relativa facilidad de uno\(\mathrm{MO}\) a otro porque sus energías están muy juntas. Mientras que los núcleos y los electrones centrales permanecen más o menos bloqueados en posición, los electrones de valencia pueden extenderse para formar una especie de mar de electrones dentro del metal. Cuando se aplica un potencial eléctrico a través del metal, los electrones de una fuente externa pueden entrar fácilmente en la banda de valencia y los electrones pueden salir fácilmente del metal. La conductividad eléctrica es esencialmente una medida de la facilidad con la que los electrones pueden fluir a través de una sustancia. Los metales suelen tener alta conductividad debido a la facilidad con la que los electrones pueden moverse de uno\(\mathrm{MO}\) a otro y al hecho de que cada uno\(\mathrm{MO}\) se extiende por toda la pieza de metal. Debido a que los números de electrones que entran y salen son los mismos, la pieza de metal permanece sin carga.
En este modelo los núcleos atómicos están empaquetados juntos y rodeados por una nube de electrones que sirven como el “pegamento” que los une entre sí. No hay enlaces discretos en este tipo de estructura. Cuando una pieza de metal se pone bajo tensión física (por ejemplo, se estira o deforma) los átomos pueden moverse uno respecto al otro pero los electrones permanecen dispersos por toda la estructura. Los metales a menudo se pueden deformar lentamente en diferentes formas sin perder su integridad estructural o conductividad eléctrica, ¡son maleables! Pueden fundirse (aumento del movimiento atómico), volverse líquidos y luego dejarse enfriar hasta que se solidifiquen; a lo largo de este proceso conservan su integridad y sus propiedades metálicas y así continúan conduciendo electricidad. [17] Esto es bastante diferente de cómo se comportan otras sustancias (como el diamante o el agua). La dureza de un metal sólido depende de qué tan bien se compongan sus átomos y cuántos electrones se aportan a la banda de valencia de los orbitales.
Entonces, ¿por qué algunos elementos se comportan como metales y otros no? Por ejemplo, el grafito conduce la electricidad pero no es maleable y no puede calentarse y moldearse en otras formas. La respuesta radica en el comportamiento de los\(\mathrm{MOs}\) y los vínculos resultantes que pueden producir. El grafito tiene una columna vertebral rígida de enlaces carbono-carbono que lo hace fuerte y estable, pero superponiendo esos enlaces es el conjunto de deslocalizados\(\mathrm{MOs}\) que se extienden por toda la lámina. Como resultado, el grafito tiene algunas propiedades que son similares al diamante (estabilidad y resistencia), algunas que son similares a los metales (conductividad eléctrica), y algunas que son consecuencia de su estructura laminar única (deslizabilidad).
¿Por qué los metales son brillantes?
Vemos cosas porque los fotones golpean la parte posterior de nuestras retinas y son absorbidos por moléculas especializadas (proteínas y moléculas pigmentarias asociadas). Esto conduce a cambios en la estructura de la proteína e inicia una cascada de eventos celulares basados en la neurona que altera la actividad cerebral. Entonces, ¿de dónde vienen estos fotones? En primer lugar, pueden emitirse desde una fuente (el Sol, una bombilla, etc.) que parece brillar y se puede ver en la oscuridad. Alternativamente, los fotones pueden reflejarse desde una superficie; de hecho, la mayoría de las cosas que vemos no emiten luz, sino que la reflejan. Una camiseta roja aparece roja porque absorbe otros colores y refleja la luz roja. Los fotones también se pueden refractar cuando pasan a través de una sustancia. Un diamante tallado brilla porque la luz se refracta a medida que pasa a través del material y sale de las muchas facetas. La refracción se produce cuando los fotones chocan con electrones, son absorbidos y luego (muy poco después) son reemitidos a medida que viajan a través de un material. Estos procesos llevan tiempo, por lo que la velocidad aparente de la luz se ralentiza. Un fotón puede tardar muchos miles de años en trasladarse del núcleo a la superficie del Sol debido a todas las colisiones que realiza durante el viaje. [18]
Para explicar por qué los metales (y el grafito) son brillantes, invocamos una combinación de reflexión, refracción, y los niveles de energía de\(\mathrm{MOs}\). Cuando un fotón de luz es absorbido y reemitido, el electrón se mueve de un orbital a otro. Consideremos una pieza de metal a temperatura ambiente. Cuando un fotón llega a la superficie del metal se encuentra con la banda casi continua de\(\mathrm{MOs}\). La mayoría de los fotones, independientemente de su longitud de onda, pueden ser absorbidos porque existe una brecha de energía entre los orbitales correspondiente a la energía del fotón. Este proceso promueve electrones hasta un nivel de energía superior. A medida que los electrones descienden de nuevo a un nivel de energía más bajo, los fotones se vuelven a emitir, dando como resultado el brillo metálico característico. Los metales en realidad emiten luz, aunque esto no significa que los metales brillen en la oscuridad (como una bombilla o el Sol). En cambio, los metales absorben y reemiten fotones, incluso a temperatura ambiente.
El color de un metal en particular depende del rango de longitudes de onda que se reemiten. Para la mayoría de los metales, los fotones reemitidos tienen un amplio rango de longitudes de onda lo que hace que la superficie metálica sea plateada. Algunos metales, como el cobre y el oro, absorben la luz en la región azul y vuelven a emitir luz con longitudes de onda que están sesgadas hacia la región del extremo rojo del espectro (\(400–700 \mathrm{~nm}\)) y por lo tanto aparecen amarillentas. Esto se debe a efectos relativistas mucho más allá del alcance de este libro, ¡pero algo que esperar en sus futuros estudios de química física!
Ahora también podemos entender por qué los metales emiten luz cuando se calientan. La energía cinética de los átomos aumenta con la temperatura, lo que promueve electrones de orbitales de baja a mayor energía. Cuando estos electrones pierden esa energía al regresar al estado fundamental, se emite como luz. Cuanto mayor sea la temperatura, menor será la longitud de onda de la luz emitida. A medida que un filamento se calienta, primero se ilumina de color rojo y luego se vuelve más blanco a medida que se emiten fotones de más y más longitudes de onda.
Preguntas para responder
- ¿Qué propiedades indican que una sustancia es metálica?
- ¿Por qué los metales son brillantes?
- ¿Cómo pueden explicarse las propiedades metálicas por la estructura atómica-molecular de\(\mathrm{Al}\) (por ejemplo)?
- ¿Por qué podemos ver a través del diamante pero no el aluminio? ¿Qué tal el grafito?
- ¿Por qué el aluminio (y para el caso todos los metales) conduce la electricidad? ¿Qué debe estar pasando a escala atómica-molecular para que esto ocurra?
- ¿Qué te dice el hecho de que el diamante no conduzca electricidad sobre la unión en el diamante?
- ¿Cómo explican los modelos de unión para diamante y grafito las diferencias en las propiedades entre el diamante, el grafito y un metal como el aluminio?
- ¿Por qué está bien usar diferentes modelos para describir la unión en diferentes especies?
Este capítulo nos ha llevado a un punto en el que deberíamos tener una idea bastante buena de los tipos de interacciones que pueden ocurrir entre los átomos del mismo elemento. Hemos visto que las propiedades de diferentes elementos pueden explicarse considerando la estructura de sus átomos y en particular la forma en que sus electrones se comportan a medida que los átomos interactúan para formar moléculas o grandes ensamblajes de átomos (como el diamante). Lo que aún no hemos considerado es cómo los átomos de diferentes elementos interactúan para formar compuestos (sustancias que tienen más de un elemento). En Capítulo\(4\) abordaremos este tema y mucho más.


