5.2: Pensando en Poblaciones de Moléculas
- Page ID
- 76593
Dentro de una población de átomos y moléculas, las muchas colisiones que ocurren por segundo conducen a un rango de velocidades y direcciones (es decir, velocidades) de los átomos/moléculas. Cuando grandes cantidades de partículas están involucradas en un fenómeno, sus acciones individuales no son importantes, por ejemplo al medir la temperatura o la presión (aunque lo son cuando las moléculas individuales chocan, es decir, participan en reacciones químicas). Tratamos grandes cantidades de moléculas como una población. Una población se caracteriza por la distribución del número o probabilidad de que las moléculas se muevan con diversas velocidades. [5] Esto permite utilizar métodos estadísticos para caracterizar el comportamiento de la población. Aunque cualquier molécula en particular se comporta de manera diferente de un momento a otro, dependiendo de que colisione con otras moléculas o no, el comportamiento de la población es bastante predecible. [6]
Desde esta perspectiva poblacional, es la distribución de energías cinéticas de átomos o moléculas la que depende de la temperatura del sistema. No nos ocuparemos de derivar las ecuaciones que describen estas relaciones, sino que nos enfocaremos en una descripción general del comportamiento de los movimientos de átomos y moléculas en diversos estados de la materia.
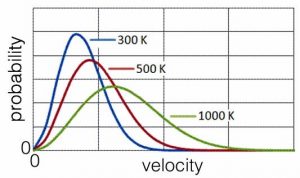
Pensemos en una población de moléculas a una temperatura particular en la fase gaseosa. Debido a sus constantes colisiones entre sí, la población de moléculas tiene una distribución de velocidades. Podemos calcular la probabilidad de que una molécula en particular se mueva a una velocidad determinada. Esta relación se conoce como la distribución Maxwell—Boltzmann, mostrada en la gráfica. Su forma es función de la temperatura del sistema; normalmente se eleva bastante pronunciadamente desde cero (todas las curvas comienzan en cero — ¿por qué crees eso?) a un máximo, que luego disminuye y disminuye a velocidades más altas (que corresponden a energías cinéticas más altas). Debido a que estamos trazando probabilidad versus energía cinética (o velocidad rms o velocidad) podemos establecer el área bajo la curva para que sea igual a una (o cualquier otra constante). A medida que cambia la temperatura, el área bajo la curva se mantiene constante. ¿Por qué? Porque estamos completamente seguros de que cada partícula tiene alguna cantidad definida de energía cinética (o velocidad o velocidad), aunque sea cero e incluso si no pudiéramos conocerla (recordemos el principio de incertidumbre). A medida que aumenta la temperatura, aumenta el número relativo de partículas que se mueven a velocidades más altas y con más energía cinética. La forma de la curva se aplana y se vuelve más amplia. Todavía hay moléculas moviéndose muy lentamente, pero hay relativamente menos de ellas. La velocidad más probable (el pico de la curva) y la velocidad promedio (que es un poco mayor ya que la curva no es simétrica) aumentan a medida que aumenta la temperatura.
Preguntas para responder
- ¿Qué sucede con la velocidad promedio de las moléculas a medida que aumenta la temperatura?
- Cuando las moléculas chocan, ¿por qué no se pegan?
- ¿Qué crees que pasa con la velocidad promedio a medida que aumenta el peso molecular (suponiendo que la temperatura se mantenga igual)?
- Imagínese un sistema compuesto por dos tipos diferentes de moléculas, una mucho más pesada que la otra. A una temperatura particular, ¿cómo se comparan sus energías cinéticas medias? ¿Cuál, en promedio, se mueve más rápido?
Preguntas para reflexionar
- ¿Qué tan grande tiene que ser un sistema para tener una temperatura,\(10\) moléculas o\(10,000,000\)?
- Si se considera el principio de incertidumbre, ¿cuál es la velocidad más lenta a la que una molécula puede moverse?
- Si coloca un termómetro en una solución, ¿por qué tarda tiempo en que la lectura en el termómetro corresponda a la temperatura de la solución?
Temperatura, Energía Cinética y Gases
Ahora aquí hay un hecho inesperado: las energías cinéticas promedio de las moléculas de cualquier gas a la misma temperatura son iguales (ya que\(\mathrm{KE} = \frac{3}{2}k\mathrm{T}\), la identidad del gas no importa). Pensemos en cómo eso podría ser cierto y qué implica sobre los gases. En la mayoría de las circunstancias las moléculas en un gas no interactúan significativamente entre sí; todo lo que hacen es chocar entre sí como bolas de billar. Entonces, cuando dos gases están a la misma temperatura, sus moléculas tienen la misma energía cinética promedio. Sin embargo, un hecho aún más inesperado es que la masa de las moléculas de un gas es diferente de la masa de las moléculas del otro gas. Por lo tanto, dado que las energías cinéticas promedio son las mismas, pero las masas moleculares son diferentes, las velocidades promedio de las moléculas en los dos gases deben ser diferentes. Por ejemplo, comparemos hidrógeno molecular (\(\mathrm{H}_{2}\)) gas (peso molecular\(= 2 \mathrm{~g/mol}\)) con oxígeno molecular (\(\mathrm{O}_{2}\)) gas (peso molecular\(= 32 \mathrm{~g/mol}\)), a la misma temperatura. Dado que están a la misma temperatura la energía cinética promedio de\(\mathrm{H}_{2}\) debe ser igual a la energía cinética promedio de\(\mathrm{O}_{2}\), entonces las\(\mathrm{H}_{2}\) moléculas deben estar moviéndose, en promedio, más rápido que las\(\mathrm{O}_{2}\) moléculas. [7]
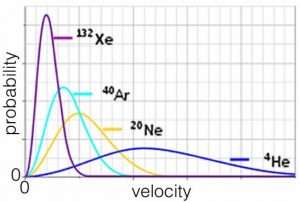
Por lo que la velocidad promedio a la que se mueve un átomo o molécula depende de su masa. Las partículas más pesadas se mueven más lentamente, en promedio, lo que tiene perfecto sentido. Considerar una trama del comportamiento de los gases nobles (monoatómicos), todos a la misma temperatura. En promedio los átomos de helio se mueven mucho más rápido que los átomos de xenón, que son más de 30 veces más pesados. Como nota al margen, las moléculas de gas tienden a moverse muy rápido. En\(0 { }^{\circ}\mathrm{C}\) la\(\mathrm{H}_{2}\) molécula promedio se mueve aproximadamente\(2000 \mathrm{~m/s}\), que es más de una milla por segundo y la\(\mathrm{O}_{2}\) molécula promedio se mueve aproximadamente\(500 \mathrm{~m/s}\). Esto explica por qué los olores viajan relativamente rápido: si alguien derrama perfume a un lado de una habitación, puedes olerlo casi instantáneamente. También explica por qué no se puede oler algo a menos que sea un gas. Volveremos a esta idea más adelante.
Preguntas para responder
- ¿Por qué no todas las partículas de gas se mueven a la misma velocidad a una temperatura determinada?
- ¿Dónde aparecería el kriptón en la trama de arriba? ¿Por qué?
- Considere el aire, un gas compuesto principalmente de\(\mathrm{N}_{2}\),\(\mathrm{O}_{2}\), y\(\mathrm{CO}_{2}\). A una temperatura particular, ¿cómo se comparan entre sí las energías cinéticas promedio de estas moléculas?
- ¿Cómo sería una gráfica de energía cinética versus probabilidad para el mismo gas a diferentes temperaturas?
- ¿Cómo sería una gráfica de energía cinética (en lugar de velocidad) versus probabilidad para diferentes gases (por ejemplo, los gases nobles) a la misma temperatura?
Preguntas para reflexionar
- Si las moléculas de gas se mueven tan rápido (alrededor\(500 \mathrm{~m/s}\)), ¿por qué la mayoría de los olores viajan significativamente menos que eso?
- ¿Por qué no importa mucho si usamos la velocidad, la velocidad o la energía cinética para presentar la distribución del movimiento de las partículas en un sistema (asumiendo que las partículas son todas iguales)?


