5.3: Moléculas vibratorias, dobladas y giratorias
- Page ID
- 76592
Como ya hemos visto la energía cinética promedio de una muestra de gas puede estar directamente relacionada con la temperatura por la ecuación\(\mathrm{E}k(\mathrm{bar}) = \frac{1}{2} mv(\mathrm{bar})^{2} = \frac{3}{2} k\mathrm{T}\) donde\(v(\mathrm{bar})\) está la velocidad promedio y\(k\) es una constante, conocida como la constante de Boltzmann. Entonces, podrías concluir razonablemente que cuando la temperatura es\(0 \mathrm{~K}\), todo movimiento se detiene. No obstante, si una molécula deja de moverse deberíamos poder decir exactamente dónde está, ¿verdad? ¡Oh, no! Eso violaría el principio de incertidumbre, ¡lo que significa que habrá alguna incertidumbre en su energía! A\(0 \mathrm{~K}\) (una temperatura que no se puede alcanzar, incluso en teoría) el sistema tendrá lo que se llama energía de punto cero: la energía que permanece cuando toda la otra energía se elimina de un sistema (un concepto mecánico cuántico completamente irrelevante para la vida normal).
https://www.youtube.com/watch?v=FnUGeYkFCCw
Para los gases monoatómicos, la temperatura es una medida de la energía cinética promedio de las moléculas. Pero para los sistemas compuestos por moléculas más complejas compuestas por múltiples átomos, hay otras formas de almacenar energía además de la traducción (es decir, moverse por el espacio). En estas situaciones, la energía agregada a un sistema no sólo puede acelerar el movimiento de las moléculas sino también hacerlas vibrar, doblar y rotar (recordemos esto lo discutimos brevemente en el Capítulo\(4\)) (FIG\(\rightarrow\)). Estas vibraciones, curvas y rotaciones son distintas para cada tipo de molécula; dependen de la forma y composición molecular. Quizás no en vano, se cuantifican. Esto significa que solo ciertos paquetes de energía pueden ser absorbidos o liberados dependiendo de qué vibraciones o rotaciones estén involucradas. [8] Debido a eso, podemos usar estos estados energéticos específicos de moléculas para identificar moléculas y determinar su estructura a nivel atómico. Así como podemos identificar átomos de elementos por sus espectros electrónicos (cómo sus electrones absorben y emiten fotones a medida que se mueven de un nivel cuántico a otro), podemos identificar moléculas por la forma en que absorben o emiten fotones a medida que la molécula se mueve de un estado vibracional o rotacional a otro. Debido a que se necesita menos energía para moverse entre estados vibracionales, los fotones de frecuencias infrarrojas o de microondas suelen estar involucrados en este análisis. Esta es la base de la espectroscopia infrarroja, tema al que volveremos en un trabajo separado.
A medida que los materiales se vuelven más complejos en su estructura, se necesita más energía para aumentar su temperatura porque hay más formas de que una molécula compleja vibre, se doble y gire; parte de la energía agregada se agota en vibraciones y rotaciones, así como en traslaciones. La cantidad de energía requerida para elevar la temperatura de una cantidad particular de sustancia está determinada por la estructura a nivel molecular del material. Podemos hacer experimentos para determinar cómo la adición de energía a una sustancia afecta su temperatura. Si bien la palabra calor se usa a veces para describir la energía térmica, en el mundo de la física se usa específicamente para describir la transferencia de energía térmica de una cosa a otra. Entonces, aquí nos quedaremos con la energía térmica.
Las unidades de energía térmica son julios (\(\mathrm{J}\)). [9] La energía térmica es la suma de las energías cinéticas y otras energías potenciales de las partículas en un sistema. Existen dos medidas de uso común de cuánta energía se necesita para cambiar la temperatura de una sustancia y, a la inversa, cuánta energía puede almacenar una sustancia a una temperatura dada: la capacidad calorífica específica (\(\mathrm{J/g} { }^{\circ}\mathrm{C}\)) y la capacidad calorífica molar (\(\mathrm{J/mol} { }^{\circ}\mathrm{C}\)). El calor específico de una sustancia te dice cuánta energía se requiere para elevar la temperatura de una masa (\(1 \mathrm{~g}\)) de material por\(1 { }^{\circ}\mathrm{C}\); la capacidad calorífica molar te indica cuánta energía se requiere para elevar la temperatura de un mol de partículas por\(1 { }^{\circ}\mathrm{C}\). Los calores específicos y la capacidad calorífica molar de una sustancia dependen tanto de la estructura molecular como de las interacciones intermoleculares (para sólidos y líquidos, pero no gases). Por lo general, las sustancias más complejas tienen una mayor capacidad de calor molar porque las moléculas más grandes tienen más formas posibles de vibrar, doblarse y rotar. Las sustancias con IMF fuertes tienden a tener mayores capacidades de calor que aquellas con IMF más débiles porque la energía debe usarse para superar las interacciones entre las moléculas, en lugar de hacer que la sustancia se mueva más rápido, lo que aumenta la temperatura.
Capacidad calorífica y estructura molecular
Se necesita\(4.12 \mathrm{~J}\) para levantar 1 gramo de agua\(1 { }^{\circ}\mathrm{C}\) (o\(1 \mathrm{~K}\).) Si se agrega energía a una olla de agua calentándola sobre una estufa, la energía se transfiere a las moléculas de agua por colisiones con la sartén, que a su vez se ha calentado por el contacto con el elemento calefactor [10]. La adición de energía al sistema da como resultado el movimiento más rápido de las moléculas, lo que incluye moverse de un lugar a otro, rotar, doblar y vibrar. Cada tipo de movimiento se suma a la energía térmica general del material. Aunque las moléculas en un gas muy raramente interactúan entre sí, las que están en un sólido y líquido interactúan constantemente. El aumento de la temperatura en función de la energía añadida es relativamente sencillo de calcular para un gas; es mucho más complicado para líquidos y sólidos, donde depende de la estructura molecular e interacciones intramoleculares (dentro de una molécula) así como intermoleculares (entre moléculas).
Considere las capacidades de calor molar y calores específicos del agua y los alcoholes de hidrocarburos (que contienen un\(\mathrm{-OH}\) grupo) metanol, etanol y propanol. Como puede ver en la siguiente tabla, el agua tiene un calor específico inusualmente alto, a pesar de que es más pequeña que las otras moléculas. Sus calores específicos son prácticamente constantes, pero sus capacidades de calor molar aumentan con la masa molar.
| Nombre | Fórmula | Masa molar,\(g\) | Capacidad de Calor Molar
\(\mathrm{J/mol} { }^{\circ}\mathrm{C}\) |
Calor Específico
\(\mathrm{J/g} { }^{\circ}\mathrm{C}\) |
| Agua | \(\mathrm{H}_{2}\mathrm{O}\) | \(18\) | \(75.4\) | \(4.18\) |
| Metanol | \(\mathrm{CH}_{3}\mathrm{OH}\) | \(32\) | \(81.0\) | \(2.53\) |
| Etanol | \(\mathrm{CH}_{3}\mathrm{CH}_{2}\mathrm{OH}\) | \(48\) | \(112\) | \(2.44\) |
| Propanol | \(\mathrm{CH}_{3}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{OH}\) | \(60\) | \(144\) | \(2.39\) |
Entonces una pregunta obvia es, ¿por qué el calor específico del agua es tan alto que el de estos alcoholes? Las razones de esta anomalía (aparente) son:
- Las moléculas de agua son más pequeñas por lo que hay más moléculas por gramo que en las sustancias más grandes y complejas.
- Cada molécula de agua puede formar hasta cuatro enlaces de hidrógeno, pero los alcoholes solo pueden formar un máximo de dos enlaces de hidrógeno cada uno (¿por qué es esto?). Como la energía térmica se agrega al sistema parte de esa energía debe ser utilizada para superar las fuerzas de atracción entre las moléculas (es decir, los enlaces de hidrógeno) antes de que pueda ser utilizada para aumentar la velocidad promedio de las moléculas. Debido a que hay más enlaces de hidrógeno formando atracciones entre las moléculas de agua, se necesita más energía para superar esas interacciones y elevar la energía cinética de las moléculas de agua. El resultado final es un menor aumento en la temperatura para la misma cantidad de energía agregada al agua en comparación con el metanol, etanol y propanol.
El calor específico relativamente alto del agua tiene importantes ramificaciones para nosotros. Alrededor del 70% de la superficie de la Tierra está cubierta de agua. Debido al alto calor específico del agua, los cambios en las cantidades de energía solar que caen en un área entre el día y la noche son “igualados” por la gran cantidad de agua en los océanos. Durante el día, el agua absorbe gran parte de la energía irradiada por el sol, pero sin un drástico aumento de temperatura. Por la noche, a medida que baja la temperatura, los océanos liberan parte de esta energía almacenada, manteniendo así las fluctuaciones de temperatura relativamente pequeñas. Este efecto modera lo que de otro modo serían cambios diarios dramáticos en la temperatura de la superficie. En contraste, las temperaturas superficiales de áreas sin agua (como desiertos), planetas (como Marte) y la Luna fluctúan mucho más dramáticamente, porque no hay agua para absorber y liberar energía térmica. [11] Esta moderación del cambio de temperatura día-noche probablemente sea uno de los factores que hicieron posible que la vida se originara, sobreviviera y evolucionara en la Tierra primitiva. A medida que avancemos, veremos otros aspectos del comportamiento del agua que son críticos para la vida.
Eliminación de energía térmica de un gas
Ahora que se nos ha introducido formalmente los conceptos de calor, energía térmica y temperatura, podemos examinar qué sucede cuando se agrega o elimina energía de la materia. Comenzamos con un gas porque es la forma más simple de materia. Podemos observar un sistema de gas mirando un recipiente sellado de vapor de agua. Podemos reducir la temperatura enfriando las paredes del contenedor; a medida que las moléculas de gas chocan con las paredes, parte de su energía es transferida a la pared y luego eliminada por el sistema de enfriamiento. Con el tiempo, la energía cinética promedio de las moléculas (temperatura) disminuye. Sabemos que todas las moléculas son atraídas entre sí por las fuerzas de dispersión londinenses. En el caso de las moléculas de agua, también hay interacciones mediadas por la capacidad de hacer enlaces de hidrógeno e interacciones dipolo-dipolo. A medida que aumenta la temperatura, estas interacciones relativamente débiles no son lo suficientemente fuertes como para mantener las moléculas pegadas; se rompen durante las colisiones moleculares. A medida que la temperatura baja, y la energía cinética promedio disminuye, cada vez más de estas interacciones persisten por tiempos cada vez más largos. Esto permite que grupos de moléculas formen agregados cada vez más grandes y más pesados. Suponiendo que nuestro contenedor está en la superficie de la Tierra, las moléculas se caen o se condensan fuera de la fase gaseosa para formar un líquido. Debido a que las moléculas en el líquido están interactuando estrechamente entre sí, el volumen ocupado por estos agregados es mucho menor que el volumen ocupado por el mismo número de moléculas en un gas. La densidad (masa/volumen) del líquido es mayor, y eventualmente estas gotas de líquido llegan a ser lo suficientemente grandes como para sentir el efecto de la gravedad, y son atraídas hacia la Tierra. A medida que las gotas de líquido caen al fondo del recipiente se funden entre sí y la fase líquida de abajo se separa de la fase gaseosa de arriba. La temperatura donde aparece por primera vez la fase líquida es el punto de ebullición (o condensación) del material (para el agua está\(100 { }^{\circ}\mathrm{C}\) bajo presión atmosférica al nivel del mar). Si seguimos eliminando energía del sistema a un ritmo bastante lento y constante, la temperatura no cambiará hasta que casi todo el vapor de agua se haya condensado en líquido. ¿Por qué crees que esto es así? Puede ser más fácil pensar en el proceso inverso: cuando el agua hierve, la temperatura del agua no cambia hasta que casi toda el agua en la fase líquida se ha vaporizado, a pesar de que se está agregando energía al sistema. ¿Para qué se utiliza esa energía?
Incluso a temperaturas muy por debajo del punto de ebullición todavía hay algunas moléculas en la fase gaseosa. ¿Por qué? Porque dentro del líquido, algunas moléculas se mueven lo suficientemente rápido (y se encuentran lo suficientemente cerca del límite líquido-gas) para romper las interacciones que las mantienen en el líquido. Cuando salen de la fase líquida, la energía cinética promedio del líquido cae (las moléculas que salen tienen una energía cinética superior a la media) y parte de la energía cinética de las moléculas que escapan se usa para liberarse de las interacciones que las mantienen juntas en la fase líquida. Las moléculas que escapan ahora tienen menor energía cinética. Esta es la base del proceso conocido como enfriamiento evaporativo. El mismo proceso explica cómo la evaporación del sudor enfría tu cuerpo.
Preguntas para responder
- ¿Se puede medir la energía térmica directamente? ¿Por qué o por qué no?
- ¿En qué podemos medir los cambios? ¿Cómo nos permite averiguar los cambios en la energía térmica de un sistema?
- Dibuje una gráfica del cambio en la temperatura cuando se agregan cantidades iguales de energía térmica a la misma velocidad que masas iguales de agua, etanol y propanol.
- ¿Cada muestra alcanza la misma temperatura? ¿Por qué o por qué no?
- Trazar el cambio de temperatura versus tiempo a medida que una muestra de vapor de agua se mueve de una temperatura de\(110 { }^{\circ}\mathrm{C}\) a\(90 { }^{\circ}\mathrm{C}\).
- Dibuje una imagen a nivel molecular de cómo se ve la muestra\(110 { }^{\circ}\mathrm{C}\) y\(90 { }^{\circ}\mathrm{C}\). Explica lo que está sucediendo en cada parte diferente de tu gráfica.
- Cuando se agrega energía y el agua hierve, la temperatura permanece en\(100 { }^{\circ}\mathrm{C}\) hasta que casi toda el agua se haya ido. ¿Para qué se utiliza la energía?
Preguntas para reflexionar
- ¿Cómo sería la vida si viviéramos en un planeta sin agua, sino que los océanos estuvieran llenos de metanol o amoníaco (o llenos de hidrocarburos como en Titán, una luna de Saturno)?
- Después de que acaba de terminar de llover, ¿por qué desaparecen las charcas de agua incluso cuando la temperatura está por debajo del punto de ebullición del agua?
- Las nubes están hechas de pequeñas gotas de agua, ¿por qué no caen a la Tierra?
Líquidos a Sólidos y Regreso
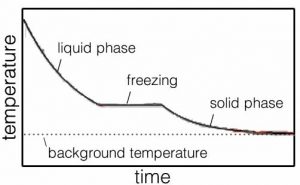
Dentro de un líquido, las moléculas se mueven unas con respecto a otras. Es por eso que fluyen los líquidos. ¿Qué significa eso a nivel molecular? Significa que las moléculas se mueven (en promedio) lo suficientemente rápido como para romper algunas, pero no todas, de las interacciones que las vinculan con sus vecinos. Pero consideremos lo que sucede a medida que eliminamos cada vez más energía del sistema a través de interacciones de las moléculas con las paredes del contenedor. Con menos energía en el sistema, hay una disminución en la frecuencia con la que las moléculas tienen suficiente energía para romper las interacciones entre ellas, y como resultado las interacciones se vuelven más estables. Una vez que la mayoría de las interacciones son estables, la sustancia se vuelve sólida. La temperatura a la que el material pasa de sólido a líquido se denomina punto de fusión. Un líquido se convierte en sólido en el punto de congelación. Para el agua a presión atmosférica, esto es\(0 { }^{\circ}\mathrm{C}\) (o\(273.15 \mathrm{~K}\)). Al igual que el punto de ebullición/condensación, la temperatura no cambia apreciablemente hasta que todo el líquido se haya solidificado en hielo, o todo el hielo se haya derretido (\(\rightarrow\)).
La forma molecular y la geometría de las interacciones entre las moléculas determinan lo que sucede cuando el agua (o cualquier otro líquido) se enfría y finalmente se congela. En el caso del agua congelada (hielo) existen más de 15 tipos de arreglos de las moléculas, que van desde el amorfo hasta diversos tipos de hielo cristalino. En el hielo amorfo, las moléculas ocupan posiciones que son más o menos aleatorias con respecto a sus vecinos; en contraste las moléculas en el hielo cristalino tienen orientaciones muy específicas entre sí. La forma de hielo que más conocemos es la conocida como Ice Ih, en la que las moléculas de agua están organizadas en una matriz hexagonal tridimensional. Cada molécula está unida a cuatro moléculas vecinas a través de enlaces de hidrógeno. Esta estructura a nivel molecular se refleja a nivel macroscópico, razón por la cual los copos de nieve son hexagonales. Una vez congeladas, las moléculas ya no pueden moverse unas con respecto a otras debido a los enlaces entre ellas; el hielo es sólido y conserva su forma, tanto a nivel visible como invisible (molecular). Sin embargo, debido a que no estamos en cero absoluto (\(0 \mathrm{K}\)o\(-273.15 { }^{\circ}\mathrm{C}\)), las moléculas siguen vibrando en su lugar.
Ahora bien, ¿qué pasaría si calentáramos nuestro contenedor transfiriendo energía de los alrededores al sistema (el hielo)? A medida que se agrega energía al hielo, las moléculas de agua vibran cada vez más vigorosamente y eventualmente se superan las interacciones de enlaces de hidrógeno que mantienen las moléculas en su lugar y las moléculas se vuelven libres para moverse entre sí. El hielo se derrite. A esta temperatura (\(0 { }^{\circ}\mathrm{C, } 273.15 \mathrm{~K}\)) toda la energía que ingresa al sistema se utiliza para superar las atracciones intermoleculares, en lugar de aumentar la velocidad del movimiento molecular. Si el sistema está bien mezclado, la temperatura permanece en\(0 { }^{\circ}\mathrm{C}\) hasta que todo el hielo se haya derretido. Entonces la temperatura comienza a subir de nuevo a medida que las moléculas de agua, ahora libres para moverse unas con respecto a otras, aumentan en la energía cinética.
Debido a la disposición de las moléculas de agua en Ice Ih, las “jaulas” hexagonales de moléculas de agua dentro del cristal tienen espacio vacío dentro de ellas. A medida que se rompen los enlaces de hidrógeno, algunas de las moléculas de agua ahora pueden acercarse más para llenar estos espacios abiertos. La estructura del hielo se derrumba sobre sí misma. Esta red abierta de moléculas, que no está presente en el agua líquida, significa que Ice Ih es menos denso que el agua líquida, razón por la cual flota sobre el agua líquida. No pensamos mucho en esta observación común, pero es bastante raro que un sólido sea menos denso que el líquido correspondiente. Más típicamente, los materiales (particularmente gases, pero también líquidos y sólidos) se expanden cuando se calientan como consecuencia del aumento de la energía cinética, haciendo que las partículas vibren más vigorosamente y ocupen más espacio.


