6.2: Solubilidad: ¿por qué algunas cosas forman soluciones y otras no?
- Page ID
- 76537
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Digamos que tienes un cilindro\(100-\mathrm{mL}\) graduado y tomas\(50 \mathrm{~mL}\) de etanol y lo agregas a\(50 \mathrm{~mL}\) de agua. Quizás se sorprenda al descubrir que el volumen de la solución resultante es menor que\(100 \mathrm{~mL}\). De hecho, se trata de\(98 \mathrm{~mL}\), asumiendo buena técnica (sin derramamiento). ¿Cómo podemos explicar esto? Bueno, primero podemos tranquilizarnos de que la materia no ha sido destruida. Si pesamos la solución, pesa lo mismo que\(50 \mathrm{~mL}\) de agua más\(50 \mathrm{~mL}\) etanol. Esto significa que la densidad de la solución de agua-etanol debe ser mayor que la densidad del agua o del etanol solo. A nivel molecular, podemos deducir de inmediato que las moléculas están más juntas en la mezcla de etanol y agua de lo que estaban cuando estaban puras (antes de mezclarlas); intenta dibujar una imagen a nivel molecular de esto para convencerte de que esto es posible. Ahora bien, si tomaras\(50 \mathrm{~mL}\) de petróleo y\(50 \mathrm{~mL}\) de agua, encontrarías que no se mezclan, por mucho que lo hayas intentado. Siempre se separarán entre sí en dos capas. ¿Qué factores determinan si las sustancias forman o no soluciones?
Primero, debemos ser conscientes de que la solubilidad no es una propiedad de todo o nada. Incluso en el caso del petróleo y el agua, un número muy pequeño de moléculas de aceite están presentes en el agua (la fase acuosa), y un pequeño número de moléculas de agua están presentes en el aceite. Hay varias formas de describir la solubilidad. La forma más común es definir el número de moles de soluto por litro de solución. A esto se le llama molaridad de la solución (\(\mathrm{M}, \mathrm{~mol/L}\)). Otra forma común es definir el número de gramos de soluto por masa de solución. Por ejemplo:\(1 \mathrm{~mg}\) (\(10^{-3} \mathrm{~g}\)) de soluto disuelto en\(1 \mathrm{~kg}\) (\(10^{3} \mathrm{~g}\)) de solución es 1 parte por millón (\(10^{6}\)) soluto, o\(1 \mathrm{~ppm}\). Como cabría esperar, dado el término de temperatura en la ecuación de energía libre, los datos de solubilidad siempre se reportan a una temperatura particular. Si no se puede disolver más soluto a una temperatura dada, se dice que la solución está saturada; si se puede disolver más soluto, es insaturada.
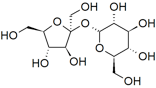
Si miramos la estructura de los compuestos que se disuelven en el agua, podemos comenzar a ver algunas tendencias: los hidrocarburos no son muy solubles en agua (recordemos del Capítulo\(4\) que estos son compuestos compuestos únicamente por carbono e hidrógeno), mientras que los alcoholes (hidrocarburos con un\(—\mathrm{O–H}\) grupo unido) con hasta a 3 carbonos son completamente solubles. A medida que aumenta el número de átomos de carbono, disminuye la solubilidad del compuesto en agua. Por ejemplo, el hexanol (\(\mathrm{CH}_{3}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{OH}\)), solo es muy ligeramente soluble en agua (\(0.4 \mathrm{~g/L}\)). Entonces quizás el grupo hidroxilo (\(—\mathrm{O–H}\)) es responsable de la solubilidad de la molécula en agua. La evidencia que respalda esta hipótesis se puede encontrar en el hecho de que los dioles (compuestos con\(2—\mathrm{O–H}\) grupos) son más solubles que alcoholes similares. Por ejemplo, en comparación con el hexanol, el 1,6-hexanodiol (\(\mathrm{HO}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{OH}\)) es bastante soluble en agua. Los compuestos solubles en agua más familiares como los azúcares glucosa, fructosa y sacarosa (un dímero de glucosa y fructosa —que se muestra en la figura) son, de hecho, polialcoholes. Cada uno de sus seis carbonos está unido a un grupo hidroxilo.
| Compuesto | Masa molar (\ mathrm {g/mol}\)) | Estructura | Solubilidad (\(\mathrm{g/L}\))\(20 { }^{\circ}\mathrm{C}\) |
| Propano | \(44\) | \(\(\mathrm{CH}_{3}\mathrm{CH}_{2}\mathrm{CH}_{3}\) | \(0.07 \mathrm{~g/L}\) |
| Etanol | \(46\) | \(\mathrm{CH}_{3}\mathrm{CH}_{2}\mathrm{OH}\) | Completamente miscible |
| Éter dimetílico | \(46\) | \(\(\mathrm{CH}_{3}\mathrm{OCH}_{3}\) | \(328 \mathrm{~g/L}\) |
| Pentano | \(72\) | \(\mathrm{CH}_{3}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{CH}_{3}\) | \(0.4 \mathrm{~g/L}\) |
| butanol | \(74\) | \(\mathrm{CH}_{3}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{OH}\) | \(80 \mathrm{~g/L}\) |
| Éter dietílico | \(74\) | \(\mathrm{CH}_{3}\mathrm{CH}_{2}\mathrm{OCH}_{2}\mathrm{CH}_{3}\) | \(69 \mathrm{~g/L}\) |
| Hexanol | \(102\) | \(\mathrm{CH}_{3}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{OH}\) | \(0.4 \mathrm{~g/L}\) |
| 1,6 Hexanodiol | \(226\) | \(\mathrm{HO}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{CH}_{2}\mathrm{OH}\) | \(500 \mathrm{~g/L}\) |
| Glucosa | \(180\) | \(\mathrm{C}_{6}\mathrm{H}_{12}\mathrm{O}_{6}\) | \(910 \mathrm{~g/L}\) |
Preguntas
Preguntas para responder
- Haz una lista de sustancias que sabes que se disuelven en agua.
- ¿Cuál de estos se disuelve: metales, compuestos iónicos, compuestos moleculares (polares, no polares), sólidos de red (grafito diamantado)?
- ¿Se puede hacer alguna generalización sobre qué cosas se disuelven y cuáles no?
- ¿Qué debe pasar para que algo se disuelva en el agua?
- ¿Cómo diseñarías un experimento para determinar la solubilidad de un soluto?
- ¿Cómo determinaría si una solución estaba saturada o no?
- Dibuje una imagen a nivel molecular de una solución de etanol y agua mostrando por qué la solución es más densa que los líquidos separados.
- Dibuje una imagen a nivel molecular de una mezcla de aceite y agua.
- Dibujar una imagen a nivel molecular del proceso de solución
- Cuando intentas mezclar aceite y agua, ¿qué capa termina encima? ¿Por qué?
Pregunta para reflexionar
- Tiene una solución saturada, con algún soluto sólido presente.
- ¿Crees que las partículas de soluto que están en solución son las mismas a lo largo del tiempo?
- ¿Cómo determinaría si eran lo mismo?
Preguntas para más tarde
- ¿Qué predeciría para el signo de\(\Delta \mathrm{S}\) sobre la formación de cualquier solución? ¿Por qué?
- ¿Qué predeciría para el signo de\(\Delta \mathrm{H}\) sobre la formación de cualquier solución? ¿Por qué?
- ¿Qué predeciría para el signo de\(\Delta \mathrm{G}\) sobre la formación de cualquier solución? ¿Por qué?


