6.3: Interacciones de enlaces de hidrógeno y solubilidad
- Page ID
- 76538
¿Cómo la adición de grupos hidroxilo aumenta la solubilidad de un hidrocarburo en agua? Para entender esto, debemos volver a los dos componentes de la ecuación de energía libre: entalpía y entropía. Para que un soluto se disuelva en un líquido, las moléculas de soluto deben dispersarse en ese líquido. La solubilidad depende de cuántas moléculas de soluto pueden estar presentes dentro de un volumen de solución antes de que comiencen a asociarse preferentemente con ellas mismas en lugar de con las moléculas de disolvente. Cuando las moléculas de soluto se dispersan, los enlaces o atracciones que mantienen unidas las partículas en el soluto se reemplazan por interacciones entre las moléculas de disolvente y soluto. Se podría deducir que una de las razones por las que los diamantes no son solubles en agua es que los\(\mathrm{C—C}\) enlaces que contienen un átomo de carbono dentro de un diamante son mucho más fuertes (requieren más energía para romperse) que las posibles interacciones entre los átomos de carbono y las moléculas de agua. Para que un diamante se disuelva en agua, debe tener lugar una reacción química en la que se rompan múltiples enlaces covalentes. Con base en esta idea, podemos concluir que cuanto más fuertes sean las interacciones entre las partículas de soluto, menos favorable es que el soluto se disuelva en agua. Al mismo tiempo, cuanto más fuertes sean las interacciones entre las moléculas de soluto y disolvente, mayor será la probabilidad de que aumente la solubilidad.
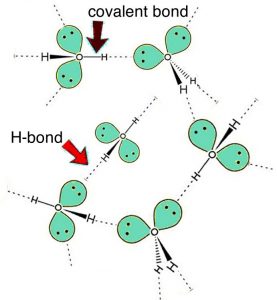
Entonces, ¿las interacciones intermoleculares explican todo sobre la solubilidad? ¿Explican las diferencias entre la solubilidad del hexano, hexanol y hexanodiol en agua? El hexanodiol (\(\mathrm{HO}(\mathrm{CH}_{2})_{6}\mathrm{OH}\)) es fácilmente soluble, y si consideramos su estructura podemos ver que las interacciones entre las moléculas de hexanodiol incluyen enlaces de hidrógeno (que involucran los dos grupos hidroxilo) e interacciones de van der Waals (LDF y dipolo-dipolo). También podemos abordar esto desde una perspectiva más abstracta. Si indicamos la parte no hidroxilo (\(—\mathrm{O–H}\)) de una molécula como\(\mathrm{R}\), entonces una molécula de alcohol se puede representar como\(\mathrm{R}—\mathrm{O–H}\), y un diol se puede representar como\(\mathrm{H–O}—\mathrm{R}—\mathrm{O–H}\). Todos los alcoholes tienen la capacidad de formar interacciones de enlaces de hidrógeno entre sí, así como con el agua. Entonces, cuando un alcohol se disuelve en agua, las interacciones entre las moléculas de alcohol son reemplazadas por interacciones entre las moléculas de alcohol y agua, una interacción similar a la que existe entre las moléculas de agua. Al igual que las moléculas de agua, los alcoholes tienen un dipolo (distribución de carga desigual), con una pequeña carga negativa en el oxígeno (s) y pequeñas cargas positivas en el hidrógeno (unido a los átomos de oxígeno). Tiene sentido que las moléculas con estructuras similares interactúen de manera similar. Así, los alcoholes de peso molecular pequeño pueden disolverse en agua. Pero si volvemos a mirar la tabla anterior, observe que el hexanol (una cadena de 6 carbonos con un\(—\mathrm{O–H}\) grupo) es mucho menos soluble que el hexanodiol (una cadena de 6 carbonos con dos\(—\mathrm{O–H}\) grupos—uno en cada extremo). A medida que la cadena de carbono no polar se alarga, la solubilidad típicamente disminuye. Sin embargo, si hay más\(—\mathrm{O–H}\) grupos presentes, hay más interacciones posibles con el agua. Esta es también la razón por la que los azúcares comunes, que en realidad son polialcoholes con un gran número de\(—\mathrm{O–H}\) grupos (al menos 4 o 5 por molécula), son muy solubles en agua. Sus\(—\mathrm{O–H}\) grupos forman enlaces de hidrógeno con moléculas de agua para formar interacciones estabilizantes. A medida que aumenta la longitud de la cadena hidrocarbonada, la parte hidrocarbonada no polar de la molécula comienza a ser más importante y la solubilidad disminuye. Este fenómeno es responsable de las declaraciones “como disoluciones similares” que a menudo se encuentran en los libros introductorios de química (incluido este, aparentemente). Entonces, ¿las interacciones intermoleculares explican todo sobre la solubilidad? ¡Si tan solo las cosas fueran tan simples!
Entropía y Solubilidad: ¿Por qué no se mezclan aceite y agua? [2]
El hecho de que el aceite y el agua no se mezclen es bien conocido. Incluso se ha convertido en una metáfora común para otras cosas que no se mezclan (personas, credos, etc.) Lo que no es tan conocido es, ¿por qué? El petróleo es un nombre genérico para un grupo de compuestos, muchos de los cuales son hidrocarburos o contienen regiones similares a hidrocarburos. Los aceites son —bien— aceitosos, son resbaladizos y (a riesgo de sonar tediosos) incapaces de mezclarse con el agua. Las moléculas en el aceite de oliva o el aceite de maíz suelen tener una cadena larga de hidrocarburos de aproximadamente 16 a 18 carbonos. Estas moléculas suelen tener grupos polares llamados ésteres (grupos de átomos que contienen\(\mathrm{C—O}\) enlaces) en un extremo. [3] Una vez que obtienes más de seis carbonos en la cadena, estos grupos no influyen mucho en la solubilidad en agua, así como los\(\mathrm{O–H}\) grupos individuales en la mayoría de los alcoholes no influyen mucho en la solubilidad. Entonces, las moléculas oleosas son principalmente no polares e interactúan entre sí, así como con otras moléculas (incluidas las moléculas de agua), principalmente a través de las fuerzas de dispersión de Londres (LDF). Cuando las moléculas de aceite se dispersan en agua, sus interacciones con las moléculas de agua incluyen tanto LDF como interacciones entre el dipolo de agua y un dipolo inducido en las moléculas de aceite. Tales interacciones dipolo-dipolo inducidas son comunes y pueden ser significativas. Si tuviéramos que estimar el cambio de entalpía asociado con la dispersión de moléculas oleosas en el agua, descubriríamos que\(\Delta \mathrm{H}\) es aproximadamente cero para muchos sistemas. Esto significa que la energía requerida para separar las moléculas en el disolvente y el soluto es aproximadamente igual a la energía liberada cuando se forman las nuevas interacciones disolvente-soluto.
Recuerde que el cambio de entropía asociado con la simple mezcla de moléculas es positivo. Entonces, si el cambio de entalpía asociado con la mezcla de aceites y agua es aproximadamente cero, y la entropía de la mezcla suele ser positiva, ¿por qué entonces el aceite y el agua no se mezclan? Parece que la única posibilidad que queda es que el cambio en la entropía asociado con la disolución de moléculas de aceite en el agua debe ser negativo (haciendo así\(\Delta \mathrm{G}\) positivo). Además, si dispersamos moléculas de aceite a través de una solución acuosa, el sistema mixto se separa espontáneamente (desmezcla). Este parece ser un proceso que involucra trabajo. ¿Qué fuerza impulsa esta obra?
Tenga la seguridad, hay una explicación no mística pero requiere pensar tanto a nivel molecular como a nivel de sistemas. Cuando las moléculas de hidrocarburos se dispersan en agua, las moléculas de agua se reordenan para maximizar el número de\(\mathrm{H}\) enlaces que hacen entre sí. Forman una estructura similar a una jaula alrededor de cada molécula de hidrocarburo. Esta jaula de moléculas de agua alrededor de cada molécula de hidrocarburo es una disposición más ordenada que la que se encuentra en el agua pura, ¡particularmente cuando contamos y sumamos todas las jaulas individuales! Es más bien como la disposición de las moléculas de agua en el hielo, aunque restringida a regiones alrededor de la molécula de hidrocarburo. Este arreglo más ordenado da como resultado una disminución de la entropía. Cuantas más moléculas de aceite se dispersen en el agua, mayor será la disminución de la entropía. Por otro lado, cuando las moléculas de aceite se agrupan, se reduce el área de “agua ordenada”; menos moléculas de agua se ven afectadas. Por lo tanto, hay un aumento en la entropía asociada con la aglutinación de moléculas de petróleo, ¡una idea totalmente contraintuitiva! Este incremento en la entropía conduce a un valor negativo para\(-\mathrm{T} \Delta \mathrm{S}\), debido al signo negativo. Por lo tanto, en ausencia de cualquier otro factor el sistema se mueve para minimizar las interacciones entre las moléculas de aceite y agua, lo que conduce a la formación de fases de aceite y agua separadas. Dependiendo de las densidades relativas de las sustancias, la fase oleosa puede estar por encima o por debajo de la fase acuosa. Esta separación impulsada por entropía de moléculas de aceite y agua se conoce comúnmente como el efecto hidrófobo. Por supuesto, las moléculas de aceite no le temen (fóbicas) al agua, y no repelen las moléculas de agua. Recordemos que todas las moléculas se atraerán entre sí a través de las fuerzas de dispersión de Londres (a menos que tengan una carga eléctrica permanente y similar).
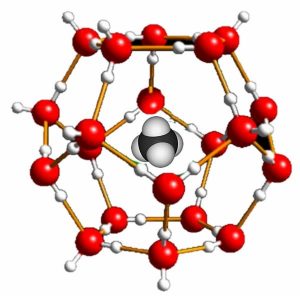
La insolubilidad del petróleo en el agua está controlada principalmente por cambios en la entropía, por lo que está directamente influenciada por la temperatura del sistema. A bajas temperaturas, es posible estabilizar mezclas de agua e hidrocarburos. En tales mezclas, que se conocen como clatratos, las moléculas de hidrocarburos están rodeadas por jaulas estables de moléculas de agua (hielo) (\(\rightarrow\)). Recordemos que el hielo tiene espacios abiertos relativamente grandes dentro de su estructura cristalina. Las moléculas de hidrocarburo encajan dentro de estos agujeros, lo que permite predecir el tamaño máximo de las moléculas de hidrocarburo que pueden formar clatratos. Por ejemplo, algunas bacterias oceánicas generan\(\mathrm{CH}_{4}\) (metano), que luego se disuelve en el agua fría para formar clatratos de metano. Los científicos estiman que entre dos y diez veces la cantidad actual de recursos de gas natural convencional están presentes como clatratos de metano. [4]
Solubilidad de los Compuestos Iónicos: Sales
Los compuestos polares tienden a disolverse en el agua, y podemos extender esa generalidad a los compuestos más polares de todos: los compuestos iónicos. La sal de mesa, o cloruro de sodio (\(\mathrm{NaCl}\)), el compuesto iónico más común, es soluble en agua (\(360 \mathrm{~g/L}\)). Recordemos que\(\mathrm{NaCl}\) es un cristal de sal compuesto no por\(\mathrm{NaCl}\) moléculas discretas, sino más bien por una matriz extendida de\(\mathrm{Na}^{+}\)\(\mathrm{Cl}^{-}\) iones unidos en tres dimensiones a través de interacciones electrostáticas. Cuando se\(\mathrm{NaCl}\) disuelve en agua, las interacciones electrostáticas dentro del cristal deben romperse. Por el contrario, cuando los compuestos moleculares se disuelven en agua, son las fuerzas intermoleculares entre moléculas separadas las que se alteran. Uno podría imaginar que la ruptura de las interacciones iónicas requeriría una entrada de energía muy alta (ya hemos visto que los diamantes no se disuelven en agua porque los enlaces covalentes reales tienen que romperse). Eso sería cierto si lo único que consideramos fuera la energía requerida para romper las interacciones iónicas, como lo indica el hecho de que se\(\mathrm{NaCl}\) funde en\(801 { }^{\circ}\mathrm{C}\) y hierve en\(1413 { }^{\circ}\mathrm{C}\). Pero sabemos que sustancias como\(\mathrm{NaCl}\) se disuelven fácilmente en el agua, así que claramente está pasando algo más. El truco es considerar todo el sistema cuando se\(\mathrm{NaCl}\) disuelve, tal como lo hicimos con las especies moleculares. Debemos considerar las interacciones que se rompen y las que se forman. Estos cambios en las interacciones se reflejan en el\(\Delta \mathrm{H}\) término (de\ (\ Delta\ mathrm {G} =\ Delta\ mathrm {H} —\ mathrm {T}\ Delta\ mathrm {S}).
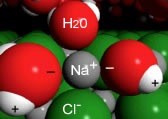
Cuando un cristal de\(\mathrm{NaCl}\) entra en contacto con el agua, las moléculas de agua interactúan con los\(\mathrm{Cl}^{-}\) iones\(\mathrm{Na}^{+}\) y en la superficie del cristal, como se muestra en la figura. Los extremos positivos de las moléculas de agua (los hidrógenos) interactúan con los iones cloruro, mientras que el extremo negativo de las moléculas de agua (el oxígeno) interactúa con los iones de sodio. Entonces el ion en la superficie del sólido interactúa con las moléculas de agua de la solución; estas moléculas de agua forman un cúmulo dinámico alrededor del ion. El movimiento térmico (que refleja la energía cinética de las moléculas, es decir, el movimiento impulsado por colisiones con otras moléculas en el sistema) luego mueve el ion y su capa de agua a la solución. [5] La capa de agua es altamente dinámica: las moléculas están entrando y saliendo de ella. La interacción ión-dipolo entre iones y moléculas de agua puede ser muy estabilizante (\(- \Delta \mathrm{H}\)). El proceso por el cual las moléculas de disolvente interactúan y estabilizan las moléculas de soluto en solución se llama solvatación. Cuando el agua es el disolvente, el proceso se conoce como hidratación.
Preguntas
Preguntas para responder
- Dibujar una imagen a nivel molecular de una solución de\(\mathrm{NaCl}\). Mostrar todos los tipos de partículas e interacciones presentes en la solución.
- Cuando calculamos y medimos cantidades termodinámicas (como\(\Delta \mathrm{H}\),\(\Delta \mathrm{S}\) y\(\Delta \mathrm{G}\)), ¿por qué es importante especificar el sistema y el entorno?
- Cuando una sustancia se disuelve en el agua, ¿cuál es el sistema y cuáles son los alrededores? ¿Por qué? ¿Qué criterios utilizaría para especificar el sistema y el entorno?
- Para una solución hecha de\(\mathrm{NaCl}\) agua, ¿qué interacciones se deben superar a medida que\(\mathrm{NaCl}\) entra en solución? ¿Qué nuevas interacciones se forman en la solución?
- Si la temperatura sube cuando se forma la solución, ¿qué podemos concluir sobre las fortalezas relativas de las interacciones que se rompen y las que se forman? ¿Qué podemos concluir si baja la temperatura?
- Cuando se mide la temperatura de una solución, ¿está midiendo el sistema o los alrededores?
Preguntas para reflexionar
- ¿Por qué la capa de agua alrededor de un ion no es estable?
- ¿Cuáles son los límites de un sistema biológico?


