6.5: Polaridad
- Page ID
- 76548
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Hasta el momento hemos considerado soluciones que están conformadas por moléculas que son especies polares o no polares o iónicas que tienen propiedades que son relativamente fáciles de predecir. Muchas sustancias, sin embargo, tienen estructuras más complejas que incorporan grupos polares, iónicos y no polares. Por ejemplo, muchas biomoléculas no pueden clasificarse como exclusivamente polares o no polares, sino que son lo suficientemente grandes como para tener distintas regiones de diferente polaridad. Se les denomina anfipáticos. Aunque las estructuras de proteínas como\(\mathrm{RNA}\)\(\mathrm{DNA}\), y otras biomoléculas son complejas, podemos usar los mismos principios que involucran efectos entrópicos y entálpicos de interacción con el agua para comprender las interacciones entre biomoléculas, así como dentro de una biomolécula dada. Las biomoléculas son muy grandes en comparación con las moléculas consideradas en la mayoría de los cursos de química, y a menudo una parte de la molécula interactúa con otra parte de la misma molécula. Las interacciones intramoleculares [6] de las macromoléculas biológicas, junto con sus interacciones con el agua, son factores clave para predecir sus formas. [7]
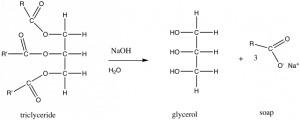

Comencemos con una estructura biomolecular relativamente simple. En la sección anterior analizamos la solubilidad de los aceites en el agua. Los aceites o grasas también se conocen como triglicéridos. En la figura,\(\mathrm{R}\) e\(\mathrm{R}_{\prime}\) indicamos las cadenas de hidrocarburos, que tienen la estructura genérica\(\mathrm{CH}_{3}\mathrm{CnH}_{2\mathrm{n}}\), que se muestra en la figura. Si tratas un aceite o grasa con hidróxido de sodio (\(\mathrm{NaOH}\)), la reacción química resultante conduce a la formación de lo que se conoce como un ácido graso (en este ejemplo, los átomos de oxígeno son granate). Un ácido graso típico tiene una cadena de hidrocarburo larga y no polar y un extremo que a menudo contiene tanto un grupo polar como un grupo iónico. La cabeza polar de la molécula interactúa con el agua con poco o ningún aumento de la entropía, a diferencia de un hidrocarburo, donde la falta de interacciones de\(\mathrm{H}\) enlace con el agua obliga a una capa más ordenada de moléculas de agua alrededor de la molécula de hidrocarburo, lo que lleva a una disminución de la entropía. Por otro lado, en el agua la región no polar de la molécula crea una disminución en la entropía ya que las moléculas de agua se organizan en un tipo de jaula a su alrededor, un resultado desfavorable en términos de\(\Delta \mathrm{S}\), y por\(\Delta \mathrm{G}\) lo tanto también. Entonces, ¿qué extremo de la molécula “gana”? Es decir, ¿tales moléculas se disuelven en agua o no? La respuesta es: ¡Ambos! Estas moléculas anfipáticas se disponen de tal manera que sus grupos polares están en contacto con el agua, mientras que sus regiones no polares no lo están. (Vea si puede sacar tal arreglo, recordando incluir las moléculas de agua en su dibujo).

De hecho, hay varias formas de producir tal arreglo, dependiendo en parte de la cantidad de agua en el sistema. Una micela estándar es una estructura esférica con las cabezas polares en el exterior y las colas no polares en el interior. Es la estructura más simple que puede acomodar tanto grupos hidrófilos como hidrofóbicos en una misma molécula. Si el agua es limitante, es posible obtener una disposición micelar invertida, en la que los grupos de cabeza polar (y agua) están dentro y las colas no polares apuntan hacia afuera (como se muestra en la figura). Otras estructuras altamente organizadas pueden formarse espontáneamente dependiendo de la estructura del grupo de cabeza y la cola. Por ejemplo, las moléculas lipídicas tienen múltiples colas de hidrocarburos y estructuras de anillo de carbono llamadas esteroles. Esa estructura crea una bicapa lipídica, una membrana polar compuesta por dos capas de moléculas lipídicas que forman límites celulares y organelares en todos los organismos. Cabe señalar que estas estructuras ordenadas son posibles sólo porque dispersar las moléculas lipídicas en agua da como resultado una disminución sustancial en el trastorno del sistema. De hecho, muchas estructuras ordenadas asociadas con sistemas vivos, como la estructura de\(\mathrm{DNA}\) y las proteínas, son el resultado de procesos impulsados por la entropía, otra idea contradictoria. ¡Esta es una de las muchas razones por las que los sistemas biológicos no violan las leyes de la termodinámica y por qué es científicamente plausible que la vida surja únicamente por procesos naturales! [8]
Preguntas
Preguntas para responder
- Si tenías un compuesto que sospechabas podría formar micelas:
- ¿Qué características estructurales buscarías?
- ¿Cómo podría diseñar un experimento para determinar si el compuesto formaría micelas en el agua?
- ¿Cuál sería la evidencia experimental?
- ¿Por qué crees que algunas moléculas anfipáticas forman cúmulos esféricos (micelas o liposomas) mientras que otras forman láminas (bicapas)? (Pista: considere la forma de la molécula individual en sí.)
- Las moléculas anfipáticas a menudo se llaman surfactantes. Por ejemplo, los compuestos que se utilizan para dispersar derrames de petróleo son surfactantes. ¿Cómo crees que funcionan?
Preguntas para reflexionar
- Si la formación de membranas y el plegamiento de proteínas son procesos impulsados por la entropía, ¿eso hace que los orígenes de la vida te parezcan más o menos “naturales”?
Soluciones, Coloides y Emulsiones
Entonces, ¿las micelas se disuelven en agua? Bueno, las micelas no son moléculas sino ensamblajes supramoleculares compuestos por muchas moléculas distintas. Una solución de glucosa consiste en moléculas de glucosa aisladas pero las micelas en solución consisten en agregados moleculares más grandes. Las soluciones de solutos macromoleculares se llaman coloides. Estas partículas pueden ser agregados de moléculas (como micelas), átomos (nanopartículas), o macromoléculas más grandes (proteínas, ácidos nucleicos), entre otras. Cuando estas partículas están en el orden de la longitud de onda de la luz visible, dispersan la luz; los objetos más pequeños no. Es por ello que una solución de sal o azúcar es translúcida, mientras que una dispersión coloidal de micelas o células es turbia. [9] Este principio también explica por qué las soluciones de jabón suelen ser turbias, ya que contienen partículas lo suficientemente grandes como para dispersar la luz. Cuando las partículas en una solución mantienen la estructura de un sólido, el resultado final se conoce como coloide. El coloide es estable debido a que se suspenden los movimientos térmicos de estas pequeñas partículas sólidas. A medida que las partículas se hacen más grandes, el coloide se vuelve inestable; la influencia de la gravedad supera los efectos del movimiento térmico y las partículas se asientan. Antes de asentarse, tales sistemas inestables se conocen como suspensión
Pero si las partículas suspendidas son líquidas, el sistema se conoce como emulsión. Por ejemplo, si miráramos un aderezo para ensaladas hecho de aceite y agua bajo un microscopio, veríamos gotas de aceite suspendidas en agua. Las emulsiones suelen ser inestables, y con el tiempo las dos fases líquidas se separan. Es por ello que hay que sacudir el aderezo para ensaladas justo antes de usarlo. Hay muchos coloides y emulsiones en el mundo que nos rodea. La leche, por ejemplo, es una emulsión de glóbulos de grasa y un coloide de micelas de proteínas (caseína).


