9.3: Aminoácidos, Proteínas y pH
- Page ID
- 76696
Además de examinar cómo la adición de un ácido o base fuerte afecta a una solución tampón, también podemos observar el efecto de\(\mathrm{pH}\) sobre un ácido o base en particular. Esto es particularmente importante en sistemas biológicos donde hay muchos grupos ácidos o bases débiles que pueden verse afectados por el\(\mathrm{pH}\). Por ejemplo, las proteínas contienen\(–\mathrm{NH}_{2}\) grupos tanto débilmente ácidos\(–\mathrm{COOH}\) como débilmente básicos. Una\(1.0-\mathrm{M}\) solución de un ácido carboxílico simple como el ácido acético tiene un\(\mathrm{pH}\) de\(\sim 2.8\); resulta que la mayoría de los ácidos carboxílicos se comportan de manera similar. Si manipulamos el\(\mathrm{pH}\), por ejemplo, añadiendo una base fuerte, el ácido acético reacciona con la base para formar un ion acetato. Basado en la ecuación Henderson—Hasselbalch, cuando [acetato] = [ácido acético], el\(\mathrm{pH}\) es igual a los ácidos\(\mathrm{pK}_{a}\), que es\(4.74\). A medida que\(\mathrm{pH}\) aumenta, la concentración de acetato también debe aumentar, hasta por\(\mathrm{pH} \sim 7\) (aproximadamente fisiológico normal\(\mathrm{pH}\)). En este punto la concentración de ácido acético es muy pequeña de hecho. La relación de base a ácido es aproximadamente\(200/1\). Es decir, en los grupos fisiológicos\(\mathrm{pH}\) como los ácidos carboxílicos se desprotonan y existen en forma de carboxilato (cargado negativamente).
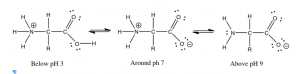
Por el contrario, si observamos el grupo amino (\(–\mathrm{NH}_{2}\)) de una proteína, en realidad es la parte base de un par ácido base conjugado en el que el ácido es la forma protonada\(–\mathrm{NH}_{3}{}^{+}\). El\(\mathrm{pK}_{a}\) de un\(–\mathrm{NH}_{3}{}^{+}\) grupo es típicamente\(\sim 9\). A una\(\mathrm{pH}\) de\(9\) hay cantidades iguales de las formas protonadas (\(–\mathrm{NH}_{2}\)) y no protonadas (\(–\mathrm{NH}_{3}{}^{+}\)). Entonces, si cambiamos el\(\mathrm{pH}\) añadiendo un ácido, la concentración de\(–\mathrm{NH}_{3}{}^{+}\) forma aumenta a medida que la forma base\(–\mathrm{NH}_{2}\) es protonada. En\(\mathrm{pH} \sim 7\) queda poco de la\(–\mathrm{NH}_{2}\) forma. Curiosamente, esto significa que un aminoácido (mostrado en la figura) nunca existe en un estado en el que tanto el grupo amino (\(–\mathrm{NH}_{2}\)) como el ácido carboxílico (\(–\mathrm{CO}_{2}\mathrm{H}\)) existan al mismo tiempo. La especie “neutra” es de hecho aquella en la que\(–\mathrm{NH}_{3}{}^{+} / –\mathrm{CO}_{2}\) — están presentes. Este zwitterion (que es una molécula neutra con una carga eléctrica positiva y negativa en diferentes ubicaciones, del zwitter alemán, que significa “entre”) es la forma predominante en fisiológico\(\mathrm{pH}\).
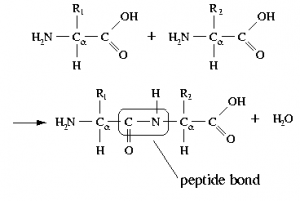
Una proteína está compuesta principalmente (a veces únicamente) de polímeros de aminoácidos, conocidos como polipéptidos. En un polipéptido, el amino (\(–\mathrm{NH}_{2}\)) y el ácido carboxílico (\(–\mathrm{CO}_{2}\mathrm{H}\)) groups of amino acids are bonded together to form a peptide bond (see figure). The resulting amide group (peptide bond) is neither acidic nor basic under physiological conditions.[9] That being said, many of the amino acids found in proteins have acidic (aspartic acid or glutamic acid) or basic (lysine, arginine, or histidine) side chains. The \(\mathrm{pH}\)del ambiente influye en las conformaciones de la molécula de proteína y las interacciones entre estas cadenas laterales cargadas (las conformaciones nativas espontáneas de la molécula se denominan proteína plegable). Los cambios del ambiente “normal” pueden conducir a cambios en la estructura de las proteínas, y esto a su vez puede cambiar la actividad biológica. En algunos casos, la actividad proteica está regulada por el medio ambiente\(\mathrm{pH}\). En otros casos, los cambios en\(\mathrm{pH}\) pueden conducir a un plegamiento incorrecto de las proteínas (o desnaturalización, que en los organismos vivos puede causar la interrupción de la actividad celular o la muerte). Por ejemplo, si estos grupos están protonados o desprotonados, el entorno electrónico en esa región de la proteína puede cambiar drásticamente, lo que puede significar que la proteína no solo cambiará la forma en que interactúa con otras especies sino que su forma puede cambiar para minimizar las interacciones repulsivas o producir nuevas interacciones atractivas. Pequeños cambios en la forma de la proteína pueden tener profundos efectos sobre cómo la proteína interactúa con otras moléculas y, si es un catalizador, su eficiencia y especificidad. De hecho, hay casos en los que\(\mathrm{pH}\) se utiliza el medio ambiente para regular la actividad proteica.
Preguntas
Preguntas a responder:
- ¿Cuál sería la proporción de\(–\mathrm{NH}_{3}{}^{+} / –\mathrm{NH}_{2}\) en una solución de una proteína en\(\mathrm{pH} 5\),\(\mathrm{pH} 7\), y\(\mathrm{pH} 9\)?
- ¿En qué tipo de interacciones participaría cada forma?
- ¿Cuál es la forma predominante de un grupo ácido carboxílico\(\mathrm{pH} 5\)? \(\mathrm{pH} 7\),\(\mathrm{pH} 9\)
- ¿En qué tipo de interacciones participaría cada forma?
- ¿Cuál es la proporción de\(–\mathrm{NH}_{3}{}^{+} / –\mathrm{NH}_{2}\) en una solución de una proteína en\(\mathrm{pH} 5\),\(\mathrm{pH} 7\), y\(\mathrm{pH} 9\)? ¿En qué tipo de interacciones participa cada formulario?
- ¿Cuál es la forma predominante de un grupo ácido carboxílico\(\mathrm{pH} 5\)? ¿Qué tal en\(\mathrm{pH} 7\) y\(\mathrm{pH} 9\)? ¿En qué tipo de interacciones participa cada formulario?


