9.4: Sistemas de Reacción Acoplados, No Equilibrio
- Page ID
- 76709
Otro sistema tampón importante es el tampón ácido carbónico (\(\mathrm{H}_{2}\mathrm{CO}_{3}\)) bicarbonato (\(\mathrm{HCO}_{3}{}^{-}\)), que es un componente amortiguador importante del plasma sanguíneo. Este sistema es más complejo que el tampón fosfato, ya que el ácido carbónico se forma por la reacción reversible del dióxido de carbono en el agua:\[\mathrm{H}_{2} \mathrm{O}+\mathrm{CO}_{2} \rightleftarrows \mathrm{H}_{2} \mathrm{CO}_{3} \quad \text { and } \quad \mathrm{H}_{2} \mathrm{CO}_{3}+\mathrm{H}_{2} \mathrm{O} \rightleftarrows \mathrm{HCO}_{3}^{-}+\mathrm{H}_{3} \mathrm{O}^{+}\]
Estas son dos reacciones unidas (o acopladas) por un intermedio común. Al examinar más de cerca estas reacciones, vemos cómo existen algunos sistemas en condiciones de no equilibrio y cómo ocurren algunas reacciones a pesar de que tienen un cambio positivo de energía libre y parecen contravenir la segunda ley de la termodinámica.
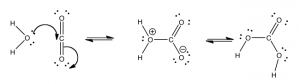
Como hemos visto anteriormente, las reacciones químicas simples se caracterizan por la rapidez con la que ocurren (su velocidad) y qué tan lejos avanzan hacia el equilibrio. Si bien aprenderás mucho más sobre las reacciones si continúas en química, eso no es algo que persigamos aquí —más bien consideraremos el comportamiento de los sistemas de reacciones y su comportamiento, particularmente cuando no han alcanzado el equilibrio. Esta es una situación común en los sistemas abiertos, sistemas en los que la energía y la materia fluyen dentro y fuera. En Capítulo\(8\), consideramos reacciones individuales y qué sucede cuando las perturbimos, ya sea agregando o quitando materia (reactivos o productos) o energía (calentando o enfriando la reacción). Ahora es el momento de mirar lo que sucede cuando las reacciones se acoplan: cuando los productos de una reacción son los materiales de partida para otras reacciones que ocurren en el mismo sistema.
Tomemos por ejemplo el sistema acoplado introducido anteriormente, el par de reacciones que están unidas por la formación y reacción del ácido carbónico. \[\mathrm{H}_{2} \mathrm{O}+\mathrm{CO}_{2} \rightleftarrows \mathrm{H}_{2} \mathrm{CO}_{3} \text { and } \mathrm{H}_{2} \mathrm{CO}_{3}+\mathrm{H}_{2} \mathrm{O} \rightleftarrows \mathrm{HCO}_{3}^{-}+\mathrm{H}_{3} \mathrm{O}^{+}\]
Estas reacciones acopladas son importantes por una serie de razones: son responsables del transporte del exceso de dióxido de carbono a los pulmones y de amortiguar el pH de la sangre. El dióxido de carbono ingresa al torrente sanguíneo disolviéndose en el plasma. Sin embargo, también puede reaccionar con el agua en una reacción donde el agua actúa como nucleófilo y el dióxido de carbono actúa como electrófilo.
La formación de ácido carbónico es termodinámicamente desfavorable. La constante de equilibrio para la hidratación del dióxido de carbono es\(1.7 \times 10^{-3}\) y el cambio estándar de energía libre\(\Delta \mathrm{G}^{\circ}\) para la reacción [10] es\(16.4 \mathrm{~kJ}\). Esto significa que la cantidad de ácido carbónico en el plasma sanguíneo es bastante baja; la mayor parte del dióxido de carbono simplemente se disuelve en el plasma (en lugar de reaccionar con el agua). Sin embargo, tan pronto como se forma el ácido carbónico, puede reaccionar con el agua:\[\mathrm{H}_{2} \mathrm{CO}_{3}+\mathrm{H}_{2} \mathrm{O} \rightleftarrows \mathrm{HCO}_{3}{ }^{-}+\mathrm{H} 3 \mathrm{O}^{+}\]
para producir bicarbonato (\(\mathrm{HCO}_{3}{}^{-}\)). Tenga en cuenta que ahora tenemos los componentes de un sistema tampón (un ácido débil, ácido carbónico, y su bicarbonato de base conjugada). La velocidad de esta reacción es incrementada por el catalizador enzimático anhidrasa carbónica. En este sistema tampón el ácido carbónico puede reaccionar con cualquier base que entre al torrente sanguíneo, y el bicarbonato con cualquier ácido. Este sistema de amortiguación es más complejo que los aislados que consideramos anteriormente, debido a que uno de los componentes (ácido carbónico) también forma parte de otra reacción de equilibrio. En esencia, esto significa que el pH de la sangre depende de la cantidad de dióxido de carbono en el torrente sanguíneo:\[\mathrm{H}_{2} \mathrm{O}+\mathrm{CO}_{2} \rightleftarrows \mathrm{H}_{2} \mathrm{CO}_{3}+\mathrm{H}_{2} \mathrm{O} \rightleftarrows \mathrm{HCO}_{3}^{-}+\mathrm{H}_{3} \mathrm{O}^{+}\]
Si eliminamos el agua de las ecuaciones (en aras de la claridad) podemos ver mejor la conexión:\[\mathrm{CO}_{2} \rightleftarrows \mathrm{H}_{2} \mathrm{CO}_{3} \rightleftarrows \mathrm{HCO}_{3}^{-}+\mathrm{H}_{3} \mathrm{O}^{+}\]
Figura\(9.4.1\) Ácido Láctico
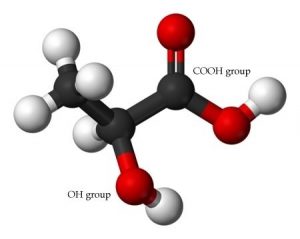
El\(\mathrm{pK}_{a}\) de ácido carbónico es\(6.37\) y el\(\mathrm{pH}\) de la sangre es típicamente\(7.2–7.4\), lo que sí cae justo dentro del rango de amortiguación. En circunstancias normales, este sistema de búfer puede manejar la mayoría de los cambios. Sin embargo, para cambios mayores, otros sistemas son llamados a jugar para ayudar a regular el pH. Por ejemplo, si te esfuerzas, uno de los productos generados es el ácido láctico, (que denotamos como\(\mathrm{LacOH}\)). [11] Cuando el ácido láctico llega al torrente sanguíneo, disminuye\(\mathrm{pH}\) (aumentando la cantidad de\(\mathrm{H}_{3}\mathrm{O}^{+}\)) a través de la reacción:\[\mathrm{LacOH}+\mathrm{H}_{2} \mathrm{O} \rightleftarrows \mathrm{H}_{3} \mathrm{O}^{+}+\mathrm{LacO}^{-}\]
Si utilizamos el principio de Le Chatelier, se puede ver que al aumentar el equilibrio\(\mathrm{H}_{3}\mathrm{O}^{+}\) se desplaza el equilibrio hacia la producción de dióxido de carbono en el sistema tampón. A medida que\(\mathrm{CO}_{2}\) aumenta la concentración de, un proceso conocido como quimiorrecepción activa los sistemas nerviosos, que a su vez regulan (aumentan) las frecuencias cardíacas y respiratorias, lo que a su vez conduce a un aumento en la tasa de\(\mathrm{CO}_{2}\) e intercambio de oxígeno en los pulmones. [12] Al inhalar\(\mathrm{O}_{2}\), exhalas\(\mathrm{CO}_{2}\) (sacándolo de tu sangre). ¡En esencia, el principio de Le Chatelier explica por qué jadeamos cuando hacemos ejercicio! [13] Por el contrario, cuando algunas personas se excitan, respiran demasiado rápido (hiperventilan);\(\mathrm{CO}_{2}\) se elimina demasiado de la sangre, lo que reduce la\(\mathrm{H}_{3}\mathrm{O}^{+}\) concentración y aumenta la\(\mathrm{pH}\). Esto puede provocar desmayos (lo que ralentiza la respiración), una forma bastante drástica de devolver la sangre a su correcta\(\mathrm{pH}\). Un enfoque alternativo y no desmayo es respirar dentro de un recipiente cerrado. Al respirar expulsado\(\mathrm{CO}_{2}\) (y un nivel inferior de\(\mathrm{O}_{2}\)), aumentas tu sangre\(\mathrm{pH}\).
Si bien podemos usar el principio de Le Chatelier para explicar el efecto de la respiración rápida o lenta, esta respuesta se basa en lo que se conoce como sistemas adaptativos y homeostáticos. Los sistemas biológicos se caracterizan por muchos de esos mecanismos reguladores interconectados. Mantienen un ambiente químico interno estable, esencial para la vida. Los sistemas reguladores acoplados se encuentran en el corazón de la función inmune y del sistema nervioso. Comprender el comportamiento de los sistemas reguladores acoplados está a la vanguardia de muchas áreas de investigación, tales como: medir la respuesta fisiológica a los niveles de diversas sustancias químicas (quimiorrecepción); reconocer y responder a moléculas extrañas en el sistema inmune; y medir la respuesta a ambos estímulos (luz, sonido, olfato, tacto) y factores internos (como el sistema nervioso). Aguas abajo de los sistemas sensoriales examinados por tales esfuerzos se encuentran redes de genes, proteínas y otras moléculas cuyas interacciones están determinadas por la termodinámica del sistema químico. Aunque fueron formados por procesos evolutivos, y a menudo son barrocos en sus detalles, son comprensibles en términos de interacciones moleculares, reacciones químicas y sus cambios energéticos acompañantes.
Preguntas
Preguntas para responder
- Si el\(\mathrm{pK}_{a}\) de ácido carbónico es\(6.35\) y el\(\mathrm{pH}\) de la sangre se acabó\(7\), ¿cuáles crees que son las cantidades relativas de ácido carbónico y bicarbonato? ¿Por qué?
- Extraer la serie de reacciones que ocurren cuando se introduce ácido láctico en el torrente sanguíneo y explica por qué esto afecta la concentración de dióxido de carbono en el torrente sanguíneo.
- Si aumenta la cantidad de dióxido de carbono en la atmósfera, ¿qué efecto tiene en los océanos y lagos?
- Si el dióxido de carbono se disuelve en agua para dar ácido carbónico, ¿qué opinas que da el dióxido de nitrógeno (\(\mathrm{NO}_{2}\)) cuando se disuelve en agua? ¿Qué tal el dióxido de azufre? ¿Qué efecto tiene esto en\(\mathrm{pH}\) el agua en la que se disuelve?


