9.5: Energética y Acoplamiento
- Page ID
- 76697
Hemos visto que para los sistemas de reacciones acopladas, cambiar la concentración de uno de los componentes en el sistema afecta a todos los demás componentes, aunque no estén reaccionando directamente con el que se cambia. Podemos usar los mismos principios para explicar por qué es posible llevar a cabo reacciones que son termodinámicamente desfavorables. Consideraremos un ejemplo bastante simple y luego pasaremos a ver cómo funciona esto en los sistemas biológicos.
Muchos metales no se encuentran en su forma elemental. Por ejemplo, el cobre, un metal importante que se utiliza para una amplia gama de aplicaciones, desde cables hasta techos, a menudo se encuentra como calcocita, un mineral que contiene cobre como sulfuro de cobre. Podemos imaginar una simple reacción química para separar el cobre del sulfuro: [14]\[\mathrm{Cu}_{2} \mathrm{S}(s) \rightleftarrows 2 \mathrm{Cu}(s)+\mathrm{S}(s) \quad \Delta \mathrm{G}^{0}=86.2 \mathrm{kJ} / \mathrm{mol}\]
Obsérvese que esta reacción es una reacción redox en la que el\(\mathrm{Cu}^{+}\) ion se reduce a\(\mathrm{Cu}\) mediante la adición de un electrón (del sulfuro\(\mathrm{S}^{2-}\), que se oxida a azufre con un estado de oxidación de 0.) Desafortunadamente, debido a que el cambio de energía libre para esta reacción es positivo, el sistema en equilibrio está compuesto principalmente por\(\mathrm{Cu}_{2} \mathrm{S}(s)\). ¿Cómo podemos sacar cobre del sulfuro de cobre? Una posibilidad para explotar la reacción entre azufre y oxígeno:\[\mathrm{S}(s)+\mathrm{O}_{2}(g) \rightleftarrows \mathrm{SO}_{2}(g), \text { for which } \Delta \mathrm{G}^{\circ}=-300.1 \mathrm{kJ} / \mathrm{mol}\]
Esta reacción es altamente favorable y “va” hacia la producción de\(\mathrm{SO}_{2}\) 2. Se trata básicamente de la quema de azufre (análoga a la quema de carbono) y es otra reacción redox en la que se oxida el azufre (de un estado de oxidación de 0 a +4). Tenga en cuenta que una razón por la cual esta reacción es tan favorable es la formación de\(\mathrm{S-O}\) los enlaces fuertes, que es un proceso altamente exotérmico.
Si tomamos\(\mathrm{Cu}_{2}\mathrm{S}(s)\) junto con\(\mathrm{O}_{2}(g)\), tenemos un sistema compuesto por dos reacciones:\ [\ begin {aligned}
&\ mathrm {Cu} _ {2}\ mathrm {~S} (s)\ rightleftarrows 2\ mathrm {Cu} (s) +\ mathrm {S} (s)\ text {[reacción 1]}\\
&\ mathrm {S} (s) +\ mathrm {O} _ {2} (g)\ derechaizquierdas\ mathrm { SO} _ {2} (g)\ texto {[reacción 2]}
\ final {alineado}\]
Estas dos reacciones comparten un componente común (\(\mathrm{S}(s)\)); por lo tanto, están acopladas. Imagínese lo que sucede cuando procede la reacción 1, aunque sea un poco. El\(\mathrm{S}(s)\) producido puede entonces reaccionar con el\(\mathrm{O}_{2}(g)\) presente. A medida que esta reacción avanza hacia su finalización,\(\mathrm{S}(s)\) se retira, dejando\(\mathrm{Cu}(s)\) y\(\mathrm{SO}_{2} (g)\). Basado en el principio de Le Chatelier, la reacción 1 ahora está fuera de equilibrio, y así genera más\(\mathrm{S}(s)\) y\(\mathrm{Cu}(s)\). La reacción 1 en aislamiento produce relativamente poco cobre o azufre, pero es arrastrada hacia los productos por la reacción 2, una reacción favorable que elimina azufre del sistema. Si asumimos que no hay otras reacciones que ocurran dentro del sistema, podemos calcular la\(\Delta \mathrm{G}^{\circ}\) para las reacciones acopladas 1 y 2. En condiciones estándar, simplemente sumamos las reacciones juntas:
| \(\mathrm{Cu}_{2}\mathrm{S}(s) \rightleftarrows 2\mathrm{Cu}(s) + \mathrm{S}(s)\) | \(86.2 \mathrm{~kJ/mol}\) |
| \(\mathrm{S}(s) + \mathrm{O}_{2}(g) \rightleftarrows \mathrm{SO}_{2} (g)\) | \(-300.1 \mathrm{~kJ/mol}\) |
| \(\mathrm{Cu}_{2}\mathrm{S}(s) + \mathrm{O}_{2} (g) \rightleftarrows 2\mathrm{Cu}(s) + \mathrm{SO}_{2} (g)\) | \(-213.9 \mathrm{~kJ/mol}\) |
Entonces, el\(\Delta \mathrm{G}^{\circ}\) para la reacción acoplada es\(-213.9 \mathrm{~kJ/mol}\). Esta misma lógica básica se aplica a cualquier sistema de reacción acoplada. Obsérvese que el intermedio común que une estas dos reacciones es el azufre (\(\mathrm{S}\)). Sin embargo, no siempre es tan sencillo identificar el intermedio común. En este sistema, estamos asumiendo tácitamente eso\(\mathrm{O}_{2}\) y\(\mathrm{SO}_{2}\) no reaccionamos con ninguno\(\mathrm{Cu}_{2}\mathrm{S}\) o\(\mathrm{SO}_{2}\). Si lo hicieran, esas reacciones también tendrían que ser consideradas en nuestro análisis. De hecho, necesitamos considerar todas las reacciones que son posibles con un sistema. Esto normalmente no es un gran problema con los sistemas químicos simples que contienen números relativamente pequeños de diferentes tipos de moléculas (a veces llamadas especies), pero es una preocupación significativa cuando consideramos sistemas biológicos o ecológicos que contienen miles de tipos diferentes de moléculas, lo que puede interactuar y reaccionar de varias maneras.
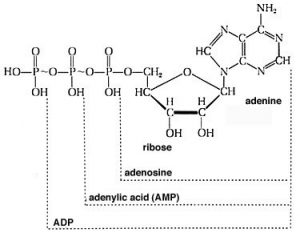
Por ejemplo, es posible que hayas aprendido en biología que la molécula adenosina trifosfato (\(\mathrm{ATP}\)) se utiliza para almacenar y proporcionar energía para los procesos celulares. ¿Qué significa esto exactamente? Primero, veamos la estructura de\(\mathrm{ATP}\): está compuesta por una base llamada adenina, una ribosa de azúcar y tres unidades de fosfato. Para nuestros propósitos, la base adenina y el azúcar (llamados adenosina cuando se unen entre sí) son irrelevantes. No cambian durante la mayoría de las reacciones en las que\(\mathrm{ATP}\) participa. Son “bloques de construcción” orgánicos con grupos funcionales que les permiten interactuar con otros componentes en la célula para otras funciones (por ejemplo, en\(\mathrm{RNA}\) y\(\mathrm{DNA}\)). Para examinar la transferencia de energía, solo podemos usar “A” (adenosina) para representar su estructura. Lo importante para nuestros propósitos son los fosfatos enganchados entre sí por los enlaces\(\mathrm{P—O—P}\) (fosfoanhídrido). En fisiológico\(\mathrm{pH}\), la mayoría (si no todos) de los oxígenos de los ésteres de fosfato están desprotonados. Esto significa que hay una concentración de carga bastante alta en esta cadena lateral de triéster, que actúa para desestabilizarla. Los enlaces que la mantienen unida son relativamente débiles, y la molécula reacciona con cualquier entidad disponible para aliviar parte de esta cepa y formar enlaces aún más estables. Por ejemplo,\(\mathrm{ATP}\) es inestable en agua y reacciona (hidroliza) para formar adenosina difosfato (\(\mathrm{ADP}\)) y fosfato inorgánico (\(\mathrm{HPO}_{4}\)), que a menudo se escribe como\(\mathrm{P}_{i}\). Esta reacción está escrita como\(\mathrm{ATP} + \mathrm{H}_{2}\mathrm{O} \rightleftarrows \mathrm{ADP} + \mathrm{P}_{i}\).
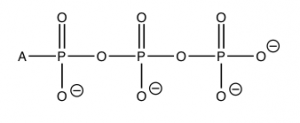
El cambio estándar de energía libre para esta reacción\(\Delta \mathrm{G}^{\circ} = – 29 \mathrm{~kJ/mol}\) (at\(\mathrm{pH } 7\)). Esta es una reacción altamente exergónica (liberación de calor o energía); tanto los cambios de entalpía como entropía para esta reacción son favorables. \(\Delta \mathrm{H}\)es negativo y\(\Delta \mathrm{S}\) es positivo. Tiene sentido que el cambio de entropía sea positivo. Después de todo, estamos produciendo dos moléculas a partir de una. El cambio de entalpía también tiene sentido. Ya hemos mencionado que\(\mathrm{ATP}\) es inestable, y la pérdida de uno de los grupos fosfato alivia parte de la cepa causada por la repulsión de carga entre los tres grupos fosfato cargados negativamente en\(\mathrm{ATP}\). Las energías de enlace en el producto son más fuertes que las energías de enlace en los reactivos y, por lo tanto, la reacción es exotérmica. Como todo en los sistemas vivos, todo esto es algo complicado por la presencia de otras sustancias en los fluidos celulares, como los iones metálicos\(\mathrm{Ca}^{2+}\) y\(\mathrm{Mg}^{2+}\), y los cambios en el pH. No obstante, la explicación sigue siendo válida. Asegúrate de no caer presa del concepto erróneo comúnmente sostenido de que es la ruptura del\(\mathrm{P—O}\) vínculo lo que libera energía. Por el contrario, es la formación de enlaces más estables (más fuertes) lo que libera energía.
Si vamos un paso más allá y observamos el cambio real de energía libre\(\Delta \mathrm{G}\) (a diferencia del cambio estándar), usando concentraciones celulares típicas de\(\mathrm{ATP}\),\(\mathrm{ADP}\) y\(\mathrm{P}_{i}\), y\(\Delta \mathrm{G} = \Delta \mathrm{G}^{\circ} + \mathrm{RT} \ln \mathrm{Q}\) (dónde\(\mathrm{Q}=[\mathrm{ADP}]\left[\mathrm{P}_{i}\right] /[\mathrm{ATP}]\)), podemos calcular:\(\Delta \mathrm{G} = – 52 \mathrm{~kJ/mol}\), asumiendo que la concentración de\(\mathrm{ATP}\) suele ser aproximadamente diez veces mayor que la de\(\mathrm{ADP}\), y eso\(\left[\mathrm{P}_{i}\right]\) es aproximadamente\(0.001 \mathrm{~M}\). Entonces, en condiciones reales en la celda, el cambio de energía libre de Gibbs es mucho más alto que el cambio de energía libre de Gibbs estándar. Esta energía no se desperdicia; se utiliza para impulsar otras reacciones que de otra manera no se producirían. Sin embargo, esta energía no puede ser utilizada para impulsar cualquier reacción aleatoria. Las reacciones tienen que ser acopladas por intermedios comunes (al igual que el sistema de carbonato de dióxido de carbono).
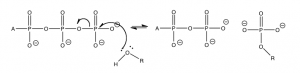
Un escenario de reacción típico es la transferencia del grupo fosfato terminal a otra biomolécula como se muestra en el diagrama. Esta transferencia ocurre con lípidos y proteínas, pero típicamente el grupo de reacción es un alcohol (\(\mathrm{ROH}\)) o a veces un ácido carboxílico (\(\mathrm{RCOOH}\)). La reacción que tiene lugar es casi la misma que la reacción de hidrólisis excepto que el nucleófilo entrante tiene muchas más “cosas” adheridas al oxígeno.

La formación de estos ésteres de fosfato hace que el grupo funcional original sea más reactivo. Por ejemplo, la formación de un enlace amida (el enlace principal que mantiene unidas a las proteínas) normalmente es exergónico (aproximadamente\(+2\) a\(4 \mathrm{~kJ/mol}\)). La formación de enlaces amida no es espontánea (es posible que desee pensar en lo que esto significa para los enlaces amida en las proteínas que componen una buena porción de usted). Por lo tanto, la síntesis de proteínas se acopla con la\(\mathrm{ATP}\) hidrólisis, al igual que la producción de muchas biomoléculas, azúcares, lípidos\(\mathrm{RNA}\), y\(\mathrm{DNA}\). Las reacciones son complejas, pero cada una de ellas está impulsada por una serie de reacciones individuales unidas por intermedios comunes.
Ahora podrías estar preguntando: si\(\mathrm{ATP}\) es tan inestable, ¿cómo se forma en primer lugar y cómo se puede encontrar en concentraciones tan altas? La respuesta corta involucra dos ideas que nos hemos encontrado antes: primero, mientras que\(\mathrm{ATP}\) es inestable (como la madera en presencia de\(\mathrm{O}_{2}\)), su hidrólisis sí implica superar una energía de activación y así bajo condiciones fisiológicas, una enzima que puede catalizar y acoplar la hidrólisis de \(\mathrm{ATP}\)a otras reacciones (una\(\mathrm{ATP}\) asa); segundo,\(\mathrm{ATP}\) se forma a través de reacciones acopladas que vinculan la oxidación de moléculas como la glucosa o a través de la absorción directa de energía en forma de luz (fotosíntesis). Cuando la glucosa reacciona con el oxígeno forma dióxido de carbono y agua:\[\mathrm{C}_{6} \mathrm{H}_{12} \mathrm{O}_{6}+6 \mathrm{O}_{2} \rightleftarrows 6 \mathrm{CO}_{2}+6 \mathrm{H}_{2} \mathrm{O}\]
con un cambio general de energía libre estándar\(\Delta \mathrm{G}^{\circ} = –2870 \mathrm{~kJ/mol}\). Las razones de este alto cambio negativo de energía libre son que\(\Delta \mathrm{S}^{\circ}\) es positivo (¿por qué crees que esto es?) , y hay un gran\(\Delta \mathrm{H}^{\circ}\) cambio negativo. Recuerde que se\(\Delta \mathrm{H}^{\circ}\) puede aproximar observando los cambios en la energía de enlace de los reactivos a los productos. Una de las principales razones de este alto cambio de entalpía es que las energías de enlace en el dióxido de carbono y el agua son muy altas (un\(\mathrm{C=O}\) enlace tarda\(805 \mathrm{~kJ/mol}\) en romperse, y un\(\mathrm{O-H}\) enlace\(463 \mathrm{~kJ/mol}\)), y por lo tanto cuando\(\mathrm{C=O}\) se forman\(\mathrm{O-H}\) los enlaces se libera una gran cantidad de energía. Cuando un mol de glucosa se oxida completamente a\(\mathrm{CO}_{2}\) y\(\mathrm{H}_{2}\mathrm{O}\), la energía producida se aprovecha para finalmente producir\(\sim 36\) moles de\(\mathrm{ATP}\) (de\(\mathrm{ADP}\) y\(\mathrm{P}_{i}\)).
El mecanismo o mecanismos involucrados en este proceso son complejos (implican gradientes iónicos intermedios y enzimas rotativas), pero el principio básico permanece: las reacciones están acopladas por procesos intermedios comunes y a menudo complejos. Este acoplamiento de reacción conduce a redes de reacciones. La síntesis y reacción de\(\mathrm{ATP}\) (y\(\mathrm{ADP}\)) se rige por los mismos principios que rigen reacciones mucho más simples. El que\(\mathrm{ADP}\) sea\(\mathrm{ATP}\) o no la especie dominante en cualquier compartimento celular depende de las condiciones y de qué sustratos están presentes para formar una reacción.
Preguntas
Preguntas para responder
- ¿Se puede dibujar la forma protonada de\(\mathrm{ATP}\)?
- ¿Se puede dibujar la forma no protonada de\(\mathrm{ATP}\), mostrando cómo la carga negativa es estabilizada por los fluidos celulares circundantes? (Pista: el fluido es principalmente agua.)
- Las\(\mathrm{pK}_{a}\)'s del ácido fosfórico (\(\mathrm{H}_{3}\mathrm{PO}_{4}\)) son\(2.15\),\(7.2\) y\(12.35\). ¿Está el\(\mathrm{ATP}\) protonado o desprotonado en el ambiente celular?
- Escriba una secuencia hipotética de dos reacciones que resulten en la producción de un producto termodinámicamente desfavorable.
- ¿Cómo se puede saber si dos reacciones están acopladas?
- ¿Por qué los sistemas biológicos dependen de reacciones acopladas?
- Si\(\mathrm{ATP}\) es inestable, ¿cómo es posible que\(\mathrm{ATP}\) pueda existir a altas concentraciones dentro de la célula?
Preguntas para reflexionar
- Si estás tratando de determinar si dos reacciones están acopladas, ¿qué buscas?
- El acoplamiento permite que ocurran reacciones desfavorables. ¿Por qué esto no viola las leyes de la termodinámica? Supongamos que tienes un conjunto de cinco reacciones acopladas. ¿Qué factores podrían complicar el comportamiento del sistema?
- ¿Cómo se podría asegurar que una reacción desfavorable continuara ocurriendo a un
ritmo significativo (útil)?


