3.4: Otras Unidades para Concentraciones de Solución
- Page ID
- 75141
- Definir las unidades de concentración de porcentaje de masa, porcentaje de volumen, porcentaje de masa y volumen, partes por millón (ppm) y partes por mil millones (ppb)
- Realizar cálculos relacionados con la concentración de una solución y los volúmenes y/o masas de sus componentes usando estas unidades
En el apartado anterior, se introdujo la molaridad, una unidad de medida muy útil para evaluar la concentración de soluciones. Sin embargo, la molaridad es solo una medida de concentración. En esta sección, presentaremos algunas otras unidades de concentración que se utilizan comúnmente en diversas aplicaciones, ya sea por conveniencia o por convención.
Porcentaje de Masa
Anteriormente en este capítulo, introdujimos la composición porcentual como medida de la cantidad relativa de un elemento dado en un compuesto. Los porcentajes también se utilizan comúnmente para expresar la composición de mezclas, incluyendo soluciones. El porcentaje de masa de un componente de solución se define como la relación entre la masa del componente y la masa de la solución, expresada como porcentaje:
\[ \text{mass percentage} = \dfrac{\text{mass of component}}{\text{mass of solution}} \times100\% \label{3.5.1} \]
Generalmente estamos más interesados en los porcentajes de masa de solutos, pero también es posible calcular el porcentaje de masa de solvente.
El porcentaje de masa también se conoce con nombres similares como porcentaje de masa, porcentaje de peso, porcentaje de peso/peso y otras variaciones sobre este tema. El símbolo más común para el porcentaje de masa es simplemente el signo de porcentaje,%, aunque a menudo se usan símbolos más detallados que incluyen% masa,% peso y (w/w)%. El uso de estos símbolos más detallados puede evitar la confusión de los porcentajes de masa con otros tipos de porcentajes, como los porcentajes de volumen (que se discutirá más adelante en esta sección).
Los porcentajes de masa son unidades de concentración populares para productos de consumo. La etiqueta de una botella típica de lejía líquida (Figura\(\PageIndex{1}\)) cita la concentración de su ingrediente activo, hipoclorito de sodio (\(\ce{NaOCl}\)), como de 7.4%. Por lo tanto, una muestra de 100.0-g de lejía contendría 7.4 g de\(\ce{NaOCl}\).

Una muestra de 5.0 g de líquido cefalorraquídeo contiene 3.75 mg (0.00375 g) de glucosa. ¿Cuál es el porcentaje en masa de glucosa en el líquido cefalorraquídeo?
Solución
La muestra de líquido cefalorraquídeo contiene aproximadamente 4 mg de glucosa en 5000 mg de líquido, por lo que la fracción de masa de glucosa debe ser un poco menor que una parte en 1000, o aproximadamente 0.1%. Sustituyendo las masas dadas en la ecuación que define rendimientos porcentuales de masa:
\[\mathrm{\%\,glucose=\dfrac{3.75\;mg \;glucose \times \frac{1\;g}{1000\; mg}}{5.0\;g \;spinal\; fluid}=0.075\%} \nonumber \]
El porcentaje de masa calculado concuerda con nuestra estimación aproximada (es un poco menos de 0.1%).
Tenga en cuenta que si bien se puede usar cualquier unidad de masa para calcular un porcentaje de masa (mg, g, kg, oz, etc.), se debe usar la misma unidad tanto para el soluto como para la solución para que las unidades de masa cancelen, produciendo una relación adimensional. En este caso, convertimos las unidades de soluto en el numerador de mg a g para que coincidan con las unidades en el denominador. Podríamos haber convertido fácilmente el denominador de g a mg en su lugar. Siempre y cuando se utilicen unidades de masa idénticas tanto para soluto como para solución, el porcentaje de masa calculado será correcto.
Una botella de un limpiador de azulejos contiene 135 g de\(\ce{HCl}\) y 775 g de agua. ¿Cuál es el porcentaje en masa de\(\ce{HCl}\) en este limpiador?
- Responder
-
14.8%
El ácido clorhídrico “concentrado” es una solución acuosa de 37.2%\(\ce{HCl}\) que se usa comúnmente como reactivo de laboratorio. La densidad de esta solución es de 1.19 g/mL. ¿Qué masa de\(\ce{HCl}\) está contenida en 0.500 L de esta solución?
Solución
La concentración de HCl es cercana al 40%, por lo que una porción de 100 g de esta solución contendría aproximadamente 40 g de HCl. Dado que la densidad de la solución no es muy diferente de la del agua (1 g/mL), una estimación razonable de la masa de HCl en 500 g (0.5 L) de la solución es aproximadamente cinco veces mayor que la de una porción de 100 g, o\(\mathrm{5 \times 40 = 200\: g}\). Para derivar la masa de soluto en una solución a partir de su porcentaje de masa, necesitamos conocer la masa correspondiente de la solución. Usando la densidad de solución dada, podemos convertir el volumen de la solución a masa, y luego usar el porcentaje de masa dado para calcular la masa de soluto. Este enfoque matemático se resume en este diagrama de flujo:
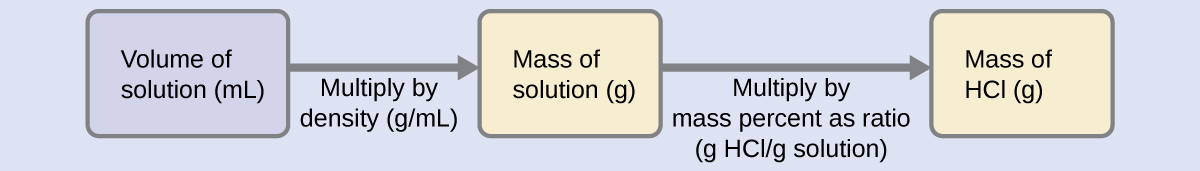
Para una cancelación adecuada de la unidad, el volumen de 0.500-L se convierte en 500 mL, y el porcentaje de masa se expresa como una relación, 37.2 g HCl/g solución:
\[ \mathrm{500\; mL\; solution \left(\dfrac{1.19\;g \;solution}{mL \;solution}\right) \left(\dfrac{37.2\;g\; HCl}{100\;g \;solution}\right)=221\;g\; HCl} \nonumber \]
Esta masa de HCl es consistente con nuestra estimación aproximada de aproximadamente 200 g.
¿Qué volumen de solución concentrada de HCl contiene 125 g de HCl?
- Responder
-
282 mL
Porcentaje de volumen
Los volúmenes de líquido en una amplia gama de magnitudes se miden convenientemente utilizando equipos de laboratorio comunes y relativamente económicos. Por lo tanto, la concentración de una solución formada disolviendo un soluto líquido en un disolvente líquido se expresa a menudo como un porcentaje en volumen,% vol o (v/v)%:
\[ \text{volume percentage} = \dfrac{\text{volume solute}}{\text{volume solution}} \times100\% \label{3.5.2} \]
El alcohol para frotar (isopropanol) generalmente se vende como una solución acuosa al 70% vol. Si la densidad del alcohol isopropílico es de 0.785 g/mL, ¿cuántos gramos de alcohol isopropílico están presentes en una botella de 355 mL de alcohol para frotar?
Solución
Según la definición de porcentaje en volumen, el volumen de isopropanol es 70% del volumen total de la solución. Al multiplicar el volumen de isopropanol por su densidad se obtiene la masa solicitada:
\[ \text {355 mL solution}(\frac{\text{70 mL isopropyl alcohol}}{\text{100 mL solution}})(\frac{\text{0.785 g isopropyl alcohol}}{\text{1 mL isopropyl alcohol}})=\text{195 g isopropyl alcohol} \nonumber \]
El vino es aproximadamente 12% de etanol (\(\ce{CH_3CH_2OH}\)) por volumen. El etanol tiene una masa molar de 46.06 g/mol y una densidad de 0.789 g/mL. ¿Cuántos moles de etanol están presentes en una botella de vino de 750 ml?
- Responder
-
1.5 mol de etanol
Porcentaje de volumen masivo
Las unidades porcentuales “mixtas”, derivadas de la masa de soluto y el volumen de solución, son populares para ciertas aplicaciones bioquímicas y médicas. Un porcentaje masa-volumen es una relación entre la masa de un soluto y el volumen de la solución expresada como porcentaje. Las unidades específicas utilizadas para la masa de soluto y el volumen de solución pueden variar, dependiendo de la solución. Por ejemplo, la solución salina fisiológica, utilizada para preparar fluidos intravenosos, tiene una concentración de 0.9% masa/volumen (m/v), lo que indica que la composición es de 0.9 g de soluto por 100 mL de solución. La concentración de glucosa en sangre (comúnmente conocida como “azúcar en la sangre”) también se expresa típicamente en términos de una relación masa-volumen. Aunque no se expresa explícitamente como porcentaje, su concentración suele darse en miligramos de glucosa por decilitro (100 mL) de sangre (Figura\(\PageIndex{2}\)).

Partes por millón y partes por mil millones
Las concentraciones muy bajas de soluto a menudo se expresan usando unidades apropiadamente pequeñas como partes por millón (ppm) o partes por mil millones (ppb). Al igual que las unidades porcentuales (“parte por cien”), ppm y ppb pueden definirse en términos de masas, volúmenes o unidades mezcladas de masa-volumen. También hay unidades ppm y ppb definidas con respecto a números de átomos y moléculas.
Las definiciones basadas en masa de ppm y ppb se dan aquí:
\[\text{ppm}=\dfrac{\text{mass solute}}{\text{mass solution}} \times 10^6\; \text{ppm} \label{3.5.3A} \]
\[\text{ppb}=\dfrac{\text{mass solute}}{\text{mass solution}} \times 10^9\; \text{ppb} \label{3.5.3B} \]
Tanto ppm como ppb son unidades convenientes para informar las concentraciones de contaminantes y otros contaminantes traza en el agua. Las concentraciones de estos contaminantes suelen ser muy bajas en aguas tratadas y naturales, y sus niveles no pueden superar los umbrales de concentración relativamente bajos sin causar efectos adversos en la salud y la vida silvestre. Por ejemplo, la EPA ha identificado que el nivel máximo seguro de iones fluoruro en el agua del grifo es de 4 ppm. Los filtros de agua en línea están diseñados para reducir la concentración de fluoruro y varios otros contaminantes a nivel de trazas en el agua del grifo (Figura\(\PageIndex{3}\)).

Según la EPA, cuando la concentración de plomo en el agua del grifo alcanza las 15 ppb, se deben tomar ciertas acciones correctivas. ¿Cuál es esta concentración en ppm? A esta concentración, ¿qué masa de plomo (μg) estaría contenida en un vaso típico de agua (300 mL)?
Solución
Las definiciones de las unidades ppm y ppb se pueden usar para convertir la concentración dada de ppb a ppm. Al comparar estas dos definiciones de unidades, se muestra que ppm es 1000 veces mayor que ppb (1 ppm = 10 3 ppb). Así:
\[ \mathrm{15\; \cancel{ppb} \times \dfrac{1\; ppm}{10^3\;\cancel{ppb}} =0.015\; ppm} \nonumber \]
La definición de la unidad ppb podrá utilizarse para calcular la masa solicitada si se proporciona la masa de la solución. Sin embargo, solo se da el volumen de solución (300 mL), por lo que debemos usar la densidad para derivar la masa correspondiente. Podemos suponer que la densidad del agua del grifo es aproximadamente la misma que la del agua pura (~1.00 g/mL), ya que las concentraciones de cualquier sustancia disuelta no deben ser muy grandes. Reorganizar la ecuación que define la unidad ppb y sustituyendo las cantidades dadas rinde:
\[\text{ppb}=\dfrac{\text{mass solute}}{\text{mass solution}} ×10^9\; \text{ppb} \nonumber \]
\[\text{mass solute} = \dfrac{\text{ppb} \times \text{mass solution}}{10^9\;\text{ppb}} \nonumber \]
\[\text{mass solute}=\mathrm{\dfrac{15\:ppb×300\:mL×\dfrac{1.00\:g}{mL}}{10^9\:ppb}=4.5 \times 10^{-6}\;g} \nonumber \]
Por último, convertir esta masa a la unidad de microgramos solicitada:
\[\mathrm{4.5 \times 10^{−6}\;g \times \dfrac{1\; \mu g}{10^{−6}\;g} =4.5\; \mu g} \nonumber \]
Se determinó que una muestra de 50.0-g de aguas residuales industriales contenía 0.48 mg de mercurio. Expresar la concentración de mercurio de las aguas residuales en unidades ppm y ppb.
- Responder
-
9.6 ppm, 9600 ppb
Resumen
Además de la molaridad, se utilizan otras unidades de concentración de solución en diversas aplicaciones. Las concentraciones porcentuales basadas en las masas, volúmenes o ambos componentes de la solución son útiles para expresar concentraciones relativamente altas, mientras que las concentraciones más bajas se expresan convenientemente usando unidades ppm o ppb. Estas unidades son populares en campos ambientales, médicos y otros, donde las unidades basadas en moles como la molaridad no son tan comúnmente utilizadas.
Glosario
- porcentaje de masa
- relación de masa soluto-solución expresada como porcentaje
- porcentaje de volumen masivo
- relación de masa de soluto a volumen de solución, expresada como porcentaje
- partes por mil millones (ppb)
- relación de soluto a masa de solución multiplicada por 10 9
- partes por millón (ppm)
- relación de soluto a masa de solución multiplicada por 10 6
- porcentaje de volumen
- relación de soluto a volumen de solución expresada como porcentaje


