13.4: Cálculos de equilibrio
- Page ID
- 75766
- Escribir ecuaciones que representen cambios en la concentración y presión para especies químicas en sistemas de equilibrio
- Usar álgebra para realizar varios tipos de cálculos de equilibrio
Sabemos que en equilibrio, el valor del cociente de reacción de cualquier reacción es igual a su constante de equilibrio. Así, podemos usar la expresión matemática para Q para determinar un número de cantidades asociadas con una reacción en equilibrio o aproximándose al equilibrio. Si bien hemos aprendido a identificar en qué dirección cambiará una reacción para alcanzar el equilibrio, queremos extender esa comprensión a los cálculos cuantitativos. Lo hacemos evaluando las formas en que las concentraciones de productos y reactivos cambian a medida que una reacción se acerca al equilibrio, teniendo en cuenta las relaciones estequiométricas de la reacción. Este enfoque algebraico para los cálculos de equilibrio se explorará en esta sección.
Los cambios en las concentraciones o presiones de los reactivos y productos ocurren a medida que un sistema de reacción se acerca al equilibrio. En esta sección veremos que podemos relacionar estos cambios entre sí utilizando los coeficientes de la ecuación química balanceada que describe el sistema. Utilizamos como ejemplo la descomposición del amoníaco.
Al calentar, el amoníaco se descompone reversiblemente en nitrógeno e hidrógeno de acuerdo con esta ecuación:
\[\ce{2NH3}(g)⇌\ce{N2}(g)+\ce{3H2}(g) \nonumber \]
Si una muestra de amoníaco se descompone en un sistema cerrado y la concentración de N 2 aumenta 0.11 M, el cambio en la concentración de N 2, Δ [N 2], la concentración final menos la concentración inicial, es 0.11 M. El cambio es positivo porque la concentración de N 2 aumenta.
El cambio en la concentración de H 2, Δ [H 2], también es positivo, la concentración de H 2 aumenta a medida que el amoníaco se descompone. La ecuación química nos dice que el cambio en la concentración de H 2 es tres veces el cambio en la concentración de N 2 debido a que por cada mol de N 2 producido, se producen 3 moles de H 2.
\[ \begin{align*} \ce{Δ[H2]} &=3×\ce{Δ[N2]} \\[4pt] &=3×(0.11\:M) \\[4pt] &=0.33\:M \end{align*} \nonumber \]
El cambio en la concentración de NH 3, Δ [NH 3], es el doble que el de Δ [N 2]; la ecuación indica que 2 moles de NH 3 deben descomponerse por cada mol de N 2 formado. Sin embargo, el cambio en la concentración de NH 3 es negativo porque la concentración de amoníaco disminuye a medida que se descompone.
\[ \begin{align*} Δ[\ce{NH3}] &=−2×Δ[\ce{N2}] \\[4pt] &=−2×(0.11\:M) \\[4pt] &=−0.22\:M \end{align*} \nonumber \]
Podemos relacionar estas relaciones directamente con los coeficientes de la ecuación
\ [\ begin {align}
&\ phantom {Δ [NH3}\ ce {2NH3} (g)
&&&&\ phantom {Δ [N2}\ ce {N2} (g)
&&+
&&\ phantom {Δ [H2]}\ ce {3H2} (g)\\
&Δ [\ ce {NH3}] =−2×Δ [\ ce {N2}] && && Δ [\ ce {N2}] =0.11\ :M && amp; && Δ [\ ce {H2}] =3×Δ [\ ce {N2}]
\ end {align}\ nonumber\]
Tenga en cuenta que todos los cambios en un lado de las flechas son del mismo signo y que todos los cambios en el otro lado de las flechas son del signo opuesto.
Si no conociéramos la magnitud del cambio en la concentración de N 2, podríamos representarlo por el símbolo x.
Los cambios en las otras concentraciones se representarían entonces como:
\(Δ[\ce{H2}]=3×Δ[\ce{N2}]=3x\)
Los coeficientes en los términos Δ son idénticos a los de la ecuación equilibrada para la reacción.
\ (\ begin {alignat} {3}
&\ ce {2NH3} (g)\ :&&\ ce {N2} (g) +\ :&&\ ce {3H2} (g)\\
&−2x &&x &&3x
\ end {alignat}\)
La forma más sencilla de encontrar los coeficientes para los cambios de concentración en cualquier reacción es usar los coeficientes en la ecuación química equilibrada. El signo del coeficiente es positivo cuando la concentración aumenta; es negativo cuando la concentración disminuye.
Completar los cambios en las concentraciones para cada una de las siguientes reacciones.
(a)\ (\ begin {alignat} {3}
&\ ce {C2H2} (g) +\ :&&\ ce {2Br2} (g)\ :&&\ ce {C2H2Br4} (g)\\
&x &&\ subrayado {\ hspace {40px}} &&\ subrayado {\ hspace {40px}}
\ end {alignat}\)
(b)\ (\ begin {alignat} {3}
&\ ce {I2} (aq) +\ :&&\ ce {I-} (aq)\ :&&\ ce {I3-} (aq)\\
&\ subrayado {\ hspace {40px}} &&\ subrayado {\ hspace {40px}} &&x
\ end {alignat}\)
(c)\ (\ begin {alignat} {3}
&\ ce {C3H8} (g) +\ :&&\ ce {5O2} (g)\ :&&\ ce {3CO2} (g) +\ :&&\ ce {4H2O} (g)\\
&x &&\ subrayado {\ hspace {40px}} &&\ subrayado {\ hspace {40px}} &&\ subrayado {\ hspace {40px}}
\ end {alignat}\)
S olución
(a)\ (\ begin {alignat} {3}
&\ ce {C2H2} (g) +\ :&&\ ce {2Br2} (g)\ :&&\ ce {C2H2Br4} (g)\\
&x &&2x &&-x
\ end {alignat}\)
(b)\ (\ begin {alignat} {3}
&\ ce {I2} (aq) +\ :&&\ ce {I-} (aq)\ :&&\ ce {I3-} (aq)\\
&-x &-x &&&x
\ end {alignat}\)
(c)\ (\ begin {alignat} {3}
&\ ce {C3H8} (g) +\ :&&\ ce {5O2} (g)\ :&&\ ce {3CO2} (g) +\ :&&\ ce {4H2O} (g)\\
&x &&5x &&-3x &&-4x
\ end {alignat}\)
Completar los cambios en las concentraciones para cada una de las siguientes reacciones:
(a)\ (\ begin {alignat} {3}
&\ ce {2SO2} (g) +\ :&&\ ce {O2} (g)\ :&&\ ce {2SO3} (g)\\
&\ subrayado {\ hspace {40px}} &&x &&\ subrayado {\ hspace {40px}}
\ end {alignat}\)
(b)\ (\ begin {alignat} {3}
&\ ce {C4H8} (g)\ :&&\ ce {2C2H4} (g)\\
&\ subrayado {\ hspace {40px}} &&-2x
\ end {alignat}\)
(c)\ (\ begin {alignat} {3}
&\ ce {4NH3} (g) +\ :&&\ ce {7H2O} (g)\ :&&\ ce {4NO2} (g) +\ :&&\ ce {6H2O} (g)\\
&\ subrayado {\ hspace {40px}} &&\ subrayado {\ hspace {40px} px}} &&\ subrayado {\ hspace {40px}} &&\ subrayado {\ hspace {40px}}
\ end { alignat}\)
- Responder a
-
2 x, x, −2 x
- Respuesta b
-
x, −2 x
- Respuesta c
-
4 x, 7 x, −4 x, −6 x o −4 x, −7 x, 4 x, 6 x
Cálculos que implican concentraciones de equilibrio
Debido a que el valor del cociente de reacción de cualquier reacción en equilibrio es igual a su constante de equilibrio, podemos usar la expresión matemática para Q c (es decir, la ley de acción de masa) para determinar un número de cantidades asociadas a una reacción en equilibrio. Puede ayudar si tenemos en cuenta que Q c = K c (en equilibrio) en todas estas situaciones y que solo hay tres tipos básicos de cálculos:
- Cálculo de una constante de equilibrio. Si se conocen concentraciones de reactivos y productos en equilibrio, se puede calcular el valor de la constante de equilibrio para la reacción.
- Cálculo de las concentraciones de equilibrio faltantes. Si se conoce el valor de la constante de equilibrio y todas las concentraciones de equilibrio, excepto una, se puede calcular la concentración restante.
- Cálculo de concentraciones de equilibrio a partir de concentraciones iniciales. Si se conoce el valor de la constante de equilibrio y un conjunto de concentraciones de reactivos y productos que no están en equilibrio, se pueden calcular las concentraciones en equilibrio.
Se podría generar una lista similar usando Q P, K P y presión parcial. Veremos resolver cada uno de estos casos en secuencia.
Cálculo de una Constante de Equilibrio
Dado que la ley de acción de masas es la única ecuación que tenemos para describir la relación entre K c y las concentraciones de reactivos y productos, cualquier problema que nos requiera resolver para K c debe proporcionar suficiente información para determinar el reactivo y concentraciones de producto en equilibrio. Armados con las concentraciones, podemos resolver la ecuación para K c, ya que será la única desconocida.
Ejemplo nos\(\PageIndex{1}\) mostró cómo determinar la constante de equilibrio de una reacción si conocemos las concentraciones de reactivos y productos en equilibrio. El siguiente ejemplo muestra cómo utilizar la estequiometría de la reacción y una combinación de concentraciones iniciales y concentraciones de equilibrio para determinar una constante de equilibrio. Esta técnica, comúnmente llamada mesa ICE —para I nitial, C hange y E quilibrium—será útil para resolver muchos problemas de equilibrio. Se genera un gráfico a partir de la reacción de equilibrio en cuestión. Debajo de la reacción se listan las concentraciones iniciales de los reactivos y productos, estas condiciones generalmente se proporcionan en el problema y consideramos que no ha ocurrido ningún cambio hacia el equilibrio. La siguiente fila de datos es el cambio que se produce a medida que el sistema se desplaza hacia el equilibrio, no olvide considerar la estequiometría de la reacción como se describe en una sección anterior de este capítulo. La última fila contiene las concentraciones una vez alcanzado el equilibrio.
Las moléculas de yodo reaccionan reversiblemente con los iones yoduro para producir iones triyoduro.
\[\ce{I2}(aq)+\ce{I-}(aq)⇌\ce{I3-}(aq) \nonumber \]
Si una solución con las concentraciones de I 2 y I − ambas iguales a 1.000 × 10 −3 M antes de la reacción da una concentración de equilibrio de I2 de 6.61 × 10 −4 M, ¿cuál es la constante de equilibrio para la reacción?
Solución
Comenzaremos este problema calculando los cambios en la concentración a medida que el sistema vaya al equilibrio. Luego determinamos las concentraciones de equilibrio y, finalmente, la constante de equilibrio. Primero, configuramos una tabla con las concentraciones iniciales, los cambios en las concentraciones y las concentraciones de equilibrio usando − x como cambio en la concentración de I 2.
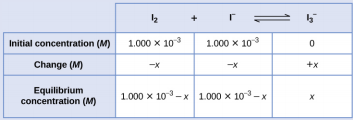
Ya que se da la concentración de equilibrio de I 2, podemos resolver para x. En equilibrio la concentración de I 2 es 6.61 × 10 −4 M para que
\(1.000×10^{−3}−x=6.61×10^{−4}\)
\(x=1.000×10^{−3}−6.61×10^{−4}\)
\(=3.39×10^{−4}\:M\)
Ahora podemos rellenar la tabla con las concentraciones en equilibrio.

Ahora calculamos el valor de la constante de equilibrio.
\(K_c=Q_c=\ce{\dfrac{[I3- ]}{[I2][I- ]}}\)
\(=\dfrac{3.39×10^{−4}\:M}{(6.61×10^{−4}\:M)(6.61×10^{−4}\:M)}=776\)
El etanol y el ácido acético reaccionan y forman agua y acetato de etilo, el disolvente responsable del olor de algunos quitaesmaltes.
\(\ce{C2H5OH + CH3CO2H ⇌ CH3CO2C2H5 + H2O}\)
Cuando se deja reaccionar 1 mol cada uno de C 2 H 5 OH y CH 3 CO 2 H en 1 L del solvente dioxano, se establece el equilibrio cuando queda\(\dfrac{1}{3}\) mol de cada uno de los reactivos. Calcular la constante de equilibrio para la reacción. (Nota: El agua no es un solvente en esta reacción.)
- Responder
-
K c = 4
Cálculo de una concentración de equilibrio faltante
Si conocemos la constante de equilibrio para una reacción y conocemos las concentraciones en equilibrio de todos los reactivos y productos excepto uno, podemos calcular la concentración faltante.
Los óxidos de nitrógeno son contaminantes del aire producidos por la reacción del nitrógeno y el oxígeno a altas temperaturas. A 2000 °C, el valor de la constante de equilibrio para la reacción,\(\ce{N2}(g)+\ce{O2}(g)⇌\ce{2NO}(g)\), es 4.1 × 10 −4. Encuentra la concentración de NO (g) en una mezcla de equilibrio con aire a 1 atm de presión a esta temperatura. En el aire, [N 2] = 0.036 mol/L y [O 2] 0.0089 mol/L.
Solución
Se nos dan todas las concentraciones de equilibrio excepto la del NO. Así, podemos resolver la concentración de equilibrio faltante reordenando la ecuación para la constante de equilibrio.
\(K_c=Q_c=\ce{\dfrac{[NO]^2}{[N2][O2]}}\)
\(\ce{[NO]^2}=K_c\ce{[N2][O2]}\)
\(\ce{[NO]}=\sqrt{K_c\ce{[N2][O2]}}\)
\(=\sqrt{(4.1×10^{−4})(0.036)(0.0089)}\)
\(=\sqrt{1.31×10^{−7}}\)
\(=3.6×10^{−4}\)
Así [NO] es 3.6 × 10 −4 mol/L en equilibrio bajo estas condiciones.
Podemos verificar nuestra respuesta sustituyendo todas las concentraciones de equilibrio en la expresión por el cociente de reacción para ver si es igual a la constante de equilibrio.
\[ \begin{align*} Q_c=\ce{\dfrac{[NO]^2}{[N2][O2]}} \\[4pt] &=\dfrac{(3.6×10^{−4})^2}{(0.036)(0.0089)} \\[4pt] &=4.0×10^{−4}=K_c \end{align*} \nonumber \]
La respuesta verifica; nuestro valor calculado da la constante de equilibrio dentro del error asociado a las cifras significativas en el problema.
La constante de equilibrio para la reacción de nitrógeno e hidrógeno para producir amoníaco a cierta temperatura es de 6.00 × 10 −2. Calcular la concentración de equilibrio de amoníaco si las concentraciones de equilibrio de nitrógeno e hidrógeno son 4.26 M y 2.09 M, respectivamente.
- Responder
-
1.53 mol/L
Cálculo de Cambios en la Concentración
Si conocemos la constante de equilibrio para una reacción y un conjunto de concentraciones de reactivos y productos que no están en equilibrio, podemos calcular los cambios en las concentraciones a medida que el sistema llega al equilibrio, así como las nuevas concentraciones en equilibrio. El procedimiento típico se puede resumir en cuatro pasos.
- Determinar la dirección en la que procede la reacción para llegar al equilibrio.
- Escribe una ecuación química equilibrada para la reacción.
- Si la dirección en la que debe proceder la reacción para alcanzar el equilibrio no es obvia, calcular Q c a partir de las concentraciones iniciales y comparar con K c para determinar la dirección del cambio.
- Determinar los cambios relativos necesarios para alcanzar el equilibrio, luego escribir las concentraciones de equilibrio en términos de estos cambios.
- Definir los cambios en las concentraciones iniciales que son necesarios para que la reacción alcance el equilibrio. Generalmente, representamos el cambio más pequeño con el símbolo x y expresamos los otros cambios en términos del cambio más pequeño.
- Definir las concentraciones de equilibrio faltantes en términos de las concentraciones iniciales y los cambios en la concentración determinados en (a).
- Resolver para el cambio y las concentraciones de equilibrio.
- Sustituir las concentraciones de equilibrio en la expresión para la constante de equilibrio, resolver para x, y verificar cualquier suposición utilizada para encontrar x.
- Calcular las concentraciones de equilibrio.
- Verifique la aritmética.
- Verificar las concentraciones de equilibrio calculadas sustituyéndolas en la expresión de equilibrio y determinando si dan la constante de equilibrio.
A veces, un paso en particular puede diferir de un problema a otro, puede ser más complejo en algunos problemas y menos complejo en otros. Sin embargo, cada cálculo de concentraciones de equilibrio a partir de un conjunto de concentraciones iniciales implicará estos pasos.
Al resolver problemas de equilibrio que implican cambios en la concentración, a veces es conveniente configurar una tabla ICE, como se describe en el apartado anterior.
Bajo ciertas condiciones, la constante de equilibrio para la descomposición de PCl 5 (g) en PCl 3 (g) y Cl 2 (g) es 0.0211. ¿Cuáles son las concentraciones de equilibrio de PCl 5, PCl 3 y Cl 2 si la concentración inicial de PCl 5 fue de 1.00 M?
Solución
Utilice el proceso paso a paso descrito anteriormente.
- La ecuación equilibrada para la descomposición de PCl 5 es
\(\ce{PCl5}(g)⇌\ce{PCl3}(g)+\ce{Cl2}(g)\)
Debido a que no tenemos productos inicialmente, Q c = 0 y la reacción procederá a la derecha.
- Representemos el incremento en la concentración de PCl 3 por el símbolo x. Los otros cambios pueden escribirse en términos de x considerando los coeficientes en la ecuación química.
\ (\ begin {alignat} {3}
&\ ce {PCL5} (g)\ :&&\ ce {PCL3} (g) +\ :&&\ ce {Cl2} (g)\\
&-x &&x &x
\ end {alignat}\) -
Los cambios en la concentración y las expresiones para las concentraciones de equilibrio son:

Esta tabla tiene dos columnas principales y cuatro filas. La primera fila para la primera columna no tiene encabezamiento y luego tiene lo siguiente en la primera columna: Concentración inicial (M), Cambio (M), Concentración en equilibrio (M). La segunda columna tiene el encabezado, “P C l subíndice 5 flecha de equilibrio P C l subíndice 3 más C l subíndice 2”. Debajo de la segunda columna hay un subgrupo de tres filas y tres columnas. La primera columna tiene lo siguiente: 1.00, x negativo, 1.00 menos x. La segunda columna tiene lo siguiente: 0, x positivo, 0 más x es igual a x. La tercera columna tiene lo siguiente: 0, x positivo, 0 más x es igual a x. - Sustituir las concentraciones de equilibrio en la ecuación de constante de equilibrio da
\(K_c=\ce{\dfrac{[PCl3][Cl2]}{[PCl5]}}=0.0211\)\(=\dfrac{(x)(x)}{(1.00−x)}\)
Esta ecuación contiene sólo una variable, x, el cambio en la concentración. Podemos escribir la ecuación como una ecuación cuadrática y resolver para x usando la fórmula cuadrática.
\(0.0211=\dfrac{(x)(x)}{(1.00−x)}\)\(0.0211(1.00−x)=x^2\)\(x^2+0.0211x−0.0211=0\)Una ecuación de la forma ax 2 + bx + c = 0 se puede reorganizar para resolver para x:
\(x=\dfrac{−b±\sqrt{b^2−4ac}}{2a}\)En este caso, a = 1, b = 0.0211, y c = −0.0211. Sustituyendo los valores apropiados por a, b y c rinde:
\(x=\dfrac{−0.0211±\sqrt{(0.0211)^2−4(1)(−0.0211)}}{2(1)}\)\(=\dfrac{−0.0211±\sqrt{(4.45×10^{−4})+(8.44×10^{−2})}}{2}\)\(=\dfrac{−0.0211±0.291}{2}\)De ahí
\(x=\dfrac{−0.0211+0.291}{2}=0.135\)o
\(x=\dfrac{−0.0211−0.291}{2}=−0.156\)Las ecuaciones cuadráticas suelen tener dos soluciones diferentes, una que es físicamente posible y otra que es físicamente imposible (una raíz extraña). En este caso, la segunda solución (−0.156) es físicamente imposible porque sabemos que el cambio debe ser un número positivo (de lo contrario terminaríamos con valores negativos para las concentraciones de los productos). Así, x = 0.135 M.
Las concentraciones de equilibrio son
\(\ce{[PCl5]}=1.00−0.135=0.87\:M\)
\(\ce{[PCl3]}=x=0.135\:M\)
\(\ce{[Cl2]}=x=0.135\:M\) - Sustitución en la expresión para K c (para verificar el cálculo) da
\(K_c=\ce{\dfrac{[PCl3][Cl2]}{[PCl5]}}=\dfrac{(0.135)(0.135)}{0.87}=0.021\)
La constante de equilibrio calculada a partir de las concentraciones de equilibrio es igual al valor de K c dado en el problema (cuando se redondea al número apropiado de cifras significativas). Así, las concentraciones de equilibrio calculadas verifican.
El ácido acético, CH 3 CO 2 H, reacciona con etanol, C 2 H 5 OH, para formar agua y acetato de etilo, CH 3 CO 2 C 2 H 5.
\[\ce{CH3CO2H + C2H5OH ⇌ CH3CO2C2H5 + H2O} \nonumber \]
La constante de equilibrio para esta reacción con dioxano como disolvente es 4.0. Cuáles son las concentraciones de equilibrio cuando una mezcla que es 0.15 M en CH 3 CO 2 H, 0.15 M en C 2 H 5 OH, 0.40 M en CH 3 CO 2 C 2 H 5, y 0.40 M en H 2 O se mezclan en suficiente dioxano para hacer 1.0 L de solución?
- Responder
-
[CH 3 CO 2 H] = 0.36 M, [C 2 H 5 OH] = 0.36 M, [CH 3 CO 2 C 2 H 5] = 0.17 M, [H 2 O] = 0.17 M
Se llena un matraz de 1.00-L con 1.00 moles de H 2 y 2.00 moles de I 2. El valor de la constante de equilibrio para la reacción de hidrógeno y yodo que reaccionan para formar yoduro de hidrógeno es de 50.5 bajo las condiciones dadas. ¿Cuáles son las concentraciones de equilibrio de H 2, I 2 e HI en moles/L?
\[\ce{H2}(g)+\ce{I2}(g)\rightleftharpoons\ce{2HI}(g) \nonumber \]
- Responder
-
[H 2] = 0.06 M, [I 2] = 1.06 M, [HI] = 1.88 M
A veces es posible utilizar el insight químico para encontrar soluciones a problemas de equilibrio sin resolver realmente una ecuación cuadrática (o más complicada). En primer lugar, sin embargo, es útil verificar que el equilibrio se puede obtener a partir de dos extremos: todos (o principalmente) reactivos y todos (o mayormente) productos.
Considera la ionización de 0.150 M HA, un ácido débil.
La forma más obvia de determinar las concentraciones de equilibrio sería comenzar con solo reactivos. Esto podría llamarse el punto de partida de “todos los reactivos”. Usando x para la cantidad de ácido ionizado en equilibrio, esta es la tabla ICE y la solución.

Configurar y resolver la ecuación cuadrática da
Usando la raíz positiva (física), las concentraciones de equilibrio son
Una forma menos obvia de resolver el problema sería asumir que todo el HA se ioniza primero, luego el sistema llega al equilibrio. Esto podría llamarse el punto de partida de “todo el producto”. Suponiendo que todo el HA ioniza da
Usando estas como concentraciones iniciales e “y” para representar la concentración de HA en equilibrio, esta es la tabla ICE para este punto de partida.
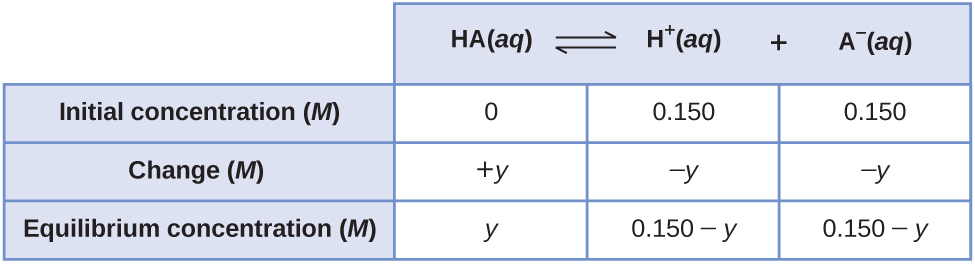
Configurar y resolver la ecuación cuadrática da
Conserve algunas cifras extra significativas para minimizar los problemas de redondeo.
Redondear cada solución a tres cifras significativas da
El uso de la raíz físicamente significativa (0.140 M) da las concentraciones de equilibrio como
Así, los dos enfoques dan los mismos resultados (a tres decimales), y muestran que ambos puntos de partida conducen a las mismas condiciones de equilibrio. El punto de inicio de “todos los reactivos” resultó en un cambio relativamente pequeño (x) debido a que el sistema estaba cerca del equilibrio, mientras que el punto de inicio de “todo el producto” tuvo un cambio relativamente grande (y) que fue casi el tamaño de las concentraciones iniciales. Se puede decir que un sistema que inicia “cerca” del equilibrio requerirá sólo un cambio “pequeño” en las condiciones (x) para alcanzar el equilibrio.
Recordemos que un pequeño Kc significa que muy poco de los reactivos forman productos y un K c grande significa que la mayoría de los reactivos forman productos. Si el sistema se puede organizar para que comience “cerca” del equilibrio, entonces si el cambio (x) es pequeño en comparación con cualquier concentración inicial, se puede descuidar. Pequeño generalmente se define como el resultado de un error de menos de 5%. Los siguientes dos ejemplos lo demuestran.
¿Cuáles son las concentraciones en equilibrio de una solución 0.15 M de HCN?
\[\ce{HCN}(aq)⇌\ce{H+}(aq)+\ce{CN-}(aq) \hspace{20px} K_c=4.9×10^{−10} \nonumber \]
Solución n
El uso de “x” para representar la concentración de cada producto en equilibrio da esta tabla ICE.
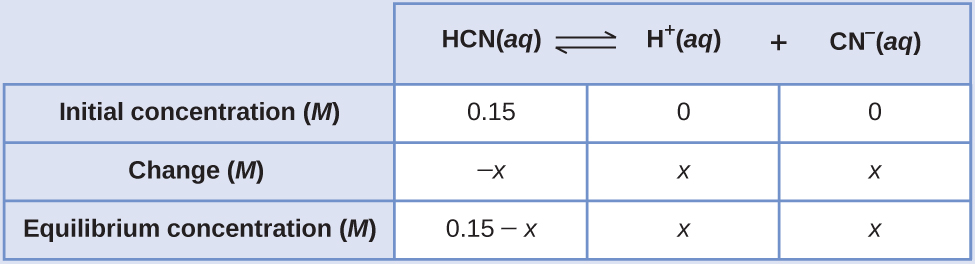
La solución exacta se puede obtener usando la fórmula cuadrática con
\[K_c=\dfrac{(x)(x)}{0.15−x} \nonumber \]
resolviendo
\[x^2+4.9×10^{−10}−7.35×10^{−11}=0 \nonumber \]
\[x=8.56×10^{−6}\:M\textrm{ (3 sig. figs.)}=8.6×10^{−6}\:M\textrm{ (2 sig. figs.)} \nonumber \]
Así [H +] = [CN —] = x = 8.6 × 10 —6 M y [HCN] = 0.15 — x = 0.15 M.
En este caso, la intuición química puede proporcionar una solución más simple. A partir de la constante de equilibrio y las condiciones iniciales, x debe ser pequeña comparada con 0.15 M. Más formalmente, si\(x≪0.15\), entonces 0.15 — x ≈ 0.15. Si esta suposición es cierta, entonces simplifica la obtención de x
\[K_c=\dfrac{(x)(x)}{0.15−x}≈\dfrac{x^2}{0.15} \nonumber \]
\[4.9×10^{−10}=\dfrac{x^2}{0.15} \nonumber \]
\[x^2=(0.15)(4.9×10^{−10})=7.4×10^{−11} \nonumber \]
\[x=\sqrt{7.4×10^{−11}}=8.6×10^{−6}\:M \nonumber \]
En este ejemplo, la resolución de la ecuación exacta (cuadrática) y el uso de aproximaciones dio el mismo resultado a dos cifras significativas. Si bien la mayoría de las veces la aproximación es un poco diferente de la solución exacta, siempre y cuando el error sea menor al 5%, la solución aproximada se considera válida. En este problema, el 5% aplica a IF (0.15 — x) ≈ 0.15 M, así que si
\[\dfrac{x}{0.15}×100\%=\dfrac{8.6×10^{−6}}{0.15}×100\%=0.006\% \nonumber \]
es menor al 5%, como lo es en este caso, el supuesto es válido. La solución aproximada es así una solución válida.
¿Cuáles son las concentraciones de equilibrio en una solución de NH 3 0.25 M?
Supongamos que x es mucho menor a 0.25 M y calcula el error en tu suposición.
- Responder
-
\(\ce{[OH- ]}=\ce{[NH4+]}=0.0021\:M\); [NH 3] = 0.25 M, error = 0.84%
El segundo ejemplo requiere que la información original se procese un poco, pero aún así se puede resolver usando una pequeña aproximación x.
Los iones de cobre (II) forman un ion complejo en presencia de amoníaco
\[\ce{Cu^2+}(aq)+\ce{4NH3}(aq)⇌\ce{Cu(NH3)4^2+}(aq) \hspace{20px} K_c=5.0×10^{13}=\ce{\dfrac{[Cu(NH3)4^2+]}{[Cu^2+(aq)][NH3]^4}} \nonumber \]
Si se agrega 0.010 mol Cu 2 + a 1.00 L de una solución que es 1.00 M NH 3 ¿cuáles son las concentraciones cuando el sistema llega al equilibrio?
Solución La concentración inicial de cobre (II) es 0.010 M. La constante de equilibrio es muy grande por lo que sería mejor comenzar con la mayor cantidad de producto posible porque “todos los productos” está mucho más cerca del equilibrio que “todos los reactivos”. Tenga en cuenta que Cu 2 + es el reactivo limitante; si todos los 0.010 M reaccionan para formar el producto, las concentraciones serían
\[\ce{[Cu^2+]}=0.010−0.010=0\:M \nonumber \]
\[\ce{[Cu(NH3)4^2+]}=0.010\:M \nonumber \]
\[\ce{[NH3]}=1.00−4×0.010=0.96\:M \nonumber \]
El uso de estos valores “desplazados” como concentraciones iniciales con x como la concentración de iones de cobre libre (II) en equilibrio da esta tabla ICE.

Como estamos empezando cerca del equilibrio, x debería ser pequeña para que
Seleccione la concentración más pequeña para la regla del 5%.
Esto es mucho menor al 5%, por lo que los supuestos son válidos. Las concentraciones en equilibrio son
Al comenzar con la cantidad máxima de producto, este sistema estuvo cerca del equilibrio y el cambio (x) fue muy pequeño. Con solo un pequeño cambio requerido para llegar al equilibrio, la ecuación para x se simplificó enormemente y dio un resultado válido muy dentro del 5% de error máximo.
¿Cuáles son las concentraciones de equilibrio cuando se agrega 0.25 mol de Ni 2 + a 1.00 L de solución de NH 3 2.00 M?
\[\ce{Ni^2+}(aq)+\ce{6NH3}(aq)⇌\ce{Ni(NH3)6^2+}(aq) \nonumber \]
con\(K_c=5.5×10^8\).Con una constante de equilibrio tan grande, primero forma la mayor cantidad de producto posible, luego asumir que solo una pequeña cantidad (x) del producto se desplaza a la izquierda. Calcula el error en tu suposición.
- Responder
-
\(\ce{[Ni(NH3)6^2+]}=0.25\:M\), [NH 3] = 0.50 M, [Ni 2 +] = 2.9 × 10 —8 M, error = 1.2 × 10 —5%
Resumen
Las relaciones de la velocidad de cambio en las concentraciones de una reacción son iguales a las relaciones de los coeficientes en la ecuación química equilibrada. El signo del coeficiente de X es positivo cuando la concentración aumenta y negativo cuando disminuye. Aprendimos a abordar tres tipos básicos de problemas de equilibrio. Cuando se dan las concentraciones de los reactivos y productos en equilibrio, podemos resolver para la constante de equilibrio; cuando se da la constante de equilibrio y algunas de las concentraciones involucradas, podemos resolver para las concentraciones faltantes; y cuando se le da la constante de equilibrio y las concentraciones iniciales, podemos resolver para las concentraciones en equilibrio.


