13.3: Equilibrios cambiantes - Principio de Le Chatelier
- Page ID
- 75739
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)- Describir las formas en que se puede recalcar un sistema de equilibrio
- Predecir la respuesta de un equilibrio estresado usando el principio de Le Chatelier
Como vimos en el apartado anterior, las reacciones proceden en ambas direcciones (los reactivos van a los productos y los productos van a los reactivos). Podemos decir que una reacción está en equilibrio si el cociente de reacción (\(Q\)) es igual a la constante de equilibrio (K). A continuación abordamos lo que sucede cuando se altera un sistema en equilibrio para que ya no\(Q\) sea igual a\(K\). Si un sistema en equilibrio se somete a una perturbación o estrés (como un cambio en la concentración) la posición del equilibrio cambia. Dado que este estrés afecta las concentraciones de los reactivos y los productos, el valor de ya no\(Q\) será igual al valor de\(K\). Para restablecer el equilibrio, el sistema se desplazará hacia los productos (if\(Q < K\)) o los reactivos (if\(Q > K\)) hasta que\(Q\) regrese al mismo valor que\(K\).
Este proceso es descrito por el principio de Le Chatelier: Cuando se altera un sistema químico en equilibrio, vuelve al equilibrio contrarrestando la perturbación. Como se describe en el párrafo anterior, la perturbación provoca un cambio en\(Q\); la reacción se desplazará para restablecerse\(Q = K\).
Predecir la dirección de una reacción reversible
El principio de Le Chatelier se puede utilizar para predecir cambios en las concentraciones de equilibrio cuando un sistema que está en equilibrio se somete a una tensión. Sin embargo, si tenemos una mezcla de reactivos y productos que aún no han alcanzado el equilibrio, los cambios necesarios para alcanzar el equilibrio pueden no ser tan obvios. En tal caso, podemos comparar los valores de Q y K para que el sistema prediga los cambios.
Un sistema químico en equilibrio se puede desplazar temporalmente fuera del equilibrio mediante la adición o eliminación de uno o más de los reactivos o productos. Las concentraciones tanto de reactivos como de productos experimentan cambios adicionales para devolver el sistema al equilibrio.
La tensión en el sistema en la Figura\(\PageIndex{1}\) es la reducción de la concentración de equilibrio de SCN − (disminuir la concentración de uno de los reactivos provocaría que Q sea mayor que K). Como consecuencia, el principio de Le Chatelier nos lleva a predecir que la concentración de Fe (SCN) 2+ debería disminuir, aumentando la concentración de SCN − en parte de su concentración original, y aumentando la concentración de Fe 3 + por encima de su inicial concentración de equilibrio.
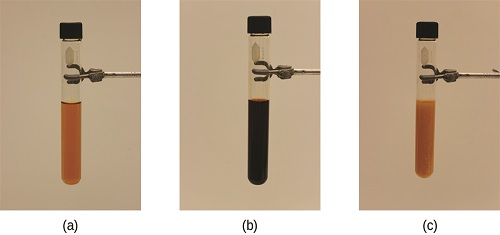
El efecto de un cambio en la concentración sobre un sistema en equilibrio se ilustra adicionalmente por el equilibrio de esta reacción química:
\[\ce{H}_{2(g)}+\ce{I}_{2(g)} \rightleftharpoons \ce{2HI}_{(g)} \label{13.4.1a} \]
\[K_c=\mathrm{50.0 \; at\; 400°C} \label{13.4.1b} \]
Los valores numéricos para este ejemplo se han determinado experimentalmente. Una mezcla de gases a 400 °C con\(\mathrm{[H_2] = [I_2]} = 0.221\; M\) y\(\ce{[HI]} = 1.563 \;M\) está en equilibrio; para esta mezcla,\(Q_c = K_c = 50.0\). Si\(\ce{H_2}\) se introduce en el sistema tan rápidamente que su concentración se duplica antes de que comience a reaccionar (nuevo\(\ce{[H_2]} = 0.442\; M\)), la reacción cambiará para que se alcance un nuevo equilibrio, en el que
- \(\ce{[H_2]} = 0.374\; M\),
- \(\ce{[I_2]} = 0.153\; M\), y
- \(\ce{[HI]} = 1.692\; M\).
Esto da:
\[Q_c=\mathrm{\dfrac{[HI]^2}{[H_2][I_2]}}=\dfrac{(1.692)^2}{(0.374)(0.153)}=50.0=K_c \label{13.4.2} \]
Hemos destacado este sistema al introducir adicionales\(\ce{H_2}\). El estrés se alivia cuando la reacción se desplaza hacia la derecha, consumiendo algo (pero no todo) del exceso\(\ce{H_2}\), reduciendo la cantidad de no combinados\(\ce{I_2}\), y formando adicionales\(\ce{HI}\).
Efecto del Cambio en la Presión sobre el Equilibrio
A veces podemos cambiar la posición de equilibrio cambiando la presión de un sistema. Sin embargo, los cambios en la presión tienen un efecto medible solo en sistemas en los que están involucrados gases, y luego solo cuando la reacción química produce un cambio en el número total de moléculas de gas en el sistema. Una manera fácil de reconocer dicho sistema es buscar diferentes números de moles de gas en los lados del reactivo y del producto del equilibrio. Al evaluar la presión (así como factores relacionados como el volumen), es importante recordar que las constantes de equilibrio se definen con respecto a la concentración (para\(K_c\)) o presión parcial (para\(K_P\)). Algunos cambios en la presión total, como agregar un gas inerte que no forma parte del equilibrio, cambiarán la presión total pero no las presiones parciales de los gases en la expresión constante de equilibrio. Así, la adición de un gas no involucrado en el equilibrio no perturbará el equilibrio.
A medida que aumentamos la presión de un sistema gaseoso en equilibrio, ya sea disminuyendo el volumen del sistema o agregando más de uno de los componentes de la mezcla de equilibrio, introducimos una tensión al aumentar las presiones parciales de uno o más de los componentes. De acuerdo con el principio de Le Chatelier, se favorecerá un cambio en el equilibrio que reduzca el número total de moléculas por unidad de volumen porque esto alivia el estrés. La reacción inversa se vería favorecida por una disminución de la presión.
Consideremos lo que sucede cuando aumentamos la presión sobre un sistema en el que\(\ce{NO}\)\(\ce{O_2}\),, y\(\ce{NO_2}\) estamos en equilibrio:
\[\ce{2NO (g) + O2(g) \rightleftharpoons 2NO2(g)} \label{13.4.3} \]
La formación de cantidades adicionales de\(\ce{NO2}\) disminuye el número total de moléculas en el sistema debido a que cada vez se consumen dos moléculas de\(\ce{NO_2}\) forma, un total de tres moléculas de\(\ce{NO}\) y\(\ce{O_2}\). Esto reduce la presión total ejercida por el sistema y reduce, pero no alivia por completo, el estrés del aumento de presión. Por otro lado, una disminución en la presión sobre el sistema favorece la descomposición de\(\ce{NO_2}\) en\(\ce{NO}\) y\(\ce{O_2}\), que tiende a restaurar la presión.
Ahora considere esta reacción:
\[\ce{N2 (g) + O2 (g) \rightleftharpoons 2NO (g)} \label{13.4.4} \]
Debido a que no hay cambio en el número total de moléculas en el sistema durante la reacción, un cambio en la presión no favorece ni la formación ni descomposición del monóxido de nitrógeno gaseoso.
Efecto del Cambio en la Temperatura sobre el Equilibrio
El cambio de concentración o presión perturba un equilibrio porque el cociente de reacción se aleja del valor de equilibrio. Cambiar la temperatura de un sistema en equilibrio tiene un efecto diferente: Un cambio en la temperatura realmente cambia el valor de la constante de equilibrio. Sin embargo, podemos predecir cualitativamente el efecto del cambio de temperatura tratándolo como una tensión en el sistema y aplicando el principio de Le Chatelier.
Cuando el hidrógeno reacciona con el yodo gaseoso, se desprende calor.
\[\ce{H2(g) + I2(g) \rightleftharpoons 2HI(g) } \;\;\ ΔH=\mathrm{−9.4\;kJ\;(exothermic)} \label{13.4.5} \]
Debido a que esta reacción es exotérmica, podemos escribirla con calor como producto.
\[\ce{H2(g) + I2(g) \rightleftharpoons 2HI(g)} + \text{heat} \label{13.4.6} \]
Al aumentar la temperatura de la reacción se incrementa la energía interna del sistema. Así, aumentar la temperatura tiene el efecto de aumentar la cantidad de uno de los productos de esta reacción. La reacción se desplaza hacia la izquierda para aliviar el estrés, y hay un aumento en la concentración de\(\ce{H2}\)\(\ce{I2}\) y una reducción en la concentración de\(\ce{HI}\). Al bajar la temperatura de este sistema se reduce la cantidad de energía presente, se favorece la producción de calor y se favorece la formación de yoduro de hidrógeno.
Cuando cambiamos la temperatura de un sistema en equilibrio, la constante de equilibrio para la reacción cambia. Bajando la temperatura en el\(\ce{HI}\) sistema aumenta la constante de equilibrio: En el nuevo equilibrio la concentración de\(\ce{HI}\) ha aumentado y las concentraciones de\(\ce{H2}\) y\(\ce{I2}\) disminuido. Al subir la temperatura se disminuye el valor de la constante de equilibrio, de 67.5 a 357 °C a 50.0 a 400 °C.
La temperatura afecta el equilibrio entre\(\ce{NO_2}\) y\(\ce{N_2O_4}\) en esta reacción
\[\ce{N2O4(g) \rightleftharpoons 2NO2(g)}\;\;\; ΔH=\mathrm{57.20\; kJ} \label{13.4.7} \]
El valor positivo ΔH nos dice que la reacción es endotérmica y podría escribirse
\[\text{heat}+\ce{N2O4(g) \rightleftharpoons 2NO2(g)} \label{13.4.8} \]
A temperaturas más altas, la mezcla gaseosa tiene un color marrón profundo, indicativo de una cantidad significativa de\(\ce{NO_2}\) moléculas marrones. Sin embargo, si ponemos una tensión en el sistema enfriando la mezcla (retirando energía), el equilibrio se desplaza hacia la izquierda para abastecer parte de la energía perdida por el enfriamiento. La concentración de incoloro\(\ce{N_2O_4}\) aumenta, y la concentración de marrón\(\ce{NO_2}\) disminuye, provocando que el color marrón se desvanezca.
Los catalizadores no afectan el equilibrio
Como aprendimos durante nuestro estudio de la cinética, un catalizador puede acelerar la velocidad de una reacción. Aunque este aumento en la velocidad de reacción puede hacer que un sistema alcance el equilibrio más rápidamente (acelerando las reacciones directa e inversa), un catalizador no tiene ningún efecto sobre el valor de una constante de equilibrio ni sobre las concentraciones de equilibrio.
La interacción de los cambios en la concentración o presión, la temperatura y la falta de influencia de un catalizador en un equilibrio químico se ilustra en la síntesis industrial de amoníaco a partir de nitrógeno e hidrógeno según la ecuación
\[\ce{N2(g) + 3H2(g) \rightleftharpoons 2NH3(g)} \label{13.4.9} \]
Por esta reacción se fabrica una gran cantidad de amoníaco. Cada año, el amoníaco se encuentra entre los 10 mejores productos químicos, en masa, fabricados en el mundo. Cada año se fabrican alrededor de 2 mil millones de libras en Estados Unidos. El amoníaco juega un papel vital en nuestra economía global. Se utiliza en la producción de fertilizantes y es, en sí mismo, un fertilizante importante para el crecimiento de maíz, algodón y otros cultivos. Grandes cantidades de amoníaco se convierten en ácido nítrico, que juega un papel importante en la producción de fertilizantes, explosivos, plásticos, tintes y fibras, y también se utiliza en la industria siderúrgica.
Haber nació en Breslau, Prusia (actualmente Wroclaw, Polonia) en diciembre de 1868. Luego pasó a estudiar química y, mientras estaba en la Universidad de Karlsruhe, desarrolló lo que más tarde se conocería como el proceso Haber: la formación catalítica de amoníaco a partir de hidrógeno y nitrógeno atmosférico bajo altas temperaturas y presiones.

Por esta obra, Haber fue galardonado con el Premio Nobel de Química de 1918 por la síntesis de amoníaco a partir de sus elementos. El proceso Haber fue una gran ayuda para la agricultura, ya que permitió que la producción de fertilizantes ya no dependiera de las existencias minadas de piensos como el nitrato de sodio.
\[\ce{N2(g) + 3H2(g) \rightleftharpoons 2NH3(g)} \nonumber \]
Actualmente, la producción anual de fertilizantes nitrogenados sintéticos supera los 100 millones de toneladas y la producción de fertilizantes sintéticos ha incrementado el número de humanos que las tierras cultivables pueden soportar de 1.9 personas por hectárea en 1908 a 4.3 en 2008. La disponibilidad de nitrógeno es un fuerte factor limitante para el crecimiento de las plantas. A pesar de representar el 78% del aire, el nitrógeno diatómico (\(\ce{N_2}\)) no está disponible nutricionalmente debido a la tremenda estabilidad del triple enlace nitrógeno-nitrógeno. Para que las plantas utilicen nitrógeno atmosférico, el nitrógeno debe convertirse a una forma más biodisponible (esta conversión se llama fijación de nitrógeno).
Además de su trabajo en la producción de amoníaco, Haber también es recordado por la historia como uno de los padres de la guerra química. Durante la Primera Guerra Mundial, jugó un papel importante en el desarrollo de gases venenosos utilizados para la guerra de trincheras. En cuanto a su papel en estos desarrollos, Haber dijo: “Durante tiempos de paz un científico pertenece al Mundo, pero durante tiempos de guerra pertenece a su país”. 1 Haber defendió el uso de la guerra de gas contra acusaciones de que era inhumana, diciendo que la muerte era muerte, por cualquier medio que se le infligiera. Se erige como ejemplo de los dilemas éticos que enfrentan los científicos en tiempos de guerra y la naturaleza de doble filo de la espada de la ciencia.
Al igual que Haber, los productos elaborados con amoníaco pueden ser multifacéticos. Además de su valor para la agricultura, los compuestos nitrogenados también pueden ser utilizados para lograr fines destructivos. El nitrato amónico también se ha utilizado en explosivos, incluyendo artefactos explosivos improvisados. El nitrato amónico fue uno de los componentes de la bomba utilizada en el ataque al Edificio Federal Alfred P. Murrah en el centro de Oklahoma City el 19 de abril de 1995.
Desde hace tiempo se sabe que el nitrógeno y el hidrógeno reaccionan para formar amoníaco. Sin embargo, se hizo posible fabricar amoníaco en cantidades útiles por la reacción de nitrógeno e hidrógeno solo a principios del siglo XX después de que se entendieran los factores que influyen en su equilibrio.
Para ser práctico, un proceso industrial debe dar un gran rendimiento de producto con relativa rapidez. Una forma de aumentar el rendimiento de amoníaco es aumentar la presión sobre el sistema en el que N 2, H 2 y NH 3 están en equilibrio o están llegando al equilibrio.
\[\ce{N2(g) + 3H2(g) \rightleftharpoons 2NH3(g)} \label{13.4.10} \]
La formación de cantidades adicionales de amoníaco reduce la presión total ejercida por el sistema y reduce en cierta medida la tensión de la presión incrementada.
Aunque aumentar la presión de una mezcla de N 2, H 2 y NH 3 aumentará el rendimiento de amoníaco, a bajas temperaturas, la tasa de formación de amoníaco es lenta. A temperatura ambiente, por ejemplo, la reacción es tan lenta que si preparáramos una mezcla de N 2 y H 2, no se formaría ninguna cantidad detectable de amoníaco durante nuestra vida. La formación de amoníaco a partir de hidrógeno y nitrógeno es un proceso exotérmico:
\[\ce{N2(g) + 3H2(g) \rightarrow 2NH3(g)} \;\;\; ΔH=\mathrm{−92.2\; kJ} \label{13.4.11} \]
Así, al aumentar la temperatura para incrementar la tasa se disminuye el rendimiento. Si bajamos la temperatura para desplazar el equilibrio para favorecer la formación de más amoníaco, el equilibrio se alcanza más lentamente debido a la gran disminución de la velocidad de reacción con la disminución de la temperatura.
Parte de la tasa de formación perdida al operar a temperaturas más bajas se puede recuperar usando un catalizador. El efecto neto del catalizador sobre la reacción es hacer que el equilibrio se alcance más rápidamente. En la producción comercial de amoníaco, se utilizan condiciones de aproximadamente 500 °C, 150—900 atm, y la presencia de un catalizador para dar el mejor compromiso entre tasa, rendimiento y costo del equipo necesario para producir y contener gases de alta presión a altas temperaturas (Figura\(\PageIndex{2}\)).
Resumen
Los sistemas en equilibrio pueden verse alterados por cambios en la temperatura, la concentración y, en algunos casos, el volumen y la presión; los cambios de volumen y presión perturbarán el equilibrio si el número de moles de gas es diferente en los lados del reactivo y del producto de la reacción. La respuesta del sistema a estas perturbaciones es descrita por el principio de Le Chatelier: El sistema responderá de una manera que contrarresta la perturbación. No todos los cambios en el sistema resultan en una alteración del equilibrio. La adición de un catalizador afecta las velocidades de las reacciones pero no altera el equilibrio, y el cambio de presión o volumen no perturbará significativamente los sistemas sin gases o con igual número de moles de gas en el lado del reactivo y del producto.
| Alteración | Cambio observado a medida que se restablece el equilibrio | Dirección de cambio | Efecto en K |
|---|---|---|---|
| reactivo añadido | el reactivo añadido se consume parcialmente | hacia los productos | ninguno |
| producto agregado | el producto agregado se consume parcialmente | hacia los reactivos | ninguno |
| disminución de volumen/aumento de la presión del gas | disminuye la presión | hacia el lado con menos moles de gas | ninguno |
| aumento de volumen/disminución de la presión del gas | aumenta la presión | hacia el lado con más moles de gas | ninguno |
| aumento de temperatura | el calor es absorbido | hacia productos para endotérmicos, hacia reactivos para exotérmicos | cambios |
| disminución de temperatura | se desprende calor | hacia reactivos para endotérmicos, hacia productos para exotérmicos | cambios |
Notas al pie
- Herrlich, P. “La responsabilidad del científico: ¿qué nos puede enseñar la historia sobre cómo los científicos deben manejar la investigación que tiene el potencial de crear daño?” Informes EMBO 14 (2013): 759—764.
Glosario
- El principio de Le Chatelier
- cuando se altera un sistema químico en equilibrio, vuelve al equilibrio contrarrestando la perturbación
- posición de equilibrio
- concentraciones o presiones parciales de los componentes de una reacción en equilibrio (comúnmente utilizados para describir condiciones antes de una perturbación)
- estrés
- cambio a las condiciones de una reacción que pueden causar un cambio en el equilibrio


