15.1: Precipitación y disolución
- Page ID
- 75691
- Escribir ecuaciones químicas y expresiones de equilibrio que representen equilibrios de solubilidad
- Realizar cálculos de equilibrio que involucren solubilidad, expresiones de equilibrio y concentraciones de soluto
La preservación de muestras de sangre de laboratorio médico, la extracción de agua de mar para obtener magnesio, la formulación de medicamentos de venta libre como Leche de Magnesia y antiácidos, y el tratamiento de la presencia de agua dura en el suministro de agua de su hogar son solo algunas de las muchas tareas que implican controlar el equilibrio entre un sólido iónico ligeramente soluble y una solución acuosa de sus iones.
En algunos casos, queremos evitar que ocurra la disolución. La caries dental, por ejemplo, ocurre cuando la hidroxilapatita cálcica, que tiene la fórmula Ca 5 (PO 4) 3 (OH), en nuestros dientes se disuelve. El proceso de disolución se ayuda cuando las bacterias en nuestra boca se deleitan con los azúcares de nuestras dietas para producir ácido láctico, que reacciona con los iones hidróxido en la hidroxilapatita de calcio. Prevenir la disolución evita la descomposición. Por otro lado, a veces queremos que una sustancia se disuelva. Queremos que el carbonato de calcio en un antiácido masticable se disuelva porque los\(\ce{CO3^2-}\) iones producidos en este proceso ayudan a calmar un malestar estomacal.
En esta sección, descubriremos cómo podemos controlar la disolución de un sólido iónico ligeramente soluble mediante la aplicación del principio de Le Chatelier. También aprenderemos a utilizar la constante de equilibrio de la reacción para determinar la concentración de iones presentes en una solución.
La constante del producto de solubilidad
El cloruro de plata es lo que se conoce como un sólido iónico escasamente soluble (Figura\(\PageIndex{1}\)). Recordemos de las reglas de solubilidad en un capítulo anterior que los haluros de Ag + normalmente no son solubles. Sin embargo, cuando añadimos un exceso de AgCl sólido al agua, se disuelve en pequeña medida y produce una mezcla que consiste en una solución muy diluida de iones Ag + y Cl — en equilibrio con cloruro de plata no disuelto:
\[\ce{AgCl}(s)\mathrm{\xrightleftharpoons[\:precipitation\:]{\:dissolution\:}}\ce{Ag+}(aq)+\ce{Cl-}(aq) \nonumber \]
Este equilibrio, al igual que otros equilibrios, es dinámico; parte del AgCl sólido continúa disolviéndose, pero al mismo tiempo, los iones Ag + y Cl — en la solución se combinan para producir una cantidad igual del sólido. En equilibrio, los procesos opuestos tienen tasas iguales.
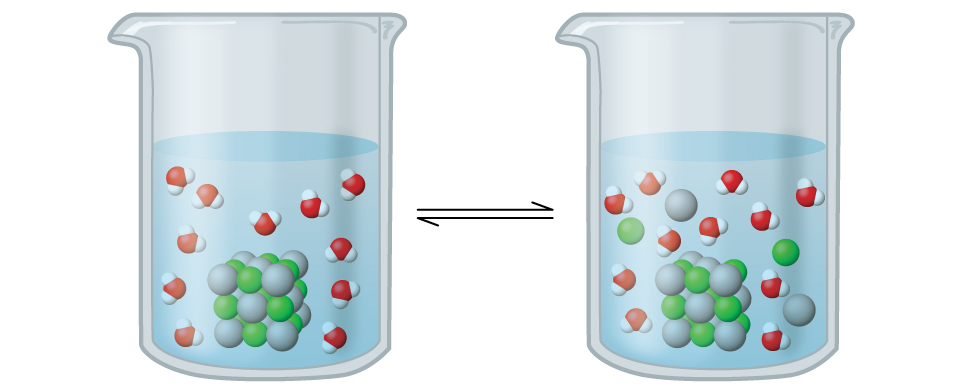
La constante de equilibrio para el equilibrio entre un sólido iónico ligeramente soluble y una solución de sus iones se denomina producto de solubilidad (K sp) del sólido. Recordemos del capítulo sobre soluciones y coloides que utilizamos la concentración de un ion como aproximación de su actividad en una solución diluida. Para cloruro de plata, en equilibrio:
\[\ce{AgCl}(s) \rightleftharpoons \ce{Ag+}(aq)+\ce{Cl-}(aq) \nonumber \]
con
\[K_\ce{sp}=[\ce{Ag+}(aq)][\ce{Cl-}(aq)] \nonumber \]
Al observar reacciones de disolución como esta, el sólido se enumera como reactivo, mientras que los iones se listan como productos. La constante del producto de solubilidad, como con cada expresión constante de equilibrio, se escribe como el producto de las concentraciones de cada uno de los iones, elevadas a la potencia de sus coeficientes estequiométricos. Aquí, la constante del producto de solubilidad es igual a Ag + y Cl, cuando una solución de cloruro de plata está en equilibrio con AgCl no disuelto. No hay denominador que represente a los reactivos en esta expresión de equilibrio ya que el reactivo es un sólido puro; por lo tanto [AgCl] no aparece en la expresión para K sp.
| Sustancia | K sp a 25 °C |
|---|---|
| CuCl | 1.2 × 10 —6 |
| CuBr | 6.27 × 10 —9 |
| AGi | 1.5 × 10 —16 |
| PbS | 7 × 10 —29 |
| Al (OH) 3 | 2 × 10 —32 |
| Fe (OH) 3 | 4 × 10 —38 |
Algunos productos de solubilidad comunes se listan en la Tabla de\(\PageIndex{1}\) acuerdo con sus valores de K sp, mientras que en la Tabla E3 aparece una compilación más extensa de productos. Cada una de estas constantes de equilibrio es mucho menor que 1 debido a que los compuestos enumerados son solo ligeramente solubles. Un pequeño K sp representa un sistema en el que el equilibrio se encuentra a la izquierda, de manera que relativamente pocos iones hidratados estarían presentes en una solución saturada.
Escriba la ecuación iónica para la disolución y la expresión del producto de solubilidad para cada uno de los siguientes compuestos iónicos ligeramente solubles:
- AgI, yoduro de plata, un sólido con propiedades antisépticas
- CaCo 3, carbonato de calcio, el ingrediente activo en muchos antiácidos masticables de venta libre
- Mg (OH) 2, hidróxido de magnesio, el ingrediente activo en la Leche de Magnesia
- Mg (NH 4) PO 4, fosfato de magnesio y amonio, sustancia esencialmente insoluble utilizada en pruebas de magnesio
- Ca 5 (PO 4) 3 OH, la apatita mineral, una fuente de fosfato para fertilizantes
(Pista: Al determinar cómo romper (d) y (e) en iones, consulte la lista de iones poliatómicos en la sección sobre nomenclatura química.)
Solución
- \(\ce{AgI}(s) \rightleftharpoons \ce{Ag+}(aq)+\ce{I-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Ag+][I- ]}\)
- \(\ce{CaCO3}(s) \rightleftharpoons \ce{Ca^2+}(aq)+\ce{CO3^2-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Ca^2+][CO3^2- ]}\)
- \(\ce{Mg(OH)2}(s) \rightleftharpoons \ce{Mg^2+}(aq)+\ce{2OH-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Mg^2+][OH- ]^2}\)
- \(\ce{Mg(NH4)PO4}(s) \rightleftharpoons \ce{Mg^2+}(aq)+\ce{NH4+}(aq)+\ce{PO4^3-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Mg^2+][NH4+][PO4^3- ]}\)
- \(\ce{Ca5(PO4)3OH}(s) \rightleftharpoons \ce{5Ca^2+}(aq)+\ce{3PO4^3-}(aq)+\ce{OH-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Ca^2+]^5[PO4^3- ]^3[OH- ]}\)
Escriba la ecuación iónica para la disolución y el producto de solubilidad para cada uno de los siguientes compuestos ligeramente solubles:
- BasO 4
- Ag 2 SO 4
- Al (OH) 3
- Pb (OH) Cl
- Contestar a
-
\(\ce{BaSO4}(s) \rightleftharpoons \ce{Ba^2+}(aq)+\ce{SO4^2-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Ba^2+][SO4^2- ]}\)
- Respuesta b
-
\(\ce{Ag2SO4}(s) \rightleftharpoons \ce{2Ag+}(aq)+\ce{SO4^2-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Ag+]^2[SO4^2- ]}\)
- Respuesta c
-
\(\ce{Al(OH)3}(s) \rightleftharpoons \ce{Al^2+}(aq)+\ce{3OH-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Al^3+][OH- ]^3}\)
- Respuesta d
-
\(\ce{Pb(OH)Cl}(s) \rightleftharpoons \ce{Pb^2+}(aq)+\ce{OH-}(aq)+\ce{Cl-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Pb^2+][OH- ][Cl- ]}\)
Ahora extenderemos la discusión de K sp y mostraremos cómo se determina la constante del producto de solubilidad a partir de la solubilidad de sus iones, así como cómo se puede usar K sp para determinar la solubilidad molar de una sustancia.
K sp y Solubilidad
Recordemos que la definición de solubilidad es la concentración máxima posible de un soluto en una solución a una temperatura y presión dadas. Podemos determinar el producto de solubilidad de un sólido ligeramente soluble a partir de esa medida de su solubilidad a una temperatura y presión dadas, siempre que la única reacción significativa que se produce cuando el sólido se disuelve sea su disociación en iones solvatados, es decir, el único equilibrio involucrado es:
\[\ce{M}_p\ce{X}_q(s) \rightleftharpoons p\mathrm{M^{m+}}(aq)+q\mathrm{X^{n−}}(aq) \nonumber \]
En este caso, calculamos la solubilidad del producto tomando la solubilidad del sólido expresada en unidades de moles por litro (mol/L), conocida como su solubilidad molar.
Comenzamos el capítulo con una discusión informal sobre cómo se forma la fluorita mineral. La fluorita, CaF 2, es un sólido ligeramente soluble que se disuelve de acuerdo con la ecuación:
\[\ce{CaF2}(s) \rightleftharpoons \ce{Ca^2+}(aq)+\ce{2F-}(aq) \nonumber \]
La concentración de Ca 2 + en una solución saturada de CaF 2 es 2.1 × 10 —4 M; por lo tanto, la de F — es 4.2 × 10 —4 M, es decir, el doble de la concentración de Ca 2 +. ¿Cuál es el producto de solubilidad de la fluorita?
Solución
Primero, escriba la expresión de K sp, luego sustituya en concentraciones y resuelva por K sp:
\[\ce{CaF2}(s) \rightleftharpoons \ce{Ca^2+}(aq)+\ce{2F-}(aq) \nonumber \]
Una solución saturada es una solución en equilibrio con el sólido. Así:
\[\begin{align*} K_\ce{sp} &=\ce{[Ca^2+][F^{-}]^2} \\[4pt] &=(2.1×10^{−4})(4.2×10^{−4})^2 \\[4pt] &=3.7×10^{−11} \end{align*} \nonumber \]
Al igual que con otras constantes de equilibrio, no incluimos unidades con K sp.
En una solución saturada que está en contacto con Mg (OH) 2 sólido, la concentración de Mg 2 + es 3.7 × 10 —5 M. ¿Cuál es el producto de solubilidad para Mg (OH) 2?
\[\ce{Mg(OH)2}(s) \rightleftharpoons \ce{Mg^2+}(aq)+\ce{2OH-}(aq) \nonumber \]
- Responder
-
2.0 × 10 —13
La K sp del bromuro de cobre (I), CuBr, es 6.3 × 10 —9. Calcular la solubilidad molar del bromuro de cobre.
Solución
La constante del producto de solubilidad del bromuro de cobre (I) es\(6.3 \times 10^{–9}\).
La reacción es:
\[\ce{CuBr}(s) \rightleftharpoons \ce{Cu+}(aq)+\ce{Br-}(aq) \nonumber \]
Primero, escriba la expresión constante de equilibrio del producto de solubilidad:
\[K_\ce{sp}=\ce{[Cu+][Br- ]} \nonumber \]
Crear una tabla ICE (como se introduce en el capítulo sobre conceptos de equilibrio fundamental), dejando vacía la columna CuBr ya que es un sólido y no contribuye a la K sp:
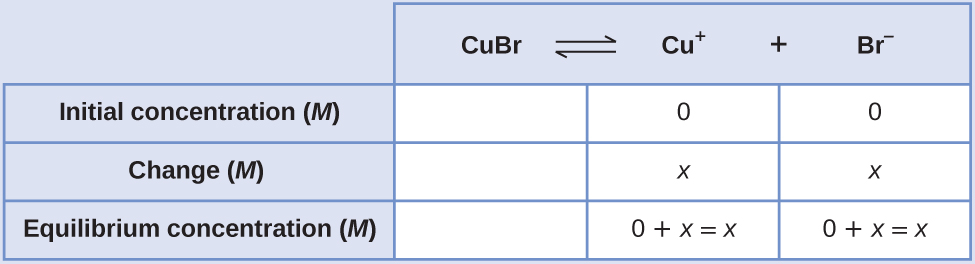
En equilibrio:
\[\begin{align*} K_{sp} &=\ce{[Cu+][Br- ]} \\[4pt] 6.3×10^{−9} &=(x)(x)=x^2 \\[4pt] x &=\sqrt{(6.3×10^{−9})}=7.9×10^{−5} \end{align*} \nonumber \]Por lo tanto, la solubilidad molar de CuBr es 7.9 × 10 —5 M.
La K sp de AGi es 1.5 × 10 —16. Calcular la solubilidad molar del yoduro de plata.
- Responder
-
1.2 × 10 —8 M
Determinación de la Solubilidad Molar de K sp, Parte II La K sp del hidróxido de calcio, Ca (OH) 2, es 8.0 × 10 —6. Calcular la solubilidad molar del hidróxido de calcio.
Solución
La constante del producto de solubilidad del hidróxido de calcio es 1.3 × 10 —6.
La reacción es:
\[\ce{Ca(OH)2}(s) \rightleftharpoons \ce{Ca^2+}(aq)+\ce{2OH-}(aq) \nonumber \]
Primero, escriba la expresión constante de equilibrio del producto de solubilidad:
\[K_\ce{sp}=\ce{[Ca^2+][OH- ]^2} \nonumber \]
Crear una tabla ICE, dejando la columna Ca (OH) 2 vacía ya que es un sólido y no contribuye a la K sp:
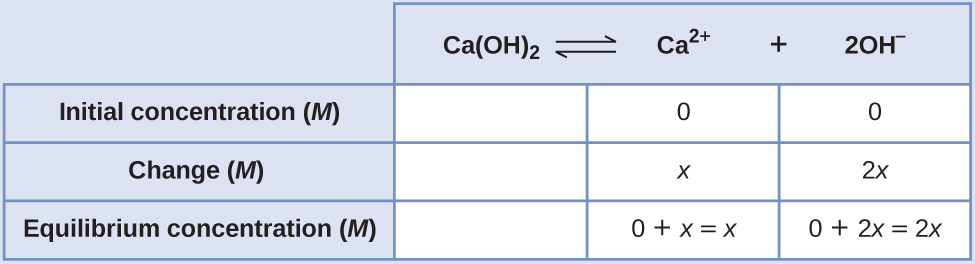
En equilibrio:
\[ \begin{align*} K_\ce{sp} &=\ce{[Ca^2+][OH- ]^2} \\[4pt] 1.3×10^{−6} &=(x)(2x)^2=(x)(4x^2)=4x^3 \\[4pt] x &=\sqrt[3]{\dfrac{1.3×10^{-6}}{4}}=6.9×10^{-3} \end{align*} \nonumber \]
Por lo tanto, la solubilidad molar de Ca (OH) 2 es 6.9 × 10 —3 M.
La K sp de pBi 2 es 1.4 × 10 —8. Calcular la solubilidad molar del yoduro de plomo (II).
- Responder
-
1.5 × 10 —3 M
Tenga en cuenta que la solubilidad no siempre se da como un valor molar. Cuando la solubilidad de un compuesto se da en alguna unidad distinta de moles por litro, debemos convertir la solubilidad en moles por litro (es decir, molaridad) para poder utilizarla en la expresión constante del producto de solubilidad. Ejemplo\(\PageIndex{5}\) muestra cómo realizar esas conversiones unitarias antes de determinar el equilibrio del producto de solubilidad.
Muchos de los pigmentos utilizados por los artistas en pinturas a base de aceite (Figura\(\PageIndex{2}\)) son escasamente solubles en agua. Por ejemplo, la solubilidad del pigmento amarillo cromo del artista, PbCRo 4, es 4.6 × 10 —6 g/L Determinar la constante de equilibrio del producto de solubilidad para PbCRo 4.

Solución
Se nos da la solubilidad de PbCRo 4 en gramos por litro. Si convertimos esta solubilidad en moles por litro, podemos encontrar las concentraciones de equilibrio de Pb 2 + y\(\ce{CrO4^2-}\), luego K sp:
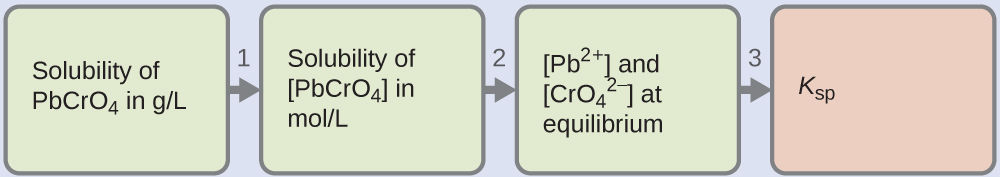
- Utilizar la masa molar de PbCRo 4\(\mathrm{\left(\dfrac{323.2\:g}{1\:mol}\right)}\) para convertir la solubilidad de PbCRo 4 en gramos por litro en moles por litro:
\(\mathrm{[PbCrO_4]=\dfrac{4.6×10^{−6}\:g\: PbCrO_4}{1\:L}×\dfrac{1\:mol\: PbCrO_4}{323.2\:g\: PbCrO_4}}\)
\(\mathrm{=\dfrac{1.4×10^{−8}\:mol\: PbCrO_4}{1\:L}}\)
\(=1.4×10^{−8}\:M\)
- La ecuación química para la disolución indica que 1 mol de PbCRo 4 da 1 mol de Pb 2 + (ac) y 1 mol de\(\ce{CrO_4^{2-}}(aq)\):
\(\ce{PbCrO4}(s) \rightleftharpoons \ce{Pb^2+}(aq)+\ce{CrO4^2-}(aq)\)
Así, tanto [Pb 2 +] como\(\ce{[CrO4^2- ]}\) son iguales a la solubilidad molar de PbCRo 4:
\(\ce{[Pb^2+]}=\ce{[CrO4^2- ]}=1.4×10^{−8}\:M\) - Resolver. K sp = [Pb 2 +]\(\ce{[CrO4^2- ]}\) = (1.4 × 10 —8) (1.4 × 10 —8) = 2.0 × 10 —16
La solubilidad de TLCl [cloruro de talio (I)], un intermedio formado cuando el talio se aísla de minerales, es de 3.46 gramos por litro a 20 °C. ¿Cuál es su producto de solubilidad?
- Responder
-
2.08 × 10 —4
Calomel, Hg 2 Cl 2, es un compuesto compuesto por el ion diatómico de mercurio (I)\(\ce{Hg2^2+}\), e iones cloruro, Cl —. Aunque ahora se sabe que la mayoría de los compuestos de mercurio son venenosos, los médicos del siglo XVIII utilizaron el calomel como medicamento. Sus pacientes rara vez sufrieron alguna intoxicación por mercurio debido a que el calomel es bastante insoluble:
\[\ce{Hg2Cl2}(s) \rightleftharpoons \ce{Hg2^2+}(aq)+\ce{2Cl-}(aq) \hspace{20px} K_\ce{sp}=1.1×10^{−18} \nonumber \]
Calcular la solubilidad molar de Hg 2 Cl 2.
Solución
La solubilidad molar de Hg 2 Cl 2 es igual a la concentración de\(\ce{Hg2^2+}\) iones porque por cada 1 mol de Hg 2 Cl 2 que se disuelve, 1 mol de\(\ce{Hg2^2+}\) formas:
- Determinar la dirección del cambio. Antes de que cualquier Hg 2 Cl 2 se disuelva, Q es cero, y la reacción se desplazará hacia la derecha para alcanzar el equilibrio.
- Determinar x y concentraciones de equilibrio. Las concentraciones y los cambios se dan en la siguiente tabla ICE:
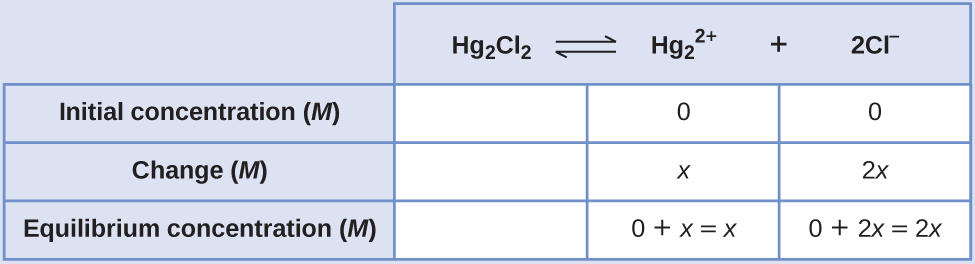
Tenga en cuenta que el cambio en la concentración de Cl — (2 x) es dos veces más grande que el cambio en la concentración de\(\ce{Hg2^2+}\) (x) porque se forman 2 mol de Cl — por cada 1 mol de\(\ce{Hg2^2+}\) que se forma. Hg 2 Cl 2 es un sólido puro, por lo que no aparece en el cálculo.
- Resolver para x y las concentraciones de equilibrio. Sustituimos las concentraciones de equilibrio en la expresión para K sp y calculamos el valor de x:
\[\begin{align*} K_\ce{sp} &=\ce{[Hg2^2+][Cl- ]^2} \\[4pt] 1.1×10^{−18} &=(x)(2x)^2 \\[4pt] 4x^3 &=1.1×10^{−18} \\[4pt] x &=\sqrt[3]{\left(\dfrac{1.1×10^{-18}}{4}\right)}=6.5×10^{-7}\:M \end{align*} \nonumber \]
Entonces las concentraciones son
\[\begin{align*} \ce{[Hg2^2+]} &=6.5×10^{−7}\:M=6.5×10^{−7}\:M \\[4pt] \ce{[Cl- ]} &=2x=2(6.5×10^{−7})=1.3×10^{−6}\:M \end{align*} \nonumber \]
La solubilidad molar de Hg 2 Cl 2 es igual a\(\ce{[Hg2^2+]}\), o 6.5 × 10 —7 M.
Revisa la obra.
En equilibrio, Q = K sp:
\[Q=\ce{[Hg2^2+][Cl- ]^2}=(6.5×10^{−7})(1.3×10^{−6})^2=1.1×10^{−18} \nonumber \]
Los cálculos verifican.
Determinar la solubilidad molar del MgF 2 a partir de su producto de solubilidad: K sp = 6.4 × 10 —9.
- Responder
-
1.2 × 10 —3 M
Los valores tabulados de K sp también se pueden comparar con los cocientes de reacción calculados a partir de datos experimentales para determinar si un sólido precipitará en una reacción en condiciones específicas: Q es igual a K sp en equilibrio; si Q es menor que K sp, el sólido se disolverá hasta que Q sea igual a K sp; si Q es mayor que K sp, la precipitación ocurrirá a una temperatura dada hasta que Q sea igual a K sp.
Se utilizan diversos tipos de técnicas de imagen médica para ayudar al diagnóstico de enfermedades de manera no invasiva. Una de esas técnicas utiliza la ingestión de un compuesto de bario antes de tomar una imagen de rayos X. El paciente ingiere una suspensión de sulfato de bario, un polvo calcáreo. Dado que la K sp del sulfato de bario es de 1.1 × 10 —10, muy poco se disuelve ya que recubre el revestimiento del tracto intestinal del paciente. Las áreas recubiertas de bario del tracto digestivo aparecen luego en una radiografía como blancas, lo que permite un mayor detalle visual que una radiografía tradicional (Figura\(\PageIndex{3}\)).
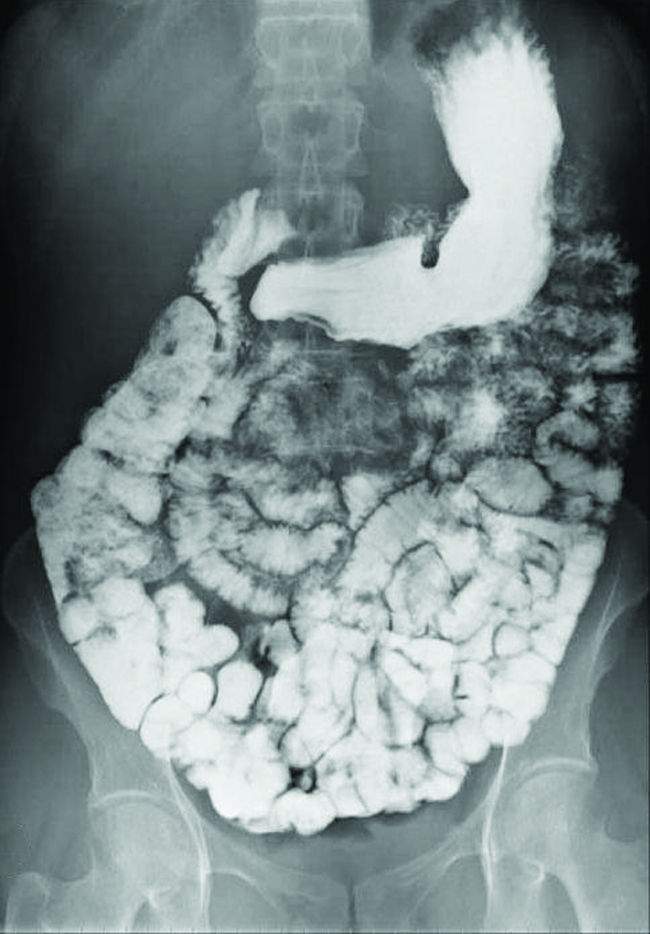
Se pueden realizar pruebas diagnósticas adicionales usando sulfato de bario y fluoroscopia. En la fluoroscopia, se pasa una radiografía continua a través del cuerpo para que el médico pueda monitorear, en una pantalla de TV o computadora, el movimiento del sulfato de bario a medida que pasa por el tracto digestivo. Las imágenes médicas que utilizan sulfato de bario pueden usarse para diagnosticar la enfermedad de reflujo ácido, la enfermedad de Crohn y las úlceras además de otras afecciones.
Predicción de la precipitación
La ecuación que describe el equilibrio entre el carbonato de calcio sólido y sus iones solvatados es:
\[\ce{CaCO3}(s) \rightleftharpoons \ce{Ca^2+}(aq)+\ce{CO3^2-}(aq) \nonumber \]
Podemos establecer este equilibrio ya sea añadiendo carbonato de calcio sólido al agua o mezclando una solución que contenga iones de calcio con una solución que contenga iones carbonato. Si agregamos carbonato de calcio al agua, el sólido se disolverá hasta que las concentraciones sean tales que el valor del cociente de reacción\(\ce{(Q=[Ca^2+][CO3^2- ])}\) sea igual al producto de solubilidad (K sp = 4.8 × 10 —9). Si mezclamos una solución de nitrato de calcio, que contiene iones Ca 2 +, con una solución de carbonato de sodio, que contiene\(\ce{CO3^2-}\) iones, precipitará el sólido iónico ligeramente soluble CaCo 3, siempre que las concentraciones de Ca 2 + y \(\ce{CO3^2-}\)los iones son tales que Q es mayor que K sp para la mezcla. La reacción se desplaza hacia la izquierda y las concentraciones de los iones se reducen por formación del sólido hasta que el valor de Q es igual a K sp. Se obtendrá una solución saturada en equilibrio con el sólido no disuelto. Si las concentraciones son tales que Q es menor que K sp, entonces la solución no está saturada y no se formará precipitado.
Podemos comparar valores numéricos de Q con K sp para predecir si ocurrirá precipitación, como\(\PageIndex{7}\) muestra el Ejemplo. (Nota: Dado que todas las formas de constantes de equilibrio dependen de la temperatura, asumiremos un ambiente de temperatura ambiente en este capítulo a menos que se especifique explícitamente un valor de temperatura diferente).
El primer paso en la preparación de magnesio metálico es la precipitación de Mg (OH) 2 a partir del agua de mar mediante la adición de cal, Ca (OH) 2, una fuente económica fácilmente disponible de iones OH:
\[\ce{Mg(OH)2}(s) \rightleftharpoons \ce{Mg^2+}(aq)+\ce{2OH-}(aq) \hspace{20px} K_\ce{sp}=8.9×10^{−12} \nonumber \]
La concentración de Mg 2 + (aq) en el agua de mar es de 0.0537 M. ¿Precipitará Mg (OH) 2 cuando se añada suficiente Ca (OH) 2 para dar un [OH —] de 0.0010 M?
Solución
Este problema pregunta si la reacción:
\[\ce{Mg(OH)2}(s) \rightleftharpoons \ce{Mg^2+}(aq)+\ce{2OH-}(aq) \nonumber \]
se desplaza hacia la izquierda y forma Mg sólido (OH) 2 cuando [Mg 2 +] = 0.0537 M y [OH —] = 0.0010 M. La reacción se desplaza hacia la izquierda si Q es mayor que K sp. El cálculo del cociente de reacción en estas condiciones se muestra aquí:
\[\mathrm{Q=[Mg^{2+}][OH^-]^2=(0.0537)(0.0010)^2=5.4×10^{−8}} \nonumber \]
Debido a que Q es mayor que K sp (Q = 5.4 × 10 —8 es mayor que K sp = 8.9 × 10 —12), podemos esperar que la reacción se desplace hacia la izquierda y forme hidróxido de magnesio sólido. Mg (OH) 2 (s) se forma hasta que las concentraciones de ion magnesio e ion hidróxido se reducen suficientemente para que el valor de Q sea igual a K sp.
Utilizar los productos de solubilidad del Cuadro E3 para determinar si el CaHPO 4 precipitará de una solución con [Ca 2 +] = 0.0001 M y\(\ce{[HPO4^2- ]}\) = 0.001 M.
- Responder
-
Sin precipitación de CaHPO 4; Q = 1 × 10 —7, que es menor que K sp
¿Precipita el cloruro de plata cuando se mezclan volúmenes iguales de una solución 2.0 × 10 —4 M de AgnO 3 y una solución 2.0 × 10 —4 M de NaCl?
(Nota: La solución también contiene Na + e\(\ce{NO3-}\) iones, pero al referirse a las reglas de solubilidad, se puede ver que el nitrato de sodio es muy soluble y no puede formar un precipitado.)
Solución
La ecuación para el equilibrio entre el cloruro de plata sólido, el ion de plata y el ion cloruro es:
El producto de solubilidad es 1.8 × 10 —10 (Cuadro E3).
AgCl precipitará si el cociente de reacción calculado a partir de las concentraciones en la mezcla de AgnO 3 y NaCl es mayor que K sp. El volumen se duplica cuando mezclamos volúmenes iguales de soluciones de AgnO 3 y NaCl, por lo que cada concentración se reduce a la mitad de su valor inicial. En consecuencia, inmediatamente después de la mezcla, [Ag +] y [Cl —] son iguales a:
El cociente de reacción, Q, es momentáneamente mayor que K sp para AgCl, por lo que se forma una solución sobresaturada:
Dado que las soluciones sobresaturadas son inestables, AgCl precipitará de la mezcla hasta que la solución vuelva al equilibrio, con Q igual a K sp.
¿Precipitará KClO 4 cuando se añadan 20 mL de una solución 0.050- M de K + a 80 mL de una solución 0.50- M de\(\ce{ClO4-}\)? (Recuerde calcular la nueva concentración de cada ion después de mezclar las soluciones antes de enchufar en la expresión del cociente de reacción).
- Responder
-
No, Q = 4.0 × 10 —3, que es menor que K sp = 1.07 × 10 —2
En los dos ejemplos anteriores, hemos visto que Mg (OH) 2 o AgCl precipitan cuando Q es mayor que K sp. En general, cuando una solución de una sal soluble del ion M m+ se mezcla con una solución de una sal soluble del ion X n-, el sólido, M p X q precipita si el valor de Q para la mezcla de M m+ y X n— es mayor que K sp para M p X q. Así, si conocemos la concentración de uno de los iones de un sólido iónico ligeramente soluble y el valor para el producto de solubilidad del sólido, entonces podemos calcular la concentración que el otro ion debe superar para que comience la precipitación. Para simplificar el cálculo, asumiremos que la precipitación comienza cuando el cociente de reacción se vuelve igual a la constante del producto de solubilidad.
La sangre no coagulará si se eliminan los iones de calcio de su plasma. Algunos tubos de extracción de sangre contienen sales del ion oxalato\(\ce{C2O4^2-}\),, para ello (Figura\(\PageIndex{4}\)). A concentraciones suficientemente altas, los iones calcio y oxalato forman sólidos, CaC 2 O 4 •H 2 O (que también contiene agua unida en el sólido). La concentración de Ca 2 + en una muestra de suero sanguíneo es de 2.2 × 10 —3 M. ¿Qué concentración de\(\ce{C2O4^2-}\) ión se debe establecer antes de que CaC 2 O 4 •H 2 O comience a precipitar?
Solución
La expresión de equilibrio es:
\[\ce{CaC2O4}(s) \rightleftharpoons \ce{Ca^2+}(aq)+\ce{C2O4^2-}(aq) \nonumber \]
Para esta reacción (Cuadro E3):
\[K_\ce{sp}=\ce{[Ca^2+][C2O4^2- ]}=1.96×10^{−8} \nonumber \]
CaC 2 O 4 no aparece en esta expresión porque es un sólido. El agua no aparece porque es el solvente.
El sólido CaC 2 O 4 no comienza a formarse hasta que Q es igual a K sp. Debido a que conocemos K sp y [Ca 2 +], podemos resolver para la concentración de\(\ce{C2O4^2-}\) que sea necesaria para producir el primer rastro de sólido:
Es necesaria una concentración de\(\ce{[C2O4^2- ]}\) = 8.9 × 10 —6 M para iniciar la precipitación de CaC 2 O 4 bajo estas condiciones.
Si una solución contiene 0.0020 mol de\(\ce{CrO4^2-}\) por litro, ¿qué concentración de ion Ag + se debe alcanzar añadiendo AgnO 3 sólido antes de que comience a precipitar Ag 2 CrO 4? Olvidar cualquier aumento de volumen al agregar el nitrato de plata sólido.
- Responder
-
4.5 × 10 —9 M
A veces es útil conocer la concentración de un ion que permanece en solución después de la precipitación. También podemos usar el producto de solubilidad para este cálculo: Si conocemos el valor de K sp y la concentración de un ion en solución, podemos calcular la concentración del segundo ion restante en solución. El cálculo es del mismo tipo que el del Ejemplo\(\PageIndex{8}\) —cálculo de la concentración de una especie en una mezcla de equilibrio a partir de las concentraciones de las otras especies y la constante de equilibrio. Sin embargo, las concentraciones son diferentes; estamos calculando concentraciones después de que se complete la precipitación, más que al inicio de la precipitación.
La ropa lavada en agua que tiene una concentración de manganeso [Mn 2 + (aq)] superior a 0.1 mg/L (1.8 × 10 —6 M) puede ser manchada por el manganeso tras la oxidación, pero la cantidad de Mn 2 + en el agua se puede reducir agregando un base. Si una persona que lava la ropa desea agregar un tampón para mantener el pH lo suficientemente alto como para precipitar el manganeso como el hidróxido, Mn (OH) 2, ¿qué pH se requiere para mantener [Mn 2 +] igual a 1.8 × 10 —6 M?
Solución
La disolución de Mn (OH) 2 se describe mediante la ecuación:
\[\ce{Mn(OH)2}(s) \rightleftharpoons \ce{Mn^2+}(aq)+\ce{2OH-}(aq) \hspace{20px} K_\ce{sp}=2×10^{−13} \nonumber \]
Necesitamos calcular la concentración de OH — cuando la concentración de Mn 2 + es 1.8 × 10 —6 M. A partir de eso, calculamos el pH. En equilibrio:
o
\[ (1.8×10^{−6})\ce{[OH- ]^2}=2×10^{−13} \nonumber \]
por lo
Ahora calculamos el pH a partir del PoH:
Si la persona que lava la ropa agrega una base, como el silicato de sodio (Na 4 SiO 4) en algunos detergentes, al agua de lavado hasta que el pH se eleva a 10.52, el ion manganeso se reducirá a una concentración de 1.8 × 10 —6 M; a esa concentración o menos, el ion no manchará la ropa.
El primer paso en la preparación de magnesio metálico es la precipitación de Mg (OH) 2 a partir del agua de mar mediante la adición de Ca (OH) 2. La concentración de Mg 2 + (aq) en el agua de mar es de 5.37 × 10 —2 M. Calcular el pH al que [Mg 2 +] se disminuye a 1.0 × 10 —5 M por la adición de Ca (OH) 2.
- Responder
-
10.97
Debido a su sensibilidad a la luz, las mezclas de haluros de plata se utilizan en fibra óptica para láseres médicos, en lentes de anteojos fotocrómicos (lentes de vidrio que se oscurecen automáticamente cuando se exponen a la luz solar) y, antes del advenimiento de la fotografía digital, en película fotográfica. Aunque AgCl (K sp = 1.6 × 10 —10), AgBr (K sp = 5.0 × 10 —13) y AgI (K sp = 1.5 × 10 —16) son cada uno bastante insolubles, no podemos preparar una mezcla sólida homogénea de ellos agregando Ag + a una solución de Cl —, Br — e I —; esencialmente todo el AGi precipitará antes de que se forme cualquiera de los otros haluros sólidos debido a su menor valor para K sp. Sin embargo, podemos preparar una mezcla homogénea de los sólidos añadiendo lentamente una solución de Cl —, Br — e I — a una solución de Ag +.
Cuando dos aniones forman compuestos ligeramente solubles con el mismo catión, o cuando dos cationes forman compuestos ligeramente solubles con el mismo anión, el compuesto menos soluble (generalmente, el compuesto con la K sp más pequeña) generalmente precipita primero cuando añadimos un agente precipitante a un solución que contiene ambos aniones (o ambos cationes). Cuando los valores de K sp de los dos compuestos difieren en dos órdenes de magnitud o más (por ejemplo, 10 —2 vs. 10 —4), casi todo el compuesto menos soluble precipita antes que cualquiera de los más solubles. Este es un ejemplo de precipitación selectiva, donde se agrega un reactivo a una solución de iones disueltos haciendo que uno de los iones precipite antes que el resto.
El papel de la precipitación en el tratamiento de aguas residuales
Los equilibrios de solubilidad son herramientas útiles en el tratamiento de aguas residuales que se llevan a cabo en instalaciones que pueden tratar el agua municipal en tu ciudad o pueblo (Figura\(\PageIndex{5}\)). Específicamente, la precipitación selectiva se utiliza para eliminar los contaminantes de las aguas residuales antes de que se vuelvan a liberar en cuerpos de agua naturales. Por ejemplo, los iones fosfato a menudo\(\ce{(PO4^2- )}\) están presentes en el agua descargada de las instalaciones de fabricación. La abundancia de fosfato hace que crezca exceso de algas, lo que impacta la cantidad de oxígeno disponible para la vida marina, además de hacer que el agua no sea apta para el consumo humano.

Una forma común de eliminar fosfatos del agua es mediante la adición de hidróxido de calcio, conocido como cal, Ca (OH) 2. La cal se convierte en carbonato de calcio, una base fuerte, en el agua. A medida que el agua se vuelve más básica, los iones calcio reaccionan con iones fosfato para producir hidroxilapatita, Ca 5 (PO4) 3 (OH), que luego precipita de la solución:
\[\ce{5Ca^2+ + 3PO4^3- + OH- \rightleftharpoons Ca10(PO4)6⋅(OH)2}(s) \nonumber \]
Luego se elimina el precipitado por filtración y el agua se devuelve a un pH neutro mediante la adición de CO 2 en un proceso de recarbonatación. También se pueden usar otros químicos para la eliminación de fosfatos por precipitación, incluyendo cloruro de hierro (III) y sulfato de aluminio.
La precipitación selectiva también puede ser utilizada en análisis cualitativos. En este método, los reactivos se agregan a una mezcla química desconocida con el fin de inducir la precipitación. Ciertos reactivos provocan que precipiten iones específicos; por lo tanto, la adición del reactivo puede usarse para determinar si el ion está presente en la solución.
Una solución contiene 0.0010 mol de KI y 0.10 mol de KCl por litro. Poco a poco se agrega AgnO 3 a esta solución. ¿Qué forma primero, AGi sólido o AgCl sólido?
Solución
Los dos equilibrios involucrados son:
Si la solución contenía concentraciones aproximadamente iguales de Cl —e I —, entonces la sal de plata con el menor K sp (AGi) precipitaría primero. Las concentraciones no son iguales, sin embargo, por lo que debemos encontrar el [Ag +] en el que AgCl comienza a precipitar y el [Ag +] en el que AgI comienza a precipitar. La sal que se forma al [Ag +] inferior precipita primero.
Para AGi: AgI precipita cuando Q es igual a K sp para AGi (1.5 × 10 —16). Cuando [I —] = 0.0010 M:
AgI comienza a precipitar cuando [Ag +] es 1.5 × 10 —13 M.
Para AgCl: AgCl precipita cuando Q es igual a K sp para AgCl (1.6 × 10 —10). Cuando [Cl —] = 0.10 M:
AgCl comienza a precipitar cuando [Ag +] es 1.6 × 10 —9 M.
AgI comienza a precipitar a un [Ag +] menor que AgCl, por lo que AgI comienza a precipitar primero.
Si se agrega solución de nitrato de plata a una solución que es 0.050 M tanto en iones Cl —como Br —, ¿a qué [Ag +] comenzaría la precipitación, y cuál sería la fórmula del precipitado?
- Responder
-
[Ag +] = 1.0 × 10 —11 M; AgBr precipita primero
Efecto Ion Común
Como vimos cuando discutimos soluciones tampón, la concentración de iones hidronio de una solución acuosa de ácido acético disminuye cuando se agrega el electrolito fuerte acetato de sodio, nACh 3 CO 2. Podemos explicar este efecto usando el principio de Le Chatelier. La adición de iones acetato hace que el equilibrio se desplace hacia la izquierda, disminuyendo la concentración de\(\ce{H3O+}\) para compensar el aumento de la concentración de iones acetato. Esto aumenta la concentración de CH 3 CO 2 H:
\ [\ ce {CH3CO2H + H2O\ derecho-izquierdocharpoons H3O+ + CH3CO2-}\)]
Debido a que el acetato de sodio y el ácido acético tienen el ion acetato en común, la influencia en el equilibrio se llama el efecto ion común. El efecto iónico común también puede tener un efecto directo sobre los equilibrios de solubilidad. Supongamos que estamos viendo la reacción donde se disuelve el yoduro de plata:
\[\ce{AgI}(s) \rightleftharpoons \ce{Ag+}(aq)+\ce{I-}(aq) \nonumber \]
Si tuviéramos que agregar yoduro de potasio (KI) a esta solución, estaríamos agregando una sustancia que comparte un ion común con el yoduro de plata. El principio de Le Chatelier nos dice que cuando se hace un cambio a un sistema en equilibrio, la reacción cambiará para contrarrestar ese cambio. En este ejemplo, habría un exceso de iones yoduro, por lo que la reacción se desplazaría hacia la izquierda, provocando que más yoduro de plata precipitara de la solución.
Calcular la solubilidad molar del sulfuro de cadmio (CdS) en una solución 0.010- M de bromuro de cadmio (CDBr 2). La K sp de CDs es 1.0 × 10 —28.
Solución
Lo primero que debes notar es que el sulfuro de cadmio se disuelve en una solución que contiene iones de cadmio. Necesitamos usar una tabla ICE para configurar este problema e incluir la concentración de CDBr 2 como contribuyente de iones cadmio:
\[\ce{CdS}(s) \rightleftharpoons \ce{Cd^2+}(aq)+\ce{S^2-}(aq) \nonumber \]
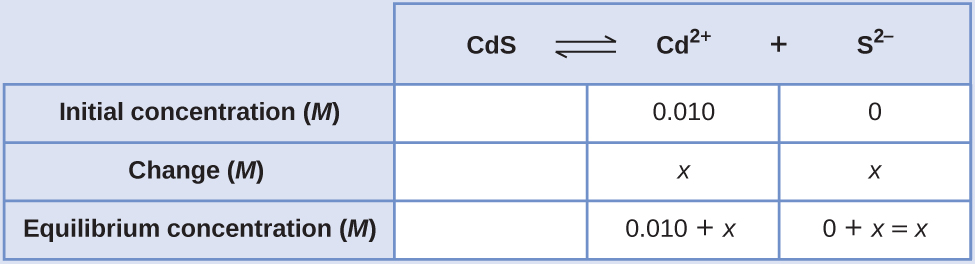
\( (0.010+x)(x)=1.0×10^{−28}\)\(x^2+0.010x−1.0×10^{−28}=0\)
Podemos resolver esta ecuación usando la fórmula cuadrática, pero también podemos hacer una suposición para hacer este cálculo mucho más simple. Dado que el valor de K sp es tan pequeño comparado con la concentración de cadmio, podemos suponer que el cambio entre la concentración inicial y la concentración de equilibrio es insignificante, de manera que 0.010 + x ~ 0.010. Volviendo a nuestra expresión K sp, ahora obtendríamos:
Por lo tanto, la solubilidad molar de CdS en esta solución es de 1.0 × 10 —26 M.
Calcular la solubilidad molar del hidróxido de aluminio, Al (OH) 3, en una solución 0.015- M de nitrato de aluminio, Al (NO 3) 3. La K sp de Al (OH) 3 es 2 × 10 —32.
- Responder
-
4 × 10 —11
Resumen
La constante de equilibrio para un equilibrio que implica la precipitación o disolución de un sólido iónico ligeramente soluble se denomina producto de solubilidad, K sp, del sólido. Cuando tenemos un equilibrio heterogéneo que involucra el sólido ligeramente soluble M p X q y sus iones M m+ y X n—:
\[\ce{M}_p\ce{X}_q(s) \rightleftharpoons p\mathrm{M^{m+}}(aq)+q\mathrm{X^{n−}}(aq) \nonumber \]
Escribimos la expresión del producto de solubilidad como:
\[K_\ce{sp}=\mathrm{[M^{m+}]}^p\mathrm{[X^{n−}]}^q \nonumber \]
El producto de solubilidad de un electrolito ligeramente soluble puede calcularse a partir de su solubilidad; a la inversa, su solubilidad puede calcularse a partir de su K sp, siempre que la única reacción significativa que se produce cuando el sólido se disuelve sea la formación de sus iones. Un electrolito ligeramente soluble comienza a precipitar cuando la magnitud del cociente de reacción para la reacción de disolución excede la magnitud del producto de solubilidad. La precipitación continúa hasta que el cociente de reacción es igual al producto de solubilidad. Se puede añadir un reactivo a una solución de iones para permitir que un ion precipite selectivamente de la solución. El efecto iónico común también puede desempeñar un papel en las reacciones de precipitación. En presencia de un ion en común con uno de los iones en la solución, se aplica el principio de Le Chatelier y sale más precipitado de la solución para que se reduzca la solubilidad molar.
Glosario
- efecto de iones comunes
- efecto sobre el equilibrio cuando se agrega a la solución una sustancia con un ion en común con la especie disuelta; provoca una disminución en la solubilidad de una especie iónica, o una disminución en la ionización de un ácido o base débil
- solubilidad molar
- solubilidad de un compuesto expresada en unidades de moles por litro (mol/L)
- precipitación selectiva
- proceso en el que los iones se separan usando diferencias en su solubilidad con un reactivo precipitante dado
- producto de solubilidad (K sp)
- constante de equilibrio para la disolución de un electrolito ligeramente soluble


