15.2: Ácidos y bases de Lewis
- Page ID
- 75704
- Explicar el modelo de Lewis de química ácido-base
- Escribir ecuaciones para la formación de aductos e iones complejos
- Realizar cálculos de equilibrio que involucran constantes de formación
En 1923, G. N. Lewis propuso una definición generalizada de comportamiento ácido-base en la que los ácidos y bases se identifican por su capacidad para aceptar o donar un par de electrones y formar un enlace covalente coordinado.
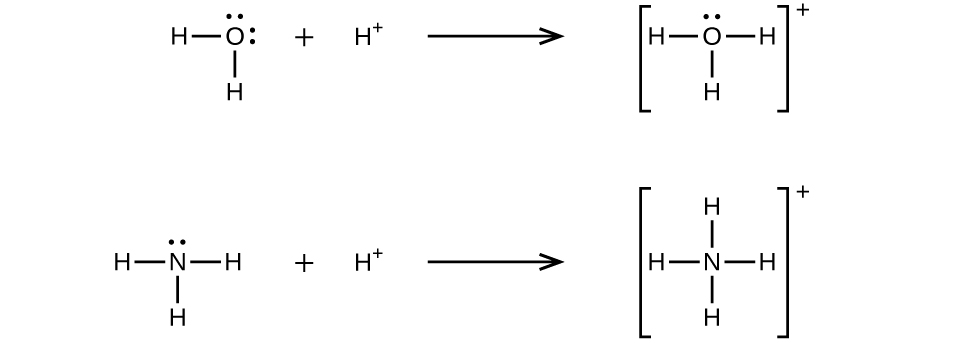
Un enlace covalente coordinado (o enlace dativo) ocurre cuando uno de los átomos en el enlace proporciona ambos electrones de unión. Por ejemplo, un enlace covalente coordinado ocurre cuando una molécula de agua se combina con un ion hidrógeno para formar un ion hidronio. Un enlace covalente coordinado también resulta cuando una molécula de amoníaco se combina con un ion hidrógeno para formar un ion amonio. Ambas ecuaciones se muestran aquí.
Definición: Ácidos y bases de Lewis
- Un ácido de Lewis es cualquier especie (molécula o ion) que pueda aceptar un par de electrones, y una base de Lewis es cualquier especie (molécula o ion) que pueda donar un par de electrones.
Una reacción ácido-base de Lewis ocurre cuando una base dona un par de electrones a un ácido. Se forma un aducto ácido-base de Lewis, un compuesto que contiene un enlace covalente coordinado entre el ácido de Lewis y la base de Lewis. Las siguientes ecuaciones ilustran la aplicación general del concepto de Lewis.
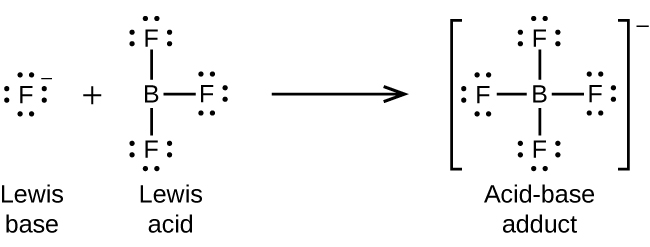
El átomo de boro en trifluoruro de boro, BF 3, tiene solo seis electrones en su caparazón de valencia. Al estar corto del octeto preferido, el BF 3 es un ácido de Lewis muy bueno y reacciona con muchas bases de Lewis; un ion fluoruro es la base de Lewis en esta reacción, donando uno de sus pares solitarios:
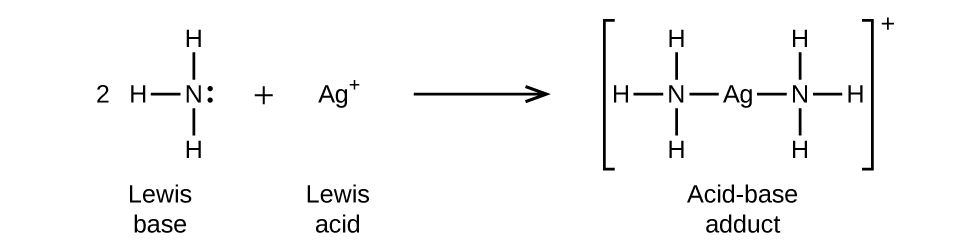
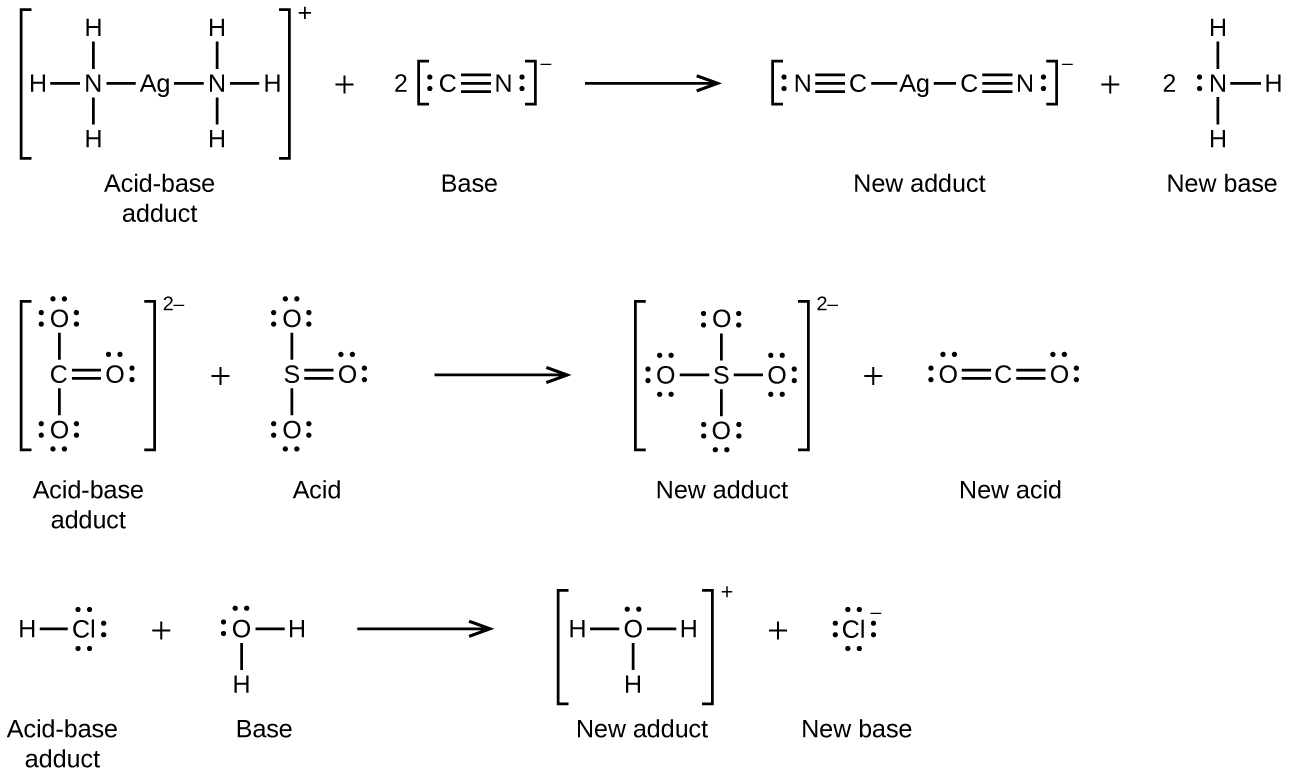
En la siguiente reacción, cada una de las dos moléculas de amoníaco, bases de Lewis, dona un par de electrones a un ion plata, el ácido de Lewis:
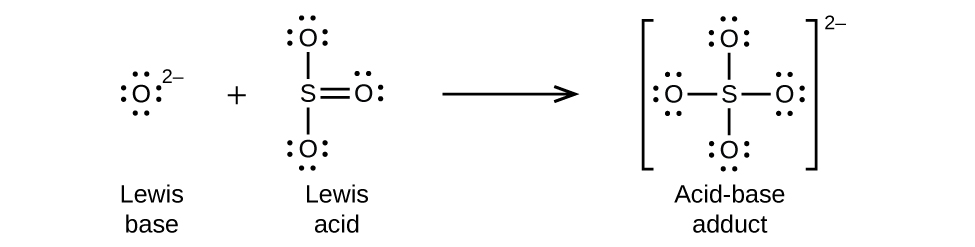
Los óxidos no metálicos actúan como ácidos de Lewis y reaccionan con iones óxido, bases de Lewis, para formar oxianiones:
Muchas reacciones ácido-base de Lewis son reacciones de desplazamiento en las que una base de Lewis desplaza otra base de Lewis de un aducto ácido-base, o en las que un ácido de Lewis desplaza a otro ácido de Lewis:
La última reacción de desplazamiento muestra cómo la reacción de un ácido de Brønsted-Lowry con una base encaja en el concepto de Lewis. Un ácido de Brønsted-Lowry como el HCl es un aducto ácido-base según el concepto de Lewis, y la transferencia de protones ocurre porque se forma un aducto ácido-base más estable. Así, aunque las definiciones de ácidos y bases en las dos teorías son bastante diferentes, las teorías se superponen considerablemente.
Muchos sólidos iónicos ligeramente solubles se disuelven cuando la concentración del ion metálico en solución disminuye a través de la formación de iones complejos (poliatómicos) en una reacción ácido-base de Lewis. Por ejemplo, el cloruro de plata se disuelve en una solución de amoníaco debido a que el ion plata reacciona con el amoníaco para formar el complejo io n\(\ce{Ag(NH3)2+}\). La estructura de Lewis del\(\ce{Ag(NH3)2+}\) ion es:
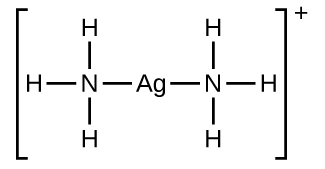
Las ecuaciones para la disolución de AgCl en una solución de NH 3 son:
\[\ce{AgCl}(s)⟶\ce{Ag+}(aq)+\ce{Cl-}(aq) \nonumber \]
\[\ce{Ag+}(aq)+\ce{2NH3}(aq)⟶\ce{Ag(NH3)2+}(aq) \nonumber \]
\[\textrm{Net: }\ce{AgCl}(s)+\ce{2NH3}(aq)⟶\ce{Ag(NH3)2+}(aq)+\ce{Cl-}(aq) \nonumber \]
El hidróxido de aluminio se disuelve en una solución de hidróxido de sodio u otra base fuerte debido a la formación del ion complejo\(\ce{Al(OH)4-}\). La estructura de Lewis del\(\ce{Al(OH)4-}\) ion es:
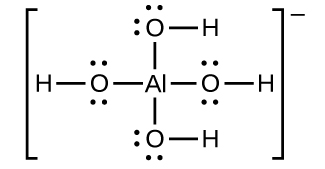
Las ecuaciones para la disolución son:
\[\ce{Al(OH)3}(s)⟶\ce{Al^3+}(aq)+\ce{3OH-}(aq) \nonumber \]
\[\ce{Al^3+}(aq)+\ce{4OH-}(aq)⟶\ce{Al(OH)4-}(aq) \nonumber \]
\[\textrm{Net: }\ce{Al(OH)3}(s)+\ce{OH-}(aq)⟶\ce{Al(OH)4-}(aq) \nonumber \]
El sulfuro de mercurio (II) se disuelve en una solución de sulfuro de sodio porque los HgS reaccionan con el ion S2—:
\[\ce{HgS}(s)⟶\ce{Hg^2+}(aq)+\ce{S^2-}(aq) \nonumber \]
\[\ce{Hg^2+}(aq)+\ce{2S^2-}(aq)⟶\ce{HgS2^2-}(aq) \nonumber \]
\[\textrm{Net: }\ce{HgS}(s)+\ce{S^2-}(aq)⟶\ce{HgS2^2-}(aq) \nonumber \]
Un ion complejo consiste en un átomo central, típicamente un catión de metal de transición, rodeado de iones, o moléculas llamadas ligandos. Estos ligandos pueden ser moléculas neutras como H 2 O o NH 3, o iones como CN — u OH —. A menudo, los ligandos actúan como bases de Lewis, donando un par de electrones al átomo central. Los ligandos se agregan alrededor del átomo central, creando un nuevo ion con una carga igual a la suma de las cargas y, más a menudo, un ion metálico de transición. Esta disposición más compleja es la razón por la que el ion resultante se llama un ion complejo. El ion complejo formado en estas reacciones no puede predecirse; debe determinarse experimentalmente. Los tipos de enlaces formados en iones complejos se denominan enlaces covalentes coordinados, ya que los electrones de los ligandos están siendo compartidos con el átomo central. Debido a esto, los iones complejos a veces se denominan complejos de coordinación. Esto se estudiará más a fondo en los próximos capítulos.
La constante de equilibrio para la reacción de los componentes de un ion complejo para formar el ion complejo en solución se denomina constante de formación (K f) (a veces llamada constante de estabilidad). Por ejemplo, el ion complejo\(\ce{Cu(CN)2-}\) se muestra aquí:
![]()
Se forma por la reacción:
\[\ce{Cu+}(aq)+\ce{2CN-}(aq)⇌\ce{Cu(CN)2-}(aq) \nonumber \]
En equilibrio:
\[K_\ce{f}=Q=\ce{\dfrac{[Cu(CN)2- ]}{[Cu+][CN- ]^2}} \nonumber \]
La inversa de la constante de formación es la constante de disociación (K d), la constante de equilibrio para la descomposición de un ion complejo en sus componentes en solución. Trabajaremos con constantes de disociación más adelante en los ejercicios para esta sección. El Cuadro E4 y el Cuadro\(\PageIndex{1}\) son tablas de constantes de formación. En general, cuanto mayor es la constante de formación, más estable es el complejo; sin embargo, como en el caso de los valores de K sp, se debe considerar la estequiometría del compuesto.
| Sustancia | K f a 25 °C |
|---|---|
| \(\ce{[Cd(CN)4]^2-}\) | 3 × 10 18 |
| \(\ce{Ag(NH3)2+}\) | 1.7 × 10 7 |
| \(\ce{[AlF6]^3-}\) | 7 × 10 19 |
Como ejemplo de disolución por formación de iones complejos, consideremos qué sucede cuando añadimos amoníaco acuoso a una mezcla de cloruro de plata y agua. El cloruro de plata se disuelve ligeramente en agua, dando una pequeña concentración de Ag + ([Ag +] = 1.3 × 10 —5 M):
\[\ce{AgCl}(s)⇌\ce{Ag+}(aq)+\ce{Cl-}(aq) \nonumber \]
Sin embargo, si NH 3 está presente en el agua, el ion complejo,\(\ce{Ag(NH3)2+}\), puede formarse de acuerdo con la ecuación:
\[\ce{Ag+}(aq)+\ce{2NH3}(aq)⇌\ce{Ag(NH3)2+}(aq) \nonumber \]
con
\[K_\ce{f}=\ce{\dfrac{[Ag(NH3)2+]}{[Ag+][NH3]^2}}=1.7×10^7 \nonumber \]
El gran tamaño de esta constante de formación indica que la mayoría de los iones de plata libres producidos por la disolución de AgCl se combinan con NH 3 para formar\(\ce{Ag(NH3)2+}\). Como consecuencia, se reduce la concentración de iones de plata, [Ag +], y el cociente de reacción para la disolución del cloruro de plata, [Ag +] [Cl —], cae por debajo del producto de solubilidad de AgCl:
\[Q=\ce{[Ag+][Cl- ]}<K_\ce{sp} \nonumber \]
Más cloruro de plata luego se disuelve. Si la concentración de amoníaco es lo suficientemente grande, todo el cloruro de plata se disuelve.
Calcular la concentración del ion plata en una solución que inicialmente es 0.10 M con respecto a\(\ce{Ag(NH3)2+}\).
S olución
Utilizamos el camino familiar para resolver este problema:
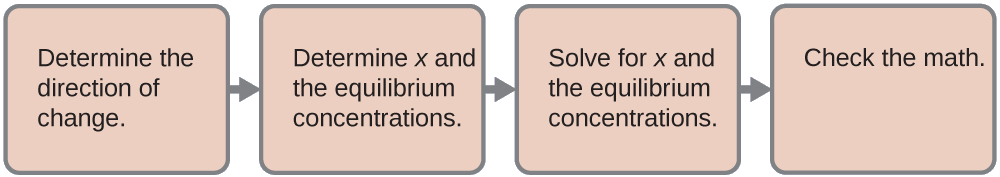
- Determinar la dirección del cambio. El ion complejo\(\ce{Ag(NH3)2+}\) está en equilibrio con sus componentes, tal como lo representa la ecuación:\[\ce{Ag+}(aq)+\ce{2NH3}(aq)⇌\ce{Ag(NH3)2+}(aq) \nonumber \]
Escribimos el equilibrio como reacción de formación porque el Cuadro E4 enumera las constantes de formación para iones complejos. Antes del equilibrio, el cociente de reacción es mayor que la constante de equilibrio (K_f = 1.7\ times 10^7\), y\(Q=\dfrac{0.10}{0 \times 0} = \infty\) (es infinitamente grande), por lo que la reacción se desplaza hacia la izquierda para alcanzar el equilibrio.


