15.3: Equilibrios acoplados
- Page ID
- 75690
- Describir ejemplos de sistemas que involucran dos (o más) equilibrios químicos simultáneos
- Calcular las concentraciones de reactivos y productos para múltiples sistemas de equilibrio
- Comparar la disolución y la formación de electrolitos débiles
Hay momentos en que una reacción de equilibrio no describe adecuadamente el sistema que se está estudiando. A veces tenemos más de un tipo de equilibrio ocurriendo a la vez (por ejemplo, una reacción ácido-base y una reacción de precipitación).
El océano es un ejemplo único de un sistema con equilibrios múltiples, o múltiples estados de equilibrios de solubilidad que funcionan simultáneamente. El dióxido de carbono en el aire se disuelve en el agua de mar, formando ácido carbónico (H 2 CO 3). El ácido carbónico luego se ioniza para formar iones de hidrógeno e iones de bicarbonato\(\ce{(HCO3- )}\), que pueden ionizarse aún más en más iones de hidrógeno e iones carbonato\(\ce{(CO3^2- )}\):
\[\ce{CO2}(g)⇌\ce{CO2}(aq) \nonumber \]
\[\ce{CO2}(aq)+\ce{H2O}⇌\ce{H2CO3}(aq) \nonumber \]
\[\ce{H2CO3}(aq)⇌\ce{H+}(aq)+\ce{HCO3-}(aq) \nonumber \]
\[\ce{HCO3-}(aq)⇌\ce{H+}(aq)+\ce{CO3^2-}(aq) \nonumber \]
El exceso de iones H + hace que el agua de mar sea más ácida. El aumento de la acidificación oceánica puede tener impactos negativos en el coral formador de arrecifes, ya que no pueden absorber el carbonato de calcio que necesitan para crecer y mantener sus esqueletos (Figura\(\PageIndex{1}\)). Esto a su vez perturba el biosistema local que depende de la salud de los arrecifes para su supervivencia. Si suficientes arrecifes locales se ven afectados de manera similar, las perturbaciones en la vida marina se pueden sentir globalmente. Los océanos del mundo se encuentran actualmente en medio de un período de intensa acidificación, que se cree que comenzó a mediados del siglo XIX, y que ahora se está acelerando a un ritmo más rápido que cualquier cambio al pH oceánico en los últimos 20 millones de años.

Conoce más sobre la acidificación oceánica y cómo afecta a otras criaturas marinas.
Los sólidos ligeramente solubles derivados de ácidos débiles generalmente se disuelven en ácidos fuertes, a menos que sus productos de solubilidad sean extremadamente pequeños. Por ejemplo, podemos disolver CuCO 3, FeS y Ca 3 (PO 4) 2 en HCl porque sus aniones básicos reaccionan para formar ácidos débiles (H 2 CO 3, H 2 S y\(\ce{H2PO4-}\)). La disminución resultante en la concentración del anión da como resultado un desplazamiento de las concentraciones de equilibrio hacia la derecha de acuerdo con el principio de Le Chatelier.

De particular relevancia para nosotros es la disolución de hidroxilapatita, Ca 5 (PO 4) 3 OH, en ácido. Las apatitas son una clase de minerales de fosfato de calcio (Figura\(\PageIndex{2}\)); una forma biológica de hidroxilapatita se encuentra como el principal mineral en el esmalte de nuestros dientes. Una mezcla de hidroxilapatita y agua (o saliva) contiene una mezcla de equilibrio de Ca 5 (PO 4) 3 OH sólido y Ca 2 + disuelto\(\ce{PO4^3-}\),, y OH iones:
\[\ce{Ca5(PO4)3OH}(s)⟶\ce{5Ca^2+}(aq)+\ce{3PO4^3-}(aq)+\ce{OH-}(aq) \nonumber \]
Cuando se exponen al ácido, los iones fosfato reaccionan con los iones hidronio para formar iones fosfato de hidrógeno y, en última instancia, el ácido fosfórico:
\[\ce{PO4^3-}(aq)+\ce{H3O+}⇌\ce{H2PO4^2-}+\ce{H2O} \nonumber \]
\[\ce{PO4^2-}(aq)+\ce{H3O+}⇌\ce{H2PO4-}+\ce{H2O} \nonumber \]
\[\ce{H2PO4- + H3O+ ⇌ H3PO4 + H2O} \nonumber \]
El ion hidróxido reacciona para formar agua:
\[\ce{OH-}(aq)+\ce{H3O+}⇌\ce{2H2O} \nonumber \]
Estas reacciones disminuyen las concentraciones de iones fosfato e hidróxido, y la hidroxilapatita adicional se disuelve en una solución ácida de acuerdo con el principio de Le Chatelier. Nuestros dientes desarrollan caries cuando los residuos ácidos producidos por bacterias que crecen en ellos hacen que la hidroxilapatita del esmalte se disuelva. Las pastas dentales con flúor contienen fluoruro de sodio, NaF o fluoruro estannoso [más apropiadamente llamado fluoruro de estaño (II)], SnF 2. Funcionan reemplazando el ion OH — en la hidroxilapatita por el ion F —, produciendo fluorapatita, Ca 5 (PO 4) 3 F:
\[\ce{NaF + Ca5(PO4)3OH ⇌ Ca5(PO4)3F + Na+ + OH-} \nonumber \]
El Ca 5 (PO 4) 3 F resultante es ligeramente menos soluble que Ca 5 (PO 4) 3 OH, y F — es una base más débil que OH —. Ambos factores hacen que la fluorapatita sea más resistente al ataque por ácidos que la hidroxilapatita. Consulte la función Química en la vida cotidiana sobre el papel del fluoruro en la prevención de las caries dentales para obtener más información.
Como vimos anteriormente, los iones fluoruro ayudan a proteger nuestros dientes al reaccionar con la hidroxilapatita para formar fluorapatita, Ca 5 (PO 4) 3 F. Dado que carece de un ion hidróxido, la fluorapatita es más resistente a los ataques por ácidos en nuestra boca y por lo tanto es menos soluble, protegiendo nuestros dientes. Los científicos descubrieron que el agua fluorada de forma natural podría ser beneficiosa para tus dientes, por lo que se convirtió en una práctica común agregar fluoruro al agua potable. Las pastas dentales y los enjuagues bucales también contienen cantidades de fluoruro (Figura\(\PageIndex{3}\)).

Desafortunadamente, el exceso de fluoruro puede negar sus ventajas. Las fuentes naturales de agua potable en diversas partes del mundo tienen concentraciones variables de fluoruro, y los lugares donde esa concentración es alta son propensos a ciertos riesgos para la salud cuando no hay otra fuente de agua potable. El efecto secundario más grave del exceso de fluoruro es la enfermedad ósea, la fluorosis esquelética. Cuando hay exceso de fluoruro en el cuerpo, puede hacer que las articulaciones se endurezcan y que los huesos se espesen. Puede impactar severamente la movilidad y puede afectar negativamente a la glándula tiroides. La fluorosis esquelética es una afección que sufren más de 2.7 millones de personas en todo el mundo. Entonces, mientras que el fluoruro puede proteger nuestros dientes de las caries, la Agencia de Protección Ambiental de Estados Unidos establece un nivel máximo de 4 ppm (4 mg/L) de fluoruro en el agua potable en Estados Unidos. Los niveles de fluoruro en el agua no están regulados en todos los países, por lo que la fluorosis es un problema en áreas con altos niveles de fluoruro en las aguas subterráneas.
Cuando la lluvia ácida ataca la piedra caliza o el mármol, que son carbonatos de calcio, se produce una reacción que es similar al ataque ácido sobre la hidroxilapatita. El ion hidronio de la lluvia ácida se combina con el ion carbonato de los carbonatos de calcio y forma el ion hidrogenocarbonato, un ácido débil:
\[\ce{H3O+}(aq)+\ce{CO3^2-}(aq)⟶\ce{HCO3-}(aq)+\ce{H2O}(l) \nonumber \]
El hidrógeno carbonato de calcio, Ca (HCO 3) 2, es soluble, por lo que los objetos de piedra caliza y mármol se disuelven lentamente en lluvia ácida.
Si se agrega carbonato de calcio a un ácido concentrado, el ion hidronio reacciona con el ion carbonato de acuerdo con la ecuación:
\[\ce{2H3O+}(aq)+\ce{CO3^2-}(aq)⟶\ce{H2CO3}(aq)+\ce{2H2O}(l) \nonumber \]
(La lluvia ácida generalmente no es lo suficientemente ácida para causar esta reacción; sin embargo, los ácidos de laboratorio sí lo son.) La solución puede saturarse con el electrolito débil ácido carbónico, que es inestable, y se puede desprender gas dióxido de carbono:
\[\ce{H2CO3}(aq)⟶\ce{CO2}(g)+\ce{H2O}(l) \nonumber \]
Estas reacciones disminuyen la concentración de iones carbonato, y el carbonato de calcio adicional se disuelve. Si hay suficiente ácido, la concentración de ion carbonato se reduce a un nivel tan bajo que el cociente de reacción para la disolución del carbonato de calcio permanece menor que el producto de solubilidad del carbonato de calcio, incluso después de que todo el carbonato de calcio se haya disuelto.
Calcular la concentración de ion amonio que se requiere para evitar la precipitación de Mg (OH) 2 en una solución con [Mg 2 +] = 0.10 M y [NH 3] = 0.10 M.
Solución
Dos equilibrios están involucrados en este sistema:
- Reacción (1):\(\ce{Mg(OH)2}(s)⇌\ce{Mg^2+}(aq)+\ce{2OH-}(aq); \hspace{20px} K_\ce{sp}=8.9×10^{−12}\)
- Reacción (2):\(\ce{NH3}(aq)+\ce{H2O}(l)⇌\ce{NH4+}(aq)+\ce{OH-}(aq) \hspace{20px} K_\ce{sp}=1.8×10^{−5}\)
Para evitar la formación de Mg (OH) 2 sólido, debemos ajustar la concentración de OH — de manera que el cociente de reacción para la Ecuación (1), Q = [Mg 2 +] [OH —] 2, sea menor que K sp para Mg (OH) 2 . (Para simplificar el cálculo, determinamos la concentración de OH — cuando Q = K sp.) [OH —] se puede reducir mediante la adición de\(\ce{NH4+}\), que desplaza la reacción (2) hacia la izquierda y reduce [OH —].
- Determinamos el [OH —] en el que Q = K sp cuando [Mg 2 +] = 0.10 M:\[Q=\ce{[Mg^2+][OH- ]^2}=(0.10)\ce{[OH- ]^2}=8.9×10^{−12} \nonumber \]
El Mg (OH) 2 sólido no se formará en esta solución cuando [OH —] sea inferior a 9.4 × 10 —6 M.
- Calculamos lo\(\mathit{[NH_4^+]}\) necesario para disminuir [OH —] a 9.4 × 10 —6 M cuando [NH 3] = 0.10. \[K_\ce{b}=\ce{\dfrac{[NH4+][OH- ]}{[NH3]}}=\dfrac{\ce{[NH4+]}(9.4×10^{−6})}{0.10}=1.8×10^{−5} \nonumber \]\[\ce{[NH4+]}=0.19\:M \nonumber \]
Cuando\(\ce{[NH4+]}\) es igual a 0.19 M, [OH —] será 9.4 × 10 —6 M. Cualquier\(\ce{[NH4+]}\) mayor de 0.19 M reducirá [OH —] por debajo de 9.4 × 10 —6 M y evitará la formación de Mg (OH) 2.
Consideremos los dos equilibrios:
\[\ce{ZnS}(s)⇌\ce{Zn^2+}(aq)+\ce{S^2-}(aq) \hspace{20px} K_\ce{sp}=1×10^{−27} \nonumber \]
\[\ce{2H2O}(l)+\ce{H2S}(aq)⇌\ce{2H3O+}(aq)+\ce{S^2-}(aq) \hspace{20px} K=1.0×10^{−26} \nonumber \]
y calcular la concentración de ion hidronio requerida para evitar la precipitación de ZnS en una solución que es 0.050 M en Zn 2 + y saturada con H 2 S (0.10 M H 2 S).
- Contestar
-
\[\ce{[H3O+]}>0.2\:M \nonumber \]
([S 2—] es menor de 2 × 10 —26 M y no se produce precipitación de ZnS).
Por lo tanto, los cálculos precisos de la solubilidad de los sólidos a partir del producto de solubilidad se limitan a casos en los que la única reacción significativa que se produce cuando el sólido se disuelve es la formación de sus iones.
Los haluros de plata no expuestos se eliminan de la película fotográfica cuando reaccionan con tiosulfato de sodio (Na 2 S 2 O 3, llamado hipo) para formar el ion complejo\(\ce{Ag(S2O3)2^3-}\) (K f = 4.7 × 10 13). La reacción con bromuro de plata es:
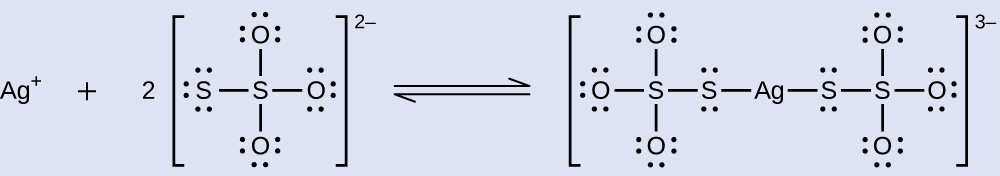
¿Qué masa de Na 2 S 2 O 3 se requiere para preparar 1.00 L de una solución que disolverá 1.00 g de AgBr por la formación de\(\ce{Ag(S2O3)2^3-}\)?
S olución
Dos equilibrios están involucrados cuando el AgBr se disuelve en una solución que contiene el\(\ce{S2O3^2-}\) ion:
- Reacción (1):\(\ce{AgBr}(s)⇌\ce{Ag+}(aq)+\ce{Br-}(aq) \hspace{20px} K_\ce{sp}=5.0×10^{−13}\)
- Reacción (2):\(\ce{Ag+}(aq)+\ce{S2O3^2-}(aq)⇌\ce{Ag(S2O3)2^3-}(aq) \hspace{20px} K_\ce{f}=4.7×10^{13}\)
Para que 1.00 g de AgBr se disuelva, el [Ag +] en la solución que resulte debe ser lo suficientemente bajo para que Q para que la Reacción (1) sea menor que K sp para esta reacción. Reducimos [Ag +] al agregar\(\ce{S2O3^2-}\) y así hacer que Reacción (2) se desplace hacia la derecha. Necesitamos los siguientes pasos para determinar qué masa de Na 2 S 2 O 3 se necesita para proporcionar la necesaria\(\ce{S2O3^2-}\).
- Se calcula el [Br —] producido por la disolución completa de 1.00 g de AgBr (5.33 × 10 —3 mol AgBr) en 1.00 L de solución:\[\ce{[Br- ]}=5.33×10^{−3}\:M \nonumber \]
- Utilizamos [Br —] y K sp para determinar la concentración máxima posible de Ag + que puede estar presente sin causar reprecipitación de AgBr:\[\ce{[Ag+]}=9.4×10^{−11}\:M \nonumber \]
- Determinamos lo\(\mathit{[S_2O_3^{2-}]}\) requerido para hacer [Ag +] = 9.4 × 10 —11 M después de que el ion Ag + restante haya reaccionado de\(\mathit{S_2O_3^{2-}}\) acuerdo con la ecuación:\[\ce{Ag+ + 2S2O3^2- ⇌ Ag(S2O3)2^3-} \hspace{20px} K_\ce{f}=4.7×10^{13} \nonumber \]
Debido a que 5.33 × 10 —3 mol de AgBr se disuelve:
\ [(5.33×10^ {−3}) − (9.4×10^ {−11}) =5.33×10^ {−3}\ ce {\ :mol\ :Ag (S2O3) 2^3-}\\ nonumber]Así, en equilibrio:\(\ce{[Ag(S2O3)2^3- ]}\) = 5.33 × 10 —3 M, [Ag +] = 9.4× 10 —11 M, y Q = K f = 4.7 × 10 13:
\[K_\ce{f}=\ce{\dfrac{[Ag(S2O3)2^3- ]}{[Ag+][S2O3^2- ]^2}}=4.7×10^{13} \nonumber \]\[\ce{[S2O3^2- ]}=1.1×10^{−3}\:M \nonumber \]Cuando\(\ce{[S2O3^2- ]}\) es 1.1 × 10 —3 M, [Ag +] es 9.4 × 10 —11 M y todo el AgBr permanece disuelto.
- Determinamos el número total de moles de los\(\mathit{S_2O_3^{2-}}\) que se deben agregar a la solución. Esto equivale a la cantidad que reacciona con Ag + para formar\(\ce{Ag(S2O3)2^3-}\) más la cantidad de libre\(\ce{S2O3^2-}\) en solución en equilibrio. Para formar 5.33 × 10 —3 mol de se\(\ce{Ag(S2O3)2^3-}\) requiere 2 × (5.33 × 10 —3) mol de\(\ce{S2O3^2-}\). Además,\(\ce{S2O3^2-}\) está presente 1.1 × 10 —3 mol de no reaccionado (Etapa 3). Así, el monto total de lo\(\ce{S2O3^2-}\) que se debe sumar es:\[\mathrm{2×(5.33×10^{−3}mol\:S_2O_3^{2-}) + 1.1×10^{−3}\:mol\:S_2O_3^{2-} = 1.18×10^{−2}\: mol\:S_2O_3^{2-}} \nonumber \]
- Determinamos la masa de Na 2 S 2 O 3 requerida para dar 1.18 × 10 —2 mol\(\mathit{S_2O_3^{2-}}\) usando la masa molar de Na 2 S 2 O 3:\[\mathrm{1.18×10^{−2}\:mol\:S_2O_3^{2-}×\dfrac{158.1\:g\:Na_2S_2O_3}{1\:mol\:Na_2S_2O_3}=1.9\:g\:Na_2S_2O_3} \nonumber \]
Así, 1.00 L de una solución preparada a partir de 1.9 g Na 2 S 2 O 3 disuelve 1.0 g de AgBr.
Se sabe que AgCl (s), cloruro de plata, tiene una solubilidad muy baja:\(\ce{Ag}(s)⇌\ce{Ag+}(aq)+\ce{Cl-}(aq)\), K sp = 1.6 × 10 —10. Agregar amoníaco aumenta significativamente la solubilidad de AgCl debido a que se forma un ion complejo:\(\ce{Ag+}(aq)+\ce{2NH3}(aq)⇌\ce{Ag(NH3)2+}(aq)\), K f = 1.7 × 10 7. ¿Qué masa de NH 3 se requiere para preparar 1.00 L de solución que disolverá 2.00 g de AgCl por formación de\(\ce{Ag(NH3)2+}\)?
- Contestar
-
1.00 L de una solución preparada con 4.81 g NH 3 disuelve 2.0 g de AgCl.
Disolución versus formación de electrolitos débiles
Podemos determinar cómo cambiar la concentración de iones en el equilibrio entre un sólido ligeramente soluble y una solución de sus iones aplicando el principio de Le Chatelier. Por ejemplo, una forma de controlar la concentración de ion manganeso (II), Mn 2 +, en una solución es ajustar el pH de la solución y, en consecuencia, manipular el equilibrio entre el hidróxido de manganeso (II) sólido ligeramente soluble, el ion manganeso (II) y el ion hidróxido:
\[\ce{Mn(OH)2}(s) ⇌ \ce{Mn^2+}(aq)+\ce{2OH-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Mn^2+][OH- ]^2} \nonumber \]
Esto podría ser importante para una lavandería porque la ropa lavada en agua que tiene una concentración de manganeso superior a 0.1 mg por litro puede ser manchada por el manganeso. Podemos reducir la concentración de manganeso aumentando la concentración de iones hidróxido. Podríamos agregar, por ejemplo, una pequeña cantidad de NaOH o alguna otra base como los silicatos que se encuentran en muchos detergentes para ropa. A medida que aumenta la concentración de iones OH, el equilibrio responde desplazándose hacia la izquierda y reduciendo la concentración de iones Mn 2 + al tiempo que aumenta la cantidad de Mn (OH) 2 sólido en la mezcla de equilibrio, como predice el principio de Le Chatelier.
¿Cuál es el efecto sobre la cantidad de Mg (OH) 2 sólido que se disuelve y las concentraciones de Mg 2 + y OH — cuando cada uno de los siguientes se agrega a una mezcla de Mg (OH) 2 sólido en agua en equilibrio?
- MgCl 2
- KOH
- un ácido
- Nano 3
- Mg (OH) 2
Solución
El equilibrio entre Mg sólido (OH) 2 y una solución de Mg 2 + y OH — es:
\[\ce{Mg(OH)2}(s) ⇌ \ce{Mg^2+}(aq)+\ce{2OH-}(aq) \nonumber \]
(a) La reacción se desplaza hacia la izquierda para aliviar la tensión producida por el ion Mg 2 + adicional, de acuerdo con el principio de Le Chatelier. En términos cuantitativos, el Mg 2 + agregado hace que el cociente de reacción sea mayor que el producto de solubilidad (Q > K sp), y se forma Mg (OH) 2 hasta que el cociente de reacción nuevamente sea igual a K sp. En el nuevo equilibrio, [OH —] es menor y [Mg 2 +] es mayor que en la solución de Mg (OH) 2 en agua pura. Mg (OH) 2 más sólido está presente.
(b) La reacción se desplaza hacia la izquierda para aliviar el estrés del ion OH — adicional. Mg (OH) 2 se forma hasta que el cociente de reacción de nuevo es igual a K sp. En el nuevo equilibrio, [OH —] es mayor y [Mg 2 +] es menor que en la solución de Mg (OH) 2 en agua pura. Mg (OH) 2 más sólido está presente.
(c) La concentración de OH —se reduce a medida que el OH — reacciona con el ácido. La reacción se desplaza hacia la derecha para aliviar el estrés de menos iones OH —. En términos cuantitativos, la disminución en la concentración de OH hace que el cociente de reacción sea menor que el producto de solubilidad (Q < K sp), y Mg (OH) 2 adicional se disuelve hasta que el cociente de reacción vuelve a ser igual a K sp. En el nuevo equilibrio, [OH —] es menor y [Mg 2 +] es mayor que en la solución de Mg (OH) 2 en agua pura. Se disuelve más Mg (OH) 2.
(d) Nano 3 no contiene ninguna de las especies involucradas en el equilibrio, por lo que debemos esperar que no tenga un efecto apreciable sobre las concentraciones de Mg 2 + y OH —. (Como hemos visto anteriormente, las sales disueltas cambian las actividades de los iones de un electrolito. No obstante, el efecto sal es generalmente pequeño, y desatenderemos los leves errores que puedan derivarse de ello.)
(e) La adición de Mg (OH) 2 sólido no tiene efecto sobre la solubilidad de Mg (OH) 2 ni sobre la concentración de Mg 2 + y OH —. La concentración de Mg (OH) 2 no aparece en la ecuación para el cociente de reacción:
\[Q=\ce{[Mg^2+][OH- ]^2} \nonumber \]
Por lo tanto, cambiar la cantidad de hidróxido de magnesio sólido en la mezcla no tiene ningún efecto sobre el valor de Q, y no se requiere ningún desplazamiento para restaurar Q al valor de la constante de equilibrio.
¿Cuál es el efecto sobre la cantidad de NiCo 3 sólido que se disuelve y las concentraciones de Ni 2 + y\(\ce{CO3^2-}\) cuando cada uno de los siguientes se agrega a una mezcla del NiCo 3 sólido ligeramente soluble y agua en equilibrio?
- Ni (NO 3) 2
- KClO 4
- NiCo 3
- K 2 CO 3
- HNO 3 (reacciona con carbonato dando\(\ce{HCO3-}\) o H 2 O y CO 2)
Contestar
(a) la masa de NiC3 (s) aumenta, [Ni 2 +] aumenta,\(\ce{[CO3^2- ]}\) disminuye; (b) ningún efecto apreciable; (c) ningún efecto excepto aumentar la cantidad de NiCo sólido 3; (d) la masa de NiCo 3 (s) aumenta, [Ni 2 +] disminuye,\(\ce{[CO3^2- ]}\) aumenta; (e) la masa de NiCo 3 (s) disminuye, [Ni 2 +] aumenta,\(\ce{[CO3^2- ]}\) disminuye
Resumen
Varios sistemas que encontramos consisten en equilibrios múltiples, sistemas donde dos o más procesos de equilibrios ocurren simultáneamente. Algunos ejemplos comunes incluyen la lluvia ácida, la fluoración y la disolución del dióxido de carbono en el agua de mar. Al observar estos sistemas, debemos considerar cada equilibrio por separado y luego combinar las constantes de equilibrio individuales en un producto de solubilidad o expresión del cociente de reacción usando las herramientas del primer capítulo de equilibrio. También se debe considerar el principio de Le Chatelier, ya que cada reacción en un sistema de equilibrios múltiples se desplazará hacia reactivos o productos basados en lo que se agrega a la reacción inicial y cómo afecta a cada reacción de equilibrio posterior.
Glosario
- equilibrio múltiple
- sistema caracterizado por más de un estado de equilibrio entre un sólido iónico ligeramente soluble y una solución acuosa de iones trabajando simultáneamente


