18.1: Periodicidad
- Page ID
- 75441
- Clasificar elementos
- Hacer predicciones sobre las propiedades de periodicidad de los elementos representativos
Comenzamos esta sección examinando los comportamientos de los metales representativos en relación con sus posiciones en la tabla periódica. El foco principal de esta sección será la aplicación de la periodicidad a los metales representativos.
Es posible dividir los elementos en grupos de acuerdo a sus configuraciones electrónicas. Los elementos representativos son elementos donde se están llenando los orbitales s y p. Los elementos de transición son elementos donde se llenan los orbitales d (grupos 3—11 en la tabla periódica), y los metales de transición internos son los elementos donde se llenan los orbitales f. Los orbitales d se llenan con los elementos del grupo 11; por lo tanto, los elementos del grupo 12 califican como elementos representativos porque el último electrón entra en un orbital s. Los metales entre los elementos representativos son los metales representativos. El carácter metálico resulta de la capacidad de un elemento para perder sus electrones de valencia externa y da como resultado una alta conductividad térmica y eléctrica, entre otras propiedades físicas y químicas. Hay 20 metales representativos no radiactivos en los grupos 1, 2, 3, 12, 13, 14 y 15 de la tabla periódica (los elementos sombreados en amarillo en la Figura\(\PageIndex{1}\)). Los elementos radiactivos copernicio, flerovio, polonio y livermorio también son metales pero están fuera del alcance de este capítulo.
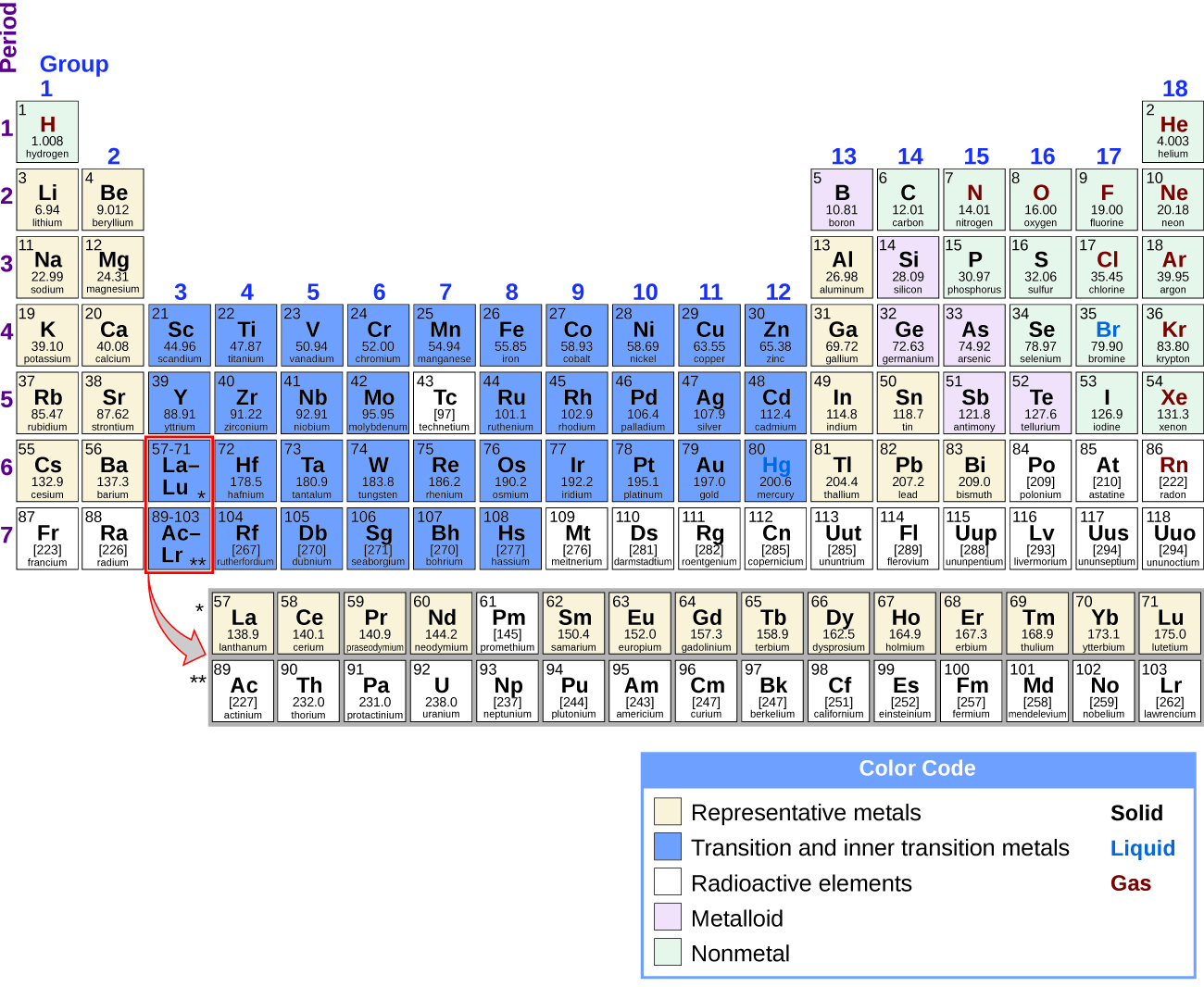
Además de los metales representativos, algunos de los elementos representativos son metaloides. Un metaloide es un elemento que tiene propiedades que se encuentran entre las de metales y no metales; estos elementos suelen ser semiconductores. Los elementos representativos restantes son no metales. A diferencia de los metales, que típicamente forman cationes y compuestos iónicos (que contienen enlaces iónicos), los no metales tienden a formar aniones o compuestos moleculares. En general, la combinación de un metal y un no metal produce una sal. Una sal es un compuesto iónico que consiste en cationes y aniones.
Una sal es un compuesto iónico que consiste en cationes y aniones.
La mayoría de los metales representativos no ocurren naturalmente en un estado no combinado porque reaccionan fácilmente con el agua y el oxígeno en el aire. Sin embargo, es posible aislar berilio elemental, magnesio, zinc, cadmio, mercurio, aluminio, estaño y plomo de sus minerales naturales y usarlos porque reaccionan muy lentamente con el aire. Parte de la razón por la que estos elementos reaccionan lentamente es que estos elementos reaccionan con el aire para formar una capa protectora. La formación de este recubrimiento protector es la pasivación. El recubrimiento es una película no reactiva de óxido o algún otro compuesto. El magnesio elemental, el aluminio, el zinc y el estaño son importantes en la fabricación de muchos artículos familiares, incluyendo alambre, utensilios de cocina, papel de aluminio y muchos objetos domésticos y personales. Aunque el berilio, el cadmio, el mercurio y el plomo están fácilmente disponibles, existen limitaciones en su uso debido a su toxicidad.
Grupo 1: Los Metales Alcalinos
Los metales alcalinos litio, sodio, potasio, rubidio, cesio y francio constituyen el grupo 1 de la tabla periódica. Si bien el hidrógeno está en el grupo 1 (y también en el grupo 17), es un no metal y merece una consideración separada más adelante en este capítulo. El nombre metal alcalino se refiere al hecho de que estos metales y sus óxidos reaccionan con el agua para formar soluciones muy básicas (alcalinas).
Las propiedades de los metales alcalinos son similares entre sí como se esperaba para los elementos de la misma familia. Los metales alcalinos tienen los radios atómicos más grandes y la energía de primera ionización más baja en sus períodos. Esta combinación hace que sea muy fácil eliminar el electrón único en el caparazón más externo (valencia) de cada uno. La fácil pérdida de este electrón de valencia significa que estos metales forman fácilmente cationes estables con una carga de 1+. Su reactividad aumenta con el aumento del número atómico debido a la facilidad de perder el electrón de valencia solitario (disminución de la energía de ionización). Dado que la oxidación es tan fácil, lo contrario, la reducción, es difícil, lo que explica por qué es difícil aislar los elementos. Los metales alcalinos sólidos son muy blandos; el litio, mostrado en la Figura\(\PageIndex{2}\), tiene la menor densidad de cualquier metal (0.5 g/cm 3).

Todos los metales alcalinos reaccionan vigorosamente con el agua para formar gas hidrógeno y una solución básica del hidróxido metálico. Esto significa que son más fáciles de oxidar que el hidrógeno. Como ejemplo, la reacción del litio con agua es:
\[\ce{2Li}(s)+\ce{2H2O}(l)⟶\ce{2LiOH}(aq)+\ce{H2}(g) \nonumber \]
Los metales alcalinos reaccionan directamente con todos los no metales (excepto los gases nobles) para producir compuestos iónicos binarios que contienen 1+ iones metálicos. Estos metales son tan reactivos que es necesario evitar el contacto tanto con la humedad como con el oxígeno en el aire. Por lo tanto, se almacenan en recipientes sellados bajo aceite mineral, como se muestra en la Figura\(\PageIndex{3}\), para evitar el contacto con el aire y la humedad. Los metales puros nunca existen libres (no combinados) en la naturaleza debido a su alta reactividad. Además, esta alta reactividad hace necesario preparar los metales por electrólisis de compuestos de metales alcalinos.

A diferencia de muchos otros metales, la reactividad y suavidad de los metales alcalinos hacen que estos metales no sean adecuados para aplicaciones estructurales. Sin embargo, hay aplicaciones donde la reactividad de los metales alcalinos es una ventaja. Por ejemplo, la producción de metales como el titanio y el circonio se basa, en parte, en la capacidad del sodio para reducir los compuestos de estos metales. La fabricación de muchos compuestos orgánicos, incluyendo ciertos tintes, fármacos y perfumes, utiliza la reducción por litio o sodio.
El sodio y sus compuestos imparten un color amarillo brillante a una llama, como se ve en la Figura\(\PageIndex{4}\). El paso de una descarga eléctrica a través del vapor de sodio también produce este color. En ambos casos, este es un ejemplo de un espectro de emisión como se discute en el capítulo sobre estructura electrónica. Las farolas en algún momento emplean luces de vapor de sodio porque el vapor de sodio penetra la niebla mejor que la mayoría de las otras luces. Esto se debe a que la niebla no dispersa tanto la luz amarilla como dispersa la luz blanca. Los otros metales alcalinos y sus sales también imparten color a una llama. El litio crea un color carmesí brillante, mientras que los demás crean un color violeta pálido.
Video\(\PageIndex{1}\): Este video demuestra las reacciones de los metales alcalinos con el agua.
Grupo 2: Los metales alcalinotérreos
Los metales alcalinotérreos (berilio, magnesio, calcio, estroncio, bario y radio) constituyen el grupo 2 de la tabla periódica. El nombre de metal alcalino proviene del hecho de que los óxidos de los miembros más pesados del grupo reaccionan con el agua para formar soluciones alcalinas. La carga nuclear aumenta al pasar del grupo 1 al grupo 2. Debido a este aumento de carga, los átomos de los metales alcalinotérreos son más pequeños y tienen mayores energías de primera ionización que los metales alcalinos dentro del mismo período. La mayor energía de ionización hace que los metales alcalinotérreos sean menos reactivos que los metales alcalinos; sin embargo, siguen siendo elementos muy reactivos. Su reactividad aumenta, como se esperaba, al aumentar el tamaño y disminuir la energía de ionización. En las reacciones químicas, estos metales pierden fácilmente ambos electrones de valencia para formar compuestos en los que exhiben un estado de oxidación de 2+. Debido a su alta reactividad, es común producir los metales alcalinotérreos, como los metales alcalinos, por electrólisis. Aunque las energías de ionización son bajas, los dos metales con las energías de ionización más altas (berilio y magnesio) sí forman compuestos que exhiben algunos caracteres covalentes. Al igual que los metales alcalinos, los metales alcalinotérreos más pesados imparten color a una llama. Al igual que en el caso de los metales alcalinos, esto forma parte del espectro de emisión de estos elementos. El calcio y el estroncio producen tonos de rojo, mientras que el bario produce un color verde.
El magnesio es un metal blanco plateado que es maleable y dúctil a altas temperaturas. La pasivación disminuye la reactividad del magnesio metálico. Al exponerse al aire, se forma una capa de oxicarbonato de magnesio fuertemente adheridas en la superficie del metal e inhibe la reacción posterior. (El carbonato proviene de la reacción del dióxido de carbono en la atmósfera.) El magnesio es el más ligero de los metales estructurales ampliamente utilizados, razón por la cual la mayor producción de magnesio es para aleaciones ligeras.
Magnesio (Figura\(\PageIndex{5}\)), calcio, estroncio y bario reaccionan con agua y aire. A temperatura ambiente, el bario muestra la reacción más vigorosa. Los productos de la reacción con agua son hidrógeno y el hidróxido metálico. La formación de gas hidrógeno indica que los metales alcalinotérreos más pesados son mejores agentes reductores (más fácilmente oxidados) que el hidrógeno. Como era de esperar, estos metales reaccionan tanto con ácidos como con no metales para formar compuestos iónicos. A diferencia de la mayoría de las sales de los metales alcalinos, muchas de las sales comunes de los metales alcalinotérreos son insolubles en agua debido a las altas energías reticulares de estos compuestos, que contienen un ion metálico divalente.

El potente poder reductor del magnesio caliente es útil en la preparación de algunos metales a partir de sus óxidos. De hecho, la afinidad del magnesio por el oxígeno es tan grande que la quema de magnesio reacciona con el dióxido de carbono, produciendo carbono elemental:
\[\ce{2Mg}(s)+\ce{CO2}(g)⟶\ce{2MgO}(s)+\ce{C}(s) \nonumber \]
Por esta razón, un extintor de CO 2 no extinguirá un fuego de magnesio. Adicionalmente, la luz blanca brillante emitida por la quema de magnesio lo hace útil en bengalas y fuegos artificiales.
Grupo 12 Metales
Los elementos del grupo 12 son elementos de transición; sin embargo, el último electrón agregado no es un electrón d, sino un electrón s. Dado que el último electrón agregado es un electrón s, estos elementos califican como metales representativos, o metales posteriores a la transición. Los elementos del grupo 12 se comportan más como los metales alcalinotérreos que los metales de transición. El grupo 12 contiene los cuatro elementos zinc, cadmio, mercurio y copernicio. Cada uno de estos elementos tiene dos electrones en su capa externa (ns 2). Cuando los átomos de estos metales forman cationes con una carga de 2+, donde se pierden los dos electrones externos, tienen configuraciones de electrones de gas pseudo-noble. El mercurio es a veces una excepción porque también exhibe un estado de oxidación de 1+ en compuestos que contienen un\(\ce{Hg2^2+}\) ion diatómico. En sus formas elementales y en compuestos, el cadmio y el mercurio son ambos tóxicos.
El zinc es el más reactivo en el grupo 12, y el mercurio es el menos reactivo. (Esta es la inversa de la tendencia de reactividad de los metales de los grupos 1 y 2, en la que la reactividad aumenta a la baja de un grupo. El incremento en la reactividad con el aumento del número atómico solo ocurre para los metales en los grupos 1 y 2.) La disminución de la reactividad se debe a la formación de iones con una configuración de gas pseudo-noble y a otros factores que están fuera del alcance de esta discusión. Los comportamientos químicos del zinc y el cadmio son bastante similares entre sí pero difieren del del mercurio.
El zinc y el cadmio tienen menores potenciales de reducción que el hidrógeno y, al igual que los metales alcalinos y alcalinotérreos, producirán gas hidrógeno cuando reaccionen con ácidos. La reacción de zinc con ácido clorhídrico, mostrada en la Figura\(\PageIndex{6}\), es:

El zinc es un metal plateado que se empaña rápidamente hasta obtener un aspecto gris azulado. Este cambio de color se debe a un recubrimiento adherente de un carbonato básico, Zn 2 (OH) 2 CO 3, que pasiva el metal para inhibir aún más la corrosión. Las pilas secas y las pilas alcalinas contienen un ánodo de zinc. El latón (Cu y Zn) y algo de bronce (Cu, Sn y a veces Zn) son importantes aleaciones de zinc. Alrededor de la mitad de la producción de zinc sirve para proteger el hierro y otros metales de la corrosión. Esta protección puede tomar la forma de un ánodo de sacrificio (también conocido como ánodo galvánico, que es un medio para proporcionar protección catódica para diversos metales) o como un revestimiento delgado sobre el metal protegido. El acero galvanizado es acero con una capa protectora de zinc.
Ánodos de sacrificio
Un ánodo de sacrificio, o ánodo galvánico, es un medio para proporcionar protección catódica de diversos metales. La protección catódica se refiere a la prevención de la corrosión mediante la conversión del metal corrosivo en un cátodo. Como cátodo, el metal resiste la corrosión, que es un proceso de oxidación. La corrosión ocurre en el ánodo de sacrificio en lugar de en el cátodo.
La construcción de dicho sistema comienza con la unión de un metal más activo (potencial de reducción más negativo) al metal que necesita protección. El accesorio puede ser directo o a través de un cable. Para completar el circuito, es necesario un puente de sal. Este puente de sal suele ser agua de mar o agua subterránea. Una vez que se completa el circuito, la oxidación (corrosión) ocurre en el ánodo y no en el cátodo.
Los ánodos de sacrificio comúnmente utilizados son magnesio, aluminio y zinc. El magnesio tiene el potencial de reducción más negativo de los tres y sirve mejor cuando el puente salino es menos eficiente debido a una baja concentración de electrolitos como en agua dulce. El zinc y el aluminio funcionan mejor en agua salada que el magnesio. El aluminio es más ligero que el zinc y tiene una mayor capacidad; sin embargo, un recubrimiento de óxido puede pasivar el aluminio. En casos especiales, otros materiales son útiles. Por ejemplo, el hierro protegerá al cobre.
El mercurio es muy diferente del zinc y el cadmio. El mercurio es el único metal que es líquido a 25 °C. Muchos metales se disuelven en mercurio, formando soluciones llamadas amalgamas (ver la característica en Amalgamas), que son aleaciones de mercurio con uno o más de otros metales. El mercurio, que se muestra en la Figura\(\PageIndex{7}\), es un elemento no reactivo que es más difícil de oxidar que el hidrógeno. Así, no desplaza el hidrógeno de los ácidos; sin embargo, reaccionará con ácidos oxidantes fuertes, como el ácido nítrico:
\[\ce{Hg}(l)+\ce{HCl}(aq)⟶\textrm{no reaction} \nonumber \]
\[\ce{3Hg}(l)+\ce{8HNO3}(aq)⟶\ce{3Hg(NO3)2}(aq)+\ce{4H2O}(l)+\ce{2NO}(g) \nonumber \]
El NO claro inicialmente formado experimenta rápidamente una mayor oxidación al NO 2 marrón rojizo.

La mayoría de los compuestos de mercurio se descomponen al calentarse La mayoría de los compuestos de mercurio contienen mercurio con un estado de oxidación 2+. Cuando hay un gran exceso de mercurio, es posible formar compuestos que contienen el\(\ce{Hg2^2+}\) ion. Todos los compuestos de mercurio son tóxicos, y es necesario ejercer mucho cuidado en su síntesis.
Una amalgama es una aleación de mercurio con uno o más de otros metales. Esto es similar a considerar que el acero es una aleación de hierro con otros metales. La mayoría de los metales formarán una amalgama con mercurio, siendo las principales excepciones el hierro, el platino, el tungsteno y el tantalio. Debido a problemas de toxicidad con mercurio, ha habido una disminución significativa en el uso de amalgamas. Históricamente, las amalgamas fueron importantes en las celdas electrolíticas y en la extracción de oro. Las amalgamas de los metales alcalinos aún encuentran uso porque son agentes reductores fuertes y más fáciles de manejar que los metales alcalinos puros. Los prospectores tuvieron un problema cuando encontraron oro finamente dividido. Aprendieron que al agregar mercurio a sus sartenes se recogía el oro en el mercurio para formar una amalgama para una recolección más fácil. Desafortunadamente, las pérdidas de pequeñas cantidades de mercurio a lo largo de los años dejaron muchos arroyos en California contaminados con mercurio. Los odontólogos utilizan amalgamas que contienen plata y otros metales para llenar las cavidades. Hay varias razones para usar una amalgama, incluyendo bajo costo, facilidad de manipulación y longevidad en comparación con materiales alternativos. Las amalgamas dentales son aproximadamente 50% de mercurio en peso, lo que, en los últimos años, se ha convertido en una preocupación por la toxicidad del mercurio.
Después de revisar los mejores datos disponibles, la Administración de Alimentos y Medicamentos (FDA) considera que los rellenos a base de amalgamas son seguros para adultos y niños mayores de seis años de edad. Incluso con múltiples empastes, los niveles de mercurio en los pacientes se mantienen muy por debajo de los niveles más bajos asociados con el daño. Los estudios clínicos no han encontrado ningún vínculo entre las amalgamas dentales y los problemas de salud. Los problemas de salud pueden no ser los mismos en los casos de niños menores de seis años o mujeres embarazadas. Las conclusiones de la FDA están en línea con las opiniones de la Agencia de Protección Ambiental (EPA) y los Centros para el Control de Enfermedades (CDC). La única consideración de salud señalada es que algunas personas son alérgicas a la amalgama o a uno de sus componentes.
Grupo 13
El grupo 13 contiene el boro metaloide y los metales aluminio, galio, indio y talio. El elemento más ligero, el boro, es semiconductor, y sus compuestos binarios tienden a ser covalentes y no iónicos. Los elementos restantes del grupo son metales, pero sus óxidos e hidróxidos cambian de carácter. Los óxidos e hidróxidos de aluminio y galio presentan comportamientos tanto ácidos como básicos. Una sustancia, como estas dos, que reaccionará tanto con ácidos como con bases es anfótera. Esta característica ilustra la combinación de comportamientos no metálicos y metálicos de estos dos elementos. Los óxidos e hidróxidos de indio y talio presentan solo un comportamiento básico, de acuerdo con el carácter claramente metálico de estos dos elementos. El punto de fusión del galio es inusualmente bajo (alrededor de 30 °C) y se derretirá en tu mano.
El aluminio es anfótero porque reaccionará tanto con ácidos como con bases. Una reacción típica con un ácido es:
\[\ce{2Al}(s)+\ce{6HCl}(aq)⟶\ce{2AlCl3}(aq)+\ce{3H2}(g) \nonumber \]
Los productos de la reacción del aluminio con una base dependen de las condiciones de reacción, siendo la siguiente una posibilidad:
\[\ce{2Al}(s)+\ce{2NaOH}(aq)+\ce{6H2O}(l)⟶\ce{2Na[Al(OH)4]}(aq)+\ce{3H2}(g) \nonumber \]
Tanto con ácidos como con bases, la reacción con el aluminio genera gas hidrógeno.
Los elementos del grupo 13 tienen una configuración electrónica de vaina de valencia de ns 2 np 1. El aluminio normalmente usa todos sus electrones de valencia cuando reacciona, dando compuestos en los que tiene un estado de oxidación de 3+. Aunque muchos de estos compuestos son covalentes, otros, como AlF 3 y Al 2 (SO 4) 3, son iónicos. Las soluciones acuosas de sales de aluminio contienen el catión\(\ce{[Al(H2O)6]^3+}\), abreviado como Al 3 + (aq). El galio, indio y talio también forman compuestos iónicos que contienen iones M 3+. Estos tres elementos exhiben no solo el estado de oxidación esperado de 3+ de los tres electrones de valencia sino también un estado de oxidación (en este caso, 1+) que es dos por debajo del valor esperado. Este fenómeno, el efecto de par inerte, se refiere a la formación de un ion estable con un estado de oxidación dos inferior al esperado para el grupo. El par de electrones es el orbital de valencia para esos elementos. En general, el efecto de par inerte es importante para los elementos p -bloque inferiores. En una solución acuosa, el ion Tl+ (ac) es más estable que Tl 3 + (ac). En general, estos metales reaccionarán con el aire y el agua para formar 3+ iones; sin embargo, el talio reacciona para dar derivados del talio (I). Todos los metales del grupo 13 reaccionan directamente con no metales como el azufre, el fósforo y los halógenos, formando compuestos binarios.
Los metales del grupo 13 (Al, Ga, In y Tl) son todos reactivos. Sin embargo, la pasivación ocurre cuando se forma una película dura, dura y delgada del óxido metálico al exponerse al aire. La interrupción de esta película puede contrarrestar la pasivación, permitiendo que el metal reaccione. Una forma de romper la película es exponer el metal pasivado al mercurio. Parte del metal se disuelve en el mercurio para formar una amalgama, que arroja la capa protectora de óxido para exponer el metal a una reacción posterior. La formación de una amalgama permite que el metal reaccione con el aire y el agua.
Video\(\PageIndex{2}\): Aunque se oxida fácilmente, la pasivación del aluminio lo hace muy útil como material de construcción fuerte y ligero. Debido a la formación de una amalgama, el mercurio es corrosivo para los materiales estructurales hechos de aluminio. Este video demuestra cómo la integridad de una viga de aluminio puede ser destruida por la adición de una pequeña cantidad de mercurio elemental.
Los usos más importantes del aluminio están en las industrias de construcción y transporte, y en la fabricación de latas de aluminio y papel de aluminio. Estos usos dependen de la ligereza, dureza y resistencia del metal, así como de su resistencia a la corrosión. Debido a que el aluminio es un excelente conductor del calor y resiste la corrosión, es útil en la fabricación de utensilios de cocina.
El aluminio es un muy buen agente reductor y puede sustituir a otros agentes reductores en el aislamiento de ciertos metales de sus óxidos. Aunque es más caro que la reducción por carbono, el aluminio es importante en el aislamiento de Mo, W y Cr de sus óxidos.
Grupo 14
Los miembros metálicos del grupo 14 son estaño, plomo y flerovio. El carbono es un no metal típico. Los elementos restantes del grupo, silicio y germanio, son ejemplos de semimetales o metaloides. El estaño y el plomo forman los cationes divalentes estables, Sn 2 + y Pb 2 +, con estados de oxidación dos por debajo del estado de oxidación grupal de 4+. La estabilidad de este estado de oxidación es consecuencia del efecto de par inerte. El estaño y el plomo también forman compuestos covalentes con un estado formal de oxidación 4+. Por ejemplo, SnCl 4 y PbCl 4 son líquidos covalentes de bajo punto de ebullición.

El estaño reacciona fácilmente con no metales y ácidos para formar compuestos de estaño (II) (lo que indica que se oxida más fácilmente que el hidrógeno) y con los no metales para formar compuestos de estaño (II) o estaño (IV) (Figura\(\PageIndex{8}\)), dependiendo de la estequiometría y las condiciones de reacción. El plomo es menos reactivo. Solo es un poco más fácil de oxidar que el hidrógeno, y la oxidación normalmente requiere un ácido concentrado caliente.
Muchos de estos elementos existen como alótropos. Los alótropos son dos o más formas del mismo elemento en el mismo estado físico con diferentes propiedades químicas y físicas. Hay dos alótropos comunes de estaño. Estos alótropos son estaño gris (quebradizo) y estaño blanco. Al igual que con otros alótropos, la diferencia entre estas formas de estaño está en la disposición de los átomos. El estaño blanco es estable por encima de 13.2 °C y es maleable como otros metales. A bajas temperaturas, el estaño gris es la forma más estable. El estaño gris es quebradizo y tiende a descomponerse en polvo. En consecuencia, los artículos hechos de estaño se desintegrarán en clima frío, particularmente si la ola de frío es larga. El cambio progresa lentamente desde la mancha de origen, y el estaño gris que se forma primero cataliza el cambio adicional. En cierto modo, este efecto es similar a la propagación de una infección en un cuerpo vegetal o animal, lo que lleva a la gente a llamar a este proceso enfermedad del estaño o plaga del estaño.
El uso principal del estaño está en el recubrimiento de acero para formar hojalata de hierro, que constituye el estaño en latas. Las aleaciones de estaño importantes son el bronce (Cu y Sn) y la soldadura (Sn y Pb). El plomo es importante en las baterías de almacenamiento de plomo en los automóviles.
Grupo 15
El bismuto, el miembro más pesado del grupo 15, es un metal menos reactivo que los otros metales representativos. Da fácilmente tres de sus cinco electrones de valencia a no metales activos para formar el ion tripositivo, Bi 3 +. Forma compuestos con el estado de oxidación grupal de 5+ solo cuando se trata con agentes oxidantes fuertes. La estabilidad del estado de oxidación 3+es otro ejemplo del efecto de par inerte.
Resumen
Esta sección se centra en la periodicidad de los elementos representativos. Estos son los elementos donde los electrones están entrando a los orbitales s y p. Los elementos representativos se presentan en los grupos 1, 2 y 12—18. Estos elementos son metales representativos, metaloides y no metales. Los metales alcalinos (grupo 1) son muy reactivos, forman fácilmente iones con una carga de 1+ para formar compuestos iónicos que suelen ser solubles en agua, y reaccionan vigorosamente con agua para formar gas hidrógeno y una solución básica del hidróxido metálico. Los electrones más externos de los metales alcalinotérreos (grupo 2) son más difíciles de eliminar que el electrón externo de los metales alcalinos, lo que lleva a que los metales del grupo 2 sean menos reactivos que los del grupo 1. Estos elementos forman fácilmente compuestos en los que los metales exhiben un estado de oxidación de 2+. El zinc, el cadmio y el mercurio (grupo 12) comúnmente exhiben el estado de oxidación del grupo de 2+ (aunque el mercurio también exhibe un estado de oxidación de 1+ en los compuestos que contienen\(\ce{Hg2^2+}\)). El aluminio, el galio, el indio y el talio (grupo 13) son más fáciles de oxidar que el hidrógeno. El aluminio, el galio y el indio ocurren con un estado de oxidación 3+ (sin embargo, el talio también ocurre comúnmente como el ion Tl +). El estaño y el plomo forman cationes divalentes estables y compuestos covalentes en los que los metales presentan el estado de oxidación 4+.
Glosario
- metal alcalinotérreo
- cualquiera de los metales (berilio, magnesio, calcio, estroncio, bario y radio) que ocupan el grupo 2 de la tabla periódica; son metales reactivos divalentes que forman óxidos básicos
- alótropos
- dos o más formas del mismo elemento, en el mismo estado físico, con diferentes estructuras químicas
- bismuto
- miembro más pesado del grupo 15; un metal menos reactivo que otros metales representativos
- metal (representante)
- átomos de los elementos metálicos de los grupos 1, 2, 12, 13, 14, 15 y 16, que forman compuestos iónicos al perder electrones de sus orbitales s o p externos
- metaloide
- elemento que tiene propiedades que se encuentran entre las de metales y no metales; estos elementos son típicamente semiconductores
- pasivación
- metales con una película protectora no reactiva de óxido u otro compuesto que cree una barrera para las reacciones químicas; la eliminación física o química de la película pasivante permite que los metales demuestren su reactividad química esperada
- elemento representativo
- elemento donde se llenan los orbitales s y p
- metal representativo
- metal entre los elementos representativos


