18.2: Ocurrencia y Preparación de los Metales Representativos
- Page ID
- 75405
- Identificar fuentes naturales de metales representativos
- Describir los procesos de reducción electrolítica y química utilizados para preparar estos elementos a partir de fuentes naturales
Debido a su reactividad, no encontramos los metales más representativos como elementos libres en la naturaleza. Sin embargo, los compuestos que contienen iones de los metales más representativos son abundantes. En esta sección, consideraremos las dos técnicas comunes utilizadas para aislar los metales de estos compuestos: la electrólisis y la reducción química.
Estos metales se encuentran principalmente en minerales, con litio que se encuentra en minerales de silicato o fosfato, y sodio y potasio que se encuentran en depósitos de sal por evaporación de mares antiguos y en silicatos. Los metales alcalinotérreos se presentan como silicatos y, a excepción del berilio, como carbonatos y sulfatos. El berilio se presenta como el mineral berilo, Be 3 Al 2 Si 6 O 18, que, con ciertas impurezas, puede ser ya sea la piedra preciosa esmeralda o aguamarina. El magnesio se encuentra en el agua de mar y, junto con los metales alcalinotérreos más pesados, ocurre como silicatos, carbonatos y sulfatos. El aluminio se presenta abundantemente en muchos tipos de arcilla y en la bauxita, un hidróxido de óxido de aluminio impuro. El principal mineral de estaño es el óxido casiterita, SnO 2, y los principales minerales de plomo y talio son los sulfuros o los productos de meteorización de los sulfuros. El resto de los metales representativos se presentan como impurezas en minerales de zinc o aluminio.
Electrólisis
Los iones de los metales de los grupos 1 y 2, junto con el aluminio, son muy difíciles de reducir; por lo tanto, es necesario preparar estos elementos por electrólisis, un proceso importante discutido en el capítulo sobre electroquímica. Brevemente, la electrólisis implica el uso de energía eléctrica para conducir reacciones químicas desfavorables hasta su finalización; es útil en el aislamiento de metales reactivos en sus formas puras. El sodio, el aluminio y el magnesio son ejemplos típicos.
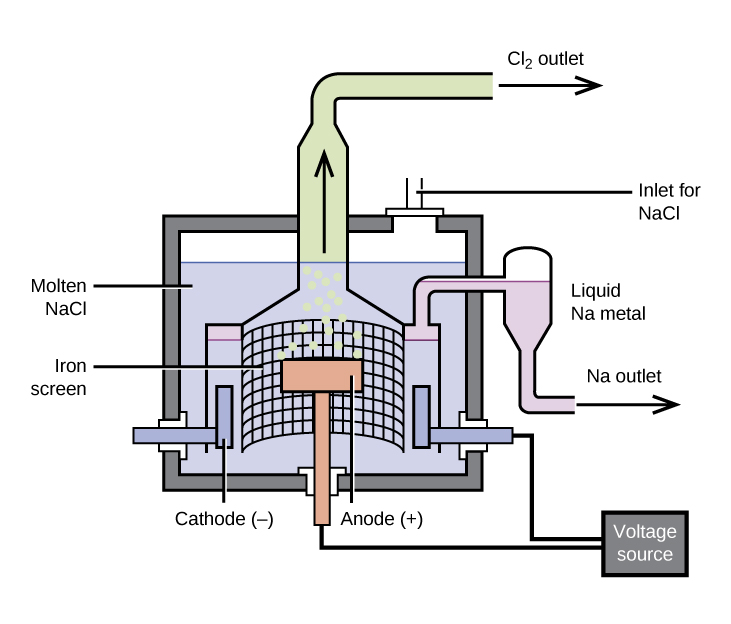
La Preparación de Sodio
El método más importante para la producción de sodio es la electrólisis del cloruro de sodio fundido; la configuración es una celda Downs, mostrada en la Figura\(\PageIndex{1}\). La reacción involucrada en este proceso es:
\[\ce{2NaCl}(l)\:\mathrm{\underset{600\:°C}{\xrightarrow{electrolysis}}}\:\ce{2Na}(l)+\ce{Cl2}(g) \nonumber \]
La celda de electrólisis contiene cloruro de sodio fundido (punto de fusión 801 °C), al que se le ha agregado cloruro de calcio para bajar el punto de fusión a 600 °C (un efecto coligativo). El paso de una corriente continua a través de la celda hace que los iones de sodio migren al cátodo cargado negativamente y capten electrones, reduciendo los iones a sodio metálico. Los iones cloruro migran al ánodo cargado positivamente, pierden electrones y se someten a oxidación a gas cloro. La reacción celular global proviene de la adición de las siguientes reacciones:
\ [\ begin {align}
&\ textrm {en el cátodo:}\ ce {2Na+} +\ ce {2e-} ⟶\ ce {2Na} (l)\\
&\ textrm {en el ánodo:}\ ce {2Cl-} ⟶\ ce {Cl2} (g) +\ ce {2e-}\\
&\ textrm {cambio general:}\ ce {2Na+} +\ ce {2Cl-} ⟶\ ce {2Na} (l) +\ ce {Cl2} (g)
\ end {align}\ nonumber\]
La separación del sodio fundido y el cloro evita la recombinación. El sodio líquido, que es menos denso que el cloruro de sodio fundido, flota hacia la superficie y fluye hacia un colector. El cloro gaseoso va a los tanques de almacenamiento. El cloro también es un producto valioso.
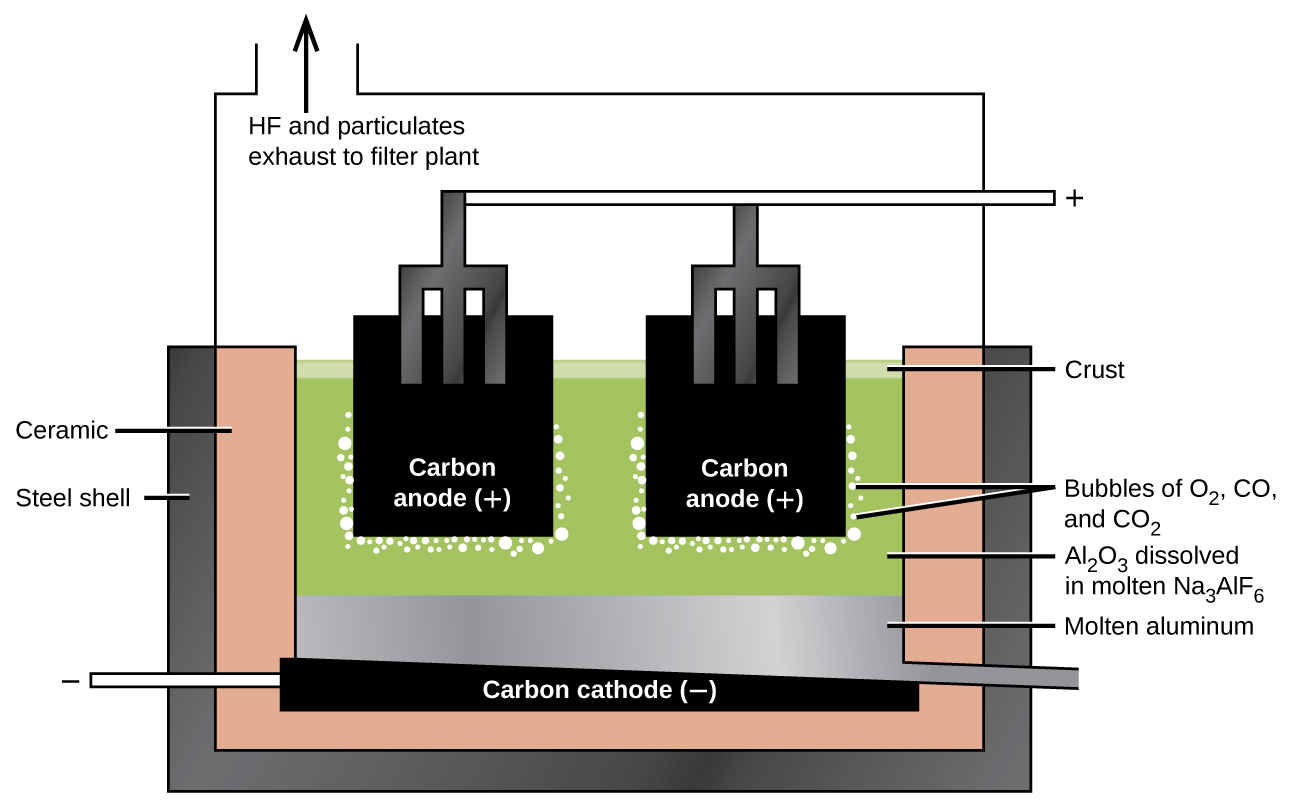
La Preparación de Aluminio
La preparación del aluminio utiliza un proceso inventado en 1886 por Charles M. Hall, quien comenzó a trabajar en el problema mientras estudiaba en el Oberlin College en Ohio. Paul L. T. Héroult descubrió el proceso independientemente uno o dos meses después en Francia. En honor a los dos inventores, esta celda de electrólisis se conoce como la celda Hall—Héroult. La celda Hall—Héroult es una celda de electrólisis para la producción de aluminio. La figura\(\PageIndex{2}\) ilustra la celda Hall—Héroult.
La producción de aluminio comienza con la purificación de bauxita, la fuente más común de aluminio. La reacción de bauxita, AlO (OH), con hidróxido de sodio caliente forma aluminato de sodio soluble, mientras que la arcilla y otras impurezas permanecen sin disolver:
\[\ce{AlO(OH)}(s)+\ce{NaOH}(aq)+\ce{H2O}(l)⟶\ce{Na[Al(OH)4]}(aq) \nonumber \]
Después de la eliminación de las impurezas por filtración, la adición de ácido al aluminato conduce a la reprecipitación del hidróxido de aluminio:
\[\ce{Na[Al(OH)4]}(aq)+\ce{H3O+}(aq)⟶\ce{Al(OH)3}(s)+\ce{Na+}(aq)+\ce{2H2O}(l) \nonumber \]
El siguiente paso es eliminar el hidróxido de aluminio precipitado por filtración. Al calentar el hidróxido se produce óxido de aluminio, Al 2 O 3, que se disuelve en una mezcla fundida de criolita, Na 3 AlF 6, y fluoruro de calcio, CaF 2. La electrólisis de esta solución se realiza en una celda como la que se muestra en la Figura\(\PageIndex{2}\). La reducción de iones de aluminio al metal ocurre en el cátodo, mientras que el oxígeno, el monóxido de carbono y el dióxido de carbono se forman en el ánodo.
La Preparación del Magnesio
El magnesio es el otro metal que se aísla en grandes cantidades por electrólisis. El agua de mar, que contiene aproximadamente 0.5% de cloruro de magnesio, sirve como la principal fuente de magnesio. La adición de hidróxido de calcio al agua de mar precipita hidróxido de magnesio. La adición de ácido clorhídrico al hidróxido de magnesio, seguida de la evaporación de la solución acuosa resultante, deja cloruro de magnesio puro. La electrólisis del cloruro de magnesio fundido forma magnesio líquido y gas cloro:
\[\ce{MgCl2}(aq)+\ce{Ca(OH)2}(aq)⟶\ce{Mg(OH)2}(s)+\ce{CaCl2}(aq) \nonumber \]
\[\ce{Mg(OH)2}(s)+\ce{2HCl}(aq)⟶\ce{MgCl2}(aq)+\ce{2H2O}(l) \nonumber \]
\[\ce{MgCl2}(l)⟶\ce{Mg}(l)+\ce{Cl2}(g) \nonumber \]
Algunas instalaciones de producción se han alejado completamente de la electrólisis. En la siguiente sección, veremos cómo el proceso Pidgeon conduce a la reducción química del magnesio.
Reducción Química
Es posible aislar muchos de los metales representativos mediante reducción química utilizando otros elementos como agentes reductores. En general, la reducción química es mucho menos costosa que la electrólisis, y por esta razón, la reducción química es el método de elección para el aislamiento de estos elementos. Por ejemplo, es posible producir potasio, rubidio y cesio por reducción química, ya que es posible reducir los cloruros fundidos de estos metales con sodio metal. Esto puede ser sorprendente dado que estos metales son más reactivos que el sodio; sin embargo, los metales formados son más volátiles que el sodio y pueden destilarse para su recolección. La eliminación del vapor metálico conduce a un cambio en el equilibrio para producir más metal (a través del principio de Le Chatelier). La producción de magnesio, zinc y estaño proporciona ejemplos adicionales de reducción química.
La Preparación del Magnesio
El proceso Pidgeon implica la reacción de óxido de magnesio con silicio elemental a altas temperaturas para formar magnesio puro:
\[\ce{Si}(s)+\ce{2MgO}(s)\xrightarrow{Δ}\ce{SiO2}(s)+\ce{2Mg}(g) \nonumber \]
Si bien esta reacción es desfavorable en términos de termodinámica, la eliminación del vapor de magnesio producido aprovecha el principio de Le Chatelier para continuar con el avance de la reacción. Más del 75% de la producción mundial de magnesio, principalmente en China, proviene de este proceso.
La Preparación del Zinc
Los minerales de zinc generalmente contienen sulfuro de zinc, óxido de zinc o carbonato de zinc. Después de la separación de estos compuestos de los minerales, el calentamiento al aire convierte el mineral en óxido de zinc mediante una de las siguientes reacciones:
\[\ce{2ZnS}(s)+\ce{3O2}(g)\xrightarrow{Δ}\ce{2ZnO}(s)+\ce{2SO2}(g) \nonumber \]
\[\ce{ZnCO3}(s)\xrightarrow{Δ}\ce{ZnO}(s)+\ce{CO2}(g) \nonumber \]
El carbono, en forma de carbón, reduce el óxido de zinc para formar vapor de zinc:
\[\ce{ZnO}(s)+\ce{C}(s)⟶\ce{Zn}(g)+\ce{CO}(g) \nonumber \]
El zinc puede ser destilado (punto de ebullición 907 °C) y condensado. Este zinc contiene impurezas de cadmio (767 °C), hierro (2862 °C), plomo (1750 °C) y arsénico (613 °C). La redestilación cuidadosa produce zinc puro. El arsénico y el cadmio se destilan del zinc porque tienen puntos de ebullición más bajos. A temperaturas más altas, el zinc se destila de las otras impurezas, principalmente plomo y hierro.
La Preparación del Estaño
La fácil reducción del óxido de estaño (IV) por las brasas de una fogata explica el conocimiento del estaño en el mundo antiguo. En el proceso moderno, el tostado de minerales de estaño que contienen SnO 2 elimina contaminantes como el arsénico y el azufre como óxidos volátiles. El tratamiento del material restante con ácido clorhídrico elimina los óxidos de otros metales. El calentamiento del mineral purificado con carbono a una temperatura superior a 1000 °C produce estaño:
\[\ce{SnO2}(s)+\ce{2C}(s)\xrightarrow{Δ}\ce{Sn}(s)+\ce{2CO}(g) \nonumber \]
El estaño fundido se acumula en el fondo del horno y se extrae y se funde en bloques.
Resumen
Debido a su reactividad química, es necesario producir los metales representativos en sus formas puras por reducción a partir de compuestos naturales. La electrólisis es importante en la producción de sodio, potasio y aluminio. La reducción química es el método principal para el aislamiento de magnesio, zinc y estaño. Procedimientos similares son importantes para los otros metales representativos.
Glosario
- reducción química
- método de preparación de un metal representativo usando un agente reductor
- Celda Downs
- celda electroquímica utilizada para la preparación comercial de sodio metálico (y cloro) a partir de cloruro de sodio fundido
- Celda Hall—Héroult
- aparato de electrólisis utilizado para aislar metal de aluminio puro de una solución de alúmina en criolita fundida
- Proceso Pidgeon
- proceso de reducción química utilizado para producir magnesio a través de la reacción térmica del óxido de magnesio con silicio


