18.3: Estructura y Propiedades Generales de los Metaloides
- Page ID
- 75422
- Describir la preparación general, las propiedades y los usos de los metaloides
- Describir la preparación, propiedades y compuestos de boro y silicio
Una serie de seis elementos llamados metaloides separan los metales de los no metales en la tabla periódica. Los metaloides son boro, silicio, germanio, arsénico, antimonio y teluro. Estos elementos se ven metálicos; sin embargo, no conducen tanto la electricidad como los metales por lo que son semiconductores. Son semiconductores porque sus electrones están más unidos a sus núcleos que los de los conductores metálicos. Su comportamiento químico cae entre el de los metales y los no metales. Por ejemplo, los metaloides puros forman cristales covalentes como los no metales, pero al igual que los metales, generalmente no forman aniones monatómicos. Este comportamiento intermedio se debe en parte a sus valores intermedios de electronegatividad. En esta sección, discutiremos brevemente el comportamiento químico de los metaloides y trataremos con más detalle dos de estos elementos, el boro y el silicio.
El boro metaloide exhibe muchas similitudes con su carbono vecino y su silicio vecino diagonal. Los tres elementos forman compuestos covalentes. Sin embargo, el boro tiene una diferencia clara en que su estructura electrónica externa de 2 s 2 2 p 1 le da un electrón de valencia menos que los orbitales de valencia. Aunque el boro exhibe un estado de oxidación de 3+ en la mayoría de sus compuestos estables, esta deficiencia de electrones proporciona al boro la capacidad de formar otros estados de oxidación, a veces fraccionarios, los cuales ocurren, por ejemplo, en los hidruros de boro.
El silicio tiene la configuración electrónica de capa de valencia 3 s 2 3 p 2, y comúnmente forma estructuras tetraédricas en las que se hibrida sp 3 con un estado de oxidación formal de 4+. Las principales diferencias entre la química del carbono y el silicio son el resultado de la fuerza relativa del enlace carbono-carbono, la capacidad del carbono para formar enlaces estables consigo mismo y la presencia de los orbitales vacíos de 3 d de valencia-cubierta en el silicio. Los orbitales d vacíos de silicio y el orbital p vacío de boro permiten que los compuestos tetraédricos de silicio y los compuestos de boro planos trigonales actúen como ácidos de Lewis. El carbono, por otro lado, no tiene orbitales de concha de valencia disponibles; los compuestos de carbono tetraédricos no pueden actuar como ácidos de Lewis. El germanio es muy similar al silicio en su comportamiento químico.
El arsénico y el antimonio generalmente forman compuestos en los que se exhibe un estado de oxidación de 3+ o 5+; sin embargo, el arsénico puede formar arseniuros con un estado de oxidación de 3−. Estos elementos se empañan solo ligeramente al aire seco pero se oxidan fácilmente cuando se calientan.
El telurio se combina directamente con la mayoría de los elementos. Los compuestos de teluro más estables son los telurios, sales de Te 2- formadas con metales activos y lantánidos, y compuestos con oxígeno, flúor y cloro, en los que el teluro normalmente exhibe un estado de oxidación 2+ o 4+. Aunque se conocen compuestos de teluro (VI) (por ejemplo, TeF 6), existe una marcada resistencia a la oxidación a este estado de oxidación de grupo máximo.
Estructuras de los Metaloides
La unión covalente es la clave de las estructuras cristalinas de los metaloides. Al respecto, estos elementos se asemejan a los no metales en su comportamiento.
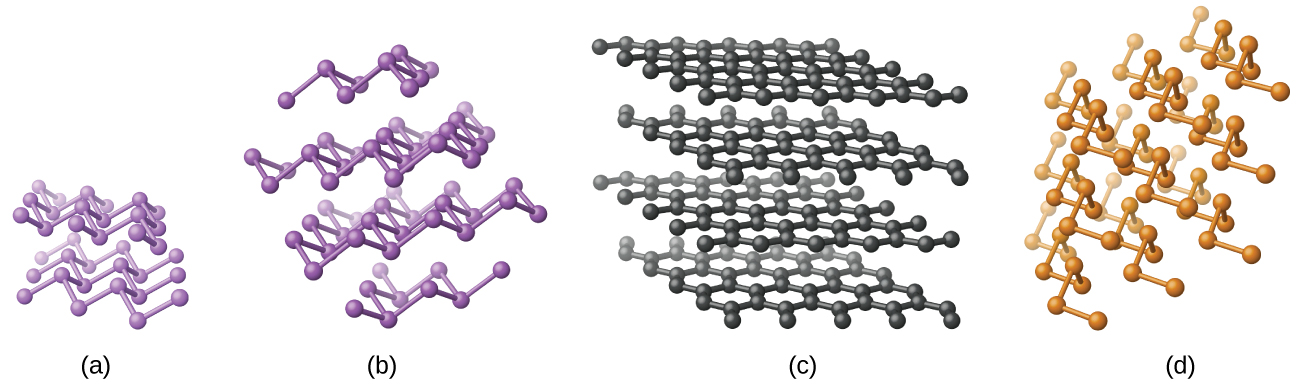
El silicio elemental, el germanio, el arsénico, el antimonio y el teluro son sólidos lustrosos de aspecto metálico. El silicio y el germanio cristalizan con una estructura de diamante. Cada átomo dentro del cristal tiene enlaces covalentes a cuatro átomos vecinos en las esquinas de un tetraedro regular. Los cristales individuales de silicio y germanio son moléculas gigantes y tridimensionales. Existen varios alótropos de arsénico siendo los más estables los de tipo capa y conteniendo láminas arrugadas de átomos de arsénico. Cada átomo de arsénico forma enlaces covalentes a otros tres átomos dentro de la lámina. La estructura cristalina del antimonio es similar a la del arsénico, ambas mostradas en la Figura\(\PageIndex{1}\). Las estructuras de arsénico y antimonio son similares a la estructura del grafito, que se trata más adelante en este capítulo. El telurio forma cristales que contienen cadenas espirales infinitas de átomos de teluro. Cada átomo en la cadena se une a otros dos átomos.
Video\(\PageIndex{1}\): Explora una estructura de cristal de diamante cúbico.
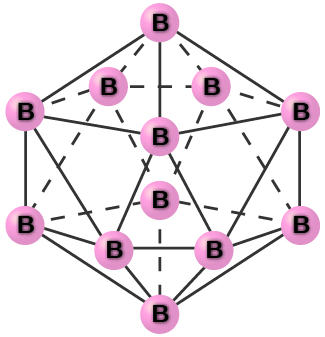
El boro cristalino puro es transparente. Los cristales consisten en icosaedros, como se muestra en la Figura\(\PageIndex{2}\), con un átomo de boro en cada esquina. En la forma más común de boro, los icosaedros se agrupan de manera similar al empaque cúbico más cercano de esferas. Todos los enlaces boro-boro dentro de cada icosaedro son idénticos y tienen aproximadamente 176pm de longitud. En las diferentes formas de boro, existen diferentes arreglos y conexiones entre los icosaedra.
El nombre silicio se deriva de la palabra latina para pedernal, silex. El silicio metaloide forma fácilmente compuestos que contienen enlaces Si-O-Si, que son de primordial importancia en el mundo mineral. Esta capacidad de unión está en contraste con el carbono no metálico, cuya capacidad para formar enlaces carbono-carbono le da una importancia primordial en el mundo vegetal y animal.
Ocurrencia, preparación y compuestos de boro y silicio
El boro constituye menos de 0.001% en peso de la corteza terrestre. En la naturaleza, solo ocurre en compuestos con oxígeno. El boro se distribuye ampliamente en regiones volcánicas como ácido bórico, B (OH) 3, y en regiones de lagos secos, incluyendo las áreas desérticas de California, como boratos y sales de oxiácidos de boro, como bórax, Na 2 B 4 O 7 10H 2 O.
El boro elemental es químicamente inerte a temperatura ambiente, reaccionando solo con flúor y oxígeno para formar trifluoruro de boro, BF 3, y óxido bórico, B 2 O 3, respectivamente. A temperaturas más altas, el boro reacciona con todos los no metales, excepto el teluro y los gases nobles, y con casi todos los metales; se oxida a B 2 O 3 cuando se calienta con ácido nítrico o sulfúrico concentrado. El boro no reacciona con los ácidos no oxidantes. Muchos compuestos de boro reaccionan fácilmente con el agua para dar ácido bórico, B (OH) 3 (a veces escrito como H 3 BO 3).
La reducción del óxido bórico con polvo de magnesio forma boro (95— 98.5% puro) como un polvo marrón amorfo:
\[\ce{B2O3}(s)+\ce{3Mg}(s)⟶\ce{2B}(s)+\ce{3MgO}(s) \nonumber \]
Una sustancia amorfa es un material que parece ser un sólido, pero que no tiene un orden de largo alcance como un verdadero sólido. El tratamiento con ácido clorhídrico elimina el óxido de magnesio. La purificación adicional del boro comienza con la conversión del boro impuro en tricloruro de boro. El siguiente paso es calentar una mezcla de tricloruro de boro e hidrógeno:
\[\ce{2BCl3}(g)+\ce{3H2}(g)\:\mathrm{\xrightarrow{1500\:°C}}\:\ce{2B}(s)+\ce{6HCl}(g) \hspace{20px} ΔH°=\mathrm{253.7\: kJ} \nonumber \]
El silicio constituye casi una cuarta parte de la masa de la corteza terrestre, el segundo en abundancia solo después del oxígeno. La corteza está compuesta casi en su totalidad por minerales en los que los átomos de silicio están en el centro del tetraedro de silicio-oxígeno, los cuales se conectan de diversas maneras para producir, entre otras cosas, cadenas, capas y estructuras tridimensionales. Estos minerales constituyen la mayor parte de las rocas, suelos y arcillas más comunes. Además, materiales como ladrillos, cerámicas y vidrios contienen compuestos de silicio.
Es posible producir silicio mediante la reducción a alta temperatura del dióxido de silicio con agentes reductores fuertes, como el carbono y el magnesio:
\[\ce{SiO2}(s)+\ce{2C}(s)\xrightarrow{Δ}\ce{Si}(s)+\ce{2CO}(g) \nonumber \]
\[\ce{SiO2}(s)+\ce{2Mg}(s)\xrightarrow{Δ}\ce{Si}(s)+\ce{2MgO}(s) \nonumber \]
El silicio extremadamente puro es necesario para la fabricación de dispositivos electrónicos semiconductores. Este proceso comienza con la conversión de silicio impuro en tetrahaluros de silicio, o silano (SiH 4), seguido de descomposición a altas temperaturas. El refinamiento de zona, ilustrado en la Figura\(\PageIndex{3}\), completa la purificación. En este método, una varilla de silicio es calentada en un extremo por una fuente de calor que produce una sección transversal delgada de silicio fundido. Al bajar lentamente la varilla a través de la fuente de calor, se mueve la zona fundida de un extremo a otro de la varilla. A medida que esta delgada región fundida se mueve, las impurezas en el silicio se disuelven en el silicio líquido y se mueven con la región fundida. En última instancia, las impurezas se mueven hacia un extremo de la varilla, que luego se corta.
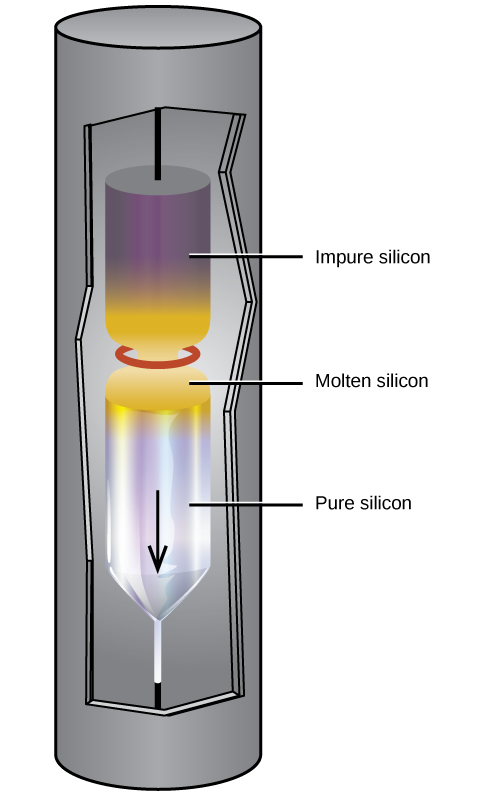
Este silicio altamente purificado, que no contiene más de una parte de impureza por millón de partes de silicio, es el elemento más importante en la industria informática. El silicio puro es necesario en dispositivos electrónicos semiconductores como transistores, chips de computadora y células solares.
Al igual que algunos metales, la pasivación del silicio ocurre debido a la formación de una película muy delgada de óxido (principalmente dióxido de silicio, SiO 2). El dióxido de silicio es soluble en base acuosa caliente; así, bases fuertes destruyen la pasivación. La eliminación de la capa de pasivación permite que la base disuelva el silicio, formando gas hidrógeno y aniones silicato. Por ejemplo:
\[\ce{Si}(s)+\ce{4OH-}(aq)⟶\ce{SiO4^4-}(aq)+\ce{2H2}(g) \nonumber \]
El silicio reacciona con halógenos a altas temperaturas, formando tetrahaluros volátiles, como SiF 4.
A diferencia del carbono, el silicio no forma fácilmente dobles o triples enlaces. Los compuestos de silicio de fórmula general SiX 4, donde X es un grupo altamente electronegativo, pueden actuar como ácidos de Lewis para formar silicio de seis coordenadas. Por ejemplo, el tetrafluoruro de silicio, SiF 4, reacciona con fluoruro de sodio para producir Na 2 [SiF 6], que contiene el\(\ce{[SiF6]^2-}\) ion octaédrico en el que el silicio es sp 3 d 2 hibridado:
\[\ce{2NaF}(s)+\ce{SiF4}(g)⟶\ce{Na2SiF6}(s) \nonumber \]
El antimonio reacciona fácilmente con cantidades estequiométricas de flúor, cloro, bromo o yodo, produciendo trihaluros o, con exceso de flúor o cloro, formando los pentahalidos SbF 5 y SbCl 5. Dependiendo de la estequiometría, forma sulfuro de antimonio (III), Sb 2 S 3, o sulfuro de antimonio (V) cuando se calienta con azufre. Como era de esperar, la naturaleza metálica del elemento es mayor que la del arsénico, que se encuentra inmediatamente por encima de él en el grupo 15.
Boro y Halouros de Silicio
Los trihaluros de boro —BF 3, BCl3, BBr 3 y BI 3 — se pueden preparar mediante la reacción directa de los elementos. Estas moléculas no polares contienen boro con hibridación sp 2 y una geometría molecular plana trigonal. Los compuestos de fluoruro y cloruro son gases incoloros, el bromuro es un líquido y el yoduro es un sólido cristalino blanco.
Excepto el trifluoruro de boro, los trihaluros de boro se hidrolizan fácilmente en agua para formar ácido bórico y el ácido hidrohalogenado correspondiente. El tricloruro de boro reacciona de acuerdo con la ecuación:
\[\ce{BCl3}(g)+\ce{3H2O}(l)⟶\ce{B(OH)3}(aq)+\ce{3HCl}(aq) \nonumber \]
El trifluoruro de boro reacciona con el ácido fluorhídrico, para producir una solución de ácido fluorobórico, HBF 4:
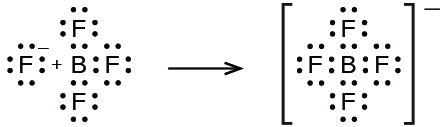
\[\ce{BF3}(aq)+\ce{HF}(aq)+\ce{H2O}(l)⟶\ce{H3O+}(aq)+\ce{BF4-}(aq) \nonumber \]
En esta reacción, la molécula BF 3 actúa como el ácido de Lewis (aceptor de pares de electrones) y acepta un par de electrones de un ion fluoruro:
Se han preparado todos los tetrahaluros de silicio, SiX 4. El tetracloruro de silicio se puede preparar mediante cloración directa a temperaturas elevadas o calentando dióxido de silicio con cloro y carbono:
\[\ce{SiO2}(s)+\ce{2C}(s)+\ce{2Cl2}(g)\xrightarrow{Δ}\ce{SiCl4}(g)+\ce{2CO}(g) \nonumber \]
El tetracloruro de silicio es una molécula tetraédrica covalente, que es un líquido incoloro, no polar, de bajo punto de ebullición (57 °C). Es posible preparar tetrafluoruro de silicio mediante la reacción del dióxido de silicio con ácido fluorhídrico:
\[\ce{SiO2}(s)+\ce{4HF}(g)⟶\ce{SiF4}(g)+\ce{2H2O}(l) \hspace{20px} ΔH°=\mathrm{−191.2\: kJ} \nonumber \]
El ácido fluorhídrico es el único ácido común que reaccionará con dióxido de silicio o silicatos. Esta reacción ocurre porque el enlace silicio-flúor es el único enlace que forma el silicio que es más fuerte que el enlace silicio-oxígeno. Por esta razón, es posible almacenar todos los ácidos comunes, distintos del ácido fluorhídrico, en recipientes de vidrio.
A excepción del tetrafluoruro de silicio, los haluros de silicio son extremadamente sensibles al agua. Al exponerse al agua, SiCl 4 reacciona rápidamente con grupos hidróxido, reemplazando los cuatro átomos de cloro para producir ácido ortosilícico inestable, Si (OH) 4 o H 4 SiO 4, que lentamente se descompone en SiO 2.
Boro y óxidos de silicio y derivados
El boro se quema a 700 °C en oxígeno, formando óxido bórico, B 2 O 3. El óxido bórico es necesario para la producción de vidrio borosilicato resistente al calor, como el que se muestra en la Figura\(\PageIndex{4}\) y ciertos vidrios ópticos. El óxido bórico se disuelve en agua caliente para formar ácido bórico, B (OH) 3:
\[\ce{B2O3}(s)+\ce{3H2O}(l)⟶\ce{2B(OH)3}(aq) \nonumber \]

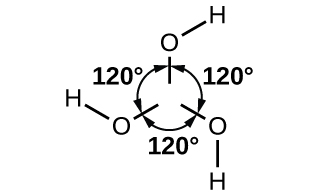
El átomo de boro en B (OH) 3 es sp 2 hibridado y se localiza en el centro de un triángulo equilátero con átomos de oxígeno en las esquinas. En el sólido B (OH) 3, los enlaces de hidrógeno mantienen unidas estas unidades triangulares. El ácido bórico, mostrado en la Figura\(\PageIndex{5}\), es un ácido muy débil que no actúa como donante de protones sino como un ácido de Lewis, aceptando un par no compartido de electrones de la base Lewis OH −:
\[\ce{B(OH)3}(aq)+\ce{2H2O}(l)⇌\ce{B(OH)4-}(aq)+\ce{H3O+}(aq) \hspace{20px} K_\ce{a}=5.8×10^{−10} \nonumber \]
Calentar el ácido bórico a 100 °C hace que las moléculas de agua se separen entre pares de grupos —OH adyacentes para formar ácido metabórico, HBO 2. A aproximadamente 150 °C, se forman enlaces B-O-B adicionales, conectando los grupos BO 3 junto con átomos de oxígeno compartidos para formar ácido tetrabórico, H 2 B 4 O 7. La pérdida completa de agua, a temperaturas aún más altas, resulta en óxido bórico.
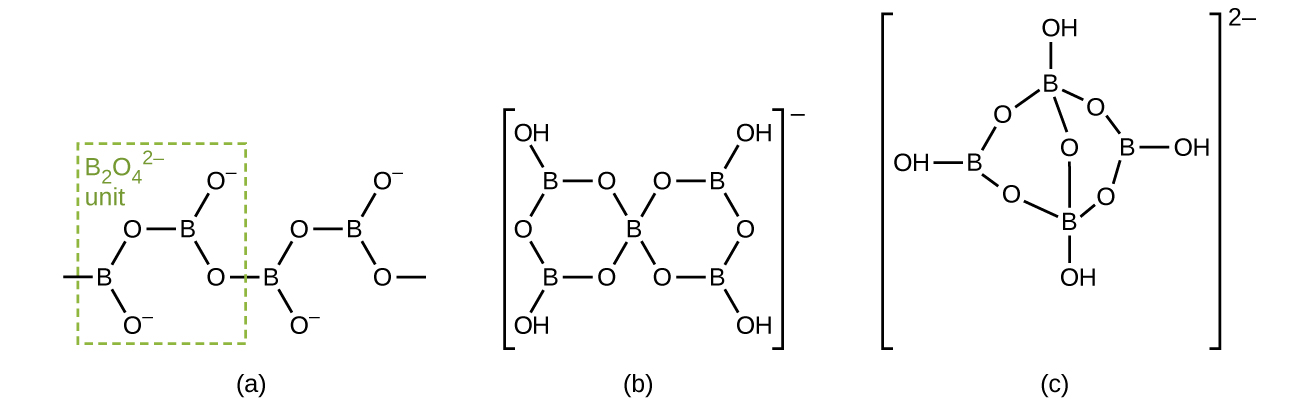
Los boratos son sales de los oxiácidos del boro. Los boratos resultan de las reacciones de una base con un oxiácido o de la fusión de ácido bórico u óxido bórico con un óxido o hidróxido metálico. Los aniones borato van desde el simple\(\ce{BO3^3-}\) ion plano trigonal hasta especies complejas que contienen cadenas y anillos de tres y cuatro átomos de boro coordinados. Las estructuras de los aniones encontradas en CaB 2 O 4, K [B 5 O 6 (OH) 4] 2H 2 O (comúnmente escrito KB 5 O 8 4H 2 O) y Na 2 [B 4 O 5 (OH) 4] 8H 2 O (comúnmente escrito Na 2 B 4 O 7 10H 2 O) se muestran en la Figura\(\PageIndex{6}\). Comercialmente, el borato más importante es el bórax, Na 2 [B 4 O 5 (OH) 4] 8H 2 O, que es un componente importante de algunos detergentes para ropa. La mayor parte del suministro de bórax proviene directamente de lagos secos, como el lago Searles en California, o se prepara a partir de kernite, Na 2 B 4 O 7 4H 2 O.
El dióxido de silicio, sílice, se presenta tanto en forma cristalina como amorfa. La forma cristalina habitual del dióxido de silicio es el cuarzo, un sólido duro, quebradizo, transparente e incoloro. Es útil de muchas maneras: para decoraciones arquitectónicas, joyas semipreciosas y control de frecuencia en transmisores de radio. La sílice toma muchas formas cristalinas, o polimorfos, en la naturaleza. Las trazas de Fe 3+ en cuarzo le dan a la amatista su característico color púrpura. El término cuarzo también se usa para artículos como tubos y lentes que se fabrican a partir de sílice amorfa. El ópalo es una forma natural de sílice amorfa.
El contraste en estructura y propiedades físicas entre el dióxido de silicio y el dióxido de carbono es interesante, como se ilustra en la Figura\(\PageIndex{7}\). El dióxido de carbono sólido (hielo seco) contiene moléculas individuales de CO 2 con cada uno de los dos átomos de oxígeno unidos al átomo de carbono por dobles enlaces. Las fuerzas intermoleculares muy débiles mantienen unidas las moléculas en el cristal. La volatilidad del hielo seco refleja estas fuerzas débiles entre las moléculas. Por el contrario, el dióxido de silicio es un sólido de red covalente. En el dióxido de silicio, cada átomo de silicio se une a cuatro átomos de oxígeno mediante enlaces simples dirigidos hacia las esquinas de un tetraedro regular, y los tetraedros SiO 4 comparten átomos de oxígeno. Esta disposición da una red tridimensional, continua, de silicio-oxígeno. Un cristal de cuarzo es una macromolécula de dióxido de silicio. La diferencia entre estos dos compuestos es la capacidad de los 14 elementos del grupo para formar enlaces π fuertes. Los elementos del segundo periodo, como el carbono, forman enlaces π muy fuertes, razón por la cual el dióxido de carbono forma moléculas pequeñas con dobles enlaces fuertes. Los elementos por debajo del segundo período, como el silicio, no forman enlaces π tan fácilmente como los elementos del segundo período, y cuando se forman, los enlaces π son más débiles que los formados por elementos del segundo período. Por esta razón, el dióxido de silicio no contiene enlaces π sino solo enlaces σ.

A 1600 °C, el cuarzo se funde para producir un líquido viscoso. Cuando el líquido se enfría, no cristaliza fácilmente sino que generalmente se superenfría y forma un vidrio, también llamado sílice. Los tetraedros SiO 4 en sílice vítrea tienen una disposición aleatoria característica de los líquidos superenfriados, y el vidrio tiene algunas propiedades muy útiles. La sílice es altamente transparente tanto a la luz visible como a la luz ultravioleta. Por ello, es importante en la fabricación de lámparas que den radiación rica en luz ultravioleta y en ciertos instrumentos ópticos que operan con luz ultravioleta. El coeficiente de expansión del vidrio de sílice es muy bajo; por lo tanto, los cambios rápidos de temperatura no hacen que se rompa. CorningWare y otros utensilios de cocina de cerámica contienen sílice amorfa.
Los silicatos son sales que contienen aniones compuestos por silicio y oxígeno. En casi todos los silicatos, los átomos de silicio hibridados sp 3 se encuentran en los centros de los tetraedros con oxígeno en las esquinas. Existe una variación en la relación silicio-oxígeno que ocurre porque los tetraedros silicio-oxígeno pueden existir como unidades discretas e independientes o pueden compartir átomos de oxígeno en las esquinas de diversas maneras. Además, la presencia de una variedad de cationes da lugar a la gran cantidad de minerales de silicato. Muchas cerámicas están compuestas por silicatos. Al incluir pequeñas cantidades de otros compuestos, es posible modificar las propiedades físicas de los materiales de silicato para producir cerámicas con características útiles.
Resumen
Los elementos boro, silicio, germanio, arsénico, antimonio y teluro separan los metales de los no metales en la tabla periódica. Estos elementos, llamados metaloides o a veces semimetales, exhiben propiedades características tanto de metales como de no metales. Las estructuras de estos elementos son similares en muchos aspectos a las de los no metales, pero los elementos son semiconductores eléctricos.
Glosario
- amorfo
- material sólido como un vidrio que no tiene un componente repetitivo regular a su estructura tridimensional; un sólido pero no un cristal
- borato
- compuesto que contiene enlaces boro-oxígeno, típicamente con grupos o cadenas como parte de la estructura química
- polimorfo
- variación en la estructura cristalina que da como resultado diferentes propiedades físicas para el compuesto resultante
- silicato
- compuesto que contiene enlaces silicio-oxígeno, con tetraedros de silicato conectados en anillos, láminas o redes tridimensionales, dependiendo de los demás elementos involucrados en la formación de los compuestos


