18.9: Ocurrencia, preparación y compuestos de oxígeno
- Page ID
- 75478
- Describir las propiedades, preparación y compuestos del oxígeno
- Describir la preparación, propiedades y usos de algunos óxidos metálicos representativos, peróxidos e hidróxidos
El oxígeno es el elemento más abundante en la corteza terrestre. La superficie terrestre está compuesta por la corteza, la atmósfera y la hidrosfera. Alrededor del 50% de la masa de la corteza terrestre consiste en oxígeno (combinado con otros elementos, principalmente silicio). El oxígeno se presenta como moléculas de O 2 y, en cierta medida, como moléculas de O 3 (ozono) en el aire. Forma alrededor del 20% de la masa del aire. Alrededor del 89% del agua en masa consiste en oxígeno combinado. En combinación con carbono, hidrógeno y nitrógeno, el oxígeno es una gran parte de las plantas y los animales.
El oxígeno es un gas incoloro, inodoro e insípido a temperaturas normales. Es un poco más denso que el aire. Aunque solo es ligeramente soluble en agua (49 mL de gas se disuelve en 1 L en STP), la solubilidad del oxígeno es muy importante para la vida acuática.
La mayor parte del oxígeno aislado comercialmente proviene del aire y el resto de la electrólisis del agua. La separación del oxígeno del aire comienza con el enfriamiento y la compresión del aire hasta que se licúa. A medida que el aire líquido se calienta, el oxígeno con su punto de ebullición más alto (90 K) se separa del nitrógeno, el cual tiene un punto de ebullición más bajo (77 K). Es posible separar los demás componentes del aire al mismo tiempo en función de las diferencias en sus puntos de ebullición.
El oxígeno es esencial en procesos de combustión como la quema de combustibles. Las plantas y los animales utilizan el oxígeno del aire en la respiración. La administración de aire enriquecido con oxígeno es una práctica médica importante cuando un paciente recibe un suministro inadecuado de oxígeno por choque, neumonía o alguna otra enfermedad.
La industria química emplea oxígeno para oxidar muchas sustancias. Una cantidad significativa de oxígeno producido comercialmente es importante en la eliminación de carbono del hierro durante la producción de acero. También son necesarias grandes cantidades de oxígeno puro en la fabricación de metales y en el corte y soldadura de metales con sopletes de oxihidrógeno y oxiacetileno.
El oxígeno líquido es importante para la industria espacial. Es un agente oxidante en motores de cohetes. También es la fuente de oxígeno gaseoso para soporte vital en el espacio.
Como sabemos, el oxígeno es muy importante para la vida. La energía requerida para el mantenimiento de las funciones normales del cuerpo en seres humanos y en otros organismos proviene de la lenta oxidación de compuestos químicos. El oxígeno es el agente oxidante final en estas reacciones. En los humanos, el oxígeno pasa de los pulmones a la sangre, donde se combina con la hemoglobina, produciendo oxihemoglobina. De esta forma, la sangre transporta el oxígeno a los tejidos, donde se transfiere a los tejidos. Los productos definitivos son el dióxido de carbono y el agua. La sangre transporta el dióxido de carbono a través de las venas hasta los pulmones, donde la sangre libera el dióxido de carbono y recoge otro suministro de oxígeno. La digestión y asimilación de los alimentos regeneran los materiales consumidos por la oxidación en el cuerpo; la energía liberada es la misma que si el alimento se quemara fuera del cuerpo.
Las plantas verdes reponen continuamente el oxígeno en la atmósfera mediante un proceso llamado fotosíntesis. Los productos de la fotosíntesis pueden variar, pero, en general, el proceso convierte el dióxido de carbono y el agua en glucosa (un azúcar) y oxígeno utilizando la energía de la luz:
\ [\ begin {alignat} {3}
&\ ce {6CO2} (g)\ :+\: &&\ ce {6H2O} (l)
\:\ mathrm {\ underset {luz} {\ xrightarrow {clorofila}}}\:
&&\ ce {C6H12O6} (aq)\ :+\: &&\ ce {6O2} (g)\\
&\ mathrm {carbono\\ dióxido} &&\ ce {agua} &&\ ce { glucosa} &&\ ce {oxígeno}
\ end {alignat}\ nonumber\]
Así, el oxígeno que se convirtió en dióxido de carbono y agua por los procesos metabólicos en plantas y animales regresa a la atmósfera por fotosíntesis.
Cuando se hace pasar oxígeno seco entre dos placas cargadas eléctricamente, se forma ozono (O 3, ilustrado en la Figura\(\PageIndex{1}\)), un alótropo de oxígeno que posee un olor distintivo. La formación de ozono a partir del oxígeno es una reacción endotérmica, en la que la energía proviene de una descarga eléctrica, calor o luz ultravioleta:
\[\ce{3O2}(g)\xrightarrow{\ce{electric\: discharge}}\ce{2O3}(g) \hspace{20px} ΔH°=\mathrm{287\: kJ} \nonumber \]
El fuerte olor asociado con chispas de equipos eléctricos se debe, en parte, al ozono.
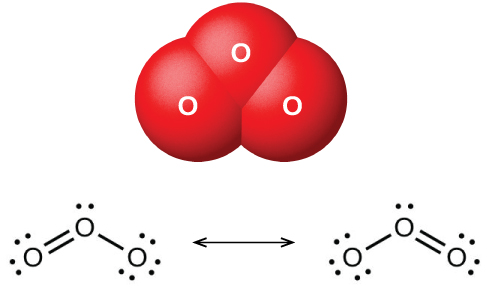
El ozono se forma naturalmente en la atmósfera superior por la acción de la luz ultravioleta del sol sobre el oxígeno allí. La mayor parte del ozono atmosférico ocurre en la estratosfera, una capa de la atmósfera que se extiende de aproximadamente 10 a 50 kilómetros por encima de la superficie terrestre. Este ozono actúa como barrera a la luz ultravioleta dañina del sol al absorberla a través de una reacción de descomposición química:
\[\ce{O3}(g)\xrightarrow{\ce{ultraviolet\: light}}\ce{O}(g)+\ce{O2}(g) \nonumber \]
Los átomos de oxígeno reactivos se recombinan con oxígeno molecular para completar el ciclo del ozono. La presencia de ozono estratosférico disminuye la frecuencia de cáncer de piel y otros efectos dañinos de la radiación ultravioleta. Se ha demostrado claramente que los clorofluorocarbonos, los CFC (conocidos comercialmente como Freones), que estuvieron presentes como propelentes de aerosol en latas de aerosol y como refrigerantes, causaron el agotamiento del ozono en la estratosfera. Esto ocurrió porque la luz ultravioleta también hace que los CFC se descompongan, produciendo cloro atómico. Los átomos de cloro reaccionan con las moléculas de ozono, lo que resulta en una eliminación neta de moléculas de O 3 de la estratosfera. Este proceso se explora en detalle en nuestra cobertura de cinética química. Hay un esfuerzo mundial para reducir la cantidad de CFC utilizados comercialmente, y el agujero de ozono ya está comenzando a disminuir de tamaño a medida que disminuyen las concentraciones atmosféricas de cloro atómico. Si bien el ozono en la estratosfera nos ayuda a protegernos, el ozono en la troposfera es un problema. Este ozono es un componente tóxico del smog fotoquímico.
Los usos del ozono dependen de su reactividad con otras sustancias. Se puede utilizar como agente blanqueador para aceites, ceras, telas y almidón: Oxida los compuestos coloreados en estas sustancias a compuestos incoloros. Es una alternativa al cloro como desinfectante para el agua.
Reacciones
El oxígeno elemental es un agente oxidante fuerte. Reacciona con la mayoría de los otros elementos y muchos compuestos.
Reacción con elementos
El oxígeno reacciona directamente a temperatura ambiente o a temperaturas elevadas con todos los demás elementos excepto los gases nobles, los halógenos y pocos metales de transición de segunda y tercera fila de baja reactividad (aquellos con mayores potenciales de reducción que el cobre). La roya es un ejemplo de la reacción del oxígeno con el hierro. Los metales más activos forman peróxidos o superóxidos. Los metales menos activos y los no metales dan óxidos. Dos ejemplos de estas reacciones son:
\[\ce{2Mg}(s)+\ce{O2}(g)⟶\ce{2MgO}(s) \nonumber \]
\[\ce{P4}(s)+\ce{5O2}(g)⟶\ce{P4O10}(s) \nonumber \]
Los óxidos de halógenos, al menos uno de los gases nobles, y metales con mayores potenciales de reducción que el cobre no se forman por la acción directa de los elementos con el oxígeno.
Reacción con compuestos
El oxígeno elemental también reacciona con algunos compuestos. Si es posible oxidar alguno de los elementos en un compuesto dado, puede ocurrir una oxidación adicional por oxígeno. Por ejemplo, sulfuro de hidrógeno, H 2 S, contiene azufre con un estado de oxidación de 2−. Debido a que el azufre no presenta su estado máximo de oxidación, esperaríamos que H 2 S reaccione con el oxígeno. Lo hace, dando agua y dióxido de azufre. La reacción es:
\[\ce{2H2S}(g)+\ce{3O2}(g)⟶\ce{2H2O}(l)+\ce{2SO2}(g) \nonumber \]
También es posible oxidar óxidos como CO y P 4 O 6 que contienen un elemento con un estado de oxidación inferior. La facilidad con la que el oxígeno elemental recoge electrones se ve reflejada por la dificultad de eliminar electrones del oxígeno en la mayoría de los óxidos. De los elementos, solo el flúor muy reactivo puede oxidar óxidos para formar gas oxígeno.
Óxidos, peróxidos e hidróxidos
Los compuestos de los metales representativos con oxígeno se dividen en tres categorías: (1) óxidos, que contienen iones óxido, O 2−; (2) peróxidos, que contienen iones peróxidos\(\ce{O2^2-}\),, con enlaces sencillos covalentes oxígeno-oxígeno y un número muy limitado de superóxidos, que contiene iones superóxido\(\ce{O2-}\),, con enlaces covalentes oxígeno-oxígeno que tienen un orden de enlace de\(\frac{3}{2}\), Además, existen (3) hidróxidos, que contienen iones hidróxido, OH −. Todos los metales representativos forman óxidos. Algunos de los metales del grupo 2 también forman peróxidos, MO 2, y los metales del grupo 1 también forman peróxidos, M 2 O 2, y superóxidos, MO 2.
Óxidos
Es posible producir los óxidos de los metales más representativos calentando los hidróxidos correspondientes (formando el óxido y el agua gaseosa) o carbonatos (formando el óxido y CO 2 gaseoso). Las ecuaciones, por ejemplo, las reacciones son:
\[\ce{2Al(OH)3}(s)\xrightarrow{Δ}\ce{Al2O3}(s)+\ce{3H2O}(g) \nonumber \]
\[\ce{CaCO3}(s)\xrightarrow{Δ}\ce{CaO}(s)+\ce{CO2}(g) \nonumber \]
Sin embargo, las sales de metales alcalinos generalmente son muy estables y no se descomponen fácilmente cuando se calientan. Los óxidos de metales alcalinos son el resultado de las reacciones de oxidación-reducción creadas por el calentamiento de nitratos o hidróxidos con los metales. Las ecuaciones para las reacciones de muestra son:
\[\ce{2KNO3}(s)+\ce{10K}(s)\xrightarrow{Δ}\ce{6K2O}(s)+\ce{N2}(g) \nonumber \]
\[\ce{2LiOH}(s)+\ce{2Li}(s)\xrightarrow{Δ}\ce{2Li2O}(s)+\ce{H2}(g) \nonumber \]
Con excepción del óxido de mercurio (II), es posible producir los óxidos de los metales de los grupos 2—15 quemando el metal correspondiente en el aire. El miembro más pesado de cada grupo, el miembro para el que el efecto de par inerte es más pronunciado, forma un óxido en el que el estado de oxidación del ion metálico es dos menos que el estado de oxidación del grupo (efecto de par inerte). Así, Tl 2 O, PbO y Bi 2 O 3 se forman cuando se quema talio, plomo y bismuto, respectivamente. Los óxidos de los miembros más ligeros de cada grupo presentan el estado de oxidación del grupo. Por ejemplo, el SnO 2 se forma a partir de la quema de estaño. El óxido de mercurio (II), HgO, se forma lentamente cuando el mercurio se calienta por debajo de 500 °C; se descompone a temperaturas más altas.
Quemar los miembros de los grupos 1 y 2 al aire no es una forma adecuada de formar los óxidos de estos elementos. Estos metales son lo suficientemente reactivos para combinarse con el nitrógeno en el aire, por lo que forman mezclas de óxidos y nitruros iónicos. Varios también forman peróxidos o superóxidos cuando se calientan al aire.
Todos los óxidos iónicos contienen el ion óxido, un aceptor de iones de hidrógeno muy potente. A excepción del óxido de aluminio muy insoluble, Al 2 O 3, estaño (IV), SnO 2 y plomo (IV), PbO 2, los óxidos de los metales representativos reaccionan con ácidos para formar sales. Algunas ecuaciones para estas reacciones son:
\[\ce{Na2O}+\ce{2HNO3}(aq)⟶\ce{2NaNO3}(aq)+\ce{H2O}(l) \nonumber \]
\[\ce{CaO}(s)+\ce{2HCL}(aq)⟶\ce{CaCl2}(aq)+\ce{H2O}(l) \nonumber \]
\[\ce{SnO}(s)+\ce{2HClO4}(aq)⟶\ce{Sn(ClO4)2}(aq)+\ce{H2O}(l) \nonumber \]
Los óxidos de los metales de los grupos 1 y 2 y del óxido de talio (I) reaccionan con el agua y forman hidróxidos. Ejemplos de tales reacciones son:
\[\ce{Na2O}(s)+\ce{H2O}(l)⟶\ce{NaOH}(aq) \nonumber \]
\[\ce{CaO}(s)+\ce{H2O}(l)⟶\ce{Ca(OH)2}(aq) \nonumber \]
\[\ce{Tl2O}(s)+\ce{H2O}(aq)⟶\ce{2TlOH}(aq) \nonumber \]
Los óxidos de los metales alcalinos tienen poca utilidad industrial, a diferencia del óxido de magnesio, óxido de calcio y óxido de aluminio. El óxido de magnesio es importante en la fabricación de ladrillos refractarios, crisoles, revestimientos de hornos y aislamiento térmico, aplicaciones que requieren estabilidad química y térmica. El óxido de calcio, a veces llamado cal viva o cal en el mercado industrial, es muy reactivo y sus principales usos reflejan su reactividad. El óxido de calcio puro emite una luz blanca intensa cuando se calienta a una temperatura alta (como se ilustra en la Figura\(\PageIndex{2}\):). Bloques de óxido de calcio calentados por llamas de gas eran las luces del escenario en los cines antes de que la electricidad estuviera disponible. Esta es la fuente de la frase “en el centro de atención”.
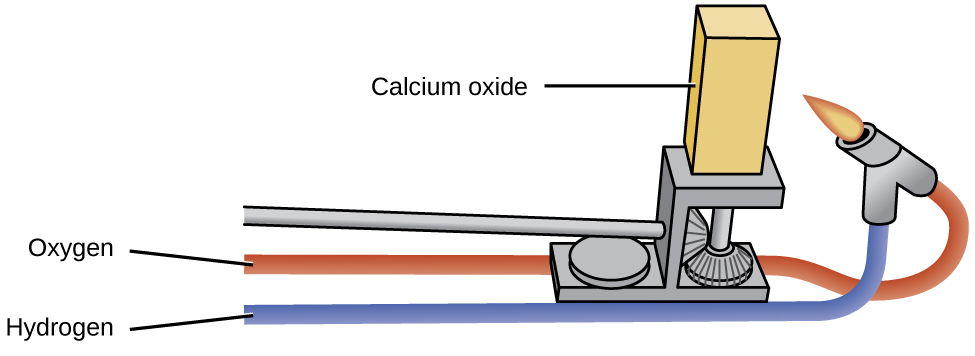
El óxido de calcio y el hidróxido de calcio son bases económicas que se utilizan ampliamente en el procesamiento químico, aunque la mayoría de los productos útiles preparados a partir de ellos no contienen calcio. El óxido de calcio, CaO, se fabrica calentando carbonato de calcio, CaCo 3, que está disponible amplia y económicamente como cáscaras de piedra caliza o ostras:
\[\ce{CaCO3}(s)⟶\ce{CaO}(s)+\ce{CO2}(g) \nonumber \]
Aunque esta reacción de descomposición es reversible, es posible obtener un rendimiento del 100% de CaO permitiendo que el CO 2 escape. Es posible preparar hidróxido de calcio mediante la reacción ácido-base familiar de un óxido metálico soluble con agua:
\[\ce{CaO}(s)+\ce{H2O}(l)⟶\ce{Ca(OH)2}(s) \nonumber \]
Tanto el CaO como el Ca (OH) 2 son útiles como bases; aceptan protones y neutralizan los ácidos.
La alúmina (Al 2 O 3) se presenta en la naturaleza como el mineral corindón, una sustancia muy dura utilizada como abrasivo para la molienda y pulido. El corindón es importante para el comercio de joyas como el rubí y el zafiro. El color del rubí se debe a la presencia de una pequeña cantidad de cromo; otras impurezas producen la amplia variedad de colores posibles para los zafiros. Los rubíes y zafiros artificiales ahora se fabrican fundiendo óxido de aluminio (punto de fusión = 2050 °C) con pequeñas cantidades de óxidos para producir los colores deseados y enfriando la masa fundida de tal manera que se produzcan cristales grandes. Los láseres de rubí utilizan cristales de rubí sintéticos.
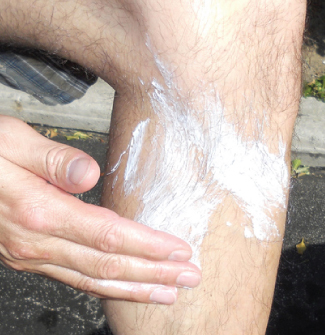
El óxido de zinc, ZnO, fue un pigmento de pintura blanca útil; sin embargo, los contaminantes tienden a decolorar el compuesto. El compuesto también es importante en la fabricación de llantas de automóviles y otros artículos de caucho, y en la preparación de ungüentos medicinales. Por ejemplo, los protectores solares a base de óxido de zinc, como se muestra en la Figura\(\PageIndex{3}\), ayudan a prevenir las quemaduras solares. El óxido de zinc en estos protectores solares está presente en forma de granos muy pequeños conocidos como nanopartículas. El dióxido de plomo es un componente de las baterías de almacenamiento de plomo cargadas. El plomo (IV) tiende a volver al ion plomo (II) más estable al ganar dos electrones, por lo que el dióxido de plomo es un poderoso agente oxidante.
Peróxidos y Superóxidos
Los peróxidos y superóxidos son oxidantes fuertes y son importantes en los procesos químicos. El peróxido de hidrógeno, H 2 O 2, preparado a partir de peróxidos metálicos, es un importante blanqueador y desinfectante. Los peróxidos y superóxidos se forman cuando los óxidos metálicos o metálicos de los grupos 1 y 2 reaccionan con oxígeno puro a temperaturas elevadas. El peróxido de sodio y los peróxidos de calcio, estroncio y bario se forman calentando el metal u óxido metálico correspondiente en oxígeno puro:
\[\ce{2Na}(s)+\ce{O2}(g)\xrightarrow{Δ}\ce{Na2O2}(s) \nonumber \]
\[\ce{2Na2O}(s)+\ce{O2}(g)\xrightarrow{Δ}\ce{2Na2O2}(s) \nonumber \]
\[\ce{2SrO}(s)+\ce{O2}(g)\xrightarrow{Δ}\ce{2SrO2}(s) \nonumber \]
Los peróxidos de potasio, rubidio y cesio se pueden preparar calentando el metal o su óxido en una cantidad cuidadosamente controlada de oxígeno:
\[\ce{2K}(s)+\ce{O2}(g)⟶\ce{K2O2}(s) \hspace{20px} \mathrm{(2\:mol\: K\: per\: mol\: O_2)} \nonumber \]
Con un exceso de oxígeno, se forman los superóxidos KO 2, RbO 2 y CsO 2. Por ejemplo:
\[\ce{K}(s)+\ce{O2}(g)⟶\ce{KO2}(s) \hspace{20px} \ce{(1\: mol\: K\: per\: mol\: O_2)} \nonumber \]
La estabilidad de los peróxidos y superóxidos de los metales alcalinos aumenta a medida que aumenta el tamaño del catión.
Hidróxidos
Los hidróxidos son compuestos que contienen el ion OH −. Es posible preparar estos compuestos mediante dos tipos generales de reacciones. Los hidróxidos metálicos solubles se pueden producir mediante la reacción del metal u óxido metálico con agua. Los hidróxidos metálicos insolubles se forman cuando una solución de una sal soluble del metal se combina con una solución que contiene iones hidróxido.
A excepción del berilio y el magnesio, los metales de los grupos 1 y 2 reaccionan con el agua para formar hidróxidos e hidrógeno gaseoso. Ejemplos de tales reacciones incluyen:
\[\ce{2Li}(s)+\ce{2H2O}(l)⟶\ce{2LiOH}(aq)+\ce{H2}(g) \nonumber \]
\[\ce{Ca}(s)+\ce{2H2O}(l)⟶\ce{Ca(OH)2}(aq)+\ce{H2}(g) \nonumber \]
Sin embargo, estas reacciones pueden ser violentas y peligrosas; por lo tanto, es preferible producir hidróxidos metálicos solubles por la reacción del óxido respectivo con agua:
\[\ce{Li2O}(s)+\ce{H2O}(l)⟶\ce{2LiOH}(aq) \nonumber \]
\[\ce{CaO}(s)+\ce{H2O}(l)⟶\ce{Ca(OH)2}(aq) \nonumber \]
La mayoría de los óxidos metálicos son anhidridos de base. Esto es obvio para los óxidos solubles porque forman hidróxidos metálicos. La mayoría de los otros óxidos metálicos son insolubles y no forman hidróxidos en el agua; sin embargo, siguen siendo anhídrido base porque reaccionarán con los ácidos.
Es posible preparar los hidróxidos insolubles de berilio, magnesio y otros metales representativos mediante la adición de hidróxido de sodio a una solución de una sal del metal respectivo. Las ecuaciones iónicas netas para las reacciones que involucran una sal de magnesio, una sal de aluminio y una sal de zinc son:
\[\ce{Mg^2+}(aq)+\ce{2OH-}(aq)⟶\ce{Mg(OH)2}(s) \nonumber \]
\[\ce{Al^3+}(aq)+\ce{3OH-}(aq)⟶\ce{Al(OH)3}(s) \nonumber \]
\[\ce{Zn^2+}(aq)+\ce{2OH-}(aq)⟶\ce{Zn(OH)2}(s) \nonumber \]
Se debe evitar un exceso de hidróxido al preparar hidróxidos de aluminio, galio, zinc y estaño (II), o los hidróxidos se disolverán con la formación de los iones complejos correspondientes:\(\ce{Al(OH)4-}\),\(\ce{Ga(OH)4-}\),\(\ce{Zn(OH)4^2-}\), y\(\ce{Sn(OH)3-}\) (Figura\(\PageIndex{4}\)). El aspecto importante de los iones complejos para este capítulo es que se forman por una reacción ácido-base de Lewis siendo el metal el ácido de Lewis.

La industria utiliza grandes cantidades de hidróxido de sodio como una base barata y fuerte. El cloruro de sodio es el material de partida para la producción de NaOH porque el NaCl es un material de partida menos costoso que el óxido. El hidróxido de sodio se encuentra entre los 10 mejores químicos en producción en Estados Unidos, y esta producción fue casi en su totalidad por electrólisis de soluciones de cloruro de sodio. Este proceso es el proceso cloro-álcali, y es el método principal para producir cloro.
El hidróxido de sodio es un compuesto iónico y se funde sin descomposición. Es muy soluble en agua, desprendiendo una gran cantidad de calor y formando soluciones muy básicas: 40 gramos de hidróxido de sodio se disuelven en solo 60 gramos de agua a 25 °C El hidróxido de sodio se emplea en la producción de otros compuestos de sodio y se utiliza para neutralizar soluciones ácidas durante la producción de otros productos químicos como petroquímicos y polímeros.
Muchas de las aplicaciones de los hidróxidos son para la neutralización de ácidos (como el antiácido que se muestra en la Figura\(\PageIndex{5}\)) y para la preparación de óxidos por descomposición térmica. Una suspensión acuosa de hidróxido de magnesio constituye la leche antiácida de magnesia. Debido a su fácil disponibilidad (a partir de la reacción del agua con óxido de calcio preparado por la descomposición de la piedra caliza, CaCo 3), bajo costo y actividad, el hidróxido de calcio se usa ampliamente en aplicaciones comerciales que necesitan una base barata y fuerte. La reacción de hidróxidos con ácidos apropiados también se utiliza para preparar sales.

El Proceso Clor-Alcali
Aunque son muy diferentes químicamente, existe un vínculo entre el cloro y el hidróxido de sodio porque existe un importante proceso electroquímico que produce los dos químicos simultáneamente. El proceso conocido como el proceso cloro-álcali, utiliza cloruro de sodio, que ocurre en grandes depósitos en muchas partes del mundo. Este es un proceso electroquímico para oxidar el ion cloruro a cloro y generar hidróxido de sodio.
El paso de una corriente continua de electricidad a través de una solución de NaCl hace que los iones cloruro migren al electrodo positivo donde se produce la oxidación a cloro gaseoso cuando el ion cede un electrón al electrodo:
\[\ce{2Cl-}(aq)⟶\ce{Cl2}(g)+\ce{2e-} \hspace{20px} \textrm{(at the positive electrode)} \nonumber \]
Los electrones producidos viajan a través del circuito eléctrico exterior hasta el electrodo negativo. Aunque los iones de sodio positivos migran hacia este electrodo negativo, el sodio metálico no se forma porque los iones de sodio son demasiado difíciles de reducir en las condiciones utilizadas. (Recordemos que el sodio metálico es lo suficientemente activo como para reaccionar con el agua y por lo tanto, incluso si se produce, reaccionaría inmediatamente con el agua para producir iones de sodio nuevamente). En cambio, las moléculas de agua recogen electrones del electrodo y se someten a reducción para formar gas hidrógeno e iones hidróxido:
\[\ce{2H2O}(l)+\ce{2e-}\textrm{ (from the negative electrode)}⟶\ce{H2}(g)+\ce{2OH-}(aq) \nonumber \]
El resultado global es la conversión de la solución acuosa de NaCl en una solución acuosa de NaOH, Cl 2 gaseoso y H 2 gaseoso:
\[\ce{2Na+}(aq)+\ce{2Cl-}(aq)+\ce{2H2O}(l)\xrightarrow{\ce{electrolysis}}\ce{2Na+}(aq)+\ce{2OH-}(aq)+\ce{Cl2}(g)+\ce{H2}(g) \nonumber \]
Compuestos de oxígeno no metálicos
La mayoría de los no metales reaccionan con el oxígeno para formar óxidos no metálicos. Dependiendo de los estados de oxidación disponibles para el elemento, se pueden formar una variedad de óxidos. El flúor se combinará con el oxígeno para formar fluoruros como el OF 2, donde el oxígeno tiene un estado 2+-oxidación.
Compuestos de oxígeno de azufre
Los dos óxidos comunes de azufre son dióxido de azufre, SO 2, y trióxido de azufre, SO 3. El olor a azufre ardiente proviene del dióxido de azufre. El dióxido de azufre, mostrado en la Figura\(\PageIndex{6}\), se presenta en los gases volcánicos y en la atmósfera cerca de plantas industriales que queman combustibles que contienen compuestos de azufre.
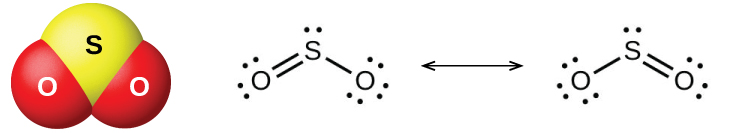
La producción comercial de dióxido de azufre es a partir de la quema de azufre o de la tostación de minerales de sulfuro como ZnS, FeS 2 y Cu 2 S en el aire. (El tostado, que forma el óxido metálico, es el primer paso en la separación de muchos metales de sus minerales). Un método conveniente para preparar dióxido de azufre en el laboratorio es por la acción de un ácido fuerte sobre sales de sulfito que contienen el\(\ce{SO3^2-}\) ion o sales de sulfito de hidrógeno que contienen\(\ce{HSO3-}\). El ácido sulfuroso, H 2 SO 3, se forma primero, pero rápidamente se descompone en dióxido de azufre y agua. El dióxido de azufre también se forma cuando muchos agentes reductores reaccionan con ácido sulfúrico concentrado y caliente. El trióxido de azufre se forma lentamente cuando se calienta el dióxido de azufre y el oxígeno juntos, y la reacción es exotérmica:
\[\ce{2SO2}(g)+\ce{O2}(g)⟶\ce{2SO3}(g) \hspace{20px} ΔH°=\mathrm{−197.8\:kJ} \nonumber \]
El dióxido de azufre es un gas a temperatura ambiente, y la molécula SO 2 está doblada. El trióxido de azufre se funde a 17 °C y hierve a 43 °C; en estado vapor, sus moléculas son unidades individuales de SO 3 (Figura\(\PageIndex{7}\)), pero en estado sólido, SO 3 existe en varias formas poliméricas.
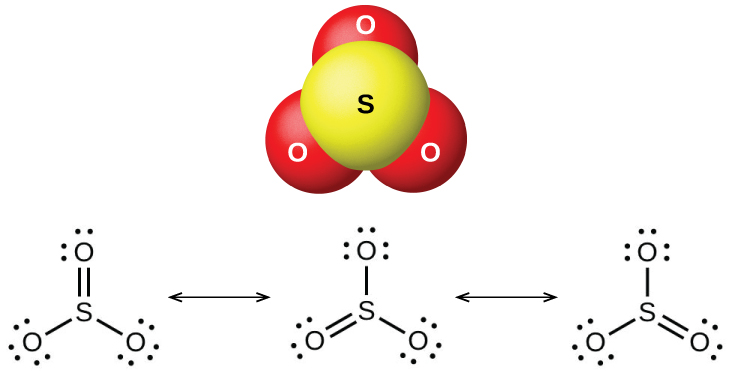
Los óxidos de azufre reaccionan como ácidos de Lewis con muchos óxidos e hidróxidos en reacciones ácido-base de Lewis, con la formación de sulfitos o sulfitos de hidrógeno, y sulfatos o sulfatos de hidrógeno, respectivamente.
Compuestos de Oxígeno Halógeno
Los halógenos no reaccionan directamente con el oxígeno, pero es posible preparar compuestos binarios de oxígeno-halógeno por las reacciones de los halógenos con compuestos que contienen oxígeno. Los compuestos de oxígeno con cloro, bromo y yodo son óxidos porque el oxígeno es el elemento más electronegativo en estos compuestos. Por otro lado, los compuestos de flúor con oxígeno son fluoruros porque el flúor es el elemento más electronegativo.
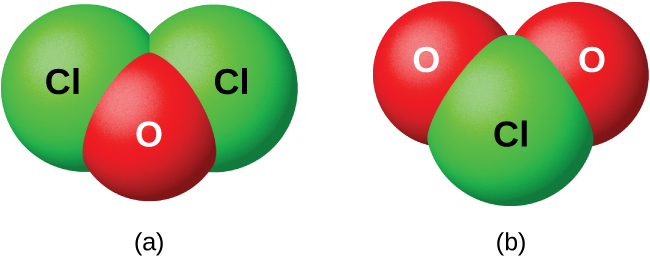
Como clase, los óxidos son extremadamente reactivos e inestables, y su química tiene poca importancia práctica. El óxido de diclorina, formalmente llamado monóxido de diclorina, y el dióxido de cloro, ambos mostrados en la Figura\(\PageIndex{8}\), son los únicos compuestos comercialmente importantes. Son importantes como agentes blanqueadores (para uso con pulpa y harina) y para el tratamiento del agua.
Oxiácidos no metálicos y sus sales
Los óxidos no metálicos forman ácidos cuando se les permite reaccionar con el agua; estos son anhidridos ácidos. Los oxianiones resultantes pueden formar sales con diversos iones metálicos.
Oxiácidos y Sales de Nitrógeno
El pentaóxido de nitrógeno, N 2 O 5 y NO 2 reaccionan con agua para formar ácido nítrico, HNO 3. Los alquimistas, ya en el siglo VIII, conocían al ácido nítrico (mostrado en la Figura\(\PageIndex{9}\)) como aqua fortis (que significa “agua fuerte”). El ácido fue útil en la separación del oro de la plata porque disuelve la plata pero no el oro. Las trazas de ácido nítrico ocurren en la atmósfera después de tormentas eléctricas, y sus sales están ampliamente distribuidas en la naturaleza. Hay tremendos depósitos de salitre chileno, NaNano 3, en la región desértica cerca del límite de Chile y Perú. El salitre de Bengala, KNO 3, ocurre en la India y en otros países del Lejano Oriente.
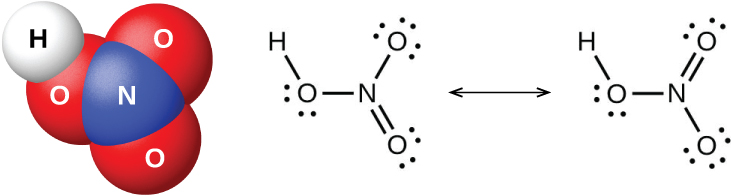
En el laboratorio, es posible producir ácido nítrico calentando una sal de nitrato (como nitrato de sodio o potasio) con ácido sulfúrico concentrado:
\[\ce{NaNO3}(s)+\ce{H2SO4}(l)\xrightarrow{Δ}\ce{NaHSO4}(s)+\ce{HNO3}(g) \nonumber \]
El proceso O stwald es el método comercial para producir ácido nítrico. Este proceso implica la oxidación de amoníaco a óxido nítrico, NO; oxidación del óxido nítrico a dióxido de nitrógeno, NO 2; y posterior oxidación e hidratación del dióxido de nitrógeno para formar ácido nítrico:
\[\ce{4NH3}(g)+\ce{5O2}(g)⟶\ce{4NO}(g)+\ce{6H2O}(g) \nonumber \]
\[\ce{2NO}(g)+\ce{O2}(g)⟶\ce{2NO2}(g) \nonumber \]
\[\ce{3NO2}(g)+\ce{H2O}(l)⟶\ce{2HNO3}(aq)+\ce{NO}(g) \nonumber \]
o
\[\ce{4NO2}(g)+\ce{O2}(g)+\ce{2H2O}(g)⟶\ce{4HNO3}(l) \nonumber \]
El ácido nítrico puro es un líquido incoloro. Sin embargo, a menudo es de color amarillo o marrón porque se forma NO 2 a medida que el ácido se descompone. El ácido nítrico es estable en solución acuosa; las soluciones que contienen 68% del ácido son ácido nítrico concentrado comercialmente disponible. Es tanto un agente oxidante fuerte como un ácido fuerte.
La acción del ácido nítrico sobre un metal rara vez produce H 2 (por reducción de H +) en cantidades más que pequeñas. En cambio, se produce la reducción de nitrógeno. Los productos formados dependen de la concentración del ácido, la actividad del metal y la temperatura. Normalmente, se forma una mezcla de nitratos, óxidos de nitrógeno y diversos productos de reducción. Los metales menos activos como el cobre, la plata y el plomo reducen el ácido nítrico concentrado principalmente a dióxido de nitrógeno. La reacción de ácido nítrico diluido con cobre produce NO. En cada caso, las sales de nitrato de los metales cristalizan tras la evaporación de las soluciones resultantes.
Los elementos no metálicos, como azufre, carbono, yodo y fósforo, sufren oxidación por ácido nítrico concentrado a sus óxidos u oxiácidos, con la formación de NO 2:
\[\ce{S}(s)+\ce{6HNO3}(aq)⟶\ce{H2SO4}(aq)+\ce{6NO2}(g)+\ce{2H2O}(l) \nonumber \]
\[\ce{C}(s)+\ce{4HNO3}(aq)⟶\ce{CO2}(g)+\ce{4NO2}(g)+\ce{2H2O}(l) \nonumber \]
El ácido nítrico oxida muchos compuestos; por ejemplo, el ácido nítrico concentrado oxida fácilmente el ácido clorhídrico a cloro y dióxido de cloro. Una mezcla de una parte de ácido nítrico concentrado y tres partes de ácido clorhídrico concentrado (llamado aqua regia, que significa agua real) reacciona vigorosamente con los metales. Esta mezcla es particularmente útil para disolver oro, platino y otros metales que son más difíciles de oxidar que el hidrógeno. Una ecuación simplificada para representar la acción del aqua regia sobre el oro es:
\[\ce{Au}(s)+\ce{4HCl}(aq)+\ce{3HNO3}(aq)⟶\ce{HAuCl4}(aq)+\ce{3NO2}(g)+\ce{3H2O}(l) \nonumber \]
Video\(\PageIndex{1}\): Aunque el oro generalmente no es reactivo, puedes ver un video de la compleja mezcla de compuestos presentes en el aqua regia disolviéndolo en solución.
Los nitratos, sales de ácido nítrico, se forman cuando los metales, óxidos, hidróxidos o carbonatos reaccionan con el ácido nítrico. La mayoría de los nitratos son solubles en agua; de hecho, uno de los usos significativos del ácido nítrico es preparar nitratos metálicos solubles.
El ácido nítrico encuentra un uso extensivo en el laboratorio y en las industrias químicas como ácido fuerte y agente oxidante fuerte. Es importante en la fabricación de explosivos, tintes, plásticos y drogas. Las sales de ácido nítrico (nitratos) son valiosas como fertilizantes. La pólvora es una mezcla de nitrato de potasio, azufre y carbón vegetal.
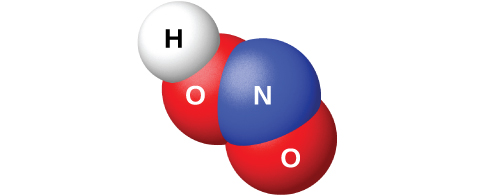
La reacción de N 2 O 3 con agua da una solución azul pálido de ácido nitroso, HNO 2. Sin embargo, el HNO 2 (mostrado en la Figura\(\PageIndex{10}\)) es más fácil de preparar mediante la adición de un ácido a una solución de nitrito; el ácido nitroso es un ácido débil, por lo que el ion nitrito es básico en solución acuosa:
\[\ce{NO2-}(aq)+\ce{H3O+}(aq)⟶\ce{HNO2}(aq)+\ce{H2O}(l) \nonumber \]
El ácido nitroso es muy inestable y solo existe en solución. Se desproporciona lentamente a temperatura ambiente (rápidamente cuando se calienta) en ácido nítrico y óxido nítrico. El ácido nitroso es un agente oxidante activo con agentes reductores fuertes, y los agentes oxidantes fuertes lo oxidan a ácido nítrico.
El nitrito de sodio, NaNO 2, es un aditivo para carnes como hot dogs y fiambres. El ion nitrito tiene dos funciones. Limita el crecimiento de bacterias que pueden causar intoxicación alimentaria, y prolonga la retención de la carne de su color rojo. La adición de nitrito de sodio a los productos cárnicos es polémica porque el ácido nitroso reacciona con ciertos compuestos orgánicos para formar una clase de compuestos conocidos como nitrosaminas. Las nitrosaminas producen cáncer en animales de laboratorio. Esto ha llevado a la FDA a limitar la cantidad de NaNO 2 en los alimentos.
Los nitritos son mucho más estables que el ácido, pero los nitritos, como los nitratos, pueden explotar. Los nitritos, al igual que los nitratos, también son solubles en agua (el AgnO 2 es solo ligeramente soluble).
Oxiácidos y sales de fósforo
El ácido ortofosfórico puro, H 3 PO 4 (Figura\(\PageIndex{11}\)), forma cristales delicuescentes incoloros que se funden a 42 °C. El nombre común de este compuesto es ácido fosfórico, y está disponible comercialmente como una solución viscosa al 82% conocida como ácido fosfórico almibarado. Un uso del ácido fosfórico es como aditivo para muchos refrescos.
Un método comercial para preparar ácido ortofosfórico es tratar roca de fosfato de calcio con ácido sulfúrico concentrado:
\[\ce{Ca3(PO4)2}(s)+\ce{3H2SO4}(aq)⟶\ce{2H3PO4}(aq)+\ce{3CaSO4}(s) \nonumber \]
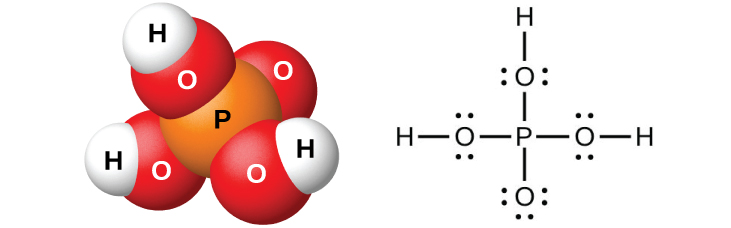
La dilución de los productos con agua, seguida de filtración para eliminar el sulfato de calcio, da una solución ácida diluida contaminada con dihidrogenofosfato de calcio, Ca (H 2 PO 4) 2, y otros compuestos asociados con roca de fosfato de calcio. Es posible preparar ácido ortofosfórico puro disolviendo P 4 O 10 en agua.
La acción del agua sobre P 4 O 6, PCl 3, PBr 3 o PI 3 forma ácido fosforoso, H 3 PO 3 (mostrado en la Figura\(\PageIndex{12}\)). El mejor método para preparar ácido fosforoso puro es hidrolizando tricloruro de fósforo:
\[\ce{PCl3}(l)+\ce{3H2O}(l)⟶\ce{H3PO3}(aq)+\ce{3HCl}(g) \nonumber \]
El calentamiento de la solución resultante expulsa el cloruro de hidrógeno y conduce a la evaporación del agua. Cuando se evapore suficiente agua, aparecerán cristales blancos de ácido fosforoso al enfriarse. Los cristales son delicuescentes, muy solubles en agua, y tienen un olor como el del ajo. El sólido se funde a 70.1 °C y se descompone a aproximadamente 200 °C por desproporción en fosfina y ácido ortofosfórico:
\[\ce{4H3PO3}(l)⟶\ce{PH3}(g)+\ce{3H3PO4}(l) \nonumber \]
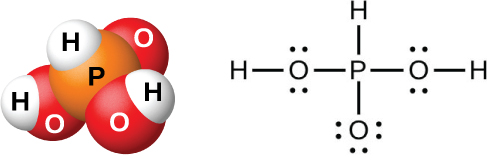
El ácido fosforoso forma solo dos series de sales, las cuales contienen el ion dihidrógeno fosfito\(\ce{H2PO3-}\), o el ion hidrógeno fosfato\(\ce{HPO3^2-}\), respectivamente. No es posible reemplazar el tercer átomo de hidrógeno porque no es muy ácido, ya que no es fácil ionizar el enlace P-H.
Oxiácidos y Sales de Azufre
La preparación del ácido sulfúrico, H 2 SO 4 (Figura\(\PageIndex{13}\)), comienza con la oxidación del azufre a trióxido de azufre y luego la conversión del trióxido en ácido sulfúrico. El ácido sulfúrico puro es un líquido oleoso incoloro que se congela a 10.5 °C y se fuma cuando se calienta porque el ácido se descompone en agua y trióxido de azufre. El proceso de calentamiento provoca la pérdida de más trióxido de azufre que agua, hasta alcanzar una concentración de 98.33% de ácido. El ácido de esta concentración hierve a 338 °C sin cambio adicional en la concentración (una solución de ebullición constante) y se concentra comercialmente H 2 SO 4. La cantidad de ácido sulfúrico utilizada en la industria supera a la de cualquier otro compuesto manufacturado.
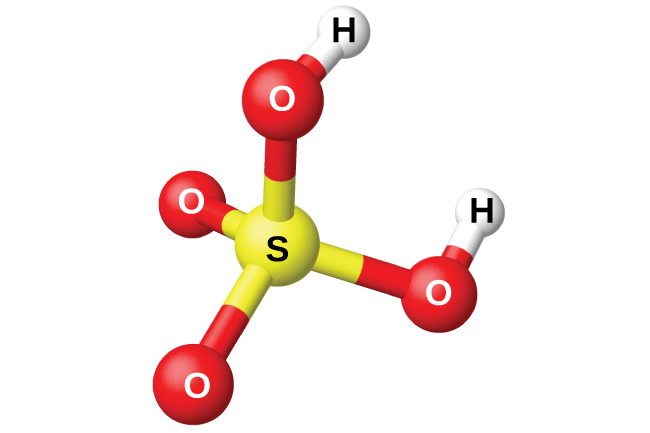
La fuerte afinidad del ácido sulfúrico concentrado por el agua lo convierte en un buen agente deshidratante. Es posible secar gases y líquidos inmiscibles que no reaccionan con el ácido haciéndolos pasar a través del ácido.
El ácido sulfúrico es un ácido diprótico fuerte que se ioniza en dos etapas. En solución acuosa, la primera etapa es esencialmente completa. La ionización secundaria no es casi tan completa, y\(\ce{HSO4-}\) es un ácido moderadamente fuerte (aproximadamente 25% ionizado en solución de una\(\ce{HSO4-}\) sal: K a = 1.2 × 10 −2).
Al ser un ácido diprótico, el ácido sulfúrico forma tanto sulfatos, como Na 2 SO 4, como sulfatos de hidrógeno, como NaHSO 4. La mayoría de los sulfatos son solubles en agua; sin embargo, los sulfatos de bario, estroncio, calcio y plomo son solo ligeramente solubles en agua.
Entre los sulfatos importantes se encuentran Na 2 SO 4 10H 2 O y las sales de Epsom, MgSO 4 7H 2 O. Debido a que el\(\ce{HSO4-}\) ion es un ácido, los sulfatos de hidrógeno, como NaHSO 4, presentan un comportamiento ácido, y este compuesto es el ingrediente principal en algunos limpiadores domésticos.
El ácido sulfúrico concentrado caliente es un agente oxidante. Dependiendo de su concentración, la temperatura y la fuerza del agente reductor, el ácido sulfúrico oxida muchos compuestos y, en el proceso, sufre reducción a SO 2,\(\ce{HSO3-}\),\(\ce{SO3^2-}\), S, H 2 S, o S2 −.
El dióxido de azufre se disuelve en agua para formar una solución de ácido sulfuroso, como se esperaba para el óxido de un no metal. El ácido sulfuroso es inestable y no es posible aislar H 2 SO 3 anhidro. El calentamiento de una solución de ácido sulfuroso expulsa el dióxido de azufre. Al igual que otros ácidos dipróticos, el ácido sulfuroso se ioniza en dos etapas: El ion sulfito de hidrógeno,\(\ce{HSO3-}\), y el ion sulfito,\(\ce{SO3^2-}\), se forman. El ácido sulfuroso es un ácido moderadamente fuerte. La ionización es de aproximadamente 25% en la primera etapa, pero es mucho menor en la segunda (K a1 = 1.2 × 10 −2 y K a2 = 6.2 × 10 −8).
Para preparar sales sólidas de sulfito e hidrógeno sulfito, es necesario agregar una cantidad estequiométrica de una base a una solución de ácido sulfuroso y luego evaporar el agua. Estas sales también se forman a partir de la reacción del SO 2 con óxidos e hidróxidos. El hidrógeno sulfito de sodio sólido para calentar forma sulfito de sodio, dióxido de azufre y agua:
\[\ce{2NaHSO3}(s)\xrightarrow{Δ}\ce{Na2SO3}(s)+\ce{SO2}(g)+\ce{H2O}(l) \nonumber \]
Los agentes oxidantes fuertes pueden oxidar el ácido sulfuroso. El oxígeno en el aire lo oxida lentamente al ácido sulfúrico más estable:
\[\ce{2H2SO3}(aq)+\ce{O2}(g)+\ce{2H2O}(l)\xrightarrow{Δ}\ce{2H3O+}(aq)+\ce{2HSO4-}(aq) \nonumber \]
Las soluciones de sulfitos también son muy susceptibles a la oxidación al aire para producir sulfatos. Así, las soluciones de sulfitos siempre contienen sulfatos después de la exposición al aire.
Oxiácidos Halógenos y Sus Sales
Los compuestos HXO, HXO 2, HXO 3 y HXO 4, donde X representa Cl, Br o I, son los ácidos hipohaloso, haloso, halico y perhálico, respectivamente. Las fuerzas de estos ácidos aumentan de los ácidos hipohalosos, que son ácidos muy débiles, a los ácidos perhálicos, que son muy fuertes. En la tabla se\(\PageIndex{1}\) enumeran los ácidos conocidos y, cuando se conocen, sus valores de pK a se dan entre paréntesis.
| Nombre | Flúor | Cloro | Bromo | Yodo |
|---|---|---|---|---|
| hipohalosa | HOF | HOCl (7.5) | HOBr (8.7) | HOI (11) |
| halous | HClO 2 (2.0) | |||
| halic | HClO 3 | HBRo 3 | HIO 3 (0.8) | |
| perhalic | HClO 4 | HBRo 4 | HIO 4 (1.6) | |
| paraperhalic | H 5 IO 6 (1.6) |
El único oxiácido conocido de flúor es el ácido hipofluoroso muy inestable, HOF, que se prepara mediante la reacción del flúor gaseoso con hielo:
\[\ce{F2}(g)+\ce{H2O}(s)⟶\ce{HOF}(g)+\ce{HF}(g) \nonumber \]
El compuesto es muy inestable y se descompone por encima de −40 °C, este compuesto no se ioniza en agua y no se conocen sales. No se sabe si el nombre ácido hipofluoroso es incluso apropiado para HOF; un nombre más apropiado podría ser hipofluorita de hidrógeno.
Las reacciones de cloro y bromo con agua son análogas a las del flúor con hielo, pero estas reacciones no van a completarse, y resultan mezclas del halógeno y los respectivos ácidos hipohalosos e hidrohalos. Aparte del HOF, los ácidos hipohalosos solo existen en solución. Los ácidos hipohalosos son todos ácidos muy débiles; sin embargo, el HOCl es un ácido más fuerte que el HOBr, que a su vez es más fuerte que el HOI.
La adición de base a las soluciones de los ácidos hipohalosos produce soluciones de sales que contienen los iones básicos del hipoalito, OX −. Es posible aislar estas sales como sólidos. Todos los hipohalitos son inestables con respecto a la desproporción en solución, pero la reacción es lenta para el hipoclorito. Hipobromito e hipoyodito desproporcionados rápidamente, incluso en el frío:
\[\ce{3XO-}(aq)⟶\ce{2X-}(aq)+\ce{XO3-}(aq) \nonumber \]
El hipoclorito de sodio es un blanqueador económico (Clorox) y germicida. La preparación comercial implica la electrólisis de soluciones frías, diluidas y acuosas de cloruro de sodio en condiciones donde el cloro resultante y el ion hidróxido pueden reaccionar. La reacción neta es:
\[\ce{Cl-}(aq)+\ce{H2O}(l)\xrightarrow{\ce{electrical\: energy}}\ce{ClO-}(aq)+\ce{H2}(g) \nonumber \]
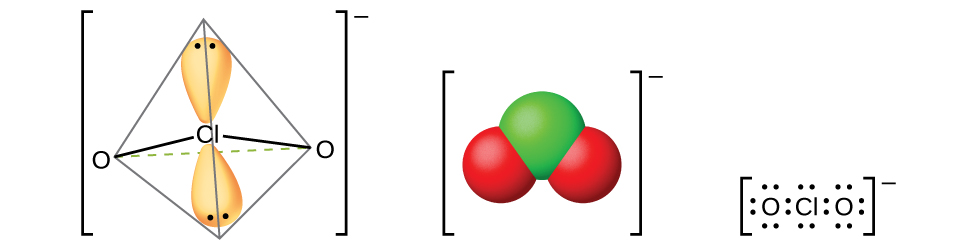
El único ácido haloso definitivamente conocido es el ácido cloroso, HClO 2, obtenido por la reacción de clorito de bario con ácido sulfúrico diluido:
\[\ce{Ba(ClO2)2}(aq)+\ce{H2SO4}(aq)⟶\ce{BaSO4}(s)+\ce{2HClO2}(aq) \nonumber \]
Filtrando el sulfato de bario insoluble deja una solución de HClO 2. El ácido cloroso no es estable; se descompone lentamente en solución para producir dióxido de cloro, ácido clorhídrico y agua. El ácido cloroso reacciona con bases para dar sales que contienen el ión clorito (mostrado en la Figura\(\PageIndex{14}\)). El clorito de sodio encuentra una amplia aplicación en el blanqueo del papel debido a que es un agente oxidante fuerte y no daña el papel.
El ácido clórico, HClO 3 y el ácido bromico, HBrO 3, son estables solo en solución. La reacción de yodo con ácido nítrico concentrado produce ácido yódico blanco estable, HIO 3:
\[\ce{I2}(s)+\ce{10HNO3}(aq)⟶\ce{2HIO3}(s)+\ce{10NO2}(g)+\ce{4H2O}(l) \nonumber \]
Es posible obtener los ácidos halícos más ligeros a partir de sus sales de bario por reacción con ácido sulfúrico diluido. La reacción es análoga a la utilizada para preparar ácido cloroso. Todos los ácidos halílicos son ácidos fuertes y agentes oxidantes muy activos. Los ácidos reaccionan con bases para formar sales que contienen iones clorato (mostrado en la Figura\(\PageIndex{15}\)). Otro método preparativo es la oxidación electroquímica de una solución caliente de un haluro metálico para formar los cloratos metálicos apropiados. El clorato de sodio es un herbicida; el clorato de potasio se utiliza como agente oxidante.
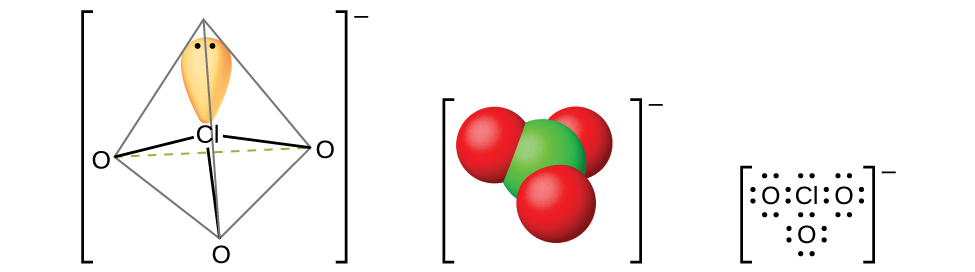
El ácido perclórico, HClO 4, se forma cuando se trata un perclorato, como el perclorato de potasio, con ácido sulfúrico a presión reducida. El HClO 4 se puede destilar de la mezcla:
\[\ce{KClO4}(s)+\ce{H2SO4}(aq)⟶\ce{HClO4}(g)+\ce{KHSO4}(s) \nonumber \]
Las soluciones acuosas diluidas de ácido perclórico son bastante estables térmicamente, pero las concentraciones superiores al 60% son inestables y peligrosas. El ácido perclórico y sus sales son poderosos agentes oxidantes, ya que el cloro muy electronegativo es más estable en un estado de oxidación menor que 7+. Se han producido explosiones graves al calentar soluciones concentradas con sustancias fácilmente oxidadas. Sin embargo, sus reacciones como agente oxidante son lentas cuando el ácido perclórico está frío y diluido. El ácido se encuentra entre los más fuertes de todos los ácidos. La mayoría de las sales que contienen el ion perclorato (Figura\(\PageIndex{16}\)) son solubles. Es posible prepararlos a partir de reacciones de bases con ácido perclórico y, comercialmente, por la electrólisis de soluciones calientes de sus cloruros.
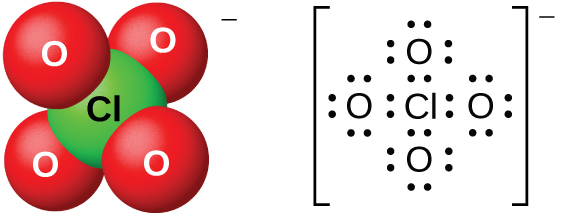
Las sales de perbromato son difíciles de preparar, y las mejores síntesis actualmente implican la oxidación de bromatos en solución básica con gas flúor seguido de acidificación. Hay pocos, si los hay, usos comerciales de este ácido o sus sales.
Hay varios ácidos diferentes que contienen yodo en el estado de oxidación 7+; incluyen ácido metaperiódico, HIO 4, y ácido paraperiódico, H 5 IO 6. Estos ácidos son agentes oxidantes fuertes y reaccionan con bases para formar las sales apropiadas.
Resumen
El oxígeno es uno de los elementos más reactivos. Esta reactividad, aunada a su abundancia, hace que la química del oxígeno sea muy rica y bien entendida. Los compuestos de los metales representativos con oxígeno existen en tres categorías (1) óxidos, (2) peróxidos y superóxidos, y (3) hidróxidos. El calentamiento de los hidróxidos, nitratos o carbonatos correspondientes es el método más común para producir óxidos. Calentar el metal u óxido metálico en oxígeno puede conducir a la formación de peróxidos y superóxidos. Los óxidos solubles se disuelven en agua para formar soluciones de hidróxidos. La mayoría de los óxidos metálicos son anhidridos de base y reaccionan con ácidos. Los hidróxidos de los metales representativos reaccionan con ácidos en reacciones ácido-base para formar sales y agua. Los hidróxidos tienen muchos usos comerciales.
Todos los no metales excepto el flúor forman múltiples óxidos. Casi todos los óxidos no metálicos son anhídrido de ácido. La acidez de los oxiácidos requiere que los átomos de hidrógeno se unan a los átomos de oxígeno en la molécula en lugar de al otro átomo no metálico. Generalmente, la fuerza del oxiácido aumenta con el número de átomos de oxígeno unidos al átomo no metálico y no a un hidrógeno.
Glosario
- Anhídrido base
- óxido metálico que se comporta como base hacia los ácidos
- proceso de cloro-álcali
- proceso de electrólisis para la síntesis de cloro e hidróxido de sodio
- sulfato de hidrógeno
- \(\ce{HSO4-}\)ion
- sulfito de hidrógeno
- \(\ce{HSO3-}\)ion
- hidróxido
- compuesto de un metal con el ion hidróxido OH - o el grupo -OH
- nitrato
- \(\ce{NO3-}\)ion; sal de ácido nítrico
- Proceso de Ostwald
- proceso industrial utilizado para convertir amoníaco en ácido nítrico
- óxido
- compuesto binario de oxígeno con otro elemento o grupo, que típicamente contiene iones O 2− o el grupo —O— o =O
- ozono
- alótropo de oxígeno; O 3
- peróxido
- molécula que contiene dos átomos de oxígeno unidos entre sí o como anión,\(\ce{O2^2-}\)
- fotosíntesis
- proceso mediante el cual la energía de la luz promueve la reacción del agua y el dióxido de carbono para formar carbohidratos y oxígeno; esto permite que los organismos fotosintéticos almacenen energía
- sulfato
- \(\ce{SO4^2-}\)ion
- sulfito
- \(\ce{SO3^2-}\)ion
- superóxido
- óxido que contiene el anión\(\ce{O2-}\)


