20.3: Aldehídos, Cetonas, Ácidos Carboxílicos y Ésteres
- Page ID
- 75186
- Describir la estructura y propiedades de aldehídos, cetonas, ácidos carboxílicos y ésteres
Otra clase de moléculas orgánicas contiene un átomo de carbono conectado a un átomo de oxígeno por un doble enlace, comúnmente llamado grupo carbonilo. El carbono plano trigonal en el grupo carbonilo puede unirse a otros dos sustituyentes que conducen a varias subfamilias (aldehídos, cetonas, ácidos carboxílicos y ésteres) descritas en esta sección.
Aldehídos y Cetonas
Tanto los aldehídos como las cetonas contienen un grupo carbonilo, un grupo funcional con un doble enlace carbono-oxígeno. Los nombres de los compuestos de aldehído y cetona se derivan usando reglas de nomenclatura similares a las de alcanos y alcoholes, e incluyen los sufijos de identificación de clase -al y -one, respectivamente.

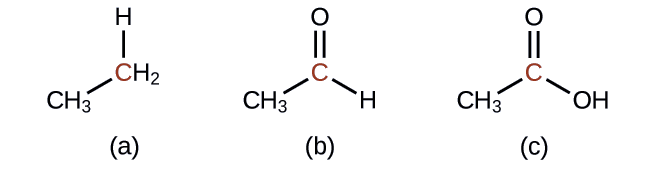
En un aldehído, el grupo carbonilo está unido a al menos un átomo de hidrógeno. En una cetona, el grupo carbonilo está unido a dos átomos de carbono. Como texto, un grupo aldehído se representa como —CHO; una cetona se representa como —C (O) — o —CO—.
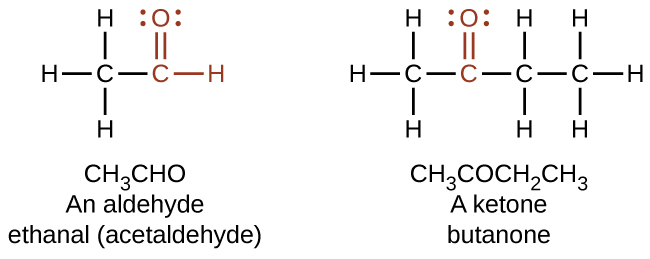
Tanto en aldehídos como en cetonas, la geometría alrededor del átomo de carbono en el grupo carbonilo es plana trigonal; el átomo de carbono exhibe hibridación sp 2. Dos de los orbitales sp 2 en el átomo de carbono en el grupo carbonilo se utilizan para formar enlaces σ con los otros átomos de carbono o hidrógeno en una molécula. El orbital híbrido sp 2 restante forma un enlace σ con el átomo de oxígeno. El orbital p no hibridado en el átomo de carbono en el grupo carbonilo se solapa con un orbital p en el átomo de oxígeno para formar el enlace π en el doble enlace.
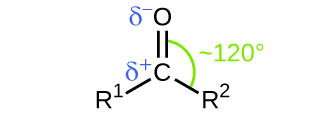
Al igual que el\(\mathrm{C=O}\) enlace en el dióxido de carbono, el\(\mathrm{C=O}\) enlace de un grupo carbonilo es polar (recordemos que el oxígeno es significativamente más electronegativo que el carbono, y los electrones compartidos son arrastrados hacia el átomo de oxígeno y lejos del átomo de carbono). Muchas de las reacciones de aldehídos y cetonas comienzan con la reacción entre una base de Lewis y el átomo de carbono en el extremo positivo del\(\mathrm{C=O}\) enlace polar para producir un intermedio inestable que posteriormente se somete a uno o más reordenamientos estructurales para formar el producto final (Figura\(\PageIndex{1}\)).
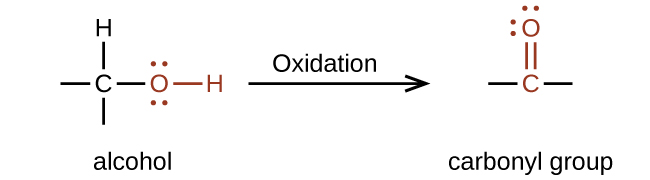
La importancia de la estructura molecular en la reactividad de los compuestos orgánicos se ilustra por las reacciones que producen aldehídos y cetonas. Podemos preparar un grupo carbonilo por oxidación de un alcohol; para las moléculas orgánicas, se dice que la oxidación de un átomo de carbono ocurre cuando un enlace carbono-hidrógeno es reemplazado por un enlace carbono-oxígeno. La reacción inversa, que reemplaza un enlace carbono-oxígeno por un enlace carbono-hidrógeno, es una reducción de ese átomo de carbono. Recordemos que al oxígeno generalmente se le asigna un número de oxidación —2 a menos que sea elemental o esté unido a un flúor. Al hidrógeno se le asigna generalmente un número de oxidación de +1 a menos que esté unido a un metal. Dado que el carbono no tiene una regla específica, su número de oxidación se determina algebraicamente factorizando los átomos a los que está unido y la carga general de la molécula o ion. En general, un átomo de carbono unido a un átomo de oxígeno tendrá un número de oxidación más positivo y un átomo de carbono unido a un átomo de hidrógeno tendrá un número de oxidación más negativo. Esto debería encajar muy bien con su comprensión de la polaridad de los enlaces C—O y C-H. Los otros reactivos y posibles productos de estas reacciones están fuera del alcance de este capítulo, por lo que nos centraremos únicamente en los cambios a los átomos de carbono:
El metano representa la forma completamente reducida de una molécula orgánica que contiene un átomo de carbono. Reemplazar secuencialmente cada uno de los enlaces carbono-hidrógeno con un enlace carbono-oxígeno conduciría a un alcohol, luego un aldehído, luego un ácido carboxílico (discutido más adelante) y, finalmente, dióxido de carbono:
\[\ce{CH4⟶CH3OH⟶CH2O⟶HCO2H⟶CO2} \nonumber \]
¿Cuáles son los números de oxidación de los átomos de carbono en las moléculas que se muestran aquí?
Solución
En este ejemplo, podemos calcular el número de oxidación (revisar el capítulo sobre reacciones de oxidación-reducción si es necesario) para el átomo de carbono en cada caso (observe cómo esto se volvería difícil para moléculas más grandes con átomos de carbono y átomos de hidrógeno adicionales, razón por la cual los químicos orgánicos utilizan la definición que trata de reemplazar los bonos C—H por los enlaces C—O descritos).
- Para CH 4, el átomo de carbono lleva un número de oxidación —4 (a los átomos de hidrógeno se les asignan números de oxidación de +1 y el átomo de carbono lo equilibra al tener un número de oxidación de —4)
- Para el alcohol (en este caso, metanol), el átomo de carbono tiene un número de oxidación de —2 (al átomo de oxígeno se le asigna —2, a los cuatro átomos de hidrógeno cada uno se le asigna +1, y el átomo de carbono equilibra la suma al tener un número de oxidación de —2; nótese que comparado con el átomo de carbono en CH 4, este carbono átomo ha perdido dos electrones por lo que se oxidó)
- Para el aldehído, el número de oxidación del átomo de carbono es 0 (—2 para el átomo de oxígeno y +1 para cada átomo de hidrógeno ya se equilibra a 0, por lo que el número de oxidación para el átomo de carbono es 0)
- Para el ácido carboxílico, el número de oxidación del átomo de carbono es +2 (dos átomos de oxígeno cada uno en —2 y dos átomos de hidrógeno en +1)
- Para el dióxido de carbono, el número de oxidación del átomo de carbono es +4 (aquí, el átomo de carbono necesita equilibrar la suma —4 de los dos átomos de oxígeno).
Indique si los átomos de carbono marcados en las tres moléculas aquí están oxidados o reducidos en relación con el átomo de carbono marcado en etanol:
No hay necesidad de calcular los estados de oxidación en este caso; en cambio, basta con comparar los tipos de átomos unidos a los átomos de carbono marcados:
- Responder a
-
reducido (enlace al átomo de oxígeno reemplazado por enlace a átomo de hidrógeno);
- Respuesta b
-
oxidado (un enlace al átomo de hidrógeno reemplazado por un enlace al átomo de oxígeno);
- Respuesta c
-
oxidado (2 enlaces a átomos de hidrógeno han sido reemplazados por enlaces a un átomo de oxígeno)
Los aldehídos se preparan comúnmente por la oxidación de alcoholes cuyo grupo funcional -OH se encuentra en el átomo de carbono al final de la cadena de átomos de carbono en el alcohol:

Los alcoholes que tienen sus grupos -OH en la mitad de la cadena son necesarios para sintetizar una cetona, lo que requiere que el grupo carbonilo esté unido a otros dos átomos de carbono:

Un alcohol con su grupo -OH unido a un átomo de carbono que está unido a ningún átomo de carbono o a otro átomo de carbono formará un aldehído. Un alcohol con su grupo —OH unido a otros dos átomos de carbono formará una cetona. Si tres carbonos están unidos al carbono unido al —OH, la molécula no tendrá un enlace C—H para ser reemplazada, por lo que no será susceptible a la oxidación.
El formaldehído, un aldehído con la fórmula HCHO, es un gas incoloro con un olor acre e irritante. Se vende en una solución acuosa llamada formalina, la cual contiene aproximadamente 37% de formaldehído en peso. El formaldehído provoca la coagulación de las proteínas, por lo que mata las bacterias (y cualquier otro organismo vivo) y detiene muchos de los procesos biológicos que provocan la descomposición del tejido. Por lo tanto, el formaldehído se utiliza para preservar especímenes de tejido y embalsamar cuerpos. También se utiliza para esterilizar el suelo u otros materiales. El formaldehído se utiliza en la fabricación de Baquelita, un plástico duro que tiene alta resistencia química y eléctrica.
La dimetil cetona, CH 3 COCH 3, comúnmente llamada acetona, es la cetona más simple. Se elabora comercialmente fermentando maíz o melaza, o por oxidación de 2-propanol. La acetona es un líquido incoloro. Entre sus múltiples usos se encuentran como disolvente para laca (incluyendo esmalte de uñas), acetato de celulosa, nitrato de celulosa, acetileno, plásticos y barnices; como removedor de pinturas y barnices; y como disolvente en la fabricación de productos farmacéuticos y químicos.
Ácidos carboxílicos y ésteres
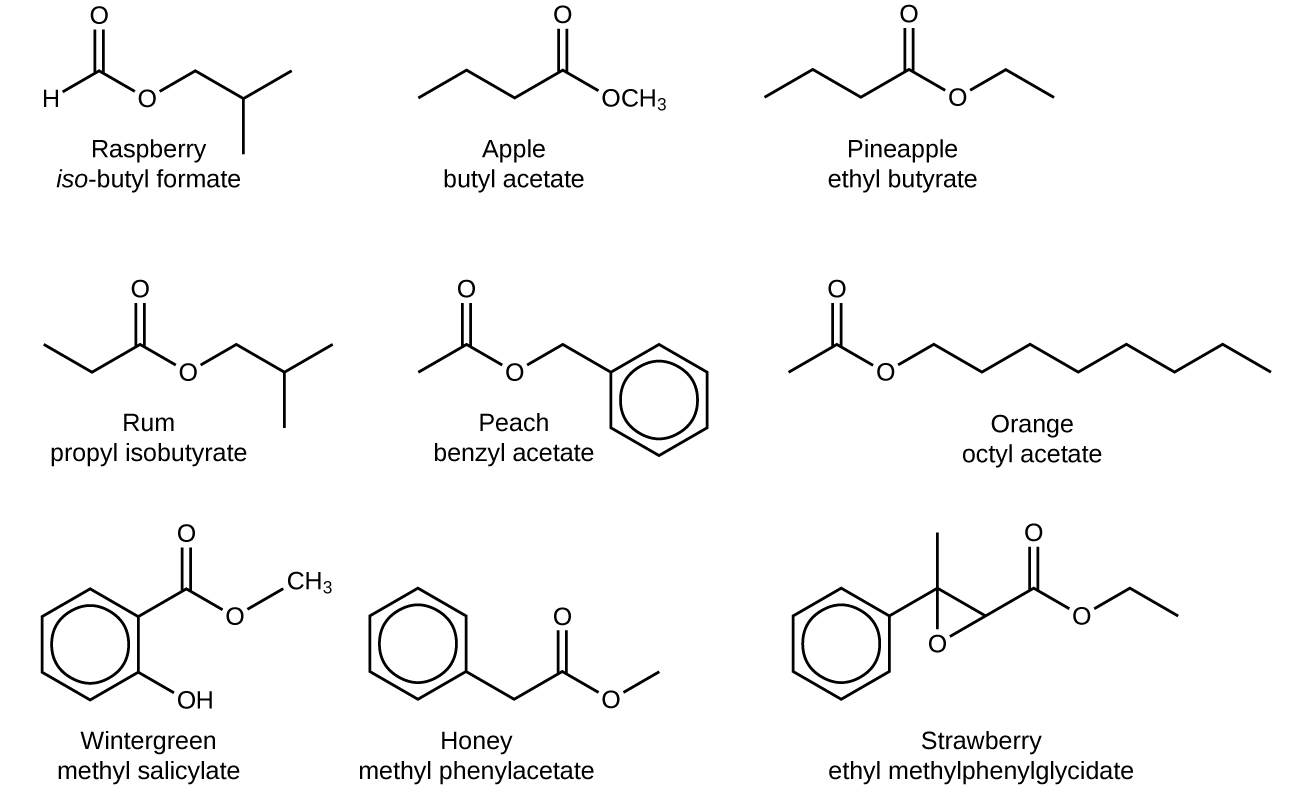
El olor a vinagre es causado por la presencia de ácido acético, un ácido carboxílico, en el vinagre. El olor de los plátanos maduros y muchos otros frutos se debe a la presencia de ésteres, compuestos que se pueden preparar por reacción de un ácido carboxílico con un alcohol. Debido a que los ésteres no tienen enlaces de hidrógeno entre las moléculas, tienen presiones de vapor más bajas que los alcoholes y ácidos carboxílicos de los que se derivan (Figura\(\PageIndex{2}\)).
Tanto los ácidos carboxílicos como los ésteres contienen un grupo carbonilo con un segundo átomo de oxígeno unido al átomo de carbono en el grupo carbonilo por un enlace sencillo. En un ácido carboxílico, el segundo átomo de oxígeno también se une a un átomo de hidrógeno. En un éster, el segundo átomo de oxígeno se une a otro átomo de carbono. Los nombres para ácidos carboxílicos y ésteres incluyen prefijos que denotan las longitudes de las cadenas de carbono en las moléculas y se derivan siguiendo reglas de nomenclatura similares a las de ácidos inorgánicos y sales (ver estos ejemplos):
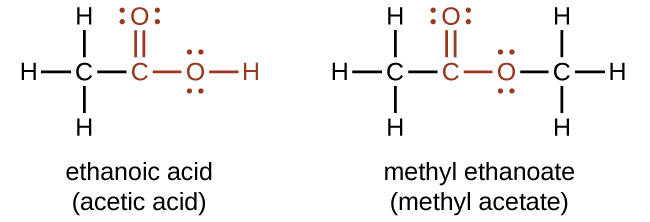
Los grupos funcionales para un ácido y para un éster se muestran en rojo en estas fórmulas.
El átomo de hidrógeno en el grupo funcional de un ácido carboxílico reaccionará con una base para formar una sal iónica:
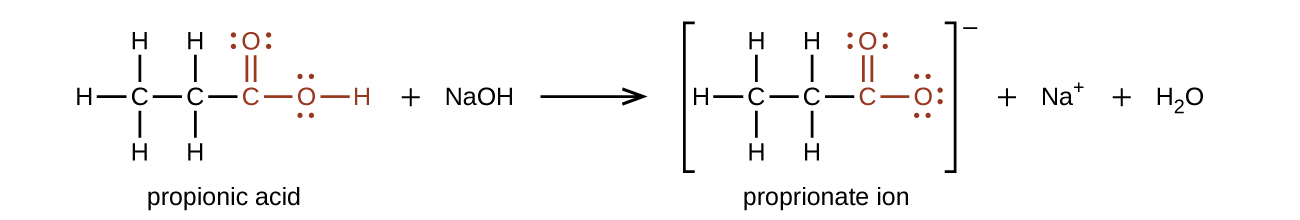
Los ácidos carboxílicos son ácidos débiles, lo que significa que no están 100% ionizados en agua. Generalmente solo alrededor del 1% de las moléculas de un ácido carboxílico disueltas en agua son ionizadas en un momento dado. Las moléculas restantes están no disociadas en solución.
Preparamos ácidos carboxílicos mediante la oxidación de aldehídos o alcoholes cuyo grupo funcional -OH se encuentra en el átomo de carbono al final de la cadena de átomos de carbono en el alcohol:
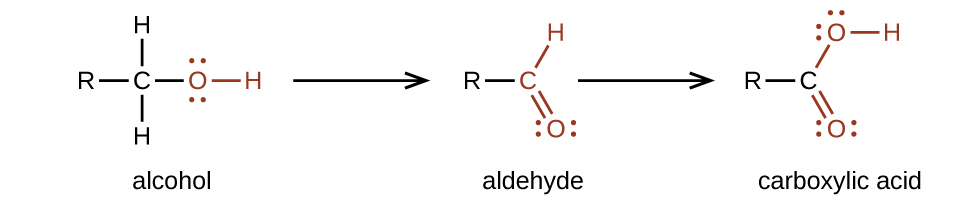
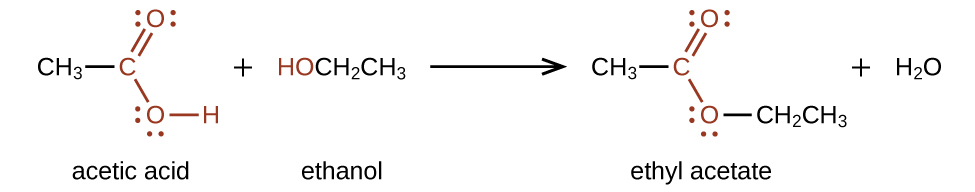
Los ésteres se producen por la reacción de ácidos con alcoholes. Por ejemplo, el éster acetato de etilo, CH 3 CO 2 CH 2 CH 3, se forma cuando el ácido acético reacciona con etanol:
El ácido carboxílico más simple es el ácido fórmico, HCO 2 H, conocido desde 1670. Su nombre proviene del vocablo latino formicus, que significa “hormiga”; primero fue aislado por la destilación de hormigas rojas. Es parcialmente responsable del dolor e irritación de las picaduras de hormigas y avispas, y es responsable de un olor característico de las hormigas que a veces se puede detectar en sus nidos.
El ácido acético, CH 3 CO 2 H, constituye 3— 6% de vinagre. El vinagre de sidra se produce permitiendo que el jugo de manzana fermente sin oxígeno presente. Las células de levadura presentes en el jugo llevan a cabo las reacciones de fermentación. Las reacciones de fermentación cambian el azúcar presente en el jugo a etanol, luego a ácido acético. El ácido acético puro tiene un olor penetrante y produce quemaduras dolorosas. Es un excelente solvente para muchos compuestos orgánicos y algunos inorgánicos, y es esencial en la producción de acetato de celulosa, un componente de muchas fibras sintéticas como el rayón.
Los olores y sabores distintivos y atractivos de muchas flores, perfumes y frutos maduros se deben a la presencia de uno o más ésteres (Figura\(\PageIndex{3}\)). Entre los ésteres naturales más importantes se encuentran las grasas (como manteca de cerdo, sebo y mantequilla) y los aceites (como los aceites de linaza, algodón y oliva), que son ésteres del alcohol trihidroxilado glicerina, C 3 H 5 (OH) 3, con ácidos carboxílicos grandes, como el ácido palmítico, CH 3 (CH 2) 14 CO 2 H, ácido esteárico, CH 3 (CH 2) 16 CO 2 H, y ácido oleico,\(\mathrm{CH_3(CH_2)_7CH=CH(CH_2)_7CO_2H}\). El ácido oleico es un ácido insaturado; contiene un\(\mathrm{C=C}\) doble enlace. Los ácidos palmítico y esteárico son ácidos saturados que no contienen dobles o triples enlaces.

Resumen
Los grupos funcionales relacionados con el grupo carbonilo incluyen el grupo —CHO de un aldehído, el grupo —CO— de una cetona, el grupo —CO 2H de un ácido carboxílico y el grupo —CO 2R de un éster. El grupo carbonilo, un doble enlace carbono-oxígeno, es la estructura clave en estas clases de moléculas orgánicas: Los aldehídos contienen al menos un átomo de hidrógeno unido al átomo de carbono carbonilo, las cetonas contienen dos grupos de carbono unidos al átomo de carbono carbonilo, los ácidos carboxílicos contienen un grupo hidroxilo unido al átomo de carbono del carbonilo, y los ésteres contienen un átomo de oxígeno unido a otro grupo de carbono conectado al átomo de carbono del carbonilo. Todos estos compuestos contienen átomos de carbono oxidados en relación con el átomo de carbono de un grupo alcohol.
Glosario
- aldehído
- compuesto orgánico que contiene un grupo carbonilo unido a dos átomos de hidrógeno o un átomo de hidrógeno y un sustituyente de carbono
- grupo carbonilo
- átomo de carbono con doble enlace a un átomo de oxígeno
- ácido carboxílico
- compuesto orgánico que contiene un grupo carbonilo con un grupo hidroxilo unido
- éster
- compuesto orgánico que contiene un grupo carbonilo con un átomo de oxígeno unido que está unido a un sustituyente de carbono
- cetona
- compuesto orgánico que contiene un grupo carbonilo con dos sustituyentes de carbono unidos al mismo


