1.3: Día 3- Energía orbital y configuración de electrones
- Page ID
- 78768
c3
Día 3: Energía orbital y configuración de electrones
D3.1 átomos con más de un solo electrón
En su cuaderno de curso, haga un encabezado para configuraciones de electrones y escriba lo que recuerde sobre las configuraciones de electrones para átomos de su experiencia anterior. También anote cualquier aspecto de las configuraciones de electrones que te desconcierte. Te pediremos que vuelvas a referirte a lo que has escrito cuando completes esta sección.
Las ideas ya desarrolladas sobre los números cuánticos, los orbitales y los tamaños y formas de las distribuciones de densidad de electrones se aplican a todos los átomos. Sin embargo, cuando hay dos o más electrones en un átomo hay fuerzas repulsivas entre los electrones así como fuerzas de atracción entre los electrones y el núcleo. Estas repulsiones afectan las energías de los electrones.
Por ejemplo, los niveles de energía en un ion He + (que, como H, tiene un solo electrón) son significativamente menores que en un átomo de H debido a la atracción de la ley de Coulomb más fuerte entre el electrón y la carga 2+ del núcleo de He. Sin embargo, en un átomo de He, que tiene dos electrones, las repulsiones electrón-electrón entre los electrones elevan significativamente los niveles de energía en comparación con He +, y un átomo de He no es tan estable como podríamos haber esperado.
Para los átomos con muchos electrones, el efecto de las repulsiones electrón-electrón difiere para diferentes subcapas. Por tanto, la energía orbital depende tanto de los números cuánticos n como de l. Para el mismo valor de n (la misma concha), a medida que l aumenta la energía también aumenta. Así, los electrones de la subcapa s tienen menor energía que los electrones de la subcapa p, que son más bajos que los electrones de la subcapa d, y así sucesivamente. Los orbitales dentro de la misma subcapa (por ejemplo 2 p x, 2 p y y 2 p z) tienen todos la misma energía; se dice que los orbitales que tienen la misma energía están degenerados.
El físico austriaco Wolfgang Pauli formuló lo que ahora se llama el principio de exclusión de Pauli:
- Cada electrón en un átomo debe tener un conjunto diferente de valores para los cuatro números cuánticos.
- Si dos electrones comparten el mismo orbital (tienen los mismos n, l y m l), entonces sus números cuánticos de espín m s deben tener valores diferentes; decimos que los dos electrones tienen espín opuesto.
- Debido a que m s sólo puede tener dos valores, +½ o -½, no más de dos electrones pueden ocupar el mismo orbital.
Al aplicar el principio de exclusión Pauli, la disposición de los electrones en cualquier átomo multielectrónico puede determinarse reconociendo que el estado fundamental de un átomo tiene todos sus electrones en orbitales con las energías más bajas posibles.
Actividad 2: Arreglo de los Electrones en Li
Diagramas de nivel de energía orbital D3.2
Un diagrama de nivel de energía orbital (o simplemente diagrama orbital) muestra las energías relativas de los orbitales y cómo se distribuyen los electrones entre orbitales dentro de una subcapa. En un diagrama orbital de nivel de energía, los orbitales individuales suelen estar representados por líneas horizontales cuya posición vertical transmite las energías relativas de los orbitales. Los electrones se representan como flechas con la dirección de la flecha comunicando el signo de m s (la flecha ↑ representa m s = +½ y la flecha ↓ representa m s = -½).
Por ejemplo, un átomo de boro tiene este diagrama orbital de nivel de energía:
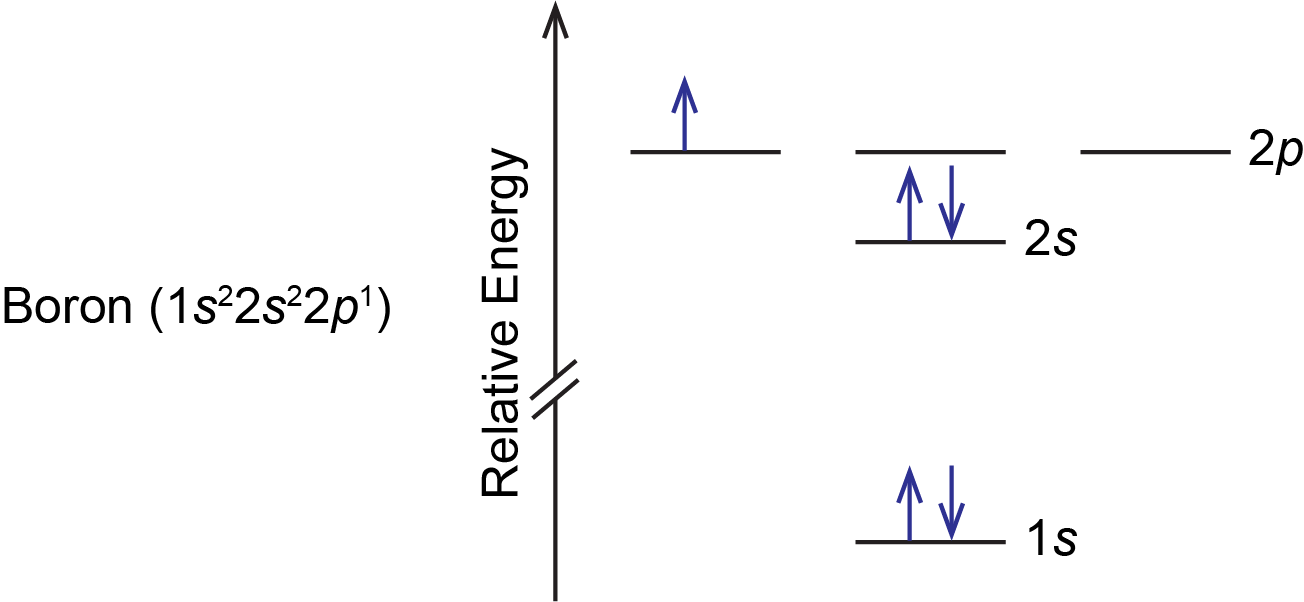
Como lo ilustra el ejemplo del boro, un diagrama orbital incluye todos los orbitales en todas las subconchas dentro de una concha parcialmente ocupada, incluso si algunos orbitales están desocupados. Obsérvese que los tres orbitales de 2 p son degenerados, por lo que el electrón puede ocupar cualquiera de ellos.
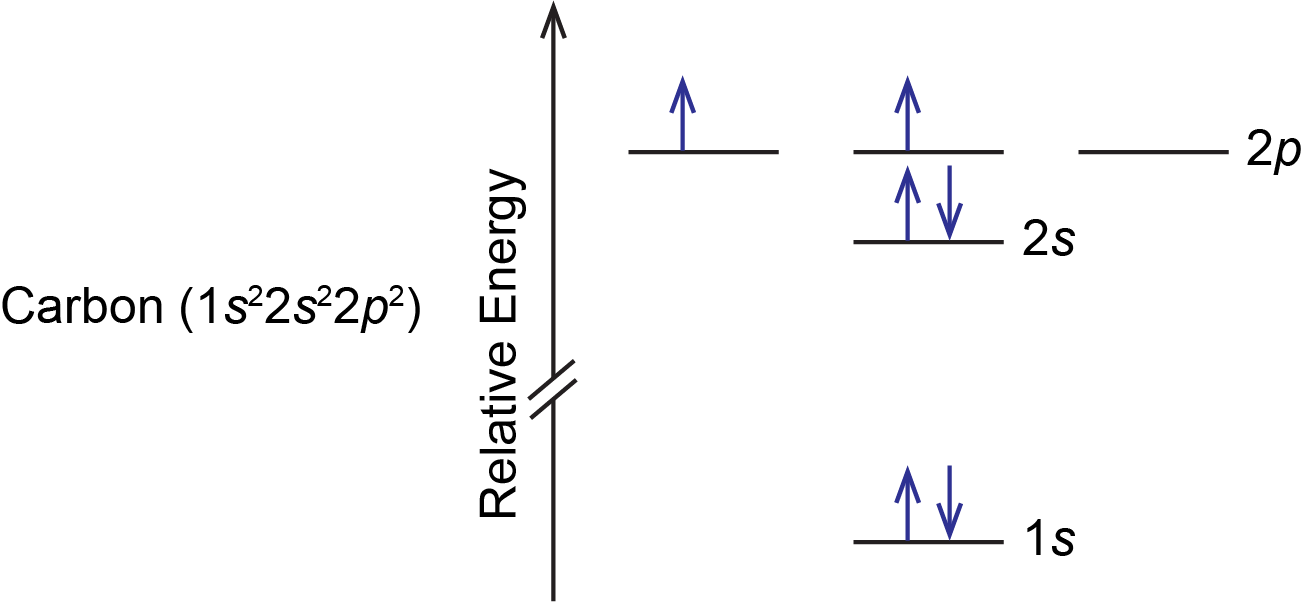
Un átomo de carbono tiene seis electrones, por lo que hay dos electrones en la subcapa de 2 p. Estos dos electrones podrían (1) emparejarse en un solo orbital de 2 p o (2) ocupar orbitales separados pero con espín opuesto o (3) ocupar orbitales separados pero con espín paralelo. Las tres posibilidades son válidas basadas en números cuánticos y el principio Pauli, pero sólo una es la más baja en energía. Los electrones que tienen espines paralelos no pueden ocupar el mismo espacio (el mismo orbital), por lo que las repulsiones entre ellos deben ser menores que si tuvieran espines opuestos. Así, la opción 3 es la más baja en energía y por lo tanto representa el estado fundamental de un átomo de carbono; las opciones 1 y 2 representan estados excitados.
Según la regla de Hund, la configuración de energía más baja tiene el número máximo de electrones desapareados con espín paralelo dentro de un conjunto de orbitales degenerados. Así, el diagrama orbital para el estado fundamental del carbono es
Configuraciones de electrones D3.3
La disposición específica de los electrones en los orbitales atómicos se denomina configuración electrónica del átomo. Determina muchas propiedades físicas y químicas de ese átomo. Por lo tanto, la tabla periódica, que está dispuesta de acuerdo con las propiedades de los elementos, se puede utilizar para predecir las configuraciones de electrones del estado fundamental de los átomos.
Una configuración electrónica se escribe simbólicamente para proporcionar tres piezas de información: el número cuántico principal (número de shell), n; una letra que designa la subcapa (s, p, d, etc.); un superíndice que muestra el número de electrones en ese particular subshell. Por ejemplo, la notación 2 p 4 indica 4 electrones en una subcapa p (l = 1) con un número cuántico principal (n) de 2.
Para cualquier elemento, la configuración electrónica del estado fundamental se puede construir comenzando con hidrógeno y siguiendo el orden de números atómicos a través de la tabla periódica. Para pasar de un elemento al siguiente, agregue un protón (y uno o más neutrones) al núcleo y un electrón a la subcapa de energía más baja que tenga una órbita incompleta llena. Repita hasta llegar al elemento deseado. Este proceso de llenado de electrones en orbitales se llama principio aufbau, de la palabra alemana Aufbauen (“construir”). Mire el video de la Figura 1 para ver cómo usar el principio aufbau para determinar las configuraciones de electrones de oxígeno y cromo.
https://mediaspace.wisc.edu/id/0_sr9om3nc?playerId=25717641
Escribir la configuración electrónica completa todo el tiempo puede ser engorroso, por lo que los químicos a menudo abrevian usando la notación de gas noble-gas. Por ejemplo, la configuración electrónica en estado fundamental del vanadio (V) es de 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 3 s 2 3 d 3 s 2. El gas noble que precede inmediatamente a V es argón (Ar); tiene una configuración electrónica en estado fundamental de 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6, que puede representarse como [Ar]. Así, la configuración electrónica en estado fundamental de V se puede acortar a [Ar] 4 s 2 3 d 3, y comunica la misma información que la configuración electrónica completa. Una lista de configuraciones de electrones de estado fundamental para todos los elementos del apéndice utiliza notación de gas noble-gas.
El principio aufbau se basa en el concepto de que para las configuraciones de electrones de estado fundamental, un electrón ocupa un orbital atómico de menor energía en lugar de ocupar un orbital de mayor energía. De ahí que el hecho de que observemos el llenado orbital de 4 s antes de los orbitales de 3 d indica que el orbital de 4 s es menor en energía. De igual manera, un orbital 6s es menor en energía en comparación con un orbital de 4 f.
La diferencia de energía entre las subcapas s, p, d y f hace que orbitales con diferentes valores n tengan energías similares. En muchos casos estas energías son tan similares que hay excepciones a la predicción de la configuración electrónica de la tabla periódica. Estas excepciones ocurren para los elementos d -block y f -block, pero no para los elementos s-block y p -block.
D3.4 Electrones de valencia
La valencia, el poder combinador de un átomo, se definió cerca del final de la Sección D1.4. Las configuraciones de electrones en estado fundamental de los átomos proporcionan información sobre la valencia: por ejemplo, ¿por qué el óxido de sodio tiene la fórmula Na 2 O pero el óxido de magnesio es MgO?. Cuando dos átomos se acercan y forman un enlace químico, la densidad electrónica más alejada del núcleo de cada átomo, en los orbitales de mayor energía, interactúa con la densidad electrónica en el otro átomo. Los electrones en los orbitales de menor energía, cuya densidad de electrones está más cerca del núcleo, son menos importantes.
Los electrones se pueden separar en dos grupos: los electrones de valencia ocupan los orbitales más externos de un átomo; los electrones centrales ocupan orbitales internos, con una densidad de electrones más cercana al núcleo. Cuando se escribe una configuración electrónica usando la notación de gas noble-gas, todos los electrones representados por el símbolo de gas noble-entre paréntesis son electrones centrales. Los electrones más allá de la configuración de gas noble son electrones de valencia si están en la capa más externa del átomo (tienen el valor n más alto) o si están en subconchas rellenas incompletamente. Por ejemplo, considere vanadio, V: [Ar] 4 s 2 3 d 3. Hay cinco electrones de valencia: dos electrones de 4 s y tres electrones de 3 d. Hay 18 electrones centrales en las subconchas de 1 s, 2 s, 2 p, 3 s y 3 p. El hecho de que V tenga cinco electrones de valencia da como resultado compuestos formadores de V en los que la valencia del vanadio oscila entre 2 y 5. Por ejemplo, los fluoruros de vanadio tienen las fórmulas VF 2, VF 3, VF 4 y VF 5.
Un químico estadounidense, G. N. Lewis, sugirió una forma sencilla de hacer un seguimiento del número de electrones de valencia: dibujar puntos alrededor del símbolo de un elemento para representar los electrones de valencia. El símbolo del elemento representa entonces el núcleo y los electrones centrales de un átomo. Un diagrama en el que los puntos representan electrones de valencia se denomina diagrama de Lewis. Los diagramas de Lewis son más útiles para los elementos del grupo principal (representativos). Aquí están los diagramas de Lewis para átomos de elementos en la tercera fila de la tabla periódica:
Al dibujar un diagrama de Lewis, los puntos se agregan uno a la vez a cada uno de los cuatro lados del símbolo del elemento. Si hay más de cuatro puntos para agregar, los puntos se emparejan. Lewis originó la idea de que cuando un átomo se une a otro átomo los electrones de valencia se reorganizan para formar un octeto, una configuración estable de electrones de valencia (s 2 p 6) que corresponde a cada gas noble en el lado derecho de una fila en el periódico mesa. Así, las configuraciones de electrones y los diagramas de Lewis para átomos pueden predecir cómo un átomo forma enlaces químicos, idea que exploraremos más adelante.
Ejercicio 4: Diagramas de Lewis
En tu cuaderno escribe un diagrama de Lewis para cada elemento:
B Ge Br K Sr Se Xe Sc
D3.5 Carga Nuclear Efectiva
Las tendencias periódicas en las propiedades atómicas se pueden predecir aplicando estas ideas sobre la atracción electrón-núcleo y la repulsión electrón-electrón:
- Las distribuciones de densidad de electrones están en conchas que aumentan de tamaño a medida que aumenta el número cuántico principal, n,. Los electrones en conchas más grandes están, en promedio, más alejados del núcleo y menos fuertemente atraídos.
- Los electrones repelen a otros electrones, elevando la energía potencial electrostática. Esto contrarresta en parte la disminución de la energía debido a la atracción de un electrón por el núcleo. Se dice que los electrones proyectan o blindan a otros electrones de la carga nuclear.
La densidad de electrones para un electrón central (un electrón en una capa interna) es, en promedio, más cercana al núcleo que la densidad de electrones para un electrón de valencia. Así, los electrones centrales pueden contrarrestar significativamente el efecto de la atracción nuclear. Considera un átomo de litio (Li, 1 s 2 2 s 1), que tiene tres protones en el núcleo. Debido a que el orbital de 2 s es mayor que el orbital de 1 s, la densidad de electrones de 1 s se localiza principalmente entre el núcleo y la densidad de electrones de 2 s. (Mueva el deslizador en el medio de la Figura 2 para ver cuánto de la densidad de electrones de 1 s se encuentra entre el núcleo y la densidad de electrones de 2 s). Así, los dos electrones de 1 s repelen el electrón de 2 s lejos del núcleo, contrarrestando parte de la carga 3+ del núcleo.
Para dar cuenta de tales repulsiones electrón-electrón, utilizamos una carga nuclear efectiva, Z eff, la carga nuclear positiva (dada por el número atómico) reducida por la repulsión de un electrón específico por todos los demás electrones. En el caso del electrón Li 2 s, la mecánica cuántica calcula que las repulsiones de los dos electrones de 1 s reducen la carga nuclear en 1.72; es decir, Z eff para el electrón de 2 s es 3 − 1.72 = 1.28. Si toda la densidad electrónica de los electrones de 1 s estuviera entre el núcleo y el electrón de 2 s, Z eff se reduciría a 1.
D3.6 Variación periódica en el radio atómico
Dado que la densidad electrónica se distribuye por todo el espacio pero se concentra cerca del núcleo, es difícil definir el tamaño de un átomo. Por lo general, los químicos piensan en los átomos como esferas con radios del orden de decenas a cientos de picometros. Una forma de determinar los radios atómicos es medir la distancia entre los núcleos atómicos en las moléculas diatómicas homonucleares. (Homonuclear significa dos átomos del mismo elemento unidos entre sí.) El radio de un átomo es la mitad de la distancia internuclear. Una segunda forma es medir la distancia entre los núcleos de dos átomos en un metal sólido, donde cada átomo toca varios vecinos más cercanos. Una vez determinado un conjunto de radios atómicos, estos valores pueden ser utilizados para estimar las longitudes de los enlaces que aún no se han medido.
Día 3 Problema de Podios Pre-Clase: Números Cuánticos y Tabla Periódica
Este problema de Podia se basa en el material de pre-clase actual; trabajar a través de ese material te ayudará a resolver el problema.
En un hipotético universo paralelo, los números cuánticos se definen de manera diferente: n, l y m s obedecen las mismas reglas que en nuestro universo, pero m l no puede tener valores negativos. Así, un subshell p contiene sólo dos orbitales p, un subshell d contiene tres orbitales d, y así sucesivamente. Las energías de las subconchas son las mismas que en nuestro universo. En su libreta, responda cada pregunta a continuación y explique cada respuesta de manera clara, concisa y con un lenguaje científicamente apropiado.
- Dibujar una tabla periódica para el universo hipotético.
- Determinar el número atómico del cuarto elemento de gas noble.
- Escribir la configuración electrónica de un ion estable formado por el elemento número 6.
- Escribir la configuración electrónica de un ion estable formado por el elemento número 18.
Dos días antes de la próxima sesión de toda la clase, esta pregunta de Podia se pondrá en vivo en Podia, donde podrás enviar tu respuesta.


