1.4: Día 4- Tendencias Periódicas; Fuerzas entre Átomos
- Page ID
- 78767
4
Día 4: Tendencias Periódicas; Fuerzas entre Átomos
Además del radio atómico, varias otras propiedades varían dependiendo de la posición en la tabla periódica. Al igual que el radio atómico, estas propiedades dependen de la carga nuclear efectiva y el tamaño de la carcasa atómica
D4.1 Variación periódica en las energías de ionización
El modelo de mecánica cuántica para el átomo de hidrógeno (Sección D2.4) discutió la ionización del átomo de hidrógeno: excitación del electrón desde el nivel n = 1 hasta el límite de n → ∞:
\[\Delta E = E_{n \rightarrow \infty} - E_1= 0 – \dfrac{-k}{1^2} = k = 2.179\;\times\;10^{–18}\;\text{J} \nonumber \]
La energía de ionización (IE), la energía mínima requerida para eliminar un electrón del orbital atómico que ocupa (excitándolo a n = ∞), también se aplica a los átomos de múltiples electrones. Como se muestra en esta tabla de energías de ionización, existen sucesivas energías de ionización, una por cada electrón.
La primera energía de ionización (IE 1) es la energía mínima requerida para eliminar el electrón menos estrechamente unido, es decir, el electrón en el orbital de mayor energía. Corresponde al proceso:
X (g) → X + (g) + e — ΔE = IE 1
La segunda energía de ionización (IE 2) es la energía mínima requerida para eliminar un electrón del catión 1+, correspondiente a:
X + (g) → X 2+ (g) + e — ΔE = IE 2
Y así sucesivamente.
Los electrones en los átomos tienen menor energía potencial que cuando se separan del átomo, por lo que siempre se requiere energía para eliminar los electrones de átomos o iones. La ionización es un proceso endotérmico y los valores de IE son siempre positivos.
Las energías de ionización se pueden determinar experimentalmente a partir de espectros atómicos o brillando luz sobre una muestra en fase gaseosa y aumentando sucesivamente la energía fotónica hasta que se observe la expulsión de un electrón. Tales experimentos también nos dan información directa sobre el orbital atómico que estaba ocupando el electrón.
En la actividad anterior, desarrollaste una regla general que a lo largo de un periodo, IE 1 aumenta al aumentar el número atómico, Z; abajo de un grupo, IE 1 disminuye con Z creciente. Mire la Figura 1 a continuación y cerciórese de ver cómo los datos en la figura apoyan ambas tendencias. Existen algunas desviaciones sistemáticas de estas tendencias, que también se pueden observar en la Figura 1.
Examinar los datos presentados en la Figura 1. Identificar todas las desviaciones de la tendencia de que la energía de ionización aumenta a lo largo de un período y disminuye en un grupo. Haga clic en cada desviación que involucre un elemento en el Período 1, Período 2 o Período 3.
Otra desviación ocurre cuando una subcapa se llena más de la mitad. Por ejemplo, el IE 1 de oxígeno es ligeramente inferior al del nitrógeno. El diagrama orbital de oxígeno muestra que el último electrón agregado (rojo) se ve obligado a emparejarse con otro electrón, debido a que la subcapa de 2 p está más de la mitad llena.
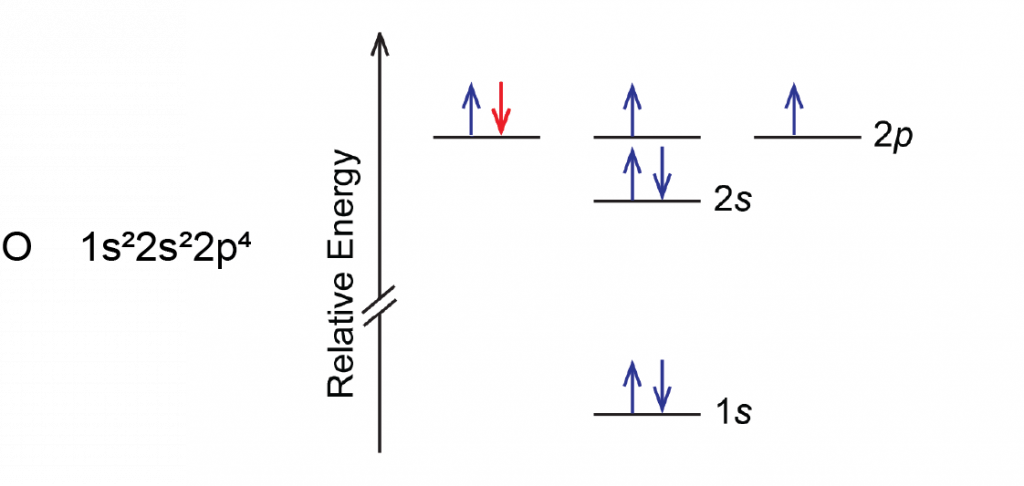
La pérdida del electrón (coloreado de rojo en el diagrama orbital) produce una mayor reducción de la repulsión electrón-electrón porque ya no hay dos electrones en el mismo orbital. Esto facilita la pérdida de un electrón de O y la energía de ionización es menor de lo esperado. La misma explicación se aplica a la inmersión para azufre después del fósforo en la Figura 1.
Al observar los sucesivos IE en el apéndice, vemos que para cualquier elemento, IE 1 < IE 2 < IE 3, y así sucesivamente, y esto se debe a la mayor Z eff en sucesivamente más iones positivos. Sin embargo, a veces el incremento en IE sucesivos es mayor de lo esperado. Por ejemplo, considere los datos en la Tabla 1:
| Element | IE 1 | IE 2 | IE 3 | IE 4 | IE 5 | IE 6 | IE 7 |
|---|---|---|---|---|---|---|---|
| K | 419 | 3069 | 4438 | 5876 | 7975 | 9620 | 11385 |
| Ca | 590 | 1145 | 4941 | 6465 | 8142 | 10496 | 12350 |
| Sc | 633 | 1244 | 2388 | 7130 | 8877 | 10720 | 13314 |
| Ga | 579 | 1982 | 2962 | 6194 | 8299 | 10874 | 13585 |
| Ge | 760 | 1537 | 3301 | 4409 | 9012 | 11183 | 13981 |
| Como | 947 | 1949 | 2731 | 4834 | 6040 | 12302 | 14183 |
| Cuadro 1. Energías de ionización sucesivas (IE) para algunos elementos del período-4 (kJ/mol) | |||||||
Estas energías de ionización observadas son consistentes con la idea de electrones de valencia, electrones en la (s) capa (s) externa (s) que están menos ligados y más accesibles energéticamente, lo que les permite participar en transformaciones químicas.
D4.2 Variación periódica en las afinidades de electrones
La afinidad electrónica (EA) se define como el cambio en la energía cuando se agrega un electrón a un átomo para formar un anión. El primer EA corresponde a agregar un electrón a un átomo:
X (g) + e — → X — (g) Δ E = EA 1
Muchos elementos tienen EA 1 negativo, lo que significa que la energía del anión 1− es menor que la energía del átomo más el electrón libre; es decir, el anión es más estable.
Para otros elementos, EA 1 es positivo, lo que significa que el anión es menos estable en comparación con el átomo parental más un electrón libre. Para estos elementos, se requiere una entrada de energía para formar el anión, y, en la fase gaseosa, el anión se disocia para producir el átomo neutro y un electrón libre debido a que estos últimos son de menor energía.
Configuraciones de electrones D4.3 de iones monoatómicos
Cuando los átomos pierden electrones o ganan electrones, se forman iones. Es útil saber qué tipos de iones se forman y cuáles son sus propiedades. Un ion monoatómico es un solo átomo que ha ganado o perdido uno o más electrones. Un ion cargado positivamente, un catión, se forma cuando un átomo pierde uno o más electrones. Un ion cargado negativamente, un anión, se forma cuando un átomo gana uno o más electrones.
Los elementos no metálicos en el extremo derecho de la tabla periódica (excepto los gases nobles) tienen mayores energías de ionización y afinidades electrónicas más negativas. Es energéticamente más favorable para ellos ganar electrones y formar aniones y menos energéticamente favorable para que formen cationes. Por ejemplo, los elementos de los grupos VIIA, VIA y algunos en VA pueden ganar 1, 2 o 3 electrones, respectivamente, para lograr la configuración electrónica de un gas noble (un octe t completo, s 2 p 6 en la capa más externa).
Los elementos metálicos del lado izquierdo de la tabla periódica tienen menores energías de ionización y menos afinidades electrónicas negativas (o positivas). Es energéticamente más favorable para ellos formar cationes. Por ejemplo, los elementos de los grupos IA, IIA y IIIA pueden perder 1, 2 o 3 electrones, respectivamente, para lograr un octeto completo (más subcapas d y f rellenas adicionales).
Para encontrar la configuración electrónica del estado fundamental de un ion monoatómico, comience con la configuración electrónica del átomo correspondiente y elimine (o agregue) un número apropiado de electrones de (o hacia) la (s) valencia (s) orbital (s) del átomo. Aquí hay algunos ejemplos:
K ([Ar] 4 s 1) ⟶ K + ([Ar]) + e
Ga ([Ar] 3 d 10 4 s 2 4 p 1) ⟶ Ga 3 + ([Ar] 3 d 10) + 3e
O (1s 2 2 s 2 2p 4) + 2e⟶ O 2- (1s 2 2 s 2 2p 6 o [Ne])
Cuando los elementos de transición y los elementos de transición internos forman cationes, el (los) electrón (s) en la capa más externa (n más grande) se eliminan antes de cualquier electrón d o f. Por ejemplo, cuando Fe pierde dos electrones para formar Fe 2 +, los dos electrones 4s se pierden:
Fe ([Ar] 3 d 6 4 s 2) ⟶ Fe 2 + ([Ar] 3 d 6) + 2e
Esto sucede porque los electrones en la subcapa de 3 d son muy efectivos en el cribado de los electrones de 4 s del núcleo pero mucho menos efectivos en el cribado entre sí. La mecánica cuántica calcula que la carga nuclear efectiva experimentada por un electrón de 4 s en Fe es 2.1, mientras que la carga nuclear efectiva experimentada por un electrón de 3 d es 4.3. Después de que se hayan eliminado los electrones de 4 s, algunos electrones 3d también pueden ionizarse. Aquí hay más ejemplos:V ([Ar] 3 d 3 4 s 2) ⟶ V 5+ ([Ar]) + 5e
Re ([Xe] 4 f 14 5 d 5 6 s 2) ⟶ Re 2 + ([Xe] 4 f 14 5 d 5) + 2e
Ejercicio 3: Configuraciones de electrones para iones monoatómicos
En su cuaderno escribe la configuración electrónica correcta para cada ion que se enumera aquí:
Sr 2 + Te 2 − Al 3 + Fe 3 + Nd 4 +
Los iones y átomos que tienen la misma configuración electrónica son isoelectrónicos. Por ejemplo, los isoelectrónicos Na +, Ne y F − tienen todos una configuración electrónica de estado fundamental de 1 s 2 2 s 2 2 p 6 (o [Ne]). Para los elementos del grupo principal, los iones más comúnmente formados son isoelectrónicos con un gas noble; es decir, estos iones tienen octetos completos.
D4.4 Electrones desapareados y magnetismo
Una forma en que los químicos han descubierto información sobre configuraciones electrónicas de iones implica magnetismo. Probablemente esté familiarizado con los imanes de refrigerador, imanes de hierro o imanes de neodimio (tierras raras). Estos exhiben ferromagnetismo, una fuerte atracción hacia un campo magnético que es fácilmente observable y a veces puede hacerse permanente. Todas las sustancias presentan diamagnetismo, una repulsión muy débil de un campo magnético que solo se puede observar en campos magnéticos extremadamente grandes. Debido a que el diamagnetismo es tan débil, suele ser demasiado pequeño para notarlo.
Además del diamagnetismo, algunas sustancias también exhiben paramagnetismo, una atracción hacia un campo magnético que no es tan fuerte como el ferromagnetismo sino mucho más fuerte que la repulsión diamagnética. El paramagnetismo surge debido a la presencia de electrones desapareados. Cada electrón tiene un pequeño campo magnético; es decir, cada electrón es un imán minúsculo. Cuando un imán macroscópico se acerca a una sustancia paramagnética, la mayoría de los imanes de electrones desapareados se alinean con el campo magnético, haciendo que la sustancia sea atraída hacia el imán (Figura 2).

La Figura 3 muestra cómo el ferromagnetismo difiere del paramagnetismo.
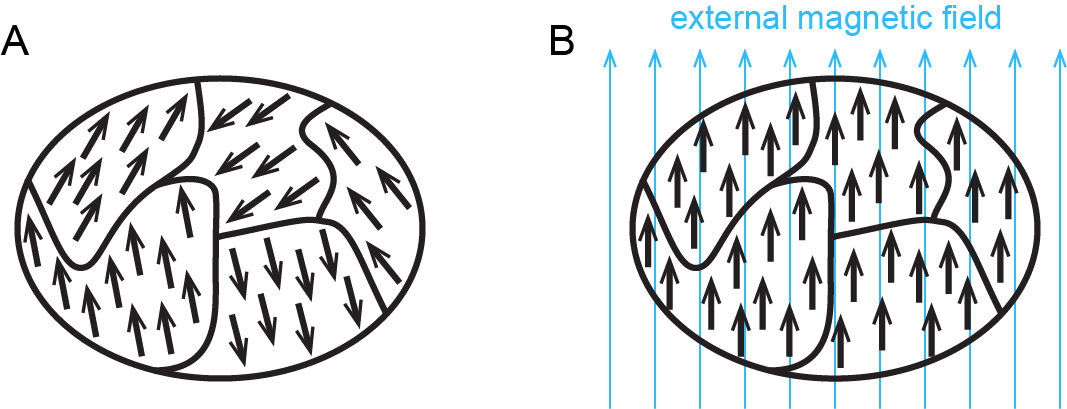
Cuando los electrones se emparejan en un orbital, sus momentos magnéticos opuestos crean campos magnéticos opuestos que se cancelan entre sí: las sustancias con todos los electrones emparejados no son ni paramagnéticas ni ferromagnéticas. Exhiben solo diamagnetismo y se dice que son diamagnéticos. Por ejemplo, el argón tiene una configuración electrónica de estado fundamental de 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6, donde cada subcapa está llena y cada orbital en la misma contiene un par de electrones con giros opuestos. De ahí que una muestra de argón sea diamagnética.
Los materiales paramagnéticos y diamagnéticos no actúan como imanes permanentes. Se requiere un campo magnético para alinear los momentos magnéticos y hacerlos magnéticos. La magnitud del paramagnetismo se puede medir pesando una muestra con una balanza altamente sensible y luego pesándola nuevamente con un imán fuerte justo debajo de la muestra. Una muestra que es atraída por el imán parece más pesada porque el imán lo atrae hacia abajo. El incremento en el peso aparente es proporcional al número de electrones desapareados.
Radios iónicos D4.5
El radio iónico es el radio de una esfera que representa un catión o un anión; se puede determinar a partir de estructuras de cristales iónicos.
Los cationes tienen menos electrones que los átomos no cargados de los que se derivan. Por lo tanto, hay menos repulsión electrón-electrón (es decir, mayor Z eff), lo que hace que el radio de un catión sea más pequeño que el radio del átomo no cargado correspondiente. Por ejemplo, el radio atómico de Al ([Ne] 3 s 2 3 p 1) es de 143pm, que es más del doble de grande que el radio iónico de 68 pm de Al 3 + ([Ne]). A menudo, como en el caso de Al, la formación de un catión implica la eliminación de todos los electrones de la capa más externa de un átomo, lo que significa que los electrones restantes están en una cáscara más pequeña, otra razón por la que los cationes son más pequeños que los átomos a partir de los cuales se forman.
Para el mismo elemento, los cationes con cargas positivas más grandes son más pequeños que los cationes con cargas más pequeñas. Por ejemplo, V 2+ tiene un radio iónico de 93 pm, mientras que el de V 3+ es de 78 pm. (Un átomo V sin carga tiene un radio atómico de 135pm.)
Los aniones tienen más electrones y por lo tanto mayor repulsión electrón-electrón (es decir, menor Z eff) que los átomos neutros de los que se derivan. Así, el radio de un anión es mayor que el radio del átomo parental. Por ejemplo, el radio iónico de S 2- ([Ne] 3 s 2 3 p 6) es de 170pm, mayor que el radio atómico de 104pm de S ([Ne] 3 s 2 3 p 4).
Las tendencias periódicas en los radios de un conjunto de aniones (o cationes) con la misma carga son similares a las tendencias de radio atómico. Por ejemplo, procediendo hacia abajo de un grupo, los radios de 1+ cationes generalmente aumentan a medida que aumenta el número atómico, correspondiente al incremento en el número cuántico principal, n.
Para especies isoelectrónicas (iones o átomos con la misma configuración electrónica, Sección D4.3), cuanto mayor sea la carga nuclear (número de protones), menor será el radio atómico/iónico. Esto implica que los aniones isoelectrónicos son más grandes que el átomo neutro que es mayor que los cationes.
En los días 2 y 3 y anteriores, hemos discutido la estructura atómica y la densidad electrónica, así como las tendencias periódicas en la carga nuclear efectiva, el tamaño de los átomos, las energías de ionización y las afinidades electrónicas. Todos estos son fundamentales para comprender las propiedades y la reactividad química de los elementos. A continuación, aplicamos esas ideas a los gases nobles y a los metales.
Aplicación de ideas centrales: dos átomos similares, dos sustancias muy diferentes
La sección D1.5 introdujo la idea de que los átomos, las moléculas y los iones con carga opuesta se atraen y que su energía potencial puede describirse mediante una curva que comienza en cero cuando las partículas están muy separadas, cae al mínimo y aumenta cuando las partículas están muy juntas. La profundidad del mínimo en dicha curva puede estar relacionada con propiedades físicas como los puntos de ebullición, ya que las partículas de nivel atómico ganan energía a medida que aumenta la temperatura.
Considera los puntos de ebullición de los primeros cinco gases nobles en la siguiente tabla.
| Gas Noble | Número atómico | Radio atómico (pm) | Punto de ebullición (K) |
| Él | 2 | 31 | 4.22 |
| Ne | 10 | 68 | 27.1 |
| Ar | 18 | 91 | 87.4 |
| Kr | 36 | 108 | 119.9 |
| Xe | 54 | 126 | 165 |
Con base en los datos del punto de ebullición, ¿para qué gas noble es mayor la atracción entre partículas? ¿Qué gas noble tiene el mínimo más profundo en su curva de energía potencial vs distancia entre átomos? En su libreta, responda estas preguntas. Luego usa un conjunto de ejes y dibuja la curva potencial-energía para cada uno de los cinco gases nobles de la tabla, describe las curvas con palabras y explica por qué dibujaste las curvas como lo hiciste.
Con base en los datos experimentales y las curvas que dibujaste, correlacionar el tamaño de la atracción entre átomos con el número de electrones y el tamaño de cada átomo. Escribe varias frases en tu cuaderno describiendo la correlación.
Ahora considere el hierro, que tiene número atómico 26 y radio atómico 126pm (el mismo radio que Xe, pero menos electrones). Con base en esta información, esboce la curva de energía potencial para los átomos de hierro en la gráfica que realizó para los gases nobles. Describe la curva en palabras y explica por qué dibujaste la curva como lo hiciste.
¿Tiene sentido lo que predijo para el hierro?
D4.6 Fuerzas Entre Átomos
Con base únicamente en datos experimentales de gases nobles, se podría predecir que el hierro sería un gas a temperatura ambiente, pero el hierro es un sólido. Las fuerzas atractivas entre los átomos de hierro deben ser mucho más fuertes que las fuerzas atractivas entre los átomos de gas noble. Para dar sentido a la diferencia entre xenón y hierro, necesitamos un mejor modelo de fuerzas entre átomos.
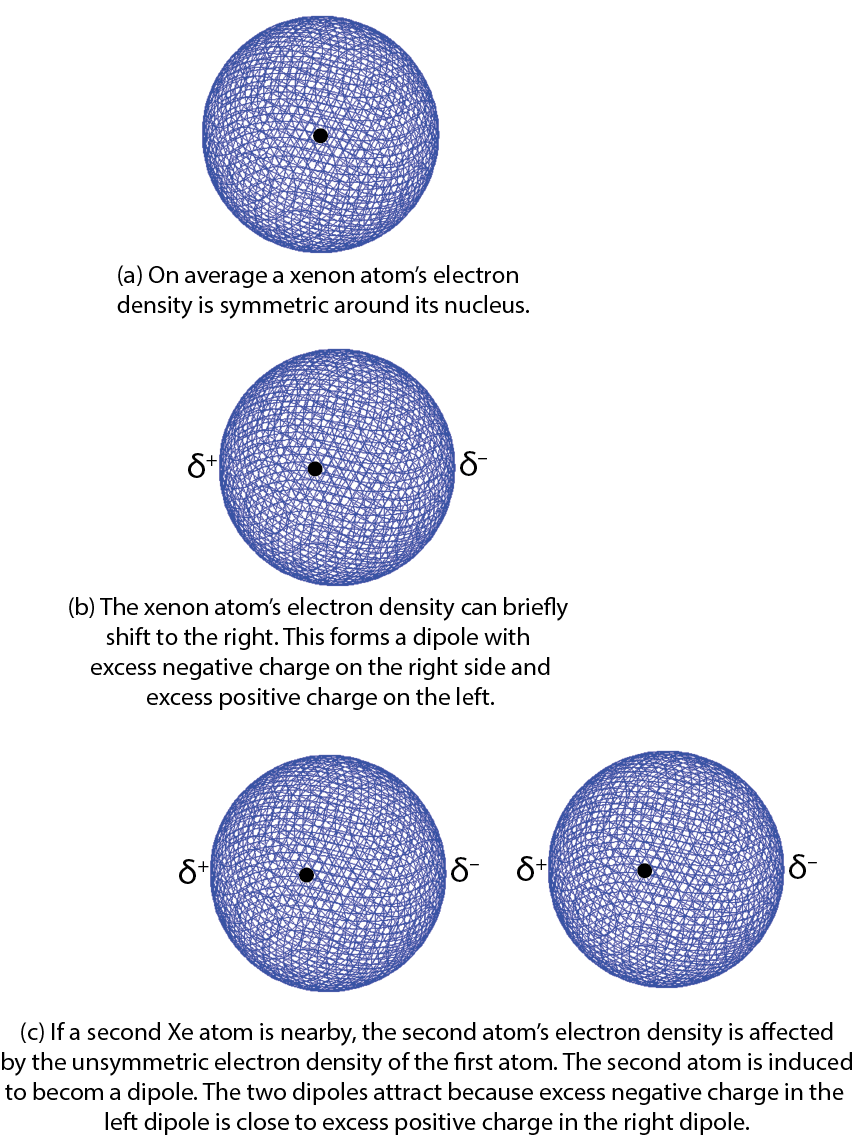 Figura 4. Explicación simplificada de la atracción entre dos átomos de Xe.
Figura 4. Explicación simplificada de la atracción entre dos átomos de Xe.
Empecemos por pensar en las atracciones entre los átomos de xenón. En promedio, la distribución de densidad electrónica de los 54 electrones que rodean un núcleo de xenón es esféricamente simétrica. Es decir, no importa en qué dirección vayas desde el núcleo, la densidad de electrones es la misma a la misma distancia del núcleo. Sin embargo, puede haber desviaciones o fluctuaciones muy breves con respecto a este promedio. En 1928 el físico germano-estadounidense Fritz London utilizó la mecánica cuántica para mostrar cómo tales fluctuaciones podrían conducir a fuerzas atractivas entre los átomos y otras partículas de escala atómica.
Aquí hay una explicación simplificada usando un átomo de Xe como ejemplo. Considera una fluctuación en la que hay un poco más de densidad de electrones en un lado del núcleo que en el otro. Una desviación tan breve crea un dipolo, una distribución de la carga eléctrica donde un lado es más positivo y el otro lado es más negativo. El dipolo solo ocurre por un instante y por lo tanto se llama dipolo instantáneo. Esto se muestra en la Figura 4, partes a y b, donde δ + y δ − indican fracciones diminutas de la carga de un electrón.
Si un segundo átomo de Xe está cerca del primero cuando se forma el dipolo instantáneo, por ejemplo, a la derecha del primero como en la Figura 4, parte c, el exceso de carga negativa a la derecha del primer átomo de Xe repele los electrones en el segundo átomo de Xe. Esto forma un segundo dipolo, nuevamente por solo un instante. Se dice que el segundo dipolo es inducido por el primero. El extremo cargado positivamente del segundo dipolo es atraído hacia el extremo cargado negativamente del primer dipolo. Por el instante en que existen los dipolos, existe una débil atracción entre los dos átomos.
Estas débiles fuerzas atractivas debido a fluctuaciones instantáneas en la densidad electrónica se llaman fuerzas de dispersión de Londres; a menudo nos referiremos a ellas como LDF. Las LDF están presentes entre todas las partículas a escala atómica: átomos, moléculas e iones. El tamaño de la fuerza de atracción depende del número de electrones en una partícula y de la facilidad con la que la distribución de la densidad de electrones puede distorsionarse a partir de su forma promedio.
D4.7 Metales
Basado en el punto de ebullición del hierro de 3135 K (2862 °C), las fuerzas entre los átomos de hierro deben ser mucho mayores que solo LDF. Lo que ya has aprendido sobre la estructura atómica, la carga nuclear efectiva y los electrones de valencia se puede utilizar para dar sentido a las fuerzas mucho mayores que atraen a los átomos de hierro, así como a los átomos de otros metales.
Los metales, que incluyen la mayoría de los elementos de la tabla periódica (Figura 5), tienen propiedades macroscópicas características: conducen bien el calor y la electricidad cuando son sólidos o líquidos; tienen superficies sólidas lustrosas (de aspecto metálico); y se deforman, en lugar de quebrarse, cuando martillado (son maleables). Muchos metales son duros, bastante fuertes y útiles como materiales de construcción. ¿Qué da origen a estas características?
Las sustancias metálicas están hechas de átomos cuyo electrón o electrones de valencia pueden ser eliminados con cantidades relativamente bajas de energía; es decir, elementos con energías de ionización relativamente bajas. Los electrones de valencia de los metales experimentan una carga nuclear efectiva menor que los electrones de valencia de los no metales; por lo tanto, los metales tienden a formar iones positivos y los no metales tienden a formar iones negativos.
En un sólido metálico, los átomos se empaquetan estrechamente (Figura 6). Un modelo describe los metales sólidos a escala atómica como átomos rodeados por electrones de valencia móviles, un llamado “mar” de electrones. Cada “átomo” consiste en los electrones núcleo y núcleo; es decir, un ion cargado positivamente que ha perdido todos sus electrones de valencia. Los electrones de valencia poco unidos son compartidos (deslocalizados) entre muchos átomos diferentes. Las atracciones electrostáticas entre el mar de electrones de valencia compartida y los iones metálicos se conocen como unión metálica. La fuerza de la unión metálica aumenta a medida que aumenta el número de electrones de valencia compartidos en el mar de electrones.
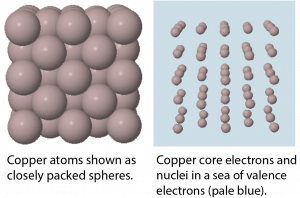
Debido a que los electrones de valencia están deslocalizados sobre muchos átomos metálicos, si un átomo se mueve con relación a otros, la atracción entre los electrones de valencia y los núcleos atómicos permanece; es decir, la unión metálica no es específica de una dirección particular. Esta característica explica muchas de las propiedades físicas observadas de los metales.
Día 4 Pre-Clase Podia Problema: Combinaciones Químicas
Este problema de Podia se basa en el material de pre-clase actual; trabajar a través de ese material te ayudará a resolver el problema.
Cuando los no metales se combinan con otros no metales, los compuestos se forman con subíndices que son números enteros pequeños, como CO y CO 2. Cuando los metales se combinan con los no metales, las fórmulas de los compuestos son análogas, como FeCl 2 y FeCl 3. Cuando los metales se combinan con otros metales, sin embargo, forman aleaciones, sustancias que tienen propiedades metálicas pero pueden consistir en muchas composiciones diferentes. Por ejemplo, el sodio y el potasio pueden formar aleaciones en las que la relación de átomos de sodio a átomos de potasio varía de todo el sodio a todo el potasio. Por lo tanto, si escribiste una fórmula para la aleación de sodio-potasio como Na x K, x podría tener cualquier valor de cero a infinito.
Piensa por qué los metales deberían ser diferentes de esta manera. Después escribe una explicación para los diferentes comportamientos.
Dos días antes de la próxima sesión de toda la clase, esta pregunta de Podia se pondrá en vivo en Podia, donde podrás enviar tu respuesta.


