1.5: Día 5- Compuestos Ionicos; Enlace Covalente
- Page ID
- 78754
5
Día 5: Compuestos Ionicos; Enlace Covalente
Aplicación de ideas centrales: dos sustancias, algunas similitudes, algunas grandes diferencias


Compare el hierro, que se funde a 1811 K (1538 °C), y el fluoruro de calcio, que se funde a 1691 K (1418 °C). ¿Las fuerzas entre las partículas de nivel atómico son similares en el fluoruro de hierro y calcio? Escribe en tu cuaderno una explicación de tu respuesta a esta pregunta.
Considere algunas otras propiedades del fluoruro de hierro y calcio.
El hierro tiene propiedades metálicas típicas: el hierro sólido puro tiene brillo metálico, es maleable y conduce electricidad.
El fluoruro de calcio tiene propiedades significativamente diferentes: como sólido es quebradizo, no se ve metálico y no conduce electricidad; aunque cuando se funde, el fluoruro de calcio conduce la electricidad.
Parece que estas dos sustancias tienen atractivos similares entre partículas de nivel atómico, pero propiedades bastante diferentes. Necesitamos un mejor modelo a escala atómica para dar sentido a estas diferencias.
D5.1 Compuestos Iónicos
En los metales, que tienen bajas cargas nucleares efectivas (y bajas energías de ionización), es relativamente fácil formar iones positivos dentro de un mar de electrones para que las atracciones entre los iones y los electrones mantengan unidos a los átomos. ¿Qué sucede cuando un átomo con una energía de ionización baja interactúa con un átomo con una gran afinidad electrónica negativa? En tal caso, la transferencia de uno o más electrones desde el átomo con la baja energía de ionización al que tiene la alta afinidad electrónica puede ser energéticamente favorable. Por ejemplo, considere la transferencia de un electrón de un átomo de Li a un átomo de F para formar un catión y un anión muy juntos: un par iónico, Li + F —.
A partir de la actividad anterior, has averiguado que la formación del par iónico está asociada con un Δ E negativo: el par iónico unido es menor en energía total (más estable) que los dos átomos a partir de los cuales se formó.
La ganancia y pérdida de electrón (s) en la formación de un par iónico típicamente da como resultado un octeto completo para el catión y anión. Por ejemplo:
Na ([Ne] 3 s 1) + Cl ([Ne] 3 s 2 3 p 5) ⟶ Na + ([Ne]) + Cl( [Ar])
Mg ([Ne] 3 s 2) + O (1 s 2 2s 2 2 p 4) ⟶ Mg 2 + ([Ne]) + O 2- ([Ne])
Ca ([Ar] 4 s 2) + 2F (1 s 2 2s 2 2 p 5) ⟶ Ca 2 + ([Ar]) + 2F( [Ne])
Cuando se forma una gran cantidad de iones, los aniones y cationes forman una estructura, llamada red cristalina iónica, donde hay igual número de aniones y cationes (por lo que hay cero carga eléctrica total); en la red cada anión tiene varios cationes como sus vecinos más cercanos, y cada catión tiene varios aniones como su vecinos más cercanos (ver ejemplo en la Figura 1). Esta disposición maximiza las atracciones anión-catiónicas (menor r da como resultado una menor energía de la ley de Coulomb) y minimiza las repulsiones anión-anión y catión-catión (mayor r entre aniones y entre cationes). Un compuesto compuesto por aniones y cationes se llama compuesto iónico y la atracción general que hace estable una red cristalina iónica se llama enlace iónico.
Por ejemplo, cuando los cationes de sodio (Na +) y los aniones bromuro (Br −) se unen, la red cristalina del compuesto bromuro de sodio, Figura 1, contiene un Na + (verde) por cada Br − (violeta). La fórmula química que representa la parte de la red que se muestra en la Figura 1 es Na 75 Br 75 porque hay 75 iones Na + y 75 Br −. El cristal real es mucho más grande por lo que los subíndices en la fórmula de un cristal real serían enormes. Una unidad de fórmula es un grupo de símbolos químicos que indica la relación de número entero más pequeña de iones de cada tipo que componen la sustancia, y se usa típicamente como fórmula para compuestos iónicos. Así, la unidad de fórmula (y la fórmula) para bromuro de sodio es NaBr.
Todas las sustancias químicas son en general eléctricamente neutras. Así, en un compuesto iónico, la carga positiva de todos los cationes debe ser igual a la carga negativa de todos los aniones. Es decir, los subíndices en una unidad de fórmula de un compuesto iónico deben dar como resultado cantidades iguales de cargas positivas y negativas. Si conocemos las cargas de los iones, entonces podemos escribir la fórmula.
Algunos iones consisten en un grupo de átomos con una carga global. Los ejemplos son dianión sulfato, SO 4 2 −, anión dihidrógeno fosfato, H 2 PO 4 −, y catión amonio, NH 4 +. Es bastante útil poder reconocer tales iones poliatómicos y sus cargas. Si necesitas refrescar tus conocimientos de iones poliatómicos, usa la tabla de referencia como haces los siguientes dos ejercicios.
Energía de celosía D5.2
Refiérase a la Actividad 1. El tercer paso consistió en acercar un ion Li + a un ion F −, lo que redujo la energía. Cuando un gran número de iones con carga opuesta se acercan para formar una red cristalina (Figura 1), la energía se reduce aún más, porque hay más iones muy cercanos en una estructura donde predominan las fuerzas atractivas sobre las fuerzas repulsivas.
La energía reticular de un compuesto iónico se define como la disminución de energía cuando la red cristalina iónica se forma a partir de los iones separados. La energía de celosía se puede calcular usando una forma modificada de la ley de Coulomb; algunas energías de celosía calculadas se encuentran en la Tabla 1. (Obsérvese que debido a que la energía de la red se define como una disminución de la energía, una gran energía de celosía positiva corresponde a un δ E negativo grande, es decir, un sólido iónico muy estable (baja energía)).
| Sustancia | Energía de celosía (kJ/mol) | ||||||
|---|---|---|---|---|---|---|---|
| NaI | 682 | ||||||
| CAi 2 | 1971 | ||||||
| MgI 2 | 2293 | ||||||
| NaOH | 887 | ||||||
| Na 2 O | 2481 | ||||||
| Nano 3 | 755 | ||||||
| Ca 3 (PO 4) 2 | 10,602 | ||||||
| CaCo 3 | 2804 | ||||||
| Cuadro 1. Energías de celosía calculadas representativas. Datos de CRC Handbook of Chemistry and Physics (2004). | |||||||
Las energías de celosía tienen un amplio rango de valores dependiendo de qué iones componen un compuesto. Considere, por ejemplo, por qué la energía de celosía aumenta a medida que pasa de NaI, a CaI 2, a MgI 2 (primeras tres filas en la Tabla 1).
Según la ley de Coulomb,
\[E_{\text{p}} = k_e\frac{Q_1Q_2}{r} \nonumber \]
la energía reticular es directamente proporcional a los tamaños de las cargas sobre los iones e inversamente proporcional a la distancia entre ellos (la suma de sus radios iónicos). Así, podemos comparar NaI, CaI 2 y MgI 2 con respecto a magnitudes de cargas y tamaños de iones.
Magnitudes de Cargas: NaI consiste en 1+ iones y 1− iones; CaI 2 y MgI 2 consisten en 2+ iones y 1− iones.
Debido a que la magnitud de Q 1 Q 2 es mayor, las energías de celosía de CaI 2 y MgI 2 deberían ser mayores que para NaI.
Tamaños de iones: Los tres compuestos contienen aniones I −, por lo que solo necesitamos comparar los radios cationes.
Los radios de Ca 2 + y Na + son similares. Esto se puede estimar a partir de la tabla periódica: Na + y Ca 2 + son ambos menores que K +, Na + porque está por encima de K + en la tabla periódica, y Ca 2 + porque es isoelectrónico con K+ pero tiene más protones en el núcleo. Es razonable suponer que los radios no son muy diferentes, y la tabla de radio iónico lo confirma: Na + 116pm; Ca 2 + 114pm. Por lo tanto, r no es un factor importante que afecte la energía de la red para NaI y CaI 2.
El radio de Mg 2 + es significativamente menor que para Ca 2 + (y Na +) porque Mg está directamente por encima de Ca en la tabla periódica y los iones tienen la misma carga. Por lo tanto, MgI 2 debe tener una energía reticular mayor que CaI 2, lo que es consistente con los valores de la tabla.
Al mirar la Tabla 1, es posible que haya notado que las energías de celosía para compuestos que contienen iones 2+ y 2− son casi cuádruples las de compuestos similares que contienen iones 1+ y 1− de tamaño similar (compare NaN 3 y CaCo 3). Esta observación es consistente con la regla general de que las energías reticulares son las más altas para las sustancias con iones pequeños y altamente cargados.
D5.3 Propiedades de los Compuestos Ionicos
Las propiedades físicas y químicas de un compuesto iónico están determinadas por los iones que constituyen el compuesto. Las propiedades del compuesto son bastante diferentes de las propiedades de los elementos que reaccionaron para formar el compuesto. Por ejemplo, tanto el sodio como el cloro reaccionan con el agua, pero el cloruro de sodio (NaCl) se disuelve en agua sin reaccionar. Es decir, los iones sodio y los iones cloruro no reaccionan con el agua, pero sí los átomos de sodio y las moléculas de Cl 2.
https://mediaspace.wisc.edu/id/0_zns... &st=137&ed=154
Los compuestos iónicos tienen muchas propiedades físicas en común:
- suelen tener puntos de fusión y puntos de ebullición muy por encima de la temperatura ambiente.
- son sólidos cristalinos con distintas formas cristalinas
- son quebradizos, se romperán si son golpeados por un martillo, y se pueden escindir fácilmente (escindir significa romperse a lo largo de planos lisos, como se muestra en este video).
- son aisladores eléctricos cuando son sólidos pero conducen electricidad cuando están fundidos (líquidos). (Ver este video.)
- cuando un compuesto iónico se disuelve en agua, la solución conduce la electricidad de manera mucho más efectiva que el agua pura.
Debido a que todos los compuestos iónicos tienen propiedades similares, es útil para poder identificar un compuesto iónico a partir de su fórmula química. En general, los compuestos iónicos contienen cationes de metales del lado izquierdo de la tabla periódica y aniones de no metales del lado derecho de la tabla periódica. Si la fórmula química de un compuesto contiene un ion poliatómico, entonces el compuesto es un compuesto iónico.
Las propiedades de los compuestos iónicos se pueden interpretar en términos de iones. En la fase sólida, los iones se fijan esencialmente en sus posiciones en una red cristalina. Las formas de celosía dependen del número y tipo de iones en la fórmula, pero cada celosía tiene una forma distintiva que da como resultado la energía más baja (energía máxima de la red). Debido a que las distancias entre iones son pequeñas, las energías de celosía son grandes. Se requiere de mucha energía para superar las atracciones entre los iones, haciendo que el cristal sea duro. La forma de celosía está relacionada con la forma del cristal macroscópico. Cuando un cristal se escinde, los planos de escisión son paralelos a los planos de la red cristalina. (Para ver por qué, mira este video.)
Cuando un sólido iónico se funde, los aniones y cationes son libres de moverse aleatoriamente entre sí. Aunque la distancia mínima promedio entre iones es todavía pequeña (solo un poco más grande que en el sólido cristalino), algunos aniones pueden estar al lado de otros aniones y algunos cationes cerca de otros cationes. De ahí que las atracciones electrostáticas no sean tan fuertes y las repulsiones electrostáticas son mayores que en la fase sólida; es decir, parte de la energía de la red necesita ser superada antes de que un compuesto iónico se derrita.
Cuando un compuesto iónico hierve para formar un gas, los iones continúan moviéndose aleatoriamente pero también están tan separados que sus atracciones electrostáticas son insignificantes. Toda la energía de la red debe ser superada para que un compuesto iónico hierva.
La corriente eléctrica es el movimiento de la carga eléctrica de un lugar a otro. La carga eléctrica es transportada por cualquier partícula cargada en movimiento. En un compuesto iónico líquido, donde los iones pueden moverse independientemente, la carga eléctrica es conducida por iones. Cuando un compuesto iónico sólido se disuelve en agua, los iones se separan y pueden moverse independientemente a lo largo de la solución. El movimiento de iones conduce la electricidad a través de la solución, tal como lo hace en el líquido fundido.
Actividad 5: Reflexión
En tu cuaderno de curso, anota tantas propiedades de los metales y de los compuestos iónicos como puedas recordar. Luego verifica para que tu lista esté completa. Luego escribe tu explicación para cada propiedad en términos de iones, celosías cristalinas, fuerzas atractivas y energía. Asegúrese de que su lista proporcione un buen resumen que pueda usar para revisar más tarde para un examen.
Aplicación de ideas centrales: comparando átomos de hidrógeno y átomos de helio
El punto de ebullición del helio es de 4.22 K (−268.93 °C), consecuencia de las muy débiles fuerzas de dispersión de Londres (LDF) entre los átomos de He. Incluso cuando dos átomos de Él están a poca distancia de distancia, hay muy poca atracción.
Cuando dos átomos de H se acercan hay una atracción mucho más fuerte: los dos átomos se convierten en una molécula H 2 al formar un enlace químico covalente. Para que las moléculas H 2 tengan suficiente energía para romper ese enlace, separando los dos átomos de H, ¡la temperatura necesita ser similar a la temperatura del Sol (5778 K)!
¿Por qué los átomos de Él se comportan tan diferente de los átomos H? Necesitamos refinar aún más nuestros modelos de estructura y energía. Esto se hace en las siguientes secciones.
D5.4 Enlace Covalente: Orbitales Moleculares
Actividad 6: Enlaces Químicos Covalentes
En su cuaderno, escriba algunas frases que describan su comprensión de los enlaces químicos covalentes. ¿Qué constituye un enlace covalente? ¿Cómo se forma? ¿Qué mantiene unidos los átomos en una molécula? A medida que trabaje a través de esta sección, tome notas adicionales para revisarlas más adelante.
Si escribiste que un enlace covalente implica compartir electrones entre átomos, ese es un buen comienzo. Pero, ¿cómo el compartir electrones mantiene unidos a los átomos?
Así como un equilibrio de las atracciones y repulsiones de la ley del culombo afecta al (los) electrón (s) y al núcleo de un átomo, las interacciones culómbicas afectan a los electrones y núcleos de una molécula. La principal diferencia es que en una molécula, cada electrón interactúa con dos o más núcleos; esta interacción adicional proporciona la estabilización que permite que la molécula exista. Si una colección de átomos separados fuera más estable que una molécula, la molécula simplemente se desmoronaría en átomos individuales.
Así como el electrón (s) ocupa orbitales atómicos estables alrededor de un solo núcleo en un átomo, los electrones ocupan orbitales estables alrededor de múltiples núcleos en una molécula. Un orbital que se extiende sobre dos o más núcleos atómicos se llama orbital molecular (MO); en el modelo MO, se forma un orbital molecular cuando los orbitales atómicos (AO) se superponen (o interpenetran).
Para entender esto mejor, piense en la formación de una molécula H 2 a partir de dos átomos de hidrógeno en estado fundamental (etiquetados como H A y H B en la Figura 3). Cuando H A está lo suficientemente lejos de H B —por ejemplo, a más de 400pm de distancia (arriba de la Figura 3) —su electrón (e A) ocupa el orbital atómico de menor energía, el orbital de 1 s. Lo mismo es cierto para H B.
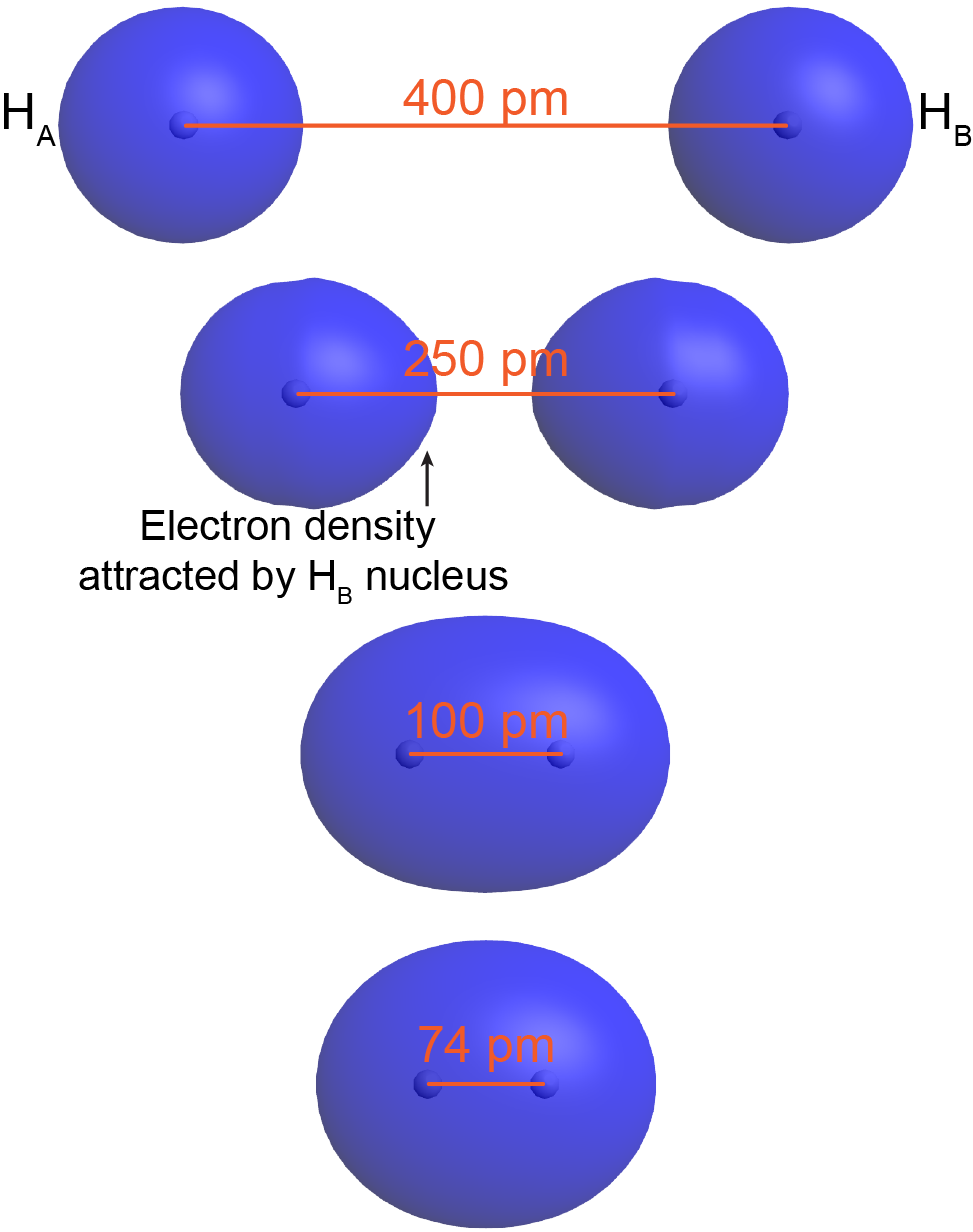
Cuando H A y H B están más cerca, e A comienza a experimentar una atracción significativa de la ley de culombios hacia el núcleo de H B. Por ejemplo, a 250pm de diferencia (Figura 3, segundo desde arriba) el orbital ocupado por e A ya no es esférico alrededor del núcleo de H A, sino que está distorsionado, hay más densidad de electrones en el lado hacia H B. Aunque el núcleo de H A atrae a e A con mayor fuerza que el núcleo de H B (porque el núcleo de H B es tamizado por e B), hay un aumento neto en la carga positiva que interactúa con e A. Esto disminuye la energía potencial de e A. El mismo argumento se aplica a e B.
Cuando los dos átomos están aún más cercanos —por ejemplo, 100pm separados— e A y e B se deslocalizan sobre ambos núcleos: ambos electrones ocupan un orbital molecular, que rodea ambos núcleos. Observe que en este orbital molecular H 2, existe una densidad de electrones significativa entre los dos núcleos, atrayendo a ambos núcleos. Esto disminuye la energía general en relación con la energía de los dos átomos de hidrógeno separados.
A medida que los dos átomos se acercan aún, hay un mínimo en la energía general para la molécula. Para H 2 el mínimo es a las 74 pm (parte inferior de la Figura 3). A distancias internucleares menores a 0.74 Å, la energía vuelve a subir debido al aumento de la repulsión núcleo-núcleo. En una molécula H 2 en estado fundamental la distancia entre núcleos de dos átomos unidos, la longitud del enlace, es de 74 pm.
La Figura 4 le permite explorar cómo cambia la densidad de electrones a medida que dos átomos de H interactúan para formar H 2 (o cómo una molécula H 2 se disocia en dos átomos H separados). El punto azul en la curva de energía potencial muestra la distancia internuclear correspondiente (longitud del enlace) y la energía potencial de la molécula. La molécula H 2 en estado fundamental es más estable que los dos átomos H en estado fundamental separados. (La energía de los átomos separados se establece en 0 kJ/mol en la Figura 4.) La magnitud de la reducción de energía, 436 kJ/mol, se llama energía de enlace, la energía requerida para romper el enlace, separando completamente los átomos.
Lo que acabamos de describir es una de las dos formas en que los dos orbitales atómicos H 1 s pueden superponer/combinar para formar un orbital molecular H 2. Ocurre cuando los dos orbitales atómicos de 1 s están en fase. En fase significa que las funciones de onda que describen los electrones A y B tienen máximos en la misma dirección al mismo tiempo.
La segunda posibilidad es que los dos orbitales atómicos superpuestos de 1 s estén desfasados, lo que significa que una función de onda atómica es positiva y la otra función de onda atómica es negativa. Esto se muestra en la Figura 5, donde las dos fases (positiva y negativa) se muestran en verde y amarillo.
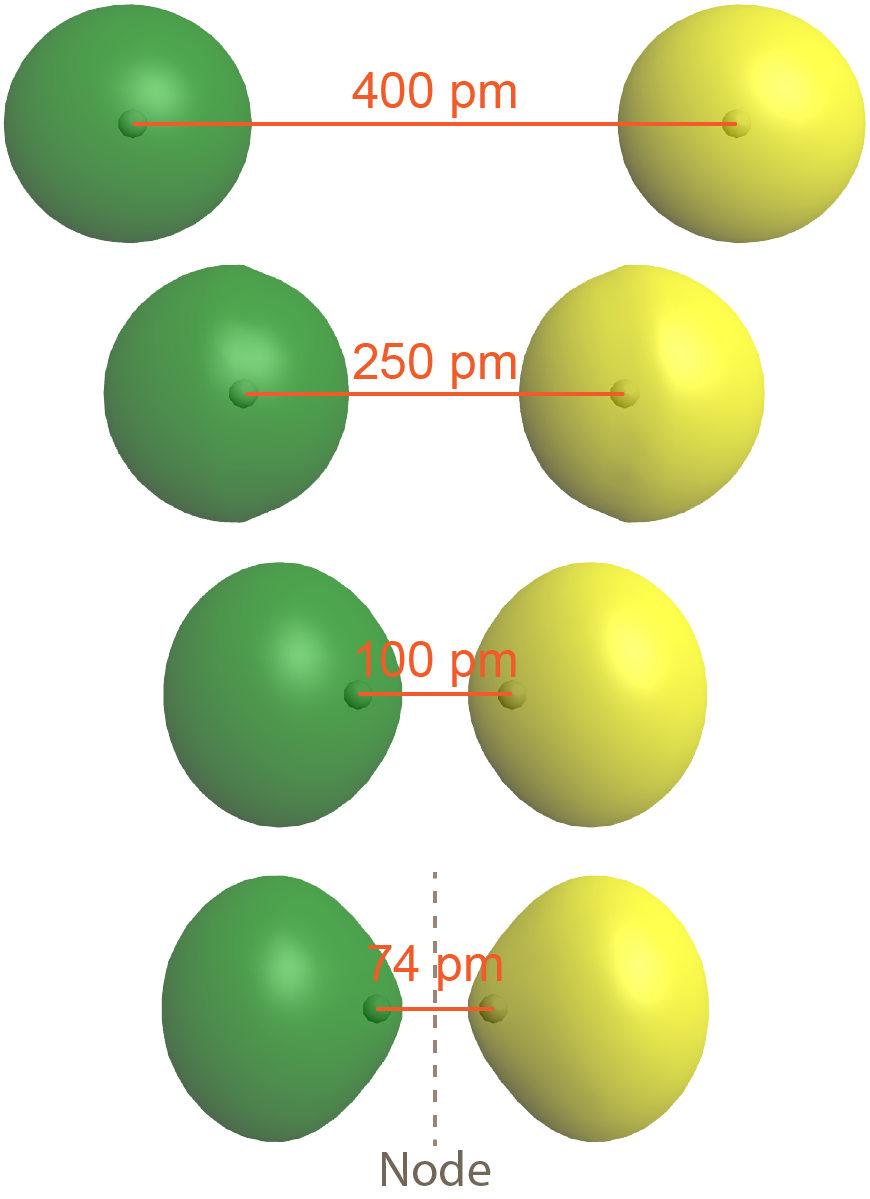
El resultado es un orbital molecular con un nodo a medio camino entre los dos átomos de H. (El nodo, donde la densidad electrónica es cero, es un plano perpendicular a una línea que conecta los dos núcleos, el eje internuclear). Obsérvese que la representación inferior en la Figura 5 es un orbital molecular único con un nodo, así como la representación inferior en la Figura 3 es un orbital molecular único pero sin un nodo.
Como es cierto de los orbitales atómicos, un orbital molecular con más nodos tiene mayor energía, lo que tiene sentido porque la presencia del nodo reduce la densidad de electrones entre los núcleos (en comparación con las densidades de electrones de los átomos individuales). Esta reducción en la densidad de electrones da como resultado una menor atracción electrón-núcleo que si los orbitales atómicos no hubieran interactuado en absoluto.
Diagrama orbital molecular (MO) D5.5
Cuando dos átomos de H se unen para formar H 2, tanto el solapamiento en fase como el solapamiento fuera de fase de los orbitales atómicos de 1 s son posibles y ambos ocurren. De ahí que dos orbitales atómicos (AO) de 1 s se superpongan para formar dos orbitales moleculares (MO). Esto es cierto en general: el número de MO formados es igual al número total de OA de los que se derivan.
Un diagrama de MO muestra las energías relativas de MO y AO e indica qué MO se forman a partir de la superposición de qué AO. Por ejemplo, la Figura 6 muestra el diagrama MO de la molécula H2. Un MO menor en energía que los AOs de los que se deriva se denomina MO de unión. Un electrón que ocupa este MO de unión aumenta la estabilidad del enlace (fortalece el enlace). El MO de unión H 2 está etiquetado como “σ 1 s”; el subíndice “1 s” designa que se deriva de los AOs de 1 s.
Un MO mayor en energía que los AO de los que se deriva se denomina MO antienlace, un electrón que ocupa este MO disminuye la estabilidad del enlace (debilita el enlace). El MO antiadhesión H 2 se etiqueta como “.”; el “*” denota que es un MO antiunión.
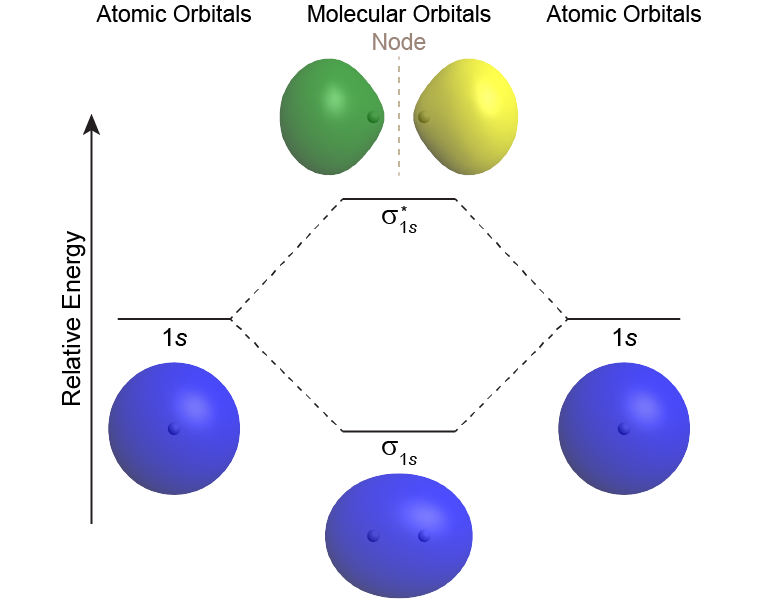
La letra griega en las etiquetas MO denota la simetría del MO con respecto al eje internuclear (la línea que conecta los dos núcleos). Las letras griegas σ, π, δ son análogas a las letras romanas s, p, d que designan formas de orbitales atómicos. Un MO que es simétrico cilindricamente se llama sigma MO y se designa σ. (Cilíndricamente simétrico significa que si colocas la molécula en el extremo y la haces girar alrededor del eje internuclear, se vería igual todo el tiempo, así como un cilindro se vería si la pararas de punta y la giraras).
Los químicos suelen utilizar dibujos 2D simples para mostrar tanto la forma como la fase de los AOs y los MO. Por lo que la esfera de un 1s AO se dibuja como un círculo y su fase se indica por dos colores diferentes o sombreado/sin sombreado o signo más/menos. Por ejemplo, la formación del MO de σ 1 s a partir de dos AOs de 1 s se puede dibujar como:

donde los puntos negros representan núcleos H, los círculos con eclosión (o signo +) representan gráficas de superficie límite de H 1 s AO, cada uno con fase positiva, y el óvalo con eclosión (o signo +) representa el MO H 2 σ 1 s, también con fase positiva.
Configuraciones de electrones D5.6 y orden de enlace
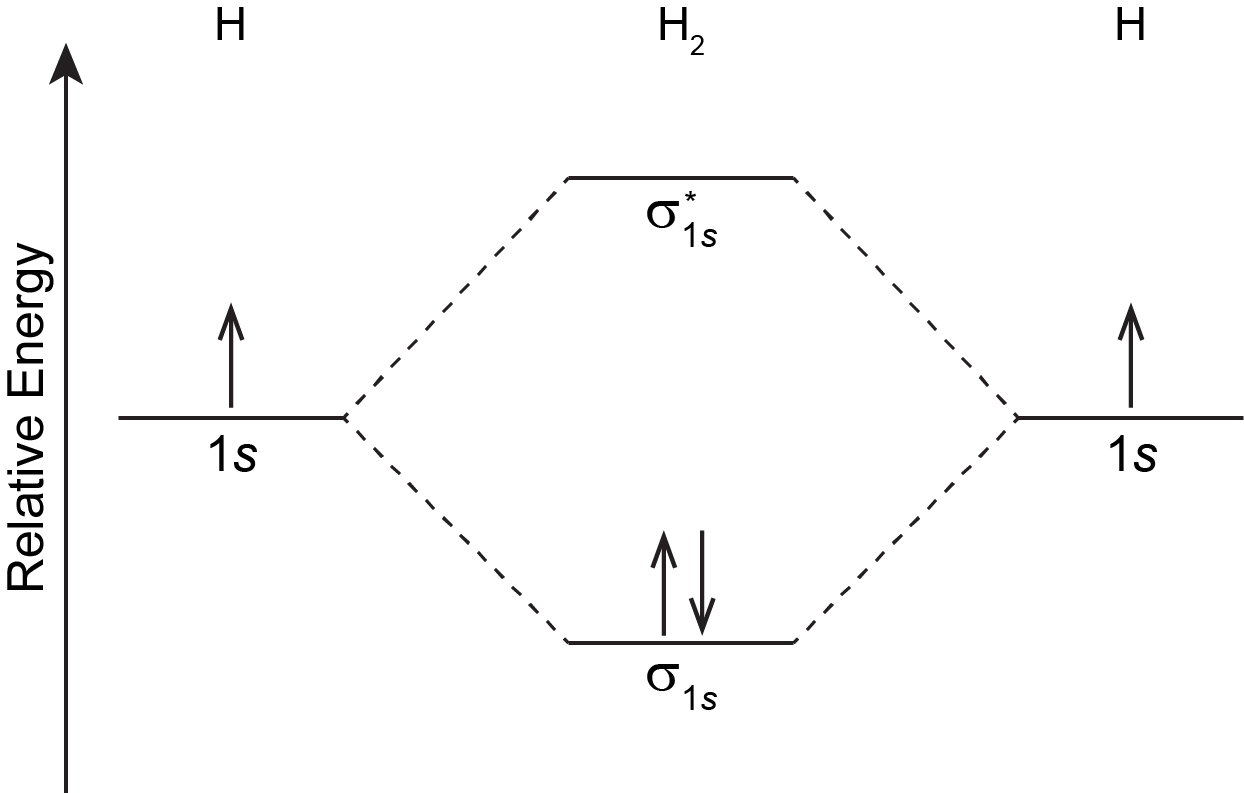
Así como un átomo tiene una configuración electrónica, también lo hace una molécula. La configuración de electrones en estado fundamental molecular se puede obtener rellenando MO, facilitado por diagramas MO como el que se muestra en la Figura 6, siguiendo reglas similares a las de las configuraciones de electrones atómicos:
- Suma todos los electrones de todos los átomos que componen la molécula.
- Cada MO puede contener como máximo dos electrones. (Dos electrones que ocupen el mismo orbital deben tener espín opuesto).
- En el diagrama MO los MO están dispuestos en orden de aumento de energía.
- Agregue electrones al MO de menor energía primero y luego a los MOs sucesivamente de mayor energía (principio Aufbau)
- Si dos o más MO tienen la misma energía (son degenerados), aplique la regla de Hund: asignar un electrón a cada MO degenerado antes de emparejar cualquier electrón
Para la molécula H 2: hay un electrón de cada átomo de H, por lo que hay dos electrones en H 2. Solo hay un MO de menor energía, σ 1 s, por lo tanto los dos electrones, con giro opuesto, lo llenarán. La configuración electrónica del estado fundamental de H 2 es (σ 1 s) 2.
\[\sigma_{1s}\]
Actividad 7: Orbitales Moleculares y Radiación Electromagnética
Los dos electrones en el MO σ 1 s, que se comparten entre los dos átomos de H, forman un enlace covalente. La configuración (σ 1 s) 2 indica un enlace covalente sencillo sigma. En general, un enlace covalente implica la superposición de dos o más AO que conduce a densidades de electrones aumentadas cerca de los núcleos atómicos para que las energías de los electrones se reduzcan. Los electrones se comparten entre pares de núcleos atómicos, o más ampliamente entre varios núcleos dentro de una molécula.
En algunos casos se pueden compartir más de dos electrones entre dos núcleos. Esto da lugar a la idea de orden de enlace, que es el número de pares de electrones compartidos entre dos átomos. Usando un diagrama MO, el orden de bonos se puede definir como:
\[\text{Bond Order} = \dfrac{1}{2}\left(n_{\text{bonding e}^-} - n_{\text{antibonding e}^-}\right) = \dfrac{1}{2}(n_\text{b} - n_\text{a}) \nonumber \]
donde n unión ees el número de electrones en MoS de unión y n antienlace ees el número de electrones en MoS antiunión. Hay un factor 1/2 porque dos electrones compartidos hacen un enlace. En general, un mayor número de electrones compartidos significa un enlace más fuerte, por lo que cuanto mayor es el orden de enlace, más fuerte es el enlace.
Actividad 8: Orbitales Moleculares para Él
Día 5 Pre-Clase Podia Problema: Puntos de Fusión de las Sales
Este problema de Podia se basa en el material de pre-clase actual; trabajar a través de ese material te ayudará a resolver el problema.
A continuación se enumeran las fórmulas y puntos de fusión de cuatro sales. Los cuatro compuestos tienen la misma red cristalina que el NaCl. Escriba una explicación clara y concisa de las diferencias en los puntos de fusión utilizando un lenguaje científicamente apropiado e incluyendo cualquier dato relevante.
NaF 996 °C NaCl 801 °C KCl 770 °C CaO 2572 °C
Dos días antes de la próxima sesión de toda la clase, esta pregunta de Podia se pondrá en vivo en Podia, donde podrás enviar tu respuesta.


