2.2: Día 10- Orbitales Híbridos; Geometría Molecular
- Page ID
- 78961
9
Día 10: Orbitales Híbridos; Geometría Molecular
La teoría de los bonos de valencia y los orbitales híbridos se introdujeron en la Sección D9.7. Las ideas aquí resumidas se desarrollarán aún más en el trabajo de hoy:
- Los orbitales híbridos se derivan combinando dos o más orbitales atómicos de la capa de valencia de un solo átomo.
- Los AO son la disposición más estable de electrones en átomos aislados.
- Los orbitales híbridos son importantes en las moléculas porque resultan en una unión σ más fuerte.
- La mayoría de los enlaces σ se forman a partir de superposiciones de orbitales híbridos. La mayoría de los enlaces π se forman a partir del solapamiento de AO no hibridados.
- El número de orbitales híbridos es igual al número de AO de valencia que se combinaron para producir los orbitales híbridos.
- El tipo de orbitales híbridos para cada átomo unido en una molécula se correlaciona con la geometría 3D local de ese átomo.
- El tipo de orbitales híbridos para cada átomo se puede determinar a partir de la estructura de Lewis (o estructuras de resonancia) de una molécula.
- A partir de la geometría 3D local de cada átomo, podemos obtener la geometría 3D global de la molécula.
D10.1 Tipos de Orbitales Híbridos
sp Orbitales Híbridos
Combinando el AO de valencia con uno de los AO de valencia p produce dos orbitales híbridos sp degenerados, como se muestra en la Figura 1 para el caso de 2 s y 2 p AO. Los dos orbitales híbridos sp están orientados a 180° entre sí, una geometría lineal. Después de la hibridación, quedan dos AO de 2 p no hibridados en el átomo.
Debido a que estos orbitales híbridos se forman a partir de una s AO y una p AO, tienen una relación 1:1 de características “s” y “p”, de ahí el nombre “sp”. Una de las formas en que los orbitales híbridos exhiben sus características mixtas de “s” y “p” es en su energía. Específicamente, las energías relativas de los orbitales híbridos sp están aproximadamente a medio camino entre los AO de 2 s y 2 p, como se ilustra en la Figura 1.
Los orbitales hibridados no son energéticamente favorables para un átomo aislado. Por ejemplo, un átomo de berilio es menor en energía con sus dos electrones de valencia en el AO de 2 s que si los electrones estuvieran en los dos orbitales híbridos sp. Sin embargo, en una molécula covalente, el lóbulo grande de cada orbital híbrido sp da mayor solapamiento con otro orbital de otro átomo, produciendo enlaces σ que disminuyen la energía de la molécula.
sp 2 Hibridación
Combinando un AO de valencia y dos AO de valencia p produce tres orbitales híbridos sp 2 degenerados, como se muestra en la Figura 2 para el caso de 2 s y 2p AO. Los tres orbitales híbridos sp 2 están orientados a 120° uno con respecto al otro y están en el mismo plano, una geometría plana trigonal (o plana triangular). Cada orbital híbrido apunta hacia una esquina diferente de un triángulo equilátero. Después de la hibridación, queda un AO de 2 p no hibridado en el átomo.
Los orbitales híbridos sp 2 tienen el doble de carácter “p” que el carácter “s”; esto se indica con el superíndice “2” en sp 2. Energéticamente, los orbitales híbridos sp 2 se encuentran más cerca del p AO que del s AO, como se ilustra en la Figura 2 (los orbitales híbridos sp 2 son más altos en energía que los orbitales híbridos sp).
sp 3 Hibridación
Combinando un AO de valencia y los tres AP de valencia p produce cuatro orbitales hibridados sp 3 degenerados, como se muestra en la Figura 4 para el caso de 2 s y 2p AO. Los cuatro orbitales hibridados sp 3 están orientados a 109.5° uno con respecto al otro, cada uno apuntando hacia una esquina diferente de un tetraedro, una geometría tetraédrica.
Un tetraedro es un objeto tridimensional que tiene cuatro caras triangulares equiláteras y cuatro vértices (esquinas). Las cuatro esquinas son equivalentes. Ver Figura 3.

Figura 3. Un tetraedro tiene cuatro lados triangulares equiláteros y cuatro ápices (esquinas). A la izquierda se muestran tres vistas de un tetraedro. Cuatro orbitales hibridados sp 3 apuntan desde el centro del tetraedro hacia las cuatro esquinas. Estos orbitales híbridos forman cuatro enlaces que apuntan hacia cada esquina de un tetraedro. El ángulo entre dos enlaces cualesquiera es de 109.5 grados.
Un orbital híbrido sp 3 tiene 75% carácter “p” y 25% carácter “s”, una relación 3:1, de ahí el superíndice “3” en su nombre. Los orbitales híbridos sp 3 tienen mayor energía que los orbitales híbridos sp 2, como se ilustra en la Figura 4.
Formación de un enlace σ
Cuando se forma un enlace σ entre dos átomos, un orbital híbrido con un electrón desapareado de un átomo se solapa con un orbital híbrido con un electrón desapareado del otro átomo. El enlace σ resultante es un orbital que contiene un par de electrones (así como una línea en una estructura de Lewis representa dos electrones en un enlace σ). Por ejemplo, la Figura 5 muestra la formación de un enlace C-C σ a partir de dos átomos de carbono hibridados sp 3.
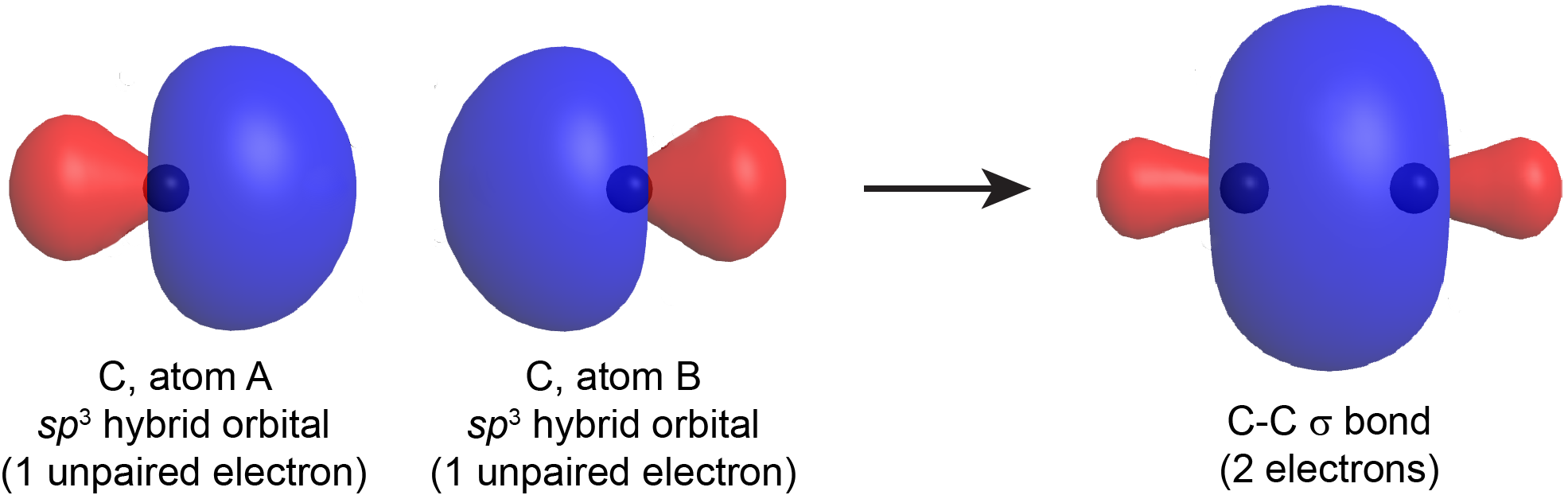
El enlace σ así formado por dos orbitales híbridos (teoría del enlace de valencia) es similar a un enlace σ formado en una molécula diatómica como se describe en la teoría MO (Sección D5.5). En las moléculas poliatómicas con más de tres átomos, los MO no se localizan entre dos átomos así, sino que en la teoría de los enlaces de valencia, los enlaces se describen individualmente, entre cada par de átomos unidos. Observe que en la teoría del enlace MO o de valencia, el enlace σ tiene una simetría cilíndrica con respecto al eje de unión.
Si un orbital hibridado sobre un átomo en una molécula tiene dos electrones pero no apunta a otro átomo, el orbital híbrido relleno no está involucrado en la unión. Esto corresponde a un par solitario sobre un átomo en una estructura de Lewis.
D10.2 Predecir la geometría de los enlaces alrededor de un átomo
Una vez que haya dibujado la mejor estructura de Lewis (o un conjunto de estructuras de resonancia) para una molécula, puede usar la (s) estructura (s) para asignar hibridación a cada átomo, predecir la disposición geométrica de los enlaces alrededor de cada átomo y luego predecir la estructura 3D para la molécula. Esta y las siguientes secciones explican cómo funciona esto.
Para cada átomo en una molécula, determine el número de AO que se hibridan, n hyb, y use este valor para predecir la hibridación.
- Contar el número de enlaces σ (n σ) que forma el átomo.
- Un enlace doble (o triple) contiene 1 enlace σ y 1 (o 2) enlace (s) π.
- ¿Hay pares solitarios en el átomo?
- En caso afirmativo: n hyb = n σ + 1
- Si no: n hyb = n σ
- ¿La n hyb de un átomo es diferente en una estructura de resonancia de otra?
- En caso afirmativo, use el n hyb más pequeño para determinar la hibridación.
- Utilice el valor de n hyb para determinar el número de AO combinados y, por lo tanto, el tipo de hibridación:
- Para n hyb = 2, el átomo se hibrida sp (se combinan dos AO);
- para n hyb = 3, el átomo es sp 2 hibridado (se combinan tres AO);
- para n hyb = 4, el átomo es sp 3 hibridado (se combinan cuatro AO);
- Un átomo de H en una molécula tiene n hyb = 1. No se hibrida; su electrón está en el AO de 1 s al formar un enlace σ.
Estas reglas derivan de la idea de que los orbitales hibridados forman enlaces σ más fuertes. Por lo tanto, cuanto más σ se une a un átomo, más orbitales atómicos se combinan para formar orbitales híbridos.
Actividad 1: Geometría molecular de BeCl2
Actividad 2: Geometría molecular de BF3
D10.3 Geometría de unión tridimensional
Los dos ejemplos hasta el momento fueron una molécula lineal (unidimensional), BeCl 2, y una molécula plana (bidimensional), BF 3. ¿Qué sucede cuando una molécula es tridimensional?
Actividad 3: Geometría molecular de CH4
Actividad 4: Geometría molecular de NH3
Notación de cuña y guión
Las estructuras de Lewis en las actividades anteriores se dibujan usando notación de cuña y guión. Las líneas rectas representan enlaces en el plano de la página/pantalla, las cuñas sólidas representan enlaces que vienen hacia usted fuera del plano, y las cuñas discontinuas representan enlaces que se alejan de usted detrás del plano.
Examine este modelo 3D de NH 3 y gírelo hasta que parezca la estructura de Lewis dibujada en la respuesta en la Actividad 4. La molécula NH 3 tiene geometría piramidal trigonal porque el par solitario sobre nitrógeno ocupa una de las esquinas de un tetraedro, dejando los tres enlaces N-H ocupando las otras tres esquinas; esto da una pirámide de tres esquinas.
Redibuja la estructura de Lewis que dibujaste para el amoníaco en la Actividad 4 usando la notación de cuña y guión. Después, gira el modelo 3D hasta que coincida con tu dibujo. Si puedes encontrar una orientación que coincida, tu estructura de Lewis de cuña y guion probablemente sea correcta; si no puedes encontrar una coincidencia, tu estructura de Lewis probablemente sea incorrecta.
Para simplificar, una estructura de Lewis en cuña dibuja tantos como sea posible de los enlaces de una molécula en un plano. Sin embargo, como es el caso de CH 4 y NH 3, la mayoría de las moléculas no tienen todos los enlaces en un mismo plano.
Moléculas D10.4 con más de un átomo central
Las moléculas más grandes tienen más de un átomo “central” con varios otros átomos unidos a él. La disposición de los enlaces para cada átomo central se puede predecir como se describe en las secciones anteriores. La forma en que estas estructuras locales se orientan unas con respecto a otras influye en la forma molecular general.
Actividad 5: Moléculas con Varios Átomos Centrales
Doble y Triple Bonos
La estructura de Lewis del eteno, C 2 H 4, muestra que cada átomo de carbono está rodeado por otro átomo de carbono y dos átomos de hidrógeno:
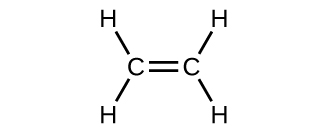
Cada átomo de carbono tiene n hyb = 3 y por lo tanto es sp 2 hibridado. Alrededor de cada átomo de C hay tres enlaces en un plano. Dos de los orbitales sp 2 forman dos enlaces C—H σ y el tercer orbital sp 2 forma un enlace C-C σ.
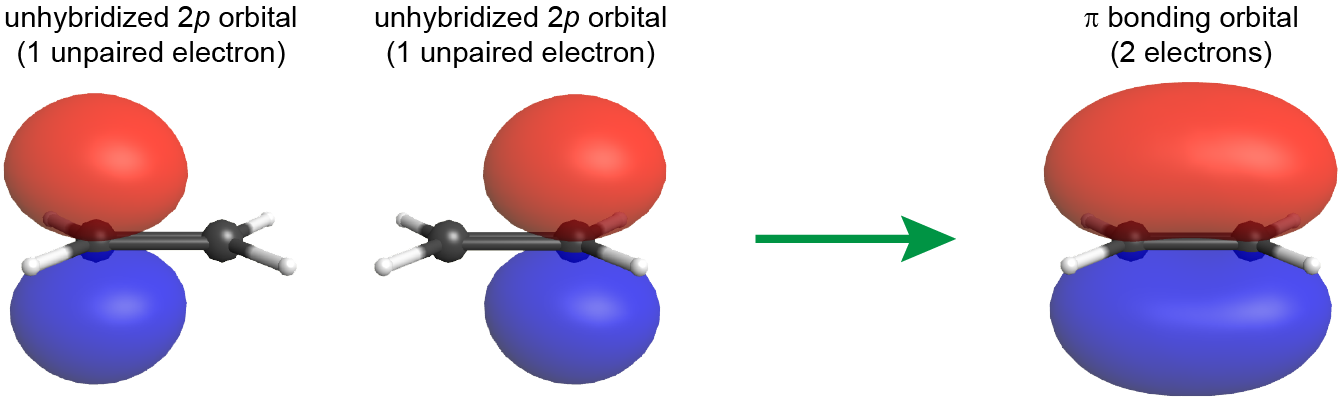
El doble enlace entre los dos átomos de C contiene un enlace π así como un enlace σ. El enlace π es el resultado de la superposición de los 2 p AO no hibridados en cada átomo de carbono. El AO de 2 p no hibridado es perpendicular al plano de los orbitales híbridos sp 2 (Figura 6). Así, cuando los AO de 2 p se superponen de una manera lado a lado para formar un enlace π, las densidades de electrones en el enlace π están por encima y por debajo del plano de la molécula (el plano que contiene los enlaces σ).
Si el plano que contiene los orbitales híbridos sp 2 de un átomo de carbono se rotara 90° con relación al otro carbono, los dos AO de 2 p también se rotarían 90° entre sí (Figura 7). Los AO de 2 p ya no podrían superponerse y el enlace π no se puede formar.
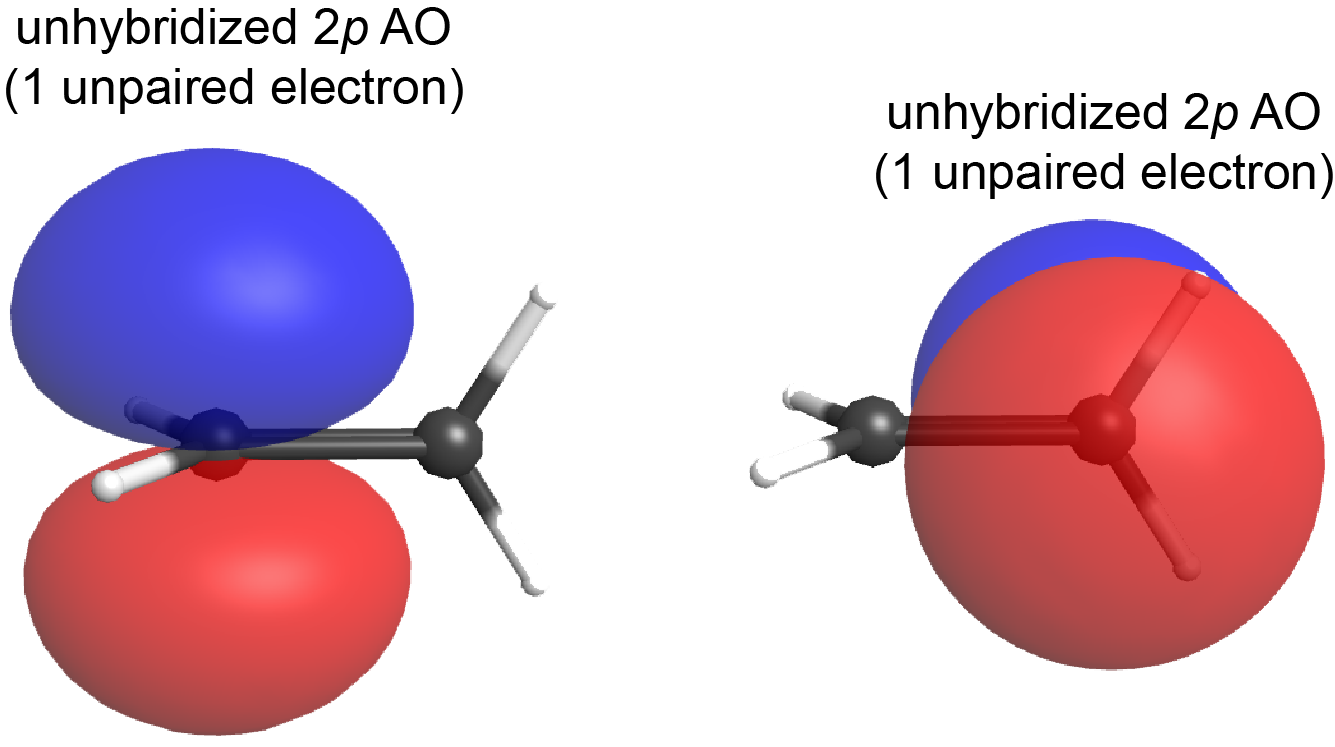
Esta es una diferencia significativa entre los enlaces σ y π: un átomo que gira alrededor del eje internuclear con respecto al otro átomo no cambia la extensión en la que los orbitales de unión σ se superponen porque el enlace σ es cilindricamente simétrico alrededor del eje del enlace (ver Figura 5); en contraste, rotación de 90° alrededor del eje internuclear rompe el enlace π por completo porque los orbitales p ya no pueden superponerse.
En acetileno, H−C=C−H, cada átomo de carbono tiene n hyb = 2 y por lo tanto se hibrida sp con dos orbitales de 2 p no hibridados. Un orbital híbrido sp de cada átomo de C se solapa para formar un enlace C-C σ, el otro orbital híbrido sp forma un enlace C-H σ con un átomo de hidrógeno. Los AO 2p no hibridados se solapan para formar dos enlaces π C-C perpendiculares (Figura 8). Los dos átomos de carbono del acetileno están así unidos entre sí por un enlace σ y dos enlaces π, dando un triple enlace.
Debido a que los enlaces π se forman a partir de p AO no hibridados, un átomo que está involucrado en el enlace π no puede hibridarse sp 3.
Actividad 6: Predicción de la Estructura de una Molécula con Varios Átomos Centrales
Hibridación D10.5 y ángulos de enlace
Piense en las moléculas de ejemplo CH 4 y NH 3 en la Sección D9.4. Ambos involucran orbitales hibridados sp 3 en el átomo central. En el caso de CH 4, un orbital de 1 s en cada uno de los cuatro átomos de H se superpone con cada uno de los cuatro orbitales híbridos sp 3 para formar cuatro enlaces. Todos los ángulos entre pares de enlaces C—H son 109.5°. En NH 3 la situación es diferente en que sólo hay tres átomos de H. Tres de los cuatro orbitales híbridos sp 3 forman tres enlaces a átomos de H, pero el cuarto orbital híbrido sp 3 contiene el par solitario. El par solitario es diferente de los átomos H, y esto es importante.
En secciones anteriores describimos cada uno de un conjunto de cuatro orbitales hibridados sp 3 como teniendo ¼ de carácter s y ¾ de carácter p. Esto es lo que sucede en CH 4. Cada uno de los cuatro enlaces C—H involucra un orbital híbrido que es ¼ s y ¾ p. La suma de los cuatro enlaces da 4 × ¼ = 1 s orbitales y 4 × ¾ = 3 p orbitales, exactamente el número y tipo de AO a partir de los cuales se formaron los orbitales híbridos.
En NH 3, sin embargo, tres de los cuatro híbridos sp 3 forman enlaces a átomos de H y el cuarto involucra un par solitario. En esta y en situaciones similares, los caracteres parciales s y p aún deben sumar a 1 y 3 pero cada orbital híbrido no tiene que ser igual que todos los demás. Es decir, un orbital híbrido que forme un enlace N-H podría tener más carácter p (y menos carácter s) en comparación con el orbital híbrido que involucra al par solitario. El único requisito es que el carácter s total y el carácter p total, sumados en los cuatro orbitales híbridos, deben ser uno s y tres p.
Una relación diferente de carácter s y carácter p da un ángulo de unión diferente. Por ejemplo, en los orbitales hibridados sp 2 (con un tercio de carácter s y dos tercios de carácter p) el ángulo entre enlaces es de 120°, mientras que, para sp 3 el ángulo es de 109.5°. Más caracteres p da como resultado un ángulo de unión más pequeño. (Esto tiene sentido, porque para el carácter p máximo, es decir, para dos orbitales p no hibridados, el ángulo de enlace sería de 90° porque los orbitales p están a 90°).
¿Cómo se puede saber cuánto carácter s y cuánto carácter p hay en un orbital híbrido específico? Un cálculo de MO-teoría puede proporcionar esta información, pero, para nuestros fines, es suficiente una regla cualitativa que indique dónde habrá más carácter p. La regla de Bent dice que un orbital híbrido sobre un átomo central tiene mayor carácter p cuanto mayor es la electronegatividad del otro átomo formando un enlace. A un par solitario se le asigna electronegatividad cero porque no hay ningún átomo que atraiga electrones en el enlace lejos del átomo central.
Aplicando la regla de Bent a NH 3, los tres átomos H unidos tienen mayor electronegatividad que el par solitario (sin átomo) por lo que esperamos más carácter p en los orbitales híbridos que forman los pares de enlaces. Por lo tanto, el ángulo entre dos enlaces N-H cualquiera debe ser menor que el ángulo tetraédrico. El ángulo medido experimentalmente es de 106.7°, un poco menor que el esperado 109.5°.
Actividad 7: Geometría molecular de H2O
En la molécula H 2 O, dos de los orbitales híbridos de O sp 2 están involucrados en la formación de los enlaces O-H σ. Uno de O pares solitarios está en el otro orbital híbrido sp 2; el otro par solitario O está en el OO de 2 p no hibridado. La geometría molecular general está doblada. Si O tuviera una hibridación sp 2 perfecta, el ángulo H-O-H sería de 120°, pero debido a que los tres orbitales híbridos no son equivalentes, el ángulo se desvía del ideal. Para obtener un ángulo de unión preciso se requiere un experimento o un cálculo MO de alto nivel.
Hibridación D10.6 en híbridos de resonancia
La asignación de hibridación y geometría molecular para moléculas que tienen dos o más estructuras de resonancia mayores es similar al proceso discutido anteriormente, pero recuerde que un conjunto de estructuras de resonancia describe una sola molécula. De ahí que la hibridación (y geometría molecular) asignada a una estructura de resonancia debe ser la misma que todas las demás estructuras de resonancia en el conjunto. Por lo tanto, al asignar hibridación, se deben considerar todas las estructuras de resonancia principales.
Considere la Figura 9:
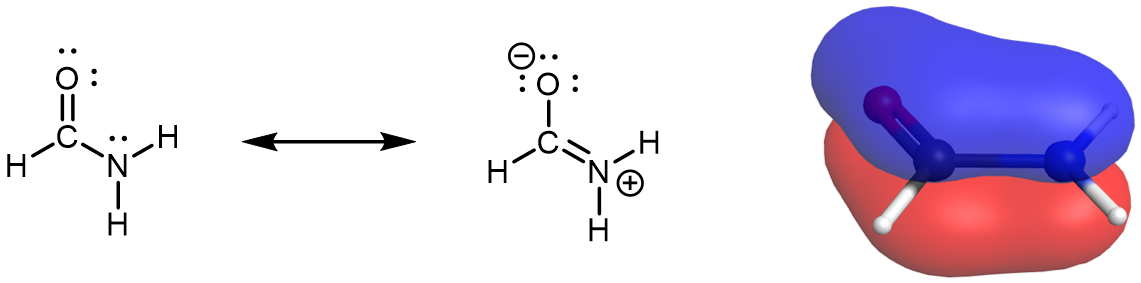
El π MO deslocalizado se extiende sobre los átomos de oxígeno, carbono y nitrógeno. Uno de los tres AO que contribuyen a este π MO es un AO de 2 p no hibridado en el átomo de N. Esto también es descrito por el conjunto de estructuras de resonancia, donde hay carácter de doble enlace entre O y C y entre C y N. Por lo tanto, el átomo de nitrógeno debe tener hibridación sp 2 (forma tres enlaces σ) y una geometría local plana trigonal. Esto es más obvio al mirar la estructura de resonancia correcta. Al observar la estructura de resonancia izquierda, podría tener la tentación de asignar la hibridación sp 3 a N dada su similitud con el amoníaco (NH 3). Sin embargo, esta es una estructura de resonancia; el conjunto de estructuras de resonancia describe una molécula que no puede ser descrita correctamente por una sola estructura de Lewis. Por lo tanto, el par solitario en N en la estructura de resonancia izquierda está en un AO de 2 p no hibridado.
Todos los átomos deben permanecer en las mismas posiciones de una estructura de resonancia a otra en un conjunto de estructuras de resonancia. No puede haber un átomo de N que sea piramidal trigonal en una estructura de resonancia y plano trigonal en otra estructura de resonancia, porque los átomos unidos al N tendrían que cambiar de posición. La evidencia experimental y los cálculos de MO de alto nivel muestran que la formamida es una molécula plana.
Día 10 Problema Podia Pre-clase: Modelos tridimensionales y estructuras de Lewis
Aquí hay tres enlaces a modelos 3-D de moléculas. Para cada molécula rotar el modelo para observar la estructura. Luego dibuja tres estructuras de Lewis 3-D de cada molécula, usando notación de cuña y guión. Cada estructura de cuña-guión debe verse desde una perspectiva diferente. Si hay alguna pareja solitaria y/o cargos formales, asegúrese de incluirlos.
La glicina es un aminoácido, un componente de las moléculas proteicas.
La acroleína se utiliza para matar algas y malezas en zanjas de riego y otras aguas naturales.
El formiato de metilo se utiliza principalmente en la fabricación de otros productos químicos.
Dos días antes de la próxima sesión de toda la clase, esta pregunta de Podia se pondrá en vivo en Podia, donde podrás enviar tu respuesta.


