2.1: Día 9- Propiedades de los Bonos; Teoría de los Bonos de Valencia
- Page ID
- 78978
8
Día 9: Propiedades de los bonos; Teoría de los bonos de valencia
D9.1 Enlaces, Moléculas y Estructuras
En una molécula, los átomos están conectados por enlaces covalentes que resultan de la superposición de orbitales atómicos. Las moléculas pueden consistir en un número pequeño o grande de átomos y pueden involucrar a todos del mismo tipo o una docena de tipos diferentes de átomos. Los átomos pueden estar conectados por enlaces en una variedad de formas diferentes, por lo que existe una amplia gama de diferentes estructuras moleculares. Así, hay muchas cosas que un químico necesita saber sobre una molécula:
- ¿Qué tipo de átomos y cuántos de cada uno hay en la molécula?
- ¿Qué átomos están unidos a qué otros átomos?
- ¿Cuáles son las longitudes de enlace entre los átomos?
- ¿Qué tan fuertes son los lazos?
- ¿Cuáles son los ángulos entre los enlaces?
- ¿Cómo están dispuestos los átomos en el espacio tridimensional?
- ¿Qué tipo de atracciones hay entre las moléculas?
- ¿Qué tan fuertes son las atracciones entre las moléculas?
- ¿Hay fuerzas atractivas no covalentes dentro de una molécula grande, sujetando una parte de la molécula a otra?
En este punto hemos introducido los cuatro primeros de estos, utilizando fórmulas moleculares, estructuras de Lewis, radios atómicos/longitudes de enlace y entalpías de enlace. Por ejemplo, en una molécula de agua, la fórmula molecular H 2 O indica que hay dos átomos de H y un átomo de O. Una estructura de Lewis, H-O-H muestra que ambos átomos de H están unidos al átomo de O. La longitud del enlace O-H (94 pm) y la entalpía del enlace (467 kJ/mol) verifican que los enlaces son fuertes, separando los átomos es difícil.
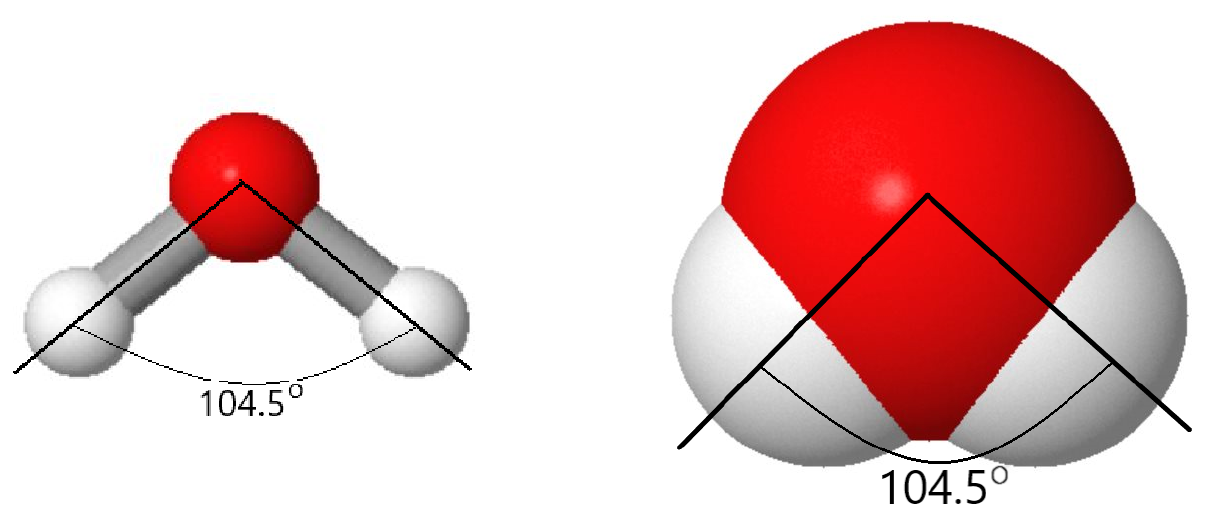
Pero hay más en una molécula de agua que eso. Un modelo de bola y varilla o relleno de espacio muestra que el ángulo entre los dos enlaces O-H es de 104.5°—algo más que un ángulo recto. Los ángulos mayores o menores de 104.5° dan como resultado una mayor energía (menor estabilidad). Como resultado de la forma y tipo de átomos en la molécula de agua, hay fuerzas más fuertes entre las moléculas de agua que entre las moléculas de metano (CH 4), aunque ambas contienen el mismo número de electrones.
A medida que aumenta el número de átomos en una molécula, los últimos cuatro factores de la lista anterior se vuelven cada vez más importantes. Los conocerás a lo largo de esta Unidad, comenzando con propiedades adicionales de los enlaces químicos en las siguientes secciones.
Polaridad de enlace D9.2
Si los dos átomos que forman un enlace covalente son idénticos, como en H 2 o Cl 2, entonces los electrones en el enlace deben ser compartidos por igual entre los dos átomos. En un enlace covalente puro, los electrones compartidos tienen la misma probabilidad de estar cerca de cada núcleo.
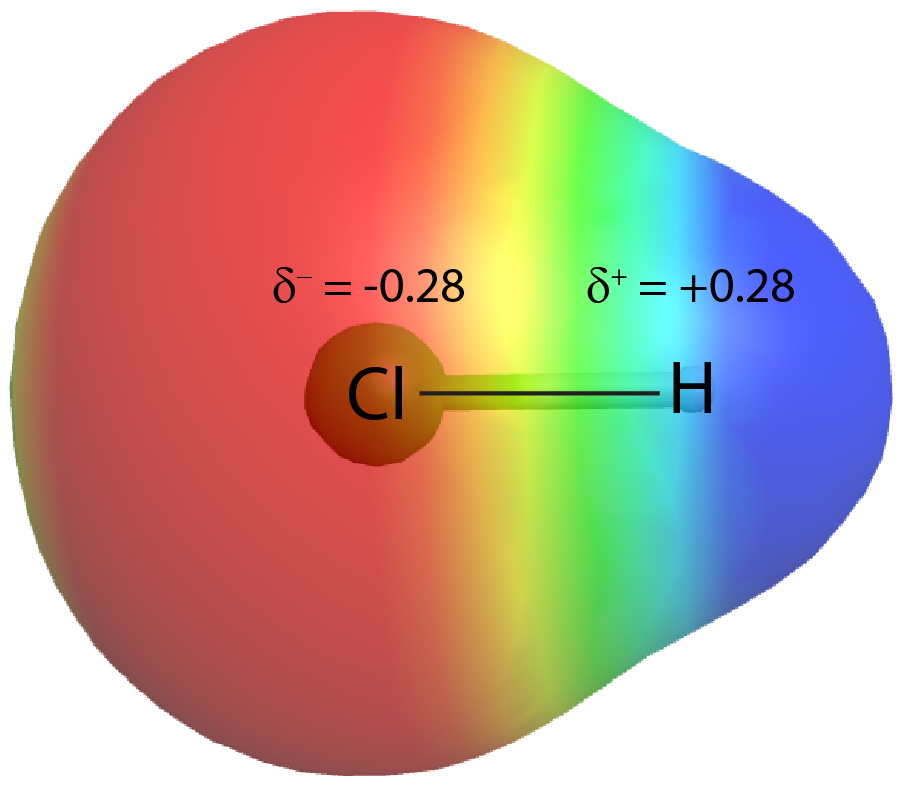
Por otro lado, si los dos átomos son diferentes, pueden tener diferentes atractivos para los electrones compartidos. Cuando los electrones de enlace son atraídos por un átomo más que el otro átomo, el enlace se denomina enlace covalente polar. Por ejemplo, en HCl, el átomo de Cl atrae al par de electrones de enlace más que el átomo de H, y la densidad electrónica del enlace H—Cl se desplaza hacia el átomo de cloro. Los cálculos de la mecánica cuántica muestran que el átomo de cloro, que tiene 17 protones, tiene una densidad electrónica equivalente a 17.28 electrones y por lo tanto una carga negativa parcial, δ — = −0.28. El átomo de hidrógeno tiene una carga positiva parcial, δ + = +0.28.
Esta distribución desigual de la densidad de electrones en dos átomos unidos produce un momento dipolar de enlace, cuya magnitud está representada por µ (letra griega mu). El momento dipolo es igual a:
μ = Qr
donde Q es la magnitud de las cargas parciales (para HCl esto es 0.28 veces la carga de un electrón) y r es la distancia entre las cargas (la longitud del enlace). Los momentos dipolares de enlace se miden en unidades de debyes (D); 1 D = 3.336 × 10-30 coulomb metro.
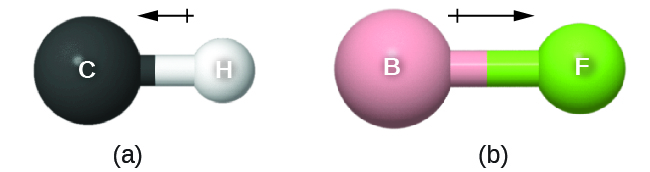
El momento dipolar de enlace tiene dirección y magnitud y puede representarse como un vector (Figura 3). Un vector dipolo se dibuja como una flecha, con la punta de flecha apuntando al extremo parcialmente negativo, y un pequeño signo + en el extremo parcialmente positivo. La longitud de la flecha es proporcional a la magnitud del momento dipolar.
D9.3 Electronegatividad
La polaridad de un enlace covalente está determinada por la diferencia entre las electronegatividades de los átomos unidos. La electronegatividad (EN) es la tendencia de un átomo en una molécula a atraer la densidad electrónica de enlace. Así, en un enlace, el átomo más electronegativo es el que tiene la carga δ −.
Cuanto mayor sea la diferencia en la electronegatividad entre dos átomos unidos, mayor es el desplazamiento de la densidad de electrones en el enlace hacia el átomo más electronegativo es. Mayor diferencia de electronegatividad, mayor Δ (EN), da mayores cargas parciales en los átomos. Los valores de electronegatividad para la mayoría de los elementos se muestran en la tabla periódica de la Actividad 1; también se tabulan en el apéndice.
Electronegatividad, afinidad electrónica y energía de ionización
Estas tres propiedades están asociadas con un átomo que gana/pierde electrones. La afinidad electrónica y la energía de ionización son cantidades físicas medibles experimentalmente.
La afinidad electrónica (EA) es el cambio de energía cuando un átomo aislado en fase gaseosa adquiere un electrón; generalmente se expresa en kJ/mol.
X (g) + e — → X — (g) Δ E = EA 1
La energía de ionización (IE) es la energía que debe transferirse a un átomo aislado en fase gaseosa para eliminar un electrón; también se expresa típicamente en kJ/mol.
X (g) → X + (g) + e — Δ E = IE 1
La electronegatividad describe cuán fuertemente un átomo atrae la densidad de electrones en un enlace. Se calcula, no se mide, tiene una escala relativa arbitraria y no tiene unidades.
Electronegatividad y Tipo de Enlace
La diferencia en electronegatividad, Δ (EN), de dos átomos unidos proporciona una estimación aproximada de la polaridad del enlace, y por lo tanto del tipo de enlace. Cuando Δ (EN) es muy pequeño (o cero), el enlace es covalente y no polar. Cuando Δ (EN) es grande, el enlace es polar covalente o iónico. (En un par unido de iones, como Na + Cl −, hay una transferencia casi completa de electrones de valencia de un átomo a otro para producir un ion positivo y un ion negativo. Los iones Na+ y Cl − forman un dipolo con δ + aproximadamente igual a +1 y δ − aproximadamente −1.)
Δ (EN) abarca una escala continua y sirve como guía general; no hay límite definitivo que defina un tipo de enlace. Por ejemplo, HF tiene Δ (EN) = 1.8 y se considera una molécula covalente polar. Por otro lado, el NaI tiene una Δ (EN) de 1.7 pero forma un compuesto iónico. Al considerar el carácter covalente o iónico de un enlace, también se deben tomar en cuenta los tipos de átomos involucrados y sus posiciones relativas en la tabla periódica. Los enlaces entre dos no metales generalmente se describen como covalentes; el enlace entre un metal y un no metal suele ser iónico.
Algunos compuestos contienen enlaces covalentes e iónicos. Por ejemplo, el nitrato de potasio, KNO 3, contiene el catión K + y el anión poliatómico NO 3 −, que tiene enlaces covalentes entre N y O.
D9.4 Cargo Formal
Es útil considerar cómo se distribuyen los electrones de valencia en una molécula. La carga formal, la carga que tendría un átomo si la densidad de electrones en los enlaces se compartiera por igual entre los átomos, es una forma de hacerlo. Para cada átomo en una estructura de Lewis, la mitad de los electrones en enlaces se asignan al átomo, y todos los electrones de pares solidos (que no se comparten con otros átomos) se asignan al átomo.
La carga formal de un átomo se calcula como la diferencia entre su número de electrones de valencia (en el átomo libre no enlazado) y su número asignado de electrones en la molécula:
cargo formal = número de valencia e— [número de par solitario e+ ½ (número de unión-par e)]
- Si el número asignado de electrones es igual al número de electrones de valencia, el átomo tiene carga formal cero.
- Si el número asignado de electrones excede el número de electrones de valencia, el átomo tiene una carga formal negativa.
- Si el número asignado de electrones es menor que el número de electrones de valencia, el átomo tiene una carga formal positiva.
Debido a que la carga formal cuenta todos los electrones de valencia en una molécula, la suma de las cargas formales de todos los átomos en una molécula o ion debe ser igual a la carga real de la molécula o ion.
El cargo formal por cualquier átomo dado no es lo mismo que su carga parcial real, como los calculados en la Sección D9.2 anterior. Esto se debe a que los cálculos de carga formal asumen que todos los enlaces covalentes son no polares, lo que rara vez es el caso excepto las moléculas homonucleares.
Uso de la carga formal para predecir la estructura de Lewis más probable
Si bien las cargas formales no representan la distribución verdadera de la densidad de electrones dentro de una molécula, no obstante explican la disposición de electrones en una estructura de Lewis en unidades de un electrón completo. Por lo tanto, si seguir los pasos para dibujar las estructuras de Lewis conducen a más de una posible disposición de electrones y/o átomos para una molécula dada, las cargas formales pueden ayudar a decidir qué arreglo es probable que sea el más estable y, por lo tanto, la estructura de Lewis más probable para la molécula dada.
- Para una molécula no cargada, es preferible una estructura de Lewis en la que todos los átomos tengan una carga formal de cero.
- Cuantos menos átomos con cargas formales distintas de cero, mejor.
- Cuanto menor sea la magnitud de los cargos formales, mejor.
- Una estructura de Lewis con cargas formales del mismo signo (ambos + o ambos −) en átomos adyacentes es menos probable.
- Las estructuras de Lewis con cargas formales negativas en átomos más electronegativos son preferibles.
Por ejemplo, considere estas tres posibles estructuras de Lewis de dióxido de carbono, CO 2:
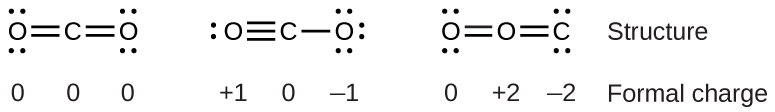
Todas las estructuras tienen octetos en cada átomo, pero la estructura de la izquierda es preferible porque todos los átomos tienen carga formal cero. La estructura de la derecha es menos probable debido a los mayores cargos formales.
Estructuras de resonancia D9.5
En una sola estructura de Lewis, un par de electrones solo pueden representarse como compartidos entre dos átomos o localizados en un solo átomo. Sin embargo, como se menciona en la Sección D6.3, los orbitales moleculares de una molécula poliatómica a menudo abarcan toda la molécula. Por ejemplo, tales distribuciones de electrones deslocalizadas en enlaces π pueden tener un efecto directo sobre las propiedades moleculares y la reactividad química. Por lo tanto, es importante poder usar estructuras de Lewis para indicar deslocalización de electrones.
Por ejemplo, se pueden dibujar dos estructuras de Lewis para el anión nitrito, NO 2 −, las cuales satisfacen las pautas para la mejor estructura de Lewis para NO 2:
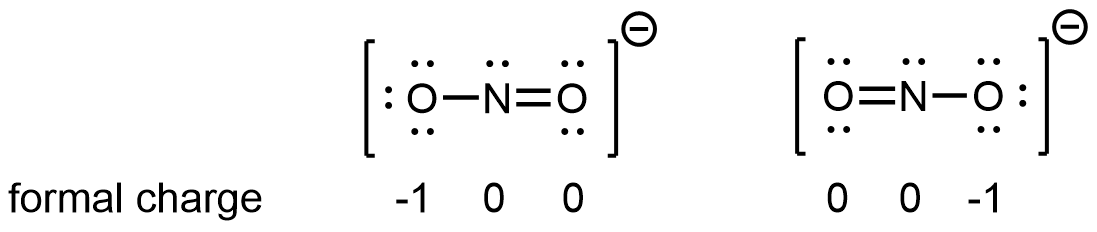
Obsérvese que en estas dos estructuras de Lewis, cada uno de los tres átomos está en la misma posición. La diferencia está en la ubicación de los electrones. En otras palabras, estas dos estructuras de Lewis transmiten la idea de que el enlace π puede estar entre O izquierdo y N central o entre N central y O derecho.
Si la molécula NO 2 fuera descrita correctamente por cualquiera de las estructuras de Lewis, esperaríamos que un enlace N-O fuera más largo que el otro. Sin embargo, los experimentos muestran que ambos enlaces en NO 2 − tienen la misma longitud. Además, los enlaces son más largos que un doble enlace N=O y más cortos que un enlace sencillo N-O. Por lo tanto, ninguna estructura de Lewis es una representación correcta de la molécula real, y la mejor representación de NO 2 − es un promedio de estas dos estructuras de Lewis.
Cuando la distribución real de electrones es un promedio ponderado de un conjunto de estructuras de Lewis, esas estructuras de Lewis se llaman estructuras de resonancia. La estructura electrónica real de la molécula (el promedio de las formas de resonancia) se denomina híbrido de resonancia. Una flecha de dos puntas entre las estructuras de Lewis indica que se están representando estructuras de resonancia:
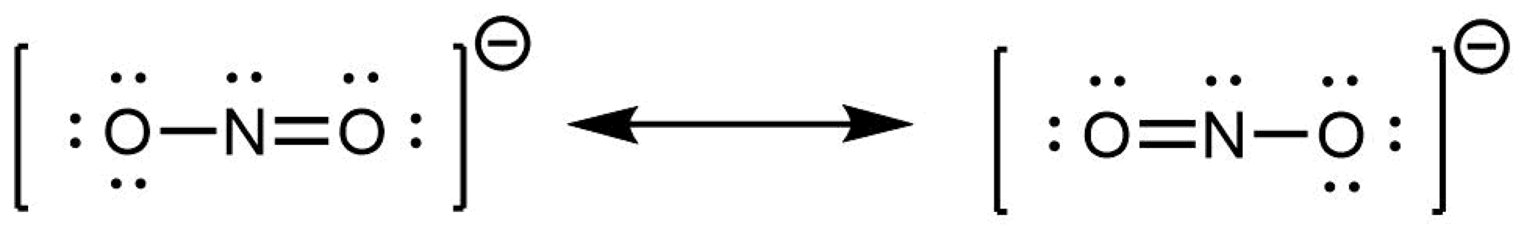
Una molécula no fluctúa entre estructuras de resonancia; más bien, la estructura electrónica real es siempre el promedio ponderado de las estructuras de resonancia. En otras palabras, una sola estructura de Lewis es insuficiente para representar correctamente la molécula (una deficiencia de un diagrama simple), y un conjunto de estructuras de resonancia (un híbrido de resonancia) es una mejor representación de la distribución de la densidad electrónica en la molécula.
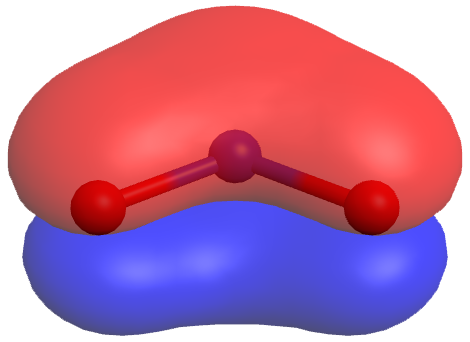
En el caso específico de NO 2, las dos estructuras de resonancia anteriores son necesarias para representar correctamente dos electrones de enlace π que están deslocalizados sobre toda la molécula (haga clic en la imagen de abajo para obtener una vista 3D giratoria del orbital molecular π ocupado por estos dos electrones):
El anión carbonato, CO 3 2 −, proporciona otro ejemplo de insuficiencia de una sola estructura de Lewis y la necesidad de un conjunto de estructuras de resonancia:
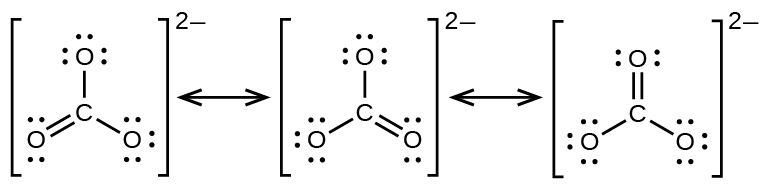
Los experimentos muestran que los tres enlaces C-O son exactamente iguales. En otras palabras, los dos electrones en el enlace π están deslocalizados sobre toda la molécula, a diferencia de estar solo entre un átomo de oxígeno y el átomo de carbono.
Para resumir, en una sola estructura de Lewis, el enlace (σ o π) es siempre entre dos átomos. Por lo tanto, se necesitan dos o más estructuras de Lewis para describir adecuadamente una molécula con electrones deslocalizados (distribuidos en tres o más átomos). Al dibujar un conjunto de estructuras de resonancia:
- Cada estructura de resonancia debe tener el mismo número de electrones.
- La carga formal total es una herramienta útil para verificar el número de electrones.
- Entre las estructuras de resonancia, las ubicaciones de los átomos son fijas: solo se mueven los electrones.
- La estructura del esqueleto de la molécula sigue siendo la misma en todas las estructuras de resonancia.
- Sin embargo, se puede dibujar un conjunto de estructuras de resonancia en cualquier perspectiva. Por ejemplo, también podrías dibujar las estructuras de resonancia CO 3 2 − como
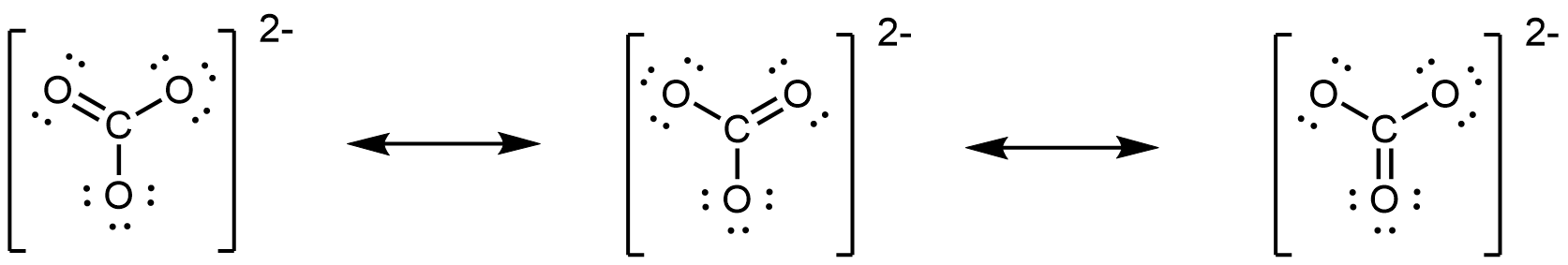
- Las flechas de doble cabeza entre las estructuras de Lewis comunican que lo que se dibuja es un conjunto de estructuras de resonancia.
En NO 2, las dos estructuras de resonancia principales contribuyen por igual al híbrido de resonancia. De manera similar, las tres estructuras principales de resonancia de CO 3 2 − contribuyen por igual al híbrido de resonancia. Sin embargo, es posible que algunas estructuras en un híbrido de resonancia sean más importantes que otras. Por ejemplo, considere estas tres estructuras de resonancia del ion cianato (OCN —):
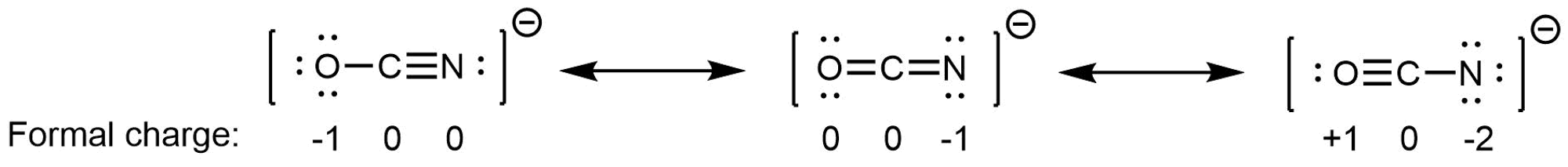
Los átomos en cada estructura de resonancia tienen un octeto completo, pero difieren en sus cargas formales. Esto implica que ciertas disposiciones de electrones pueden ser un poco más estables que otras, y por lo tanto no contribuyen por igual al híbrido de resonancia.
A partir de las reglas de carga formal, podemos estimar que la estructura de resonancia de la derecha contribuiría menos; esa disposición de los electrones es la menos estable de los tres. La estructura de resonancia de la izquierda contribuiría más que la estructura media porque tiene la carga formal -1 en el átomo O más electronegativo. (Para OCN —, los cálculos de mecánica cuántica de alto nivel muestran que la estructura izquierda contribuye 61% al híbrido de resonancia, la estructura media aporta 30% y la estructura de resonancia derecha aporta solo 4%).
Moléculas aromáticas D9.6
El benceno, C 6 H 6, es representativo de una gran cantidad de compuestos aromáticos. Estos compuestos contienen estructuras de anillo y exhiben enlaces que deben describirse usando estructuras de resonancia. Las estructuras de resonancia para benceno son:
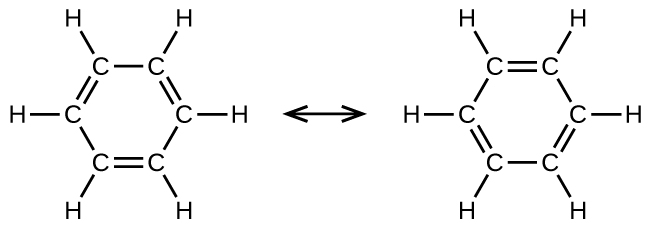
Los seis enlaces C-C son equivalentes y presentan longitudes de enlace intermedias entre las de un enlace sencillo C-C y un doble enlace C=C.
La reactividad química de los compuestos aromáticos difiere de la reactividad de los alquenos. Por ejemplo, los compuestos aromáticos no experimentan reacciones de adición. En cambio, con la ayuda de un catalizador, pueden sufrir reacciones de sustitución donde uno de los átomos de hidrógeno es reemplazado por un sustituyente: otro átomo o grupo de átomos. Una reacción de sustitución deja intactos los dobles enlaces deslocalizados.
D9.7 Teoría de los bonos de valencia
Las estructuras de Lewis son representaciones planas fáciles de dibujar de unión en moléculas. Nos ayudan a averiguar y pensar qué átomos están unidos a cuáles y si los enlaces son simples o múltiples. Sin embargo, por defecto, no representan la geometría 3D de una molécula, ni los orbitales moleculares (MO) que determinan las distribuciones de densidad de electrones.
Probablemente haya usado VSEPR para predecir las formas 3D de las moléculas. VSEPR implica contar regiones de electrones (pares) alrededor de un átomo central, asumiendo que las regiones de electrones se repelen y permanecen lo más alejadas posible, y enlazando átomos terminales a regiones electrónicas. VSEPR suele ser bueno para predecir la disposición de los enlaces alrededor de un átomo, y está bien usarlo para predecir arreglos idealizados lineales, planos trigonales y tetraédricos de enlaces que encontrarás en este curso, pero VSEPR tiene limitaciones significativas:
- VSEPR tiene poca o ninguna base en la teoría cuántica moderna; acabas de dedicar un tiempo significativo a estudiar teoría cuántica y queremos que puedas usar esa experiencia.
- A menudo es difícil aplicar VSEPR a moléculas descritas por dos o más estructuras de resonancia (es decir, moléculas con electrones deslocalizados). Así, VSEPR hace que sea más difícil entender muchas estructuras moleculares, por ejemplo, estructuras de moléculas de proteínas.
- VSEPR asume que los pares solitarios ocupan más espacio que los pares de enlaces, pero no hay evidencia, experimental o teórica, que apoye esa suposición; de hecho, hay alguna evidencia de lo contrario.
- VSEPR asume que todos los pares solitarios son equivalentes, pero hay evidencia experimental de que no lo son. Por ejemplo, los dos pares solitarios en una molécula de agua no tienen la misma energía de ionización y no tienen distribuciones de probabilidad equivalentes (Journal of Chemical Education 1987, Vol. 64, pp 124-128.).
- VSEPR a menudo no puede explicar los ángulos de unión relativos. Por ejemplo, ¿por qué el ángulo H-P-H en PH 3 es de 93.5° mientras que el ángulo H-N-H en NH 3 es de 107.5°? (Si la disminución en el ángulo de enlace desde el ángulo tetraédrico de 109.5° a 107.5° para NH 3 se debe a un par solitario “más gordo”, ¿por qué el ángulo disminuye tanto más para el átomo P más grande? Un par solitario “más gordo” debería tener menos probabilidades de repeler a los otros bonos porque están más separados).
Por estas razones, VSEPR es un modelo que tiene aplicabilidad limitada. En este curso usaremos un mejor modelo —la teoría de los vínculos de valencia— que sea consistente con la teoría cuántica moderna, haga predicciones más precisas y completas que VSEPR, y sea una mejor base para comprender temas de vinculación más avanzados. Si quieres, está bien usar VSEPR para predecir formas idealizadas, pero aplicar las ideas presentadas en esta sección y las secciones D10.1 a D10.6 te permitirá describir mejor estructuras con electrones deslocalizados y predecir los ángulos de enlace con mayor precisión.
La teoría de los enlaces de valencia es un modelo que se enfoca en la formación de enlaces químicos individuales, como la formación de un enlace σ entre dos átomos dentro de una molécula poliatómica. Al igual que la teoría orbital molecular, la teoría de enlaces de valencia trata de cómo los orbitales atómicos (OA) cambian y se combinan cuando se forma una molécula, pero en lugar de formar MO que abarcan toda la molécula, la teoría del enlace de valencia combina los orbitales de valencia de cada átomo individualmente para que la combinación proporcione un enlace más fuerte en direcciones específicas. De ahí que la teoría del enlace de valencia nos permita derivar geometrías 3D idealizadas para moléculas basadas únicamente en sus estructuras de Lewis, sin tener que realizar ningún cálculo.
La teoría de los enlaces de valencia utiliza el grado de superposición orbital para inferir las fortalezas de los enlaces químicos: una mayor superposición conduce a enlaces que son más fuertes y, por lo tanto, una molécula que es más estable. Para un átomo dado en una molécula, la superposición con orbitales en otros átomos puede ser mayor cuando algunos o todos los AO del átomo forman orbitales híbridos. Los orbitales híbridos son combinaciones de orbitales atómicos de valencia que enfatizan la concentración de la densidad de electrones en direcciones específicas. La mayor densidad de electrones de un orbital híbrido en una dirección específica proporciona una mayor superposición con un orbital de otro átomo cuando se forma un enlace σ.
Para un ejemplo de cómo funciona la hibridación orbital, considere combinar un solo AO de 2 s con un solo AO de 2 p, ambos en el mismo átomo (Figura 4). El AO de 2 s es esféricamente simétrico, por lo que tiene la misma fase (signo matemático) a cada lado del núcleo, pero el AO de 2 p cambia de signo en el núcleo. Así, en un lado del núcleo, los AO de 2 s y 2p están en fase, mientras que en el otro lado están desfasados.
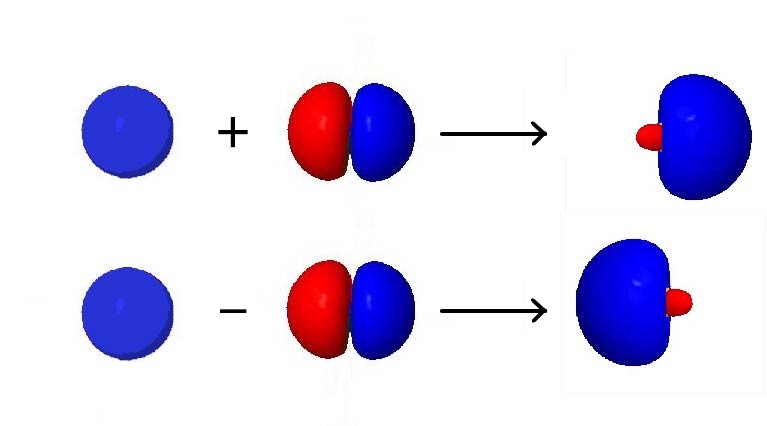
Si agregamos los dos AO, el nuevo orbital híbrido será más grande en el lado donde los AO están en fase y más pequeño en el otro lado donde los AO están desfasados. Si los restamos, el orbital híbrido resultante será más grande en el lado donde los AO están desfasados y más pequeños donde están en fase. De ahí que a partir de una AO de 2 s y una AO de 2 p, podemos derivar dos orbitales híbridos sp.
Actividad 3: Hibridación orbital
Día 9 Problema Podia Pre-clase: Enlaces Covalentes
1. Considera estos enlaces químicos:
C—H C=C C—C C—Br C—F
Elige un par de bonos de la lista, predice cuál es más largo y escribe una explicación de tu predicción.
Elige un par de vínculos de la lista, predice cuál es más fuerte y escribe una explicación de tu predicción.
Elige un par de enlaces de la lista, predice cuál es más polar y escribe una explicación de tu predicción.
2. NO es una molécula con un número impar de electrones. Escribe una estructura de Lewis para NO. ¿Hay estructuras de resonancia? ¿Una estructura de resonancia es más dominante que otra? Si es así, identificar la estructura más dominante y explicar por qué es más dominante.
Dos días antes de la próxima sesión de toda la clase, esta pregunta de Podia se pondrá en vivo en Podia, donde podrás enviar tu respuesta.