2.3: Día 11- Estructura Molecular- Isómeros
- Page ID
- 78951
10
Día 11: Estructura Molecular: Isómeros
Estructuras de Línea D11.1
Piense en la importancia de las estructuras de las sustancias moleculares covalentes. Los hidrocarburos (Sección D7.2) o moléculas estrechamente relacionadas son buenos ejemplos porque hay muchas moléculas de hidrocarburos diferentes y muchos hidrocarburos tienen muchos átomos. Saber qué átomos están unidos a cuáles y las diferentes formas en que están unidos permite predicciones sobre las propiedades de los compuestos correspondientes.
Por ejemplo, las moléculas de hidrocarburos en el aceite de motor para automóviles contienen de 16 a 20 átomos de carbono y más del doble de átomos de hidrógeno asociados. Dibujar estructuras de Lewis para moléculas tan grandes lleva tiempo y puede ser demasiado complicado, por lo que a menudo se usa un tipo de dibujo más simple, llamado estructura lineal. En una estructura lineal (también llamada estructura esquelética) para un hidrocarburo, solo se muestran los enlaces C-C; se omiten los símbolos de elementos y los enlaces C-H. Los átomos de carbono están representados por el final de una línea o una unión entre dos líneas. La Figura 1 muestra una estructura lineal de ejemplo. Decidir dónde está cada átomo de C y cada átomo de H en la estructura lineal; luego cuente el número de átomos de C y H para verificar que la estructura lineal representa la misma molécula que la estructura de Lewis.
Las estructuras lineales son mucho más fáciles de dibujar, y la estructura molecular general de la cadena o cadenas de carbono es más clara. Sin embargo, también es mucho más fácil cometer errores al dibujar y leer estructuras de líneas: una línea extra es un grupo CH n extra completo y también es más fácil perder algunos de los enlaces C-H implícitos.
En las estructuras lineales, los átomos distintos del carbono y el hidrógeno están representados por sus símbolos elementales, y cualquier átomo de H unido a ellos se muestra explícitamente (por ejemplo, ver la molécula C en el ejercicio anterior). En las estructuras lineales, los pares solitarios en los átomos a menudo también se omiten. Debido a que no se muestran los enlaces C-H y los pares solitarios, es necesario incluir la carga formal en cualquier átomo que tenga una carga formal distinta de cero al trazar una estructura lineal. De lo contrario, habría un recuento erróneo de enlaces o electrones.
Estructuras isoméricas D11.2
Cuando más de una estructura molecular corresponde a la misma fórmula molecular, las dos o más estructuras se denominan estructuras isoméricas, o isómeros. Por ejemplo, hay dos estructuras correspondientes a la fórmula CHN. Son H—C=N: (cianuro de hidrógeno) y H—N=C: (cianuro de hidrógeno). A temperatura ambiente y especialmente a temperaturas más bajas, ambas estructuras existen como compuestos separados. Es decir, la sustancia representada por una estructura puede purificarse y separarse de la otra y cada sustancia tiene propiedades diferentes.
Cuando las fórmulas moleculares son diferentes, las fórmulas deben describir sustancias con diferentes propiedades porque la fórmula dice cuántos átomos de cada tipo hay en una molécula y los enlaces químicos tendrían que romperse para cambiar el número o átomos o tipo de átomos. Romper enlaces covalentes requiere energía, y a temperatura ambiente muy pocas moléculas tienen suficiente energía para que se produzca la ruptura del enlace. Los isómeros ocurren cuando dos estructuras moleculares diferentes con el mismo número de átomos de cada tipo no tienen suficiente energía para cambiar de una estructura a otra. Por ejemplo, H—N=C: no cambia a H—C=N: porque el cambio requiere romper un enlace N-H. A temperatura ambiente las moléculas H—N=C: no tienen suficiente energía para superar la entalpía de enlace del enlace N-H, por lo que no cambian; así, H—N=C: puede purificarse y separarse de H—C=N:.
Típicamente, los isómeros se definen por si pueden intercambiarse a temperatura ambiente. A temperatura ambiente, las moléculas no tienen suficiente energía para romper la mayoría de los enlaces covalentes. Así, si el intercambio de dos estructuras requiere romper un enlace covalente, las dos estructuras son isómeros. Si se eleva la temperatura, las moléculas tienen mayor energía promedio y es más probable que una estructura pueda cambiar a otra. Si se baja la temperatura, se vuelve más difícil intercambiar estructuras; es decir, la energía promedio de las moléculas es menor y las estructuras que podrían intercambiarse a temperatura ambiente ya no tienen suficiente energía.
Conformaciones D11.3
A temperatura ambiente, las moléculas están en constante movimiento tanto con respecto a otras moléculas como como resultado de movimientos internos como la rotación de una parte de una molécula con respecto a otra parte de la misma molécula. A continuación se muestra una animación de una molécula de butano a temperatura ambiente. Observe que hay rotación alrededor del enlace sencillo C—C central (que se mantiene estacionario en la animación para mostrar mejor la rotación) y también alrededor de los otros enlaces C-C. Tales rotaciones en una molécula conducen a diferentes conformaciones o confórmeros, estructuras que difieren solo por las rotaciones alrededor de enlaces simples.
Un enlace a un elemento interactivo se puede encontrar aquí.
Actividad 1: Representando conformadores
Las rotaciones alrededor de los enlaces C-C requieren poca energía porque el orbital molecular de un enlace covalente σ tiene simetría cilíndrica a lo largo del eje internuclear (Sección D5.5, Sección D10.1). La simetría cilíndrica significa que independientemente de cómo se roten dos átomos unidos a σentre sí alrededor del eje internuclear, el enlace σ permanece intacto entre ellos. Por ejemplo, considere la rotación alrededor del enlace C-C en 1,2-dicloroetano:
Observe en la Figura 3 que la rotación completa alrededor del enlace C-C requiere un cambio de energía de 40 kJ/mol. La entalpía de enlace de un enlace C-C es de 346 kJ/mol, por lo que la energía requerida para la rotación es un poco más de una décima parte de la energía requerida para romper el enlace. Debido a que la energía requerida para la rotación alrededor de los enlaces simples es pequeña, tales rotaciones ocurren fácilmente a temperatura ambiente para la mayoría de las moléculas. De ahí que a temperatura ambiente no se pueda aislar un conformador de otro y los químicos consideran que los confórmeros representan el mismo compuesto químico, con el mismo nombre y las mismas propiedades físicas. No se necesita romper el enlace para pasar de un conformador a otro.
Si pudieras ver todas las estructuras moleculares en una muestra de 1,2-dicloroetano a temperatura ambiente en un instante específico, encontrarás las tres estructuras siguientes:
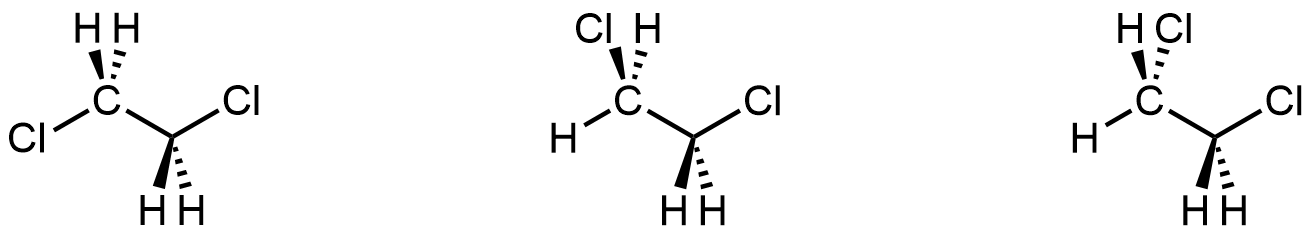
Cada estructura corresponde a uno de los mínimos en la curva de energía de la Figura 3. Si, en cambio, seguiste una molécula a lo largo del tiempo, la verías pasar de una estructura a la siguiente a medida que gira el enlace C-C (como se ve en la Figura 3). Debido a que los experimentos se realizan típicamente a temperatura ambiente, consideramos las tres estructuras como conformadores de la misma molécula. Se puede dibujar cualquiera de ellos como una representación de 1,2-diclororetano.
A partir de esta animación de una molécula de nonano se puede ver que diferentes conformadores de una misma molécula pueden adoptar, a primera vista, formas moleculares dramáticamente diferentes. Si cambias tu punto de vista moviendo la molécula con tu ratón, puedes ver que la molécula también se ve bastante diferente desde diferentes perspectivas.
Dadas dos o más estructuras de Lewis, es importante que se pueda reconocer si son confórmeros o isómeros. Las estructuras de Lewis o las estructuras lineales que se ven muy diferentes pueden ser diferentes conformadores o el mismo conformador dibujado desde diferentes perspectivas; en cualquier caso, las estructuras representan la misma sustancia.
Una buena manera de saber si dos estructuras representan la misma sustancia es elaborar el nombre correcto de cada estructura. Si los nombres son los mismos, las estructuras representan confórmeros, no sustancias diferentes. No se le probará explícitamente en la nomenclatura de compuestos (nomenclatura) en este curso, pero le recomendamos encarecidamente que estudie la sección sobre alcanos en el apéndice nomenclatura de la IUPAC. Los nombres de la IUPAC son una forma sistemática de nombrar compuestos químicos que también pueden ayudarte a pensar en la estructura molecular. En el futuro, si encuentra un nombre para un compuesto químico que no le es familiar, el apéndice de la nomenclatura de la IUPAC puede ayudar.
Actividad 2 Identificar conformadores
Químicamente, diferentes confórmeros pueden afectar la reactividad de una molécula. Y a mayor escala, las enormes moléculas proteicas adoptan solo algunas de las muchas conformaciones posibles; las formas de las moléculas proteicas son esenciales para sus funciones biológicas.
D11.4 Isómeros constitucionales
Los compuestos con la misma fórmula molecular pero diferente conectividad atómica se denominan isómeros constitucionales (o isómeros estructurales). Por ejemplo, hay dos alcanos con la fórmula C 4 H 10:
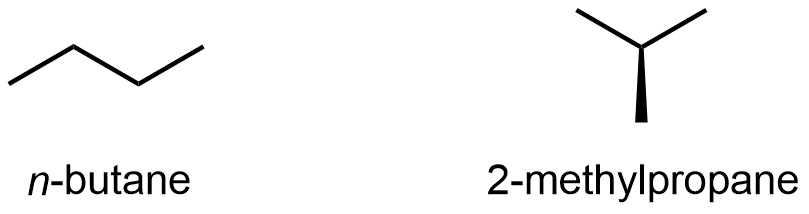
El n — en n-butano representa normal, es decir, una cadena carbonada no ramificada. Normalmente se omite la “n -” y el compuesto se nombra simplemente “butano”; se supone que sabes que ningún prefijo se refiere a la cadena no ramificada.
El nombre tradicional de 2-metilpropano es isobutano. Muchas veces, se omite el “2-” y el compuesto solo se llama “metilpropano” porque esa es la única ubicación a la que se une el grupo metilo (si el metilo está unido a cualquiera de los extremos, la molécula es n-butano); de ahí que no haya ambigüedad omitiendo el “2-”.
Actividad 3 Análisis de Isómeros Constitucionales
En tu cuaderno de curso escribe una respuesta a cada pregunta y una explicación de tu respuesta:
- Describir la forma de la molécula de n-butano y cómo difiere de la forma de la molécula de 2-metilpropano.
- Analizar la unión en cada molécula. ¿Todos los átomos de C están unidos al mismo número de átomos de H? Si no, ¿el número de átomos de C unidos de manera similar es el mismo en cada una de las dos estructuras?
- Para convertir de n-butano a 2-metilpropano, ¿se necesitarían romper uno o más enlaces químicos para que los átomos pudieran reorganizarse?
- ¿Esperarías que las propiedades físicas (como el punto de fusión y el punto de ebullición) fueran diferentes para las dos sustancias?
Para cambiar de un isómero constitucional a otro se requiere romper y reformar los enlaces químicos, lo que requiere un aporte significativo de energía. A temperatura ambiente, muy pocas moléculas tienen tanta energía. Por lo tanto, los isómeros constitucionales pueden sintetizarse y separarse entre sí: son sustancias diferentes.
Además de examinar la conectividad en las estructuras de Lewis, otra forma de saber si una estructura de Lewis representa la misma molécula que otra estructura de Lewis es elaborar los nombres de la IUPAC para ambas estructuras. Los nombres de la IUPAC están diseñados de manera que la misma estructura siempre tenga el mismo nombre; si dos estructuras son diferentes, nombrarlas correctamente dará como resultado nombres diferentes.
Los alquenos y alquinos también pueden exhibir isomería constitucional. Por ejemplo, los cuatro átomos de carbono en la cadena de buteno dan lugar a tres isómeros constitucionales diferentes:
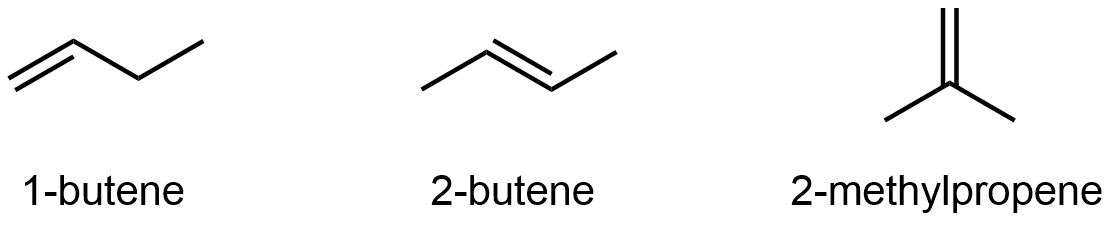
No es solo la ubicación del enlace π lo que difiere, asegúrese de que puede deducir todos los enlaces C-H y C-C que necesitan romperse y reformarse yendo de un isómero a otro observando solo las estructuras de línea. Consulte los modelos 3D de 1-buteno, 2-buteno y 2-metilpropeno para verificar.
Y de manera similar, el butino puede tener dos isómeros constitucionales diferentes:

Ejercicio 4: Isómeros de bencenos sustituidos
La estructura del orto-xileno se muestra aquí:
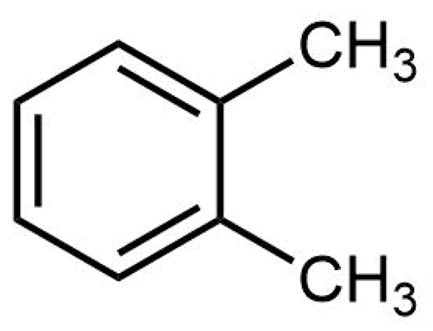
Haga clic en cada estructura a continuación que sea un isómero constitucional de orto-xileno.
Estereoisómeros D11.5: isómeros geométricos
Los estereoisómeros son moléculas que tienen la misma fórmula molecular y la misma conectividad atómica, pero difieren en la orientación de los átomos en el espacio 3D. De ahí que las moléculas que son estereoisómeros entre sí provienen del mismo isómero estructural. Existen varios tipos diferentes de estereoisómeros. Primero discutiremos los isómeros geométricos.
Los dos átomos de carbono en un doble enlace C=C no pueden rotar libremente uno con respecto al otro porque dicha rotación requiere romper el enlace π (ver Sección D10.4). Una vez que se rompe el enlace π habría rotación libre alrededor del enlace σ restante, pero a temperatura ambiente la mayoría de las moléculas no tienen suficiente energía para romper un enlace π. Por lo tanto, no hay rotación libre alrededor de un doble enlace C=C. Esto da lugar a isómeros geométricos, estereoisómeros que difieren en la orientación de los grupos conectados a un enlace C=C.
Por ejemplo, hay dos isómeros geométricos de 2-buteno, cis-2-buteno y trans -2-buteno:

El isómero con ambos grupos metilo en el mismo lado del doble enlace se denomina isómero cis (arriba, los grupos metilo se muestran ya que ambos están por encima del doble enlace). El que tiene los grupos metilo en lados opuestos se denomina isómero trans. Los isómeros geométricos tienen diferentes propiedades físicas, como el punto de ebullición, que hacen posible su separación. De ahí que sean sustancias diferentes, y en nomenclatura, se distinguen por los prefijos “cis” y “trans”. La Figura 5 muestra una animación de una molécula de cis-2-buteno que muestra conformaciones que son accesibles a temperatura ambiente.
Un enlace a un elemento interactivo se puede encontrar aquí.
El isomerismo cis-trans solo es posible cuando hay dos grupos diferentes en cada extremo de un doble enlace. Por ejemplo, en una molécula de alqueno como esta
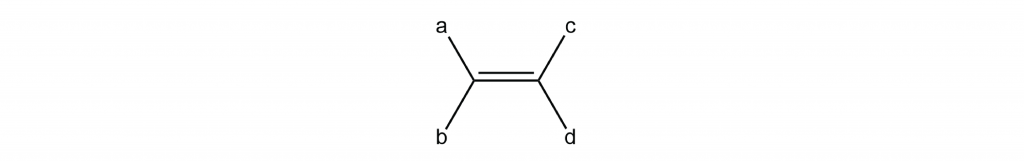
puede haber isómeros geométricos si a y b son grupos diferentes y c y d son grupos diferentes. Si ambos grupos en cada extremo del doble enlace fueran iguales (a lo mismo que b, o c lo mismo que d), rotar alrededor del doble enlace no produciría una estructura molecular diferente.
Estereoisómeros D11.6: Enantiómeros
Otro tipo de estereoisómero es un par de moléculas que son imágenes especulares que no pueden superponerse entre sí. Dichos estereoisómeros se llaman enantiómeros (o isómeros ópticos), y se describen como quirales (de la palabra griega cheir, χειρ, que significa “mano”; sus manos izquierda y derecha exhiben quiralidad, son imágenes especulares no superpuestas entre sí).
La mayoría de las propiedades físicas, químicas y fisiológicas de dos sustancias enantioméricas son idénticas. Las diferencias entre enantiómeros solo se hacen evidentes cuando las sustancias interactúan con otras moléculas o ambientes quirales. (Un ejemplo infame de una diferencia fisiológica es el medicamento talidomida, donde un isómero causa defectos de nacimiento pero el otro no.)
La mayoría de las moléculas quirales tienen al menos un átomo que está unido a cuatro grupos diferentes, un centro quiral. Los centros quirales suelen estar marcados con un asterisco (*) en las estructuras moleculares. Un átomo de carbono que es un centro quiral se conoce como un átomo de carbono asimétrico o un átomo de carbono quiral. Por ejemplo, el átomo de carbono en bromocloroyodometano es un centro quiral y hay dos isómeros enantioméricos: las dos moléculas de imagen especular de ChBrClI no se superponen entre sí (Figuras 6 y 7).
Un enlace a un elemento interactivo se puede encontrar aquí.
Actividad 4 Analizando Enantiómeros
Estudie cuidadosamente la Figura 6 y la Figura 7. Cerciórese de entender lo que significa superponer y por qué estas dos moléculas de imagen especular no se pueden superponer.
- Con base en tus observaciones, idear un método para distinguir una estructura de la otra; es decir, describe cómo puedes decir que una molécula es diferente de la otra. Escribe tu método en tu libreta.
- Para convertir de (R) -bromocloroyodometano a (S) -bromocloroyodometano, ¿se necesitarían romper uno o más enlaces químicos para que los átomos pudieran reorganizarse? Si es así, describa qué vínculos podrían romperse y cuáles podrían formarse para intercambiar las estructuras.
La diferencia entre los dos enantiómeros puede no parecer significativa, pero tendrías que romper al menos parcialmente y volver a formar dos enlaces σ para pasar de un enantiómero al otro. De ahí que las estructuras enantioméricas representan diferentes sustancias que pueden separarse entre sí. La separación suele ser difícil y requiere un ambiente quiral: una sustancia quiral diferente que interactúa de manera diferente con la molécula de la izquierda en comparación con la molécula de la derecha. Una analogía macroscópica es esta: si todos los guantes que tienes estuvieran mezclados, podrías separar los guantes de la mano izquierda de los de la derecha por la forma en que interactúan con tu mano derecha; todos los guantes que te quedan son diestros.
Todas las moléculas tienen una imagen especular, pero solo las moléculas quirales tienen imágenes especulares no superponibles. Contraste ChBrCli con CHCl 2 I (dicloroyodometano), el cual se muestra en la Figura 8. ChCl 2 I y su imagen especular son superpuestas. Así CHCl 2 I no es una molécula quiral (se dice que es aquiral). Dos grupos (los átomos de Cl) unidos al átomo de carbono en CHCl 2 I son iguales, por lo que no hay centro quiral.
Un enlace a un elemento interactivo se puede encontrar aquí.
Figura 8. El diclorofluorometano no es quiral. La molécula y su imagen especular son superpuestas.Generalmente, la forma más fácil de detectar un centro quiral es buscar cuatro grupos diferentes unidos a un átomo. Los “grupos” son considerados en su totalidad, no solo el átomo que está directamente unido al centro quiral. Por ejemplo, un grupo metilo es un grupo diferente de un grupo etilo, que es diferente de un grupo propilo y así sucesivamente. Por lo tanto, los alcanos pueden ser quirales, por ejemplo:
Simplemente porque veas cuñas discontinuas y sólidas en una estructura, no asumas automáticamente que estás mirando un centro quiral. Por ejemplo, el ácido láctico tiene un átomo de carbono asimétrico (quiral) (denotado por *) y es una molécula quiral, mientras que el ácido isobutírico no es una molécula quiral.
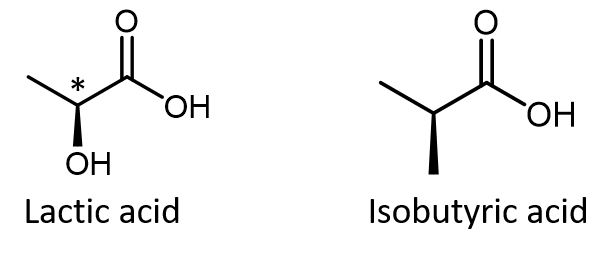
Asegúrese de que pueda reconocer por la estructura de Lewis de cuña y guion que el átomo de carbono quiral en el ácido láctico tiene cuatro grupos diferentes a su alrededor pero el átomo de carbono correspondiente en el ácido isobutírico no. Utilice estos tres enlaces para acceder a modelos giratorios 3D de los dos enantiómeros del ácido láctico y la estructura única del ácido isobutírico. Enlace de ácido láctico 1. Enlace ácido láctico 2. Ácido isobutírico.
D11.7 Fuerzas intermoleculares
Si una sustancia molecular covalente es un sólido, líquido o gas a temperatura ambiente (o cualquier otra temperatura) depende de las fuerzas de atracción entre las moléculas que componen la sustancia. Cualquier fuerza de atracción entre moléculas se conoce como fuerzas intermoleculares (IMF). Las fuerzas intermoleculares varían ampliamente, pero los IMF suelen ser más débiles que los enlaces covalentes. Una forma de FMI, las fuerzas de dispersión de Londres, ya se discutió en la Unidad 1, donde indicamos que los puntos de ebullición reflejan la energía necesaria para superar las fuerzas intermoleculares a medida que las moléculas pasan de estar muy próximas entre sí en la fase líquida a estar muy separadas en la fase gaseosa. Así, los puntos de ebullición son buenos indicadores de las resistencias relativas de los IMF de diferentes sustancias moleculares.
Los puntos de ebullición de alcanos lineales (C n H 2n +2), con n = 1-20 se muestran en la Figura 9. Los puntos de ebullición aumentan gradualmente al aumentar la longitud de la molécula. Deberías poder explicar esta tendencia en los puntos de ebullición basados en LDF.
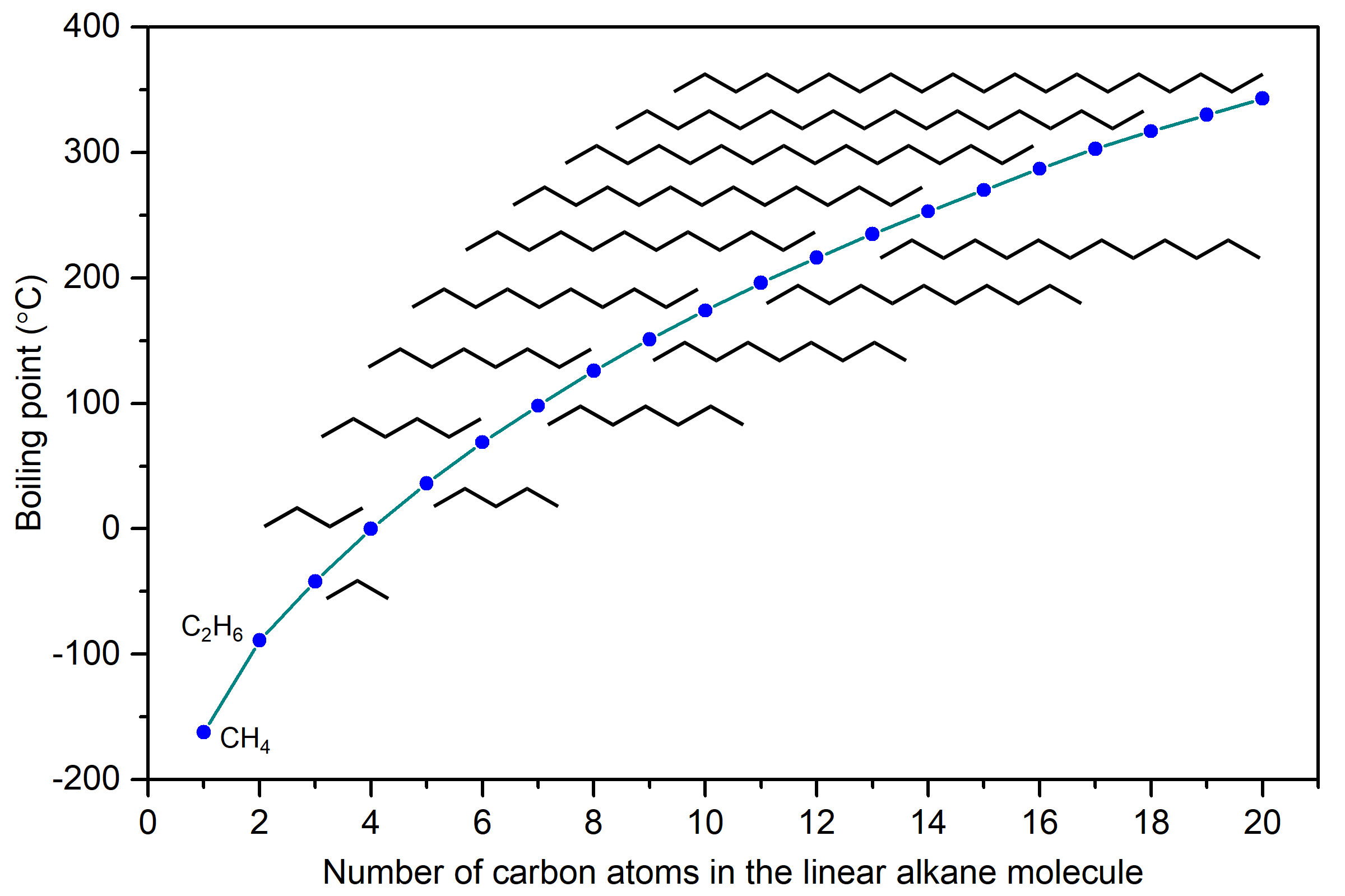
Los LDF aumentan con el número de electrones y también con la facilidad de distorsión de la distribución de probabilidad de electrones en un átomo o molécula. Debido a que los alcanos lineales más largos tienen más electrones, los LDF aumentan y los puntos de ebullición también aumentan.
Otro factor que afecta la fuerza de las LDF es la geometría molecular. Por ejemplo, los puntos de ebullición para n-pentano, isopentano (2-metilbutano) y neopentano (2,2-dimetilpropano) son 36 °C, 27 °C y 9.5 °C, respectivamente, lo que indica que los LDF son mayores para n-pentano y menos para neopentano.
Estas tres moléculas son isómeros constitucionales y por lo tanto tienen el mismo número de electrones. En el n-pentano, la forma lineal abierta proporciona una mayor área de superficie entre las moléculas cuando entran en contacto, lo que resulta en LDF más fuertes entre las moléculas. El neopentano tiene la forma más compacta de los tres, produciendo la menor superficie para el contacto intermolecular y, por lo tanto, las LDF más débiles.
Otra propiedad física que está influenciada por los IMF es la viscosidad de un líquido, que es una medida de la resistencia del líquido al flujo. Cuanto más fuertes son los IMF, más difícil es que las moléculas se desplacen entre sí y mayor es la viscosidad del líquido. Las moléculas de alcano pueden llegar a ser bastante grandes y la Figura 9 muestra que la fuerza de las fuerzas de dispersión de Londres es bastante significativa en alcanos más grandes (el punto de ebullición del pentadecano C 15 H 32 es 270°C). De ahí que los alcanos constituidos por moléculas más grandes también tengan mayor viscosidad. Algunos ejemplos de usos para estos alcanos de cadena larga son el aceite lubricante y la cera de parafina. Los alcanos con una longitud de cadena de 35 o más átomos de carbono se encuentran en el asfalto (o betún), que es una sustancia pegajosa y altamente viscosa.
Día 11 Problema de Podios Pre-Clase: Conformadores e Isómeros
Aquí hay una estructura de 2,5-dimetilhept-3-eno.
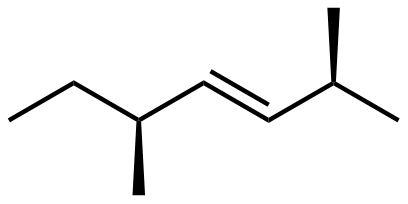
- Hay un centro de carbono quiral en esta molécula. Dibuja la estructura e identifica el carbono quiral con un asterisco (*).
- Dibuja una conformación diferente de la estructura anterior.
- Dibujar el enantiómero de esta molécula.
- Dibuja el isómero geométrico de esta molécula.
- Dibujar un isómero constitucional de esta molécula que probablemente tendría un punto de ebullición más alto.
- Explica por qué crees que este isómero constitucional tendría un punto de ebullición más alto.
- Dibujar una conformación diferente de este isómero constitucional.
Dos días antes de la próxima sesión de toda la clase, esta pregunta de Podia se pondrá en vivo en Podia, donde podrás enviar tu respuesta.


