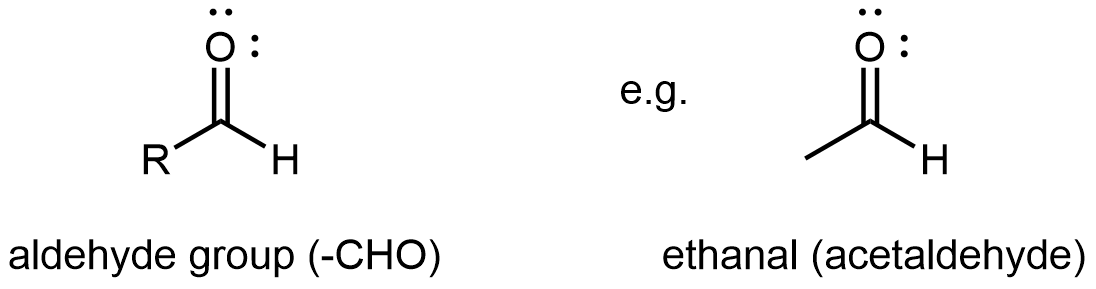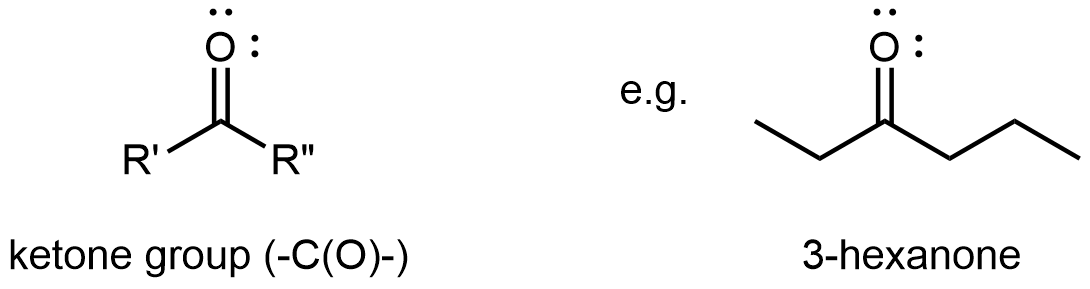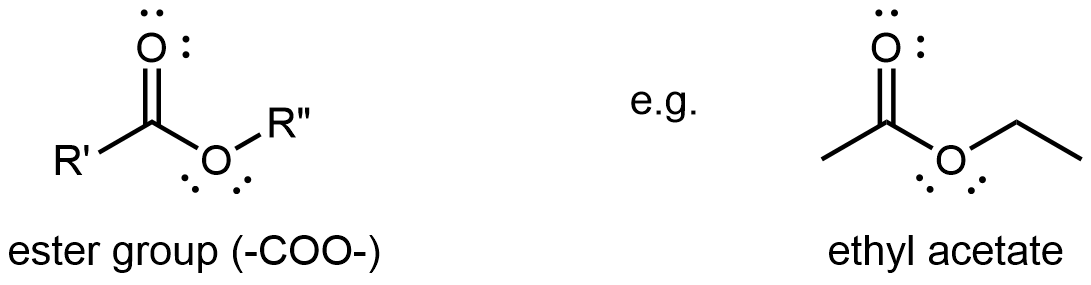2.4: Día 12- Fuerzas Intermoleculares; Grupos Funcionales
- Page ID
- 78979
11
Día 12: Fuerzas Intermoleculares; Grupos Funcionales
Aplicación de ideas básicas: comparación de propano y éter dimetílico
D12.1 Fuerzas Intermoleculares: Atracciones Dipolo-Dipolo
El FMI adicional aludido en el cuadro Aplicar ideas centrales se llama atracción dipolo-dipolo, fuerzas electrostáticas atractivas entre moléculas polares. La fuerza de atracción surge cuando el extremo positivo de un dipolo molecular interactúa con el extremo negativo de otro dipolo molecular (Figura 1).
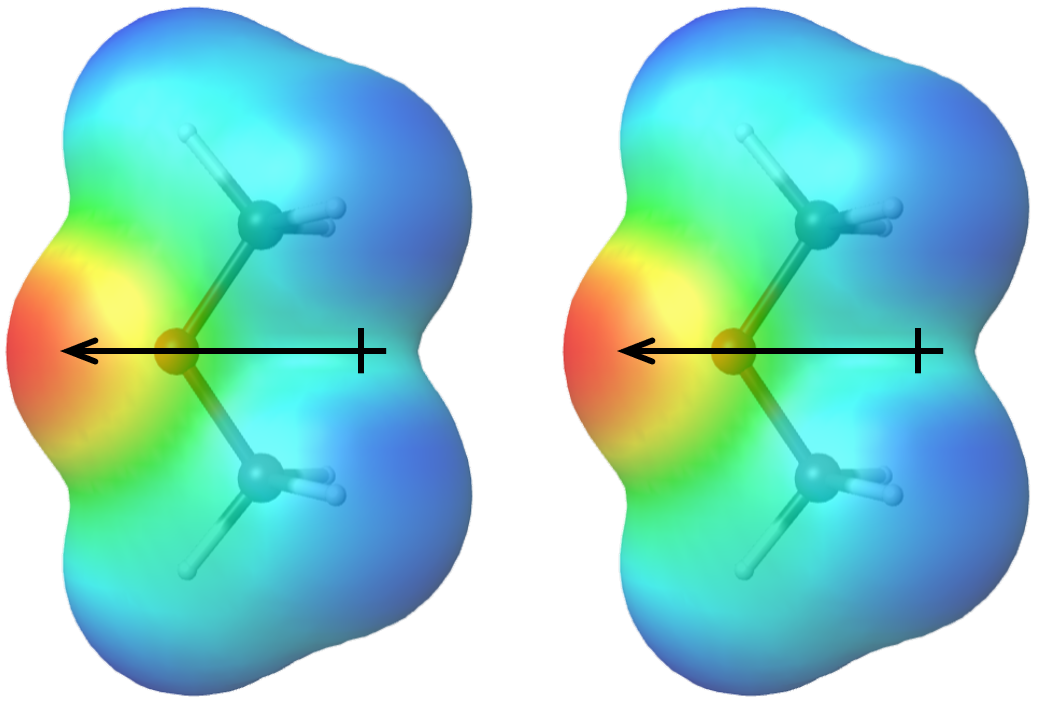
Cuanto más polar es una molécula (es decir, cuanto mayor es su momento dipolar molecular), más fuertes son las atracciones dipolo-dipolo entre las moléculas de esa sustancia. La polaridad molecular depende tanto de los tamaños de los dipolos de enlace (es decir, de las diferencias de electronegatividad entre pares de átomos unidos) como de la forma de la molécula. Las propiedades físicas de una sustancia están influenciadas por todos los IMF entre las moléculas de la sustancia, por lo que es importante considerar tanto las LDF como las atracciones dipolo-dipolo al predecir propiedades como los puntos de ebullición.
¿Cómo sabemos si una molécula tiene un momento dipolo? En la Sección D9.2 describimos enlaces covalentes polares, enlaces en los que existe una distribución desigual de la densidad electrónica en dos átomos unidos y por lo tanto un momento dipolar de enlace. La suma de todos los momentos dipolares de enlace en una molécula da un momento dipolo molecular. Las moléculas que tienen un momento dipolar molecular se denominan moléculas polares; las moléculas que tienen un momento dipolo molecular cero (o cercano a cero) se denominan moléculas no polares.
Para predecir si una molécula es polar, primero determine si existen enlaces polares comparando las electronegatividades de cada par de átomos unidos. Si las diferencias de electronegatividad son pequeñas o cero, no hay enlaces polares y la molécula debe ser no polar. Si hay enlaces polares, la molécula podría ser polar, pero también es posible que los dipolos de enlace se cancelen. Por ejemplo, tanto el dióxido de carbono (CO 2) como el dióxido de azufre (SO 2) tienen enlaces polares, pero solo el SO 2 es polar. En CO 2, el carbono central tiene dos enlaces σ, se hibrida sp, y por lo tanto la molécula es lineal. Los dipolos de enlace son grandes (Δ EN = 3.5 − 2.6 = 0.9) e iguales en magnitud, pero apuntan en direcciones exactamente opuestas. Esto da como resultado un momento dipolar molecular de cero. En SO 2, donde el átomo S central tiene dos enlaces σ y un par solitario, el átomo S es sp 2 hibridado y la molécula está doblada. Así, los dipolos de enlace también son grandes (Δ EN = 3.5 − 2.6 = 0.9), pero están en ángulo y el dipolo molecular resultante no es cero.
Los dipolos de enlace se comportan como vectores, así que si estás familiarizado con la adición de vectores puedes predecir cuándo cancelan los dipolos de enlace y cuándo no. Otra forma de predecir es esta: las moléculas con todos los átomos terminales iguales y sin pares solitarios en el átomo central son no polares debido a la cancelación de dipolos de enlace. (En el caso de una molécula con un número impar de electrones, un solo electrón en el átomo central cuenta como un par solitario). Para las moléculas multicéntricas, predecir dipolos moleculares es más complicado. Generalmente, si los átomos tienen electronegatividades similares, entonces los dipolos de enlace son débiles y el momento dipolar molecular es pequeño. Por ejemplo, debido a que C y H tienen electronegatividad similar, los enlaces C-H tienen una polaridad de enlace pequeña y las moléculas de hidrocarburos son no polares. El momento dipolar del propano, por ejemplo, es inferior a 0.1 D, esencialmente insignificante.
Grupos funcionales D12.2
Se conocen más de veinte millones de compuestos orgánicos, por lo que sería imposible memorizar las propiedades químicas de cada uno. Afortunadamente, podemos hacer uso de grupos funcionales para deducir las probables propiedades químicas y físicas de una molécula. Un grupo funcional es un átomo o grupo de átomos que tiene propiedades químicas similares siempre que esté presente en una molécula. Aunque otras partes de una molécula sean bastante diferentes, un grupo funcional específico suele reaccionar de la misma manera.
Debido a que los enlaces C—C y C—H son fuertes, los alcanos no son reactivos a temperatura ambiente; se utilizan principalmente como combustibles (Sección D7.2). Las partes alcano de las moléculas generalmente no participan en reacciones y no se definen como grupos funcionales. Un grupo alquilo es una porción de una molécula de alcano unida a otra cosa. Ejemplos de grupos alquilo son -CH 3 (metilo), -CH 3 CH 2 (etilo) y -CH (CH 3) 2 (2-propilo). (Ver nomenclatura de alcanos para más ejemplos.) A menudo usamos R (para el R est de la molécula) para designar cualquier grupo alquilo (o a veces otro tipo de grupo) en una molécula. Cuando hay dos o más grupos alquilo diferentes, usamos R, R', R”, etc. Por ejemplo, R y R', son trans entre sí en la siguiente estructura alqueno:
Cuando se dibuja una molécula usando R o R' para grupos alquilo, se pone mayor énfasis en un grupo funcional específico, en este caso, el enlace alqueno C=C.
Las secciones D7.3 y D7.4 describieron los grupos funcionales en alquenos y alquinos. El grupo funcional aromático se discutió en la Sección D9.6. Las siguientes secciones consideran grupos funcionales que contienen heteroátomos: átomos distintos de carbono e hidrógeno. Cada uno de estos grupos funcionales tiene su propia reactividad específica. Cada grupo funcional también puede afectar los tipos de fuerzas intermoleculares, dando lugar a diferentes propiedades físicas.
D12.3 Aldehídos y Cetonas
Un aldehído o una cetona contiene un grupo carbonilo, un átomo de carbono con doble enlace a un átomo de oxígeno. El átomo de carbono en un grupo carbonilo se llama carbono carbonilo. En un grupo funcional aldehído, el carbono carbonilo también está unido a un átomo de hidrógeno. Por lo tanto, un grupo aldehído solo puede enlazarse a un grupo R (otro átomo de carbono o un átomo de H), y el grupo aldehído siempre está al final de una cadena de átomos de carbono (haga clic en la imagen de abajo para un modelo 3D).
Un grupo funcional cetona consiste únicamente en el grupo carbonilo. Se une a dos grupos R, que pueden ser iguales o diferentes, y se encuentra en parte a lo largo de una cadena de átomos de carbono. (haga clic en la imagen de abajo para obtener un modelo 3D.)
La reactividad tanto de aldehídos como de cetonas está directamente relacionada con la reactividad del grupo carbonilo.
El formaldehído es un gas incoloro con un olor acre e irritante. Se vende en una solución acuosa llamada formalina, que contiene aproximadamente 37% de formaldehído en masa.
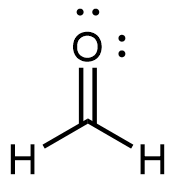
El formaldehído provoca la coagulación de las proteínas, por lo que mata las bacterias (y cualquier otro organismo vivo) y detiene muchos de los procesos biológicos que provocan la descomposición del tejido. Así, el formaldehído se utiliza para conservar especímenes de tejido y embalsamar cuerpos. También se utiliza para esterilizar el suelo u otros materiales. El formaldehído se utiliza en la fabricación de Baquelita, un plástico duro que tiene alta resistencia química y eléctrica.
La dimetil cetona, CH 3 COCH 3, comúnmente llamada acetona, es la cetona más simple. Es un líquido incoloro que puede elaborarse comercialmente fermentando maíz o melaza. Entre sus múltiples usos se encuentran como disolvente para laca (incluyendo esmalte de uñas), acetato de celulosa, nitrato de celulosa, acetileno, plásticos y barnices; como removedor de pinturas y barnices; y como disolvente en la fabricación de productos farmacéuticos y químicos.
Actividad 1: Hibridación de cetona y geometría de enlace local
Éteres D12.4
Un grupo funcional éter contiene el grupo —O—, que se une a dos grupos R diferentes y se encuentra en medio de una molécula.
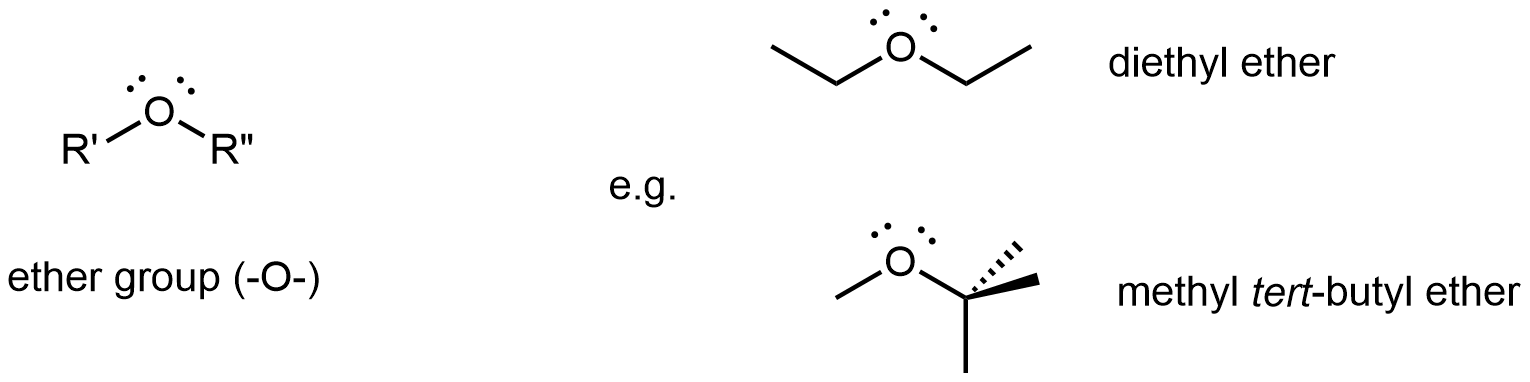
El éter dietílico, el compuesto más utilizado de esta clase, es un líquido incoloro y volátil que es altamente inflamable. Se utilizó por primera vez en 1846 como anestésico, pero mejores anestésicos ahora han ocupado en gran medida su lugar. El éter dietílico y otros éteres ahora se utilizan principalmente como solventes para gomas, grasas, ceras y resinas. El metil terc - butil éter (abreviado MTBE) se utiliza como aditivo para la gasolina. MTBE pertenece a un grupo de químicos conocidos como oxigenados debido a su capacidad para aumentar el contenido de oxígeno de la gasolina.
Actividad 2: Hibridación de éter y Geometría de Enlace Local
Ésteres D12.5
Un grupo funcional éster contiene un grupo carbonilo con un segundo átomo de oxígeno unido solo al carbono carbonilo y también unido a otro átomo de carbono. Una estructura general de éster tiene un grupo R unido al átomo de carbono de carbonilo y otro grupo R unido al segundo oxígeno. Es un grupo funcional que se encuentra en medio de una molécula. (Haga clic en la imagen de abajo para obtener un modelo 3D.)
El átomo de carbono del grupo funcional éster es sp 2 hibridado con una geometría local plana trigonal. Su oxígeno carbonílico es sp hibridado, y uno de sus AOS 2 p no hibridados forma el enlace π con el carbono no hibridado 2 p AO. Este oxígeno también tiene dos pares solitarios: uno ocupa un orbital híbrido sp; el otro ocupa un AO de 2 p que es perpendicular al enlace π. El segundo oxígeno (oxígeno no carbonilo) es sp 2 hibridado y tiene una geometría local doblada. También tiene dos pares solitarios, uno en un orbital híbrido sp 2 y el otro en el AO de 2 p no hibridado. Véase la Figura 2 a continuación.
Como se muestra en la Figura 2, el par solitario 2 p en el no carbonilo O está alineado paralelo a los orbitales p que forman el enlace π. Esto conduce a cierta deslocalización de las densidades de electrones de pares solitarios, que pueden ser expresadas por estructuras de resonancia:

Si bien la estructura de resonancia de la derecha hace solo una contribución menor a la descripción de la molécula de éster, esa estructura es importante para comprender las propiedades químicas y físicas del éster. Por ejemplo, el grupo -COO- éster es plano, y el enlace C-O no carbonilo no es tan libremente giratorio como un enlace sencillo típico. Además, la reactividad de un éster es bastante diferente de la de una cetona o un éter, y por lo tanto un éster es un grupo funcional distinto.
Actividad 3: Hibridación Ester y Geometría de Enlace Local
Los olores de los plátanos maduros y muchos otros frutos se deben a la presencia de ésteres.
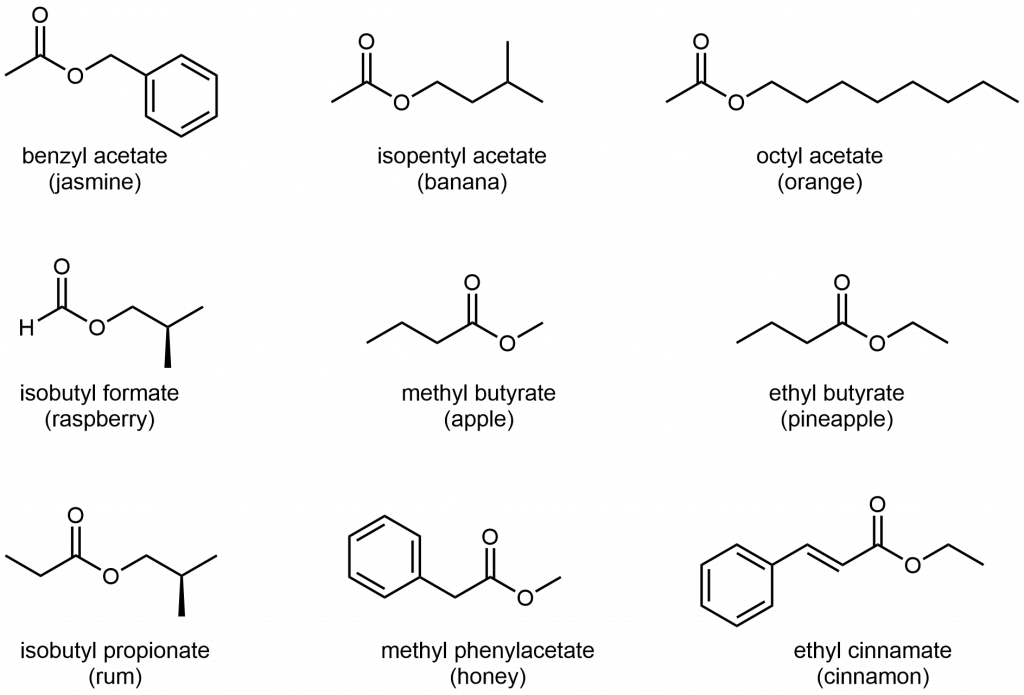
Figura 3. Estructuras de algunos ésteres que son responsables de los olores asociados a diversas plantas y sus frutos. Muchos otros ésteres y sus olores se enumeran en este enlace.
Día 12 Problema de Podia Pre-clase: Predecir puntos de ebullición
Los puntos de ebullición observados para CCl 4 y CHCl 3 son:
CCl 4: 77 °C ChCl 3: 61 °C
Usa tu conocimiento de las fuerzas intermoleculares para escribir una explicación de por qué CCl 4 tiene un punto de ebullición más alto.
Dos días antes de la próxima sesión de toda la clase, esta pregunta de Podia se pondrá en vivo en Podia, donde podrás enviar tu respuesta.