2.5: Día 13- Alcoholes, Ácidos Carboxílicos, Aminas, Amidas; Enlace de hidrógeno
- Page ID
- 78970
12
Día 13: Alcoholes, ácidos carboxílicos, aminas, amidas; enlaces de hidrógeno
Alcoholes D13.1
Un grupo funcional alcohol contiene un grupo -OH (hidroxilo) unido covalentemente a un átomo de carbono. (Obsérvese que el grupo -OH está unido covalentemente, el OH no es un ion hidróxido). Los nombres de los alcoholes se derivan de los nombres de los alcanos correspondientes eliminando la “e” final y agregando “ol”. Por ejemplo, la estructura del alcohol más simple se deriva de la estructura del metano reemplazando un átomo de H por un grupo OH (CH 3 OH). Se llama metanol.
El etanol es producido por algunas especies de levaduras que catalizan la fermentación de diversos azúcares:
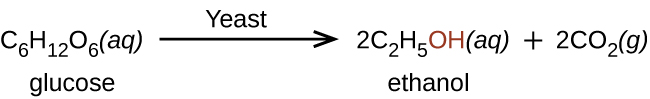
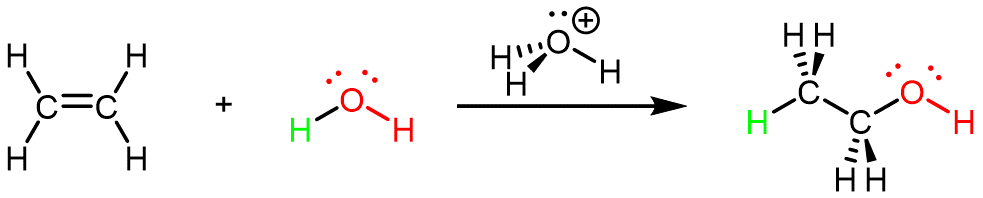
El etanol también se puede sintetizar usando la reacción de adición de eteno y agua usando un ácido como catalizador:
Ejercicio 1: Estructuras de Alcoholes
Saber nombrar sistemáticamente compuestos puede ser útil, especialmente cuando se trata de descifrar si las estructuras lineales mostradas son isómeros constitucionales o no. Consulte el apéndice de nomenclatura para obtener descripciones adicionales sobre cómo nombrar compuestos alcohólicos. (No serás probado explícitamente en nomenclatura en este curso.)
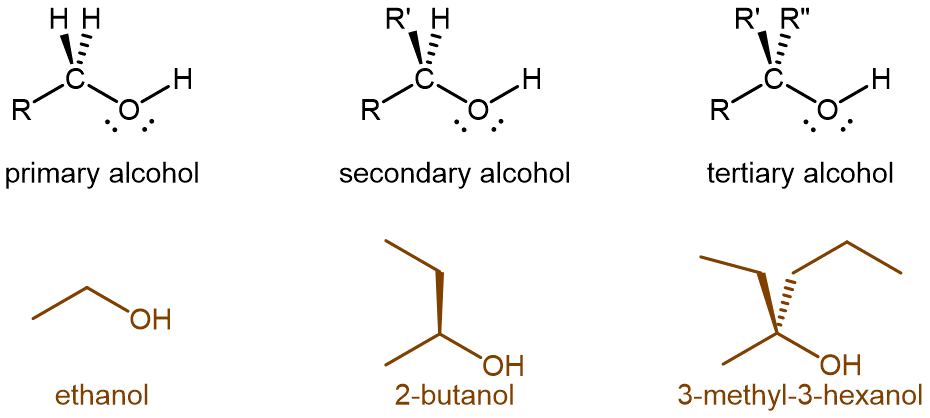
Las moléculas de alcohol pueden clasificarse según el número de grupos alquilo unidos al carbono con el grupo -OH, como se muestra en la Figura 1. Si un grupo alquilo (o solo hidrógeno) está unido a ese carbono, el alcohol es un alcohol primario (1º). Si se unen dos grupos alquilo, el alcohol es un alcohol secundario (2º). Si se unen tres grupos alquilo, el alcohol es un alcohol terciario (3º).
Ácidos Carboxílicos D13.2
Un grupo funcional ácido carboxílico, -COOH, tiene un grupo carbonilo y un grupo hidroxilo (-OH) unidos al mismo átomo de carbono. Se diferencia de un éster en que el oxígeno no carbonilo está unido a un átomo de hidrógeno en lugar de a un grupo R. De ahí que los grupos de ácido carboxílico se encuentren en un extremo de una molécula.
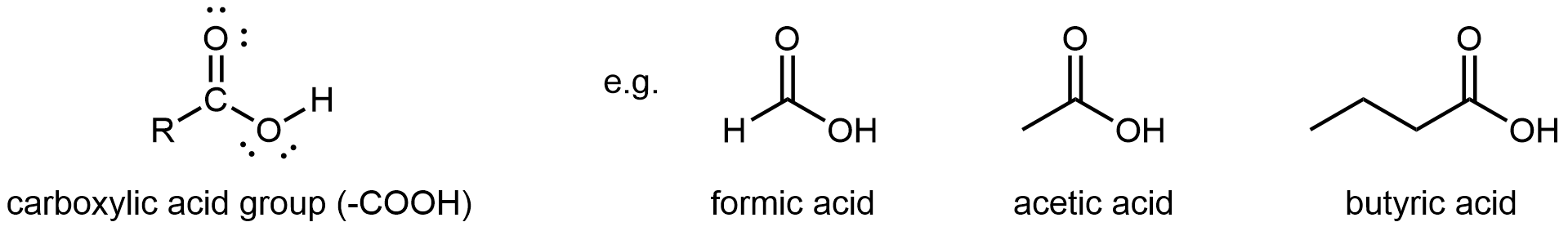
El ácido carboxílico más simple es el ácido fórmico, conocido desde 1670. Su nombre proviene del vocablo latino para hormiga, formicus. Es parcialmente responsable del dolor e irritación de las picaduras de hormigas y avispones. El ácido acético es un componente principal (> 4% en volumen) del vinagre. El vinagre de sidra se produce al permitir que el jugo de manzana fermente sin oxígeno presente; la levadura cambia el azúcar a etanol, que luego se convierte en ácido acético mediante oxidación biológica. El ácido butírico, un componente de la mantequilla rancia y el queso Limburger, tiene un olor vil.
Los grupos de ácido carboxílico son ácidos porque su enlace O-H puede romperse con relativa facilidad para producir -COO — y H +, lo que les permite donar un protón, H +, a otra molécula o ion. Esta acidez surge de la estabilidad relativa del anión carboxilato, RCOO −.
Actividad 1: Resonancia y acidez de un ácido carboxílico
D13.3 Aaminas
Un grupo funcional amina es un derivado del amoníaco que contiene uno o más enlaces carbono-nitrógeno.
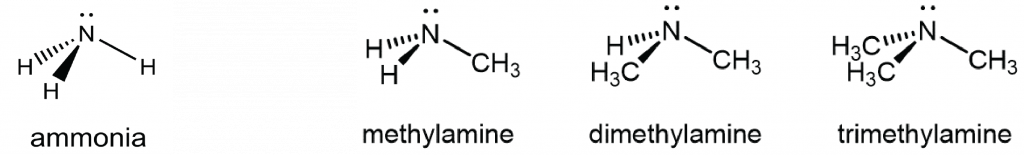
Se pueden clasificar las moléculas de amina por el número de enlaces C-N. En el ejemplo anterior, la metilamina es una amina primaria (1º), la dimetilamina es una amina secundaria (2º) y la trimetilamina es una amina terciaria (3º). En esta figura se muestran grupos metilo pero cualquier grupo R, como el etilo, podría reemplazar a cualquiera de los grupos metilo.
Al igual que el amoníaco, las aminas son básicas debido al par solitario en el átomo de nitrógeno, y pueden sufrir reacciones ácido-base para formar cationes amina protonados análogos al ion amonio NH:
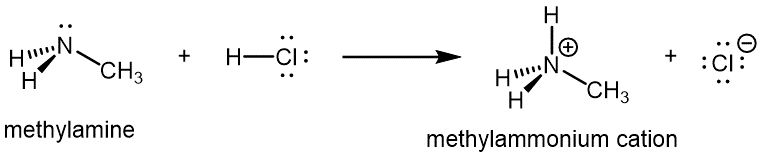
Amidas D13.4
Un grupo funcional amida contiene un átomo de nitrógeno conectado al átomo de carbono de un grupo carbonilo. Al igual que las aminas, las amidas se pueden clasificar por el número de átomos de carbono unidos al nitrógeno:

Actividad 2: Aminas, Amidas y Estructuras de Resonancia
Aunque la estructura de resonancia con cargas formales sobre O y N no contribuye tanto al híbrido de resonancia como la estructura de resonancia sin cargas formales, es crucial para comprender las propiedades químicas y físicas de las moléculas de amida. Por ejemplo, el carácter de doble enlace parcial da lugar a una barrera de energía significativa para la rotación del enlace C-N. Y debido a que el par solitario en el átomo de N es parte de la red de enlace π, el átomo de N en una amida es aproximadamente 10 veces menos básico que el átomo de N en una amina.
D13.5 Reacciones de Alcoholes, Aminas y Ácidos Carboxílicos
Reacciones de oxidación
Todas las sustancias cuyas moléculas contienen secciones de hidrocarburos son combustibles, las partes de hidrocarburos se pueden oxidar completamente a dióxido de carbono y agua. Para muchos compuestos la oxidación controlada es más importante que la combustión porque puede convertir un tipo de grupo funcional en otro grupo funcional, dándonos compuestos químicos útiles en diversas aplicaciones. Un ejemplo es la oxidación de alcoholes, que pueden convertirse en aldehídos, cetonas o ácidos carboxílicos.
La oxidación de un compuesto orgánico generalmente se puede reconocer como una adición de átomo (s) de oxígeno o eliminación de átomos de hidrógeno de la molécula reaccionante. La facilidad con la que se puede oxidar un alcohol y la extensión de la oxidación depende de si el alcohol es primario, secundario o terciario.
Para un alcohol primario, la oxidación controlada produce primero un aldehído. Si hay un exceso de oxidante, el aldehído se oxida adicionalmente a un ácido carboxílico:
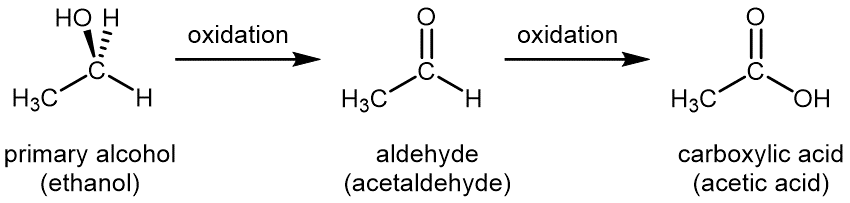
Los agentes oxidantes comunes utilizados en el laboratorio para la oxidación controlada son solución acuosa de permanganato de potasio, KMnO 4 (aq), o dicromato de potasio ácido acuoso, K 2 Cr 2 O 7 (ac).
Para un alcohol secundario, el producto de oxidación es una cetona:
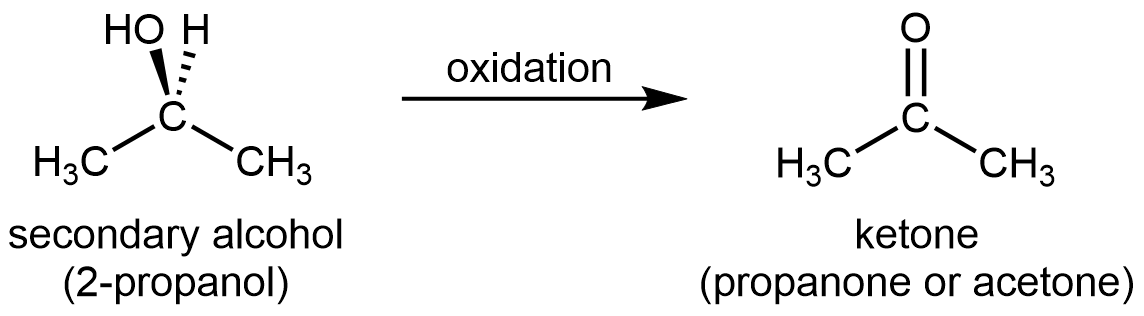
Las cetonas son difíciles de oxidar aún más porque, sin romper los enlaces C-C, no hay manera obvia de agregar un átomo de oxígeno más al carbono del carbonilo y tampoco hay átomos de hidrógeno para eliminar de ese carbono.
Los alcoholes terciarios, sin átomos de hidrógeno unidos al átomo de carbono que está unido al grupo —OH, son difíciles de oxidar. Los alcoholes terciarios se someten a combustión (para producir CO 2 y H 2 O), pero generalmente no experimentan oxidación controlada.
Reacciones de condensación
En una reacción de condensación, dos moléculas se unen para formar una molécula más grande y una molécula pequeña y estable como H 2 O o HCl. Por ejemplo, el acetato de etilo, CH 3 COOCH 2 CH 3, se forma cuando el ácido acético reacciona con etanol en presencia de un catalizador ácido:
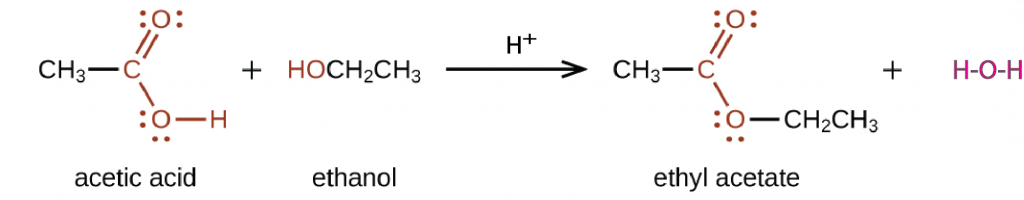
En general, la condensación de un ácido carboxílico y un alcohol produce un éster.
Las reacciones de condensación son reversibles: no todas las moléculas reaccionantes se convierten en moléculas de producto y, si se mezclan moléculas de producto, se forman algunas moléculas reaccionantes. La reacción inversa de una condensación que produce agua se denomina reacción de hidrólisis. En la hidrólisis, el agua se descompone en H y OH con H uniendo a una parte la molécula más grande y OH a otra: la hidrólisis proviene de hidro, “agua” y lisis, “rompiendo”.
Los éteres se pueden obtener a partir de reacciones de condensación que involucran dos moléculas de alcohol. Si las dos moléculas de alcohol son iguales, se forma un éter simétrico. Por ejemplo, cuando el etanol se trata con una cantidad limitada de ácido sulfúrico y se calienta a 140 °C, se forman éter dietílico y agua:
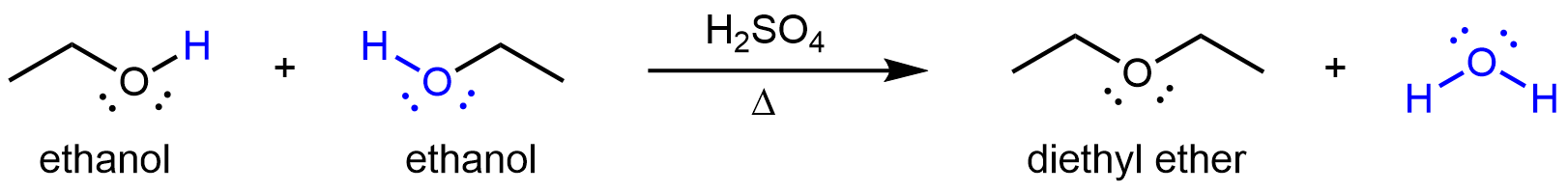
Si la reacción de condensación involucra dos alcoholes diferentes, se pueden formar éteres asimétricos. Por ejemplo:

Alternativamente, las reacciones de adición entre alquenos y alcoholes pueden formar éteres. Por ejemplo:

Las amidas se pueden producir a partir de ácidos carboxílicos y aminas primarias o secundarias (o amoníaco) a través de reacciones de condensación:
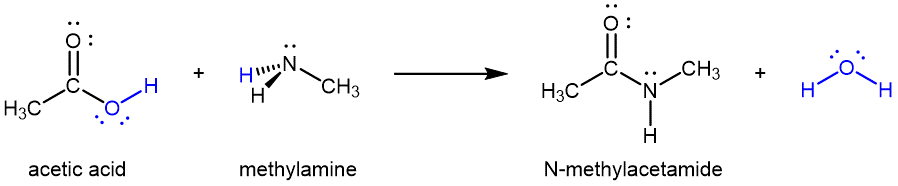
Es a través de esta reacción que los aminoácidos (moléculas que contienen tanto un grupo funcional amina como un ácido carboxílico) se unen en un polímero para formar péptidos y proteínas.
Aplicación de ideas básicas: comparación de propano, éter dimetílico y etanol
Cuando anteriormente comparamos los puntos de ebullición del propano y el éter dimetílico, vimos el efecto de las atracciones dipolo-dipolo. Agreguemos etanol a esa comparación:
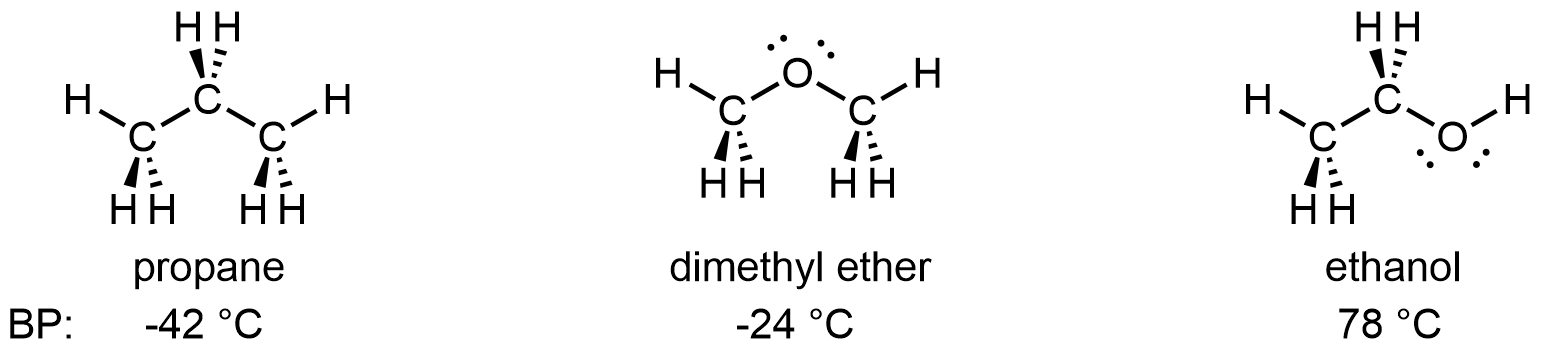
D13.6 Fuerzas Intermoleculares: Enlace de Hidrógeno
El IMF adicional que existe entre las moléculas de etanol, pero que no existe entre las moléculas de propano o entre las moléculas de éter dimetílico, se denomina enlaces de hidrógeno. Es la interacción entre un enlace covalente X-H (X denota un átomo altamente electronegativo) y el par solitario sobre un átomo rico en electrones, Z. La interacción de enlaces de hidrógeno puede designarse como X-H···Z (el “···” es el enlace de hidrógeno en sí).
El fuerte enlace de hidrógeno ocurre entre el enlace F-H, O-H o N-H y un par solitario de electrones en otro átomo F, O o N. F, O y N, se encuentran entre los elementos más electronegativos en la tabla periódica, una característica necesaria para un fuerte enlace de hidrógeno.
Un enlace de hidrógeno tiene aproximadamente 5-10% la fuerza de un enlace covalente típico. Parte de esta fuerza proviene de las interacciones dipolo-dipolo, pero lo más importante es el intercambio parcial de electrones que se asemeja a la formación de un enlace covalente. Esto se ilustra en la Figura 2, que muestra la interacción del enlace de hidrógeno entre dos moléculas de agua. La molécula de agua izquierda proporciona el enlace O-H (denotaremos esto como O L -H); la molécula de agua derecha proporciona el átomo O con el par solitario (denotaremos esto como O R).
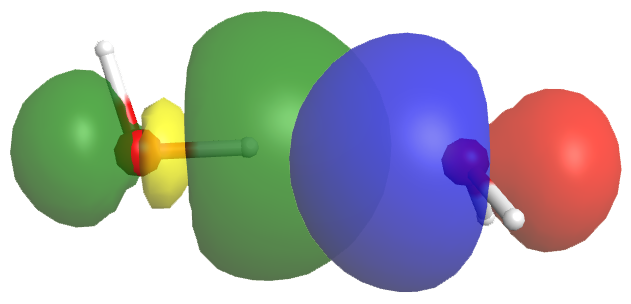
El orbital OL-H antienlace σ* vacío (amarillo/verde) se superpone con el orbital del par solitario del átomo O R (azul/rojo). Esta superposición permite que se comparta cierta densidad de electrones entre las dos moléculas de agua, formando así un enlace de hidrógeno. Si más densidad de electrones se moviera del par solitario O R al orbital O L -H σ*, el orbital antienlace se llenaría, el enlace O L-H se rompería y se habría producido una reacción química, se formaría un nuevo enlace O R-H, resultando en el agua correcta molécula convirtiéndose en H 3 O +:
H 2 O + H 2 O ⟶ OH — + H 3 O +
Así, formar un enlace de hidrógeno se asemeja a la formación de un enlace covalente.
Actividad 3: IMF entre moléculas de agua y entre moléculas de fluoruro de hidrógeno
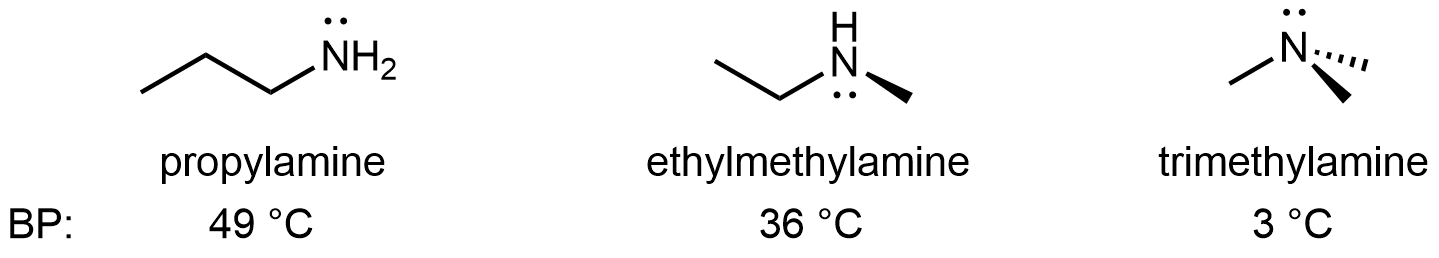
Para las aminas, las aminas 1º y 2º son capaces de formar enlaces de hidrógeno fuertes debido a la presencia de un enlace N-H y el par solitario en el átomo de N, pero las aminas de 3º no pueden formar enlaces de hidrógeno. Por ejemplo, para los tres isómeros de amina que se muestran a continuación, el punto de ebullición de la amina 3º es significativamente menor que los isómeros 1º y 2º.
Para las amidas, debido a que el par solitario en el átomo de N es parte de la red de enlace π, no está disponible para enlaces de hidrógeno. Sin embargo, los enlaces de hidrógeno aún se pueden formar en las amidas 1º y 2º entre el enlace (s) N-H y los pares solitarios en el átomo de O.
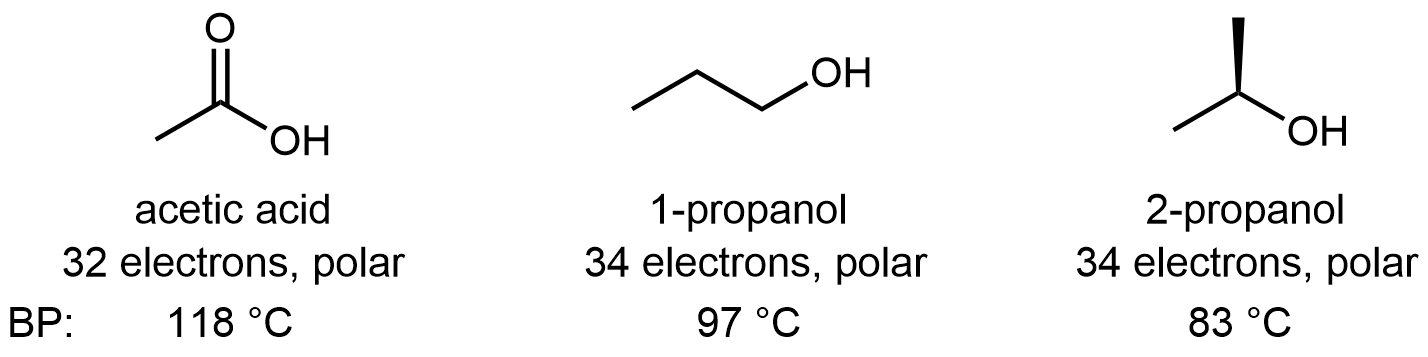
Las moléculas que contienen el grupo funcional ácido carboxílico también pueden formar enlaces de hidrógeno. El ácido acético puro se llama ácido acético glacial porque su punto de fusión de 16.6 °C es lo suficientemente alto como para que pueda congelarse en un laboratorio frío. También es bastante espeso y almibarado porque las muchas atracciones de enlace de hidrógeno entre las moléculas dan como resultado una alta viscosidad. La acidez del grupo ácido carboxílico aumenta la fuerza del enlace de hidrógeno O-H···O, de tal manera que los enlaces de hidrógeno entre las moléculas de ácido carboxílico suelen ser mayores que entre las moléculas de alcohol. Por ejemplo:
D13.7 Fuerzas intermoleculares: Solubilidad en agua
Los IMF afectan directamente la solubilidad en agua de un compuesto. Consideremos como ejemplo el grupo funcional alcohol.
El extremo -OH de una molécula de alcohol es hidrófilo (“amante del agua”), capaz de fuertes interacciones intermoleculares con moléculas de agua. Las interacciones dipolo-dipolo y enlaces de hidrógeno entre las moléculas de alcohol y agua son similares en fuerza a las que existen entre las moléculas de alcohol y alcohol o entre las moléculas de agua y agua. El extremo hidrocarbonado (alquilo) de una molécula de alcohol es esencialmente no polar y es hidrofóbico (“temeroso del agua”), donde las interacciones intermoleculares entre las moléculas hidrofóbicas y las moléculas de agua son débiles en comparación con los IMF entre las moléculas de agua-agua o hidrocarburo-hidrocarburo moléculas.
De ahí que aunque el tamaño del grupo alquilo tiene poca influencia en la reactividad de una molécula de alcohol, tiene un impacto significativo en la solubilidad de los alcoholes en agua. Los alcoholes con grupos alquilo pequeños, por ejemplo metanol y etanol, son completamente miscibles con agua, lo que significa que tienen una solubilidad mutua infinita en agua. Los alcoholes con grupos alquilo más grandes, como el 1-octanol, son inmiscibles en agua, lo que significa que cuando se agrega 1-octanol al agua se forman dos capas. Una capa es agua casi pura y la otra capa casi pura 1-octanol, debido a que la solubilidad de cada sustancia en la otra es muy baja.
Esto es igualmente cierto para los otros grupos funcionales polares y de enlace de hidrógeno. Por ejemplo, el ácido acético es miscible con agua, mientras que el ácido octanoico es inmiscible con agua.
Día 13 Pre-clase Podia Problema: Grupos Funcionales, Reacciones, Solubilidad
Considera las estructuras que se muestran a continuación. Enumere todas las sustancias que entran en cada una de las cinco categorías siguientes y explica por qué cada sustancia se ajusta a cada categoría en la que la colocaste. Explique también por qué las otras sustancias no encajan en cada categoría.
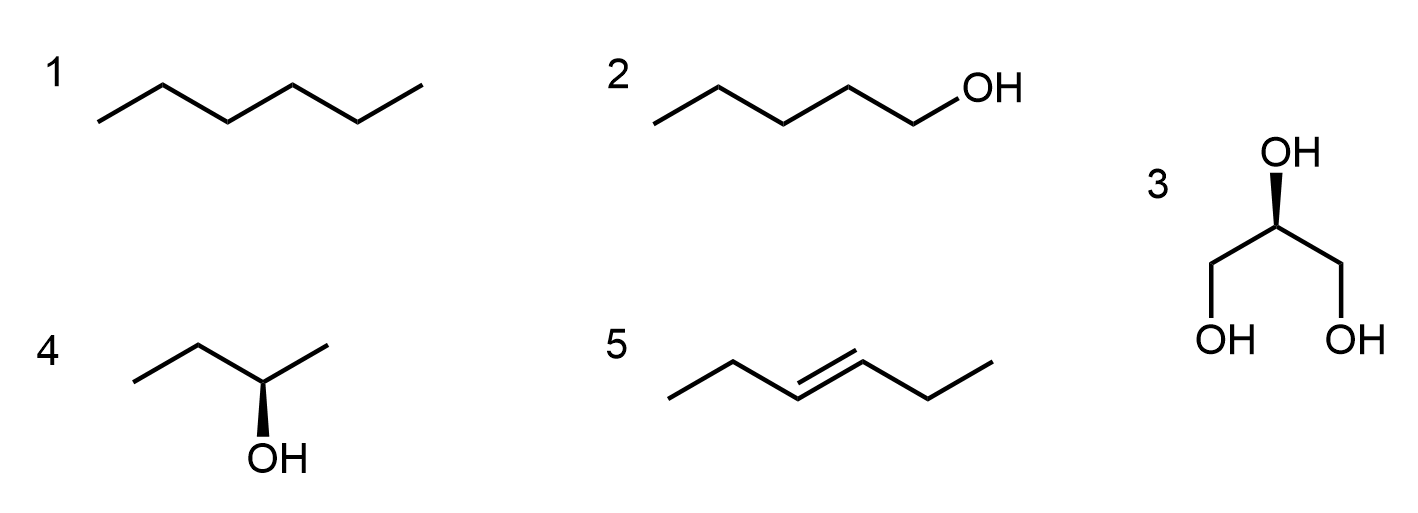
- Contiene un grupo funcional alcohol secundario.
- Es menos soluble en agua que el 1-hexanol.
- Tiene un punto de ebullición mayor que el 1-hexanol.
- Reacciona con K 2 Cr 2 O 7 (ac) para formar un ácido carboxílico.
- Se somete a adición de agua (con un catalizador ácido) para formar un alcohol secundario.
Dos días antes de la próxima sesión de toda la clase, esta pregunta de Podia se pondrá en vivo en Podia, donde podrás enviar tu respuesta.


