2.6: Día 14- Macromoléculas
- Page ID
- 78964
13
Día 14: Macromoléculas
Aplicación de ideas centrales: hacer moléculas realmente grandes
El ADN es un ejemplo de una macromolécula, una molécula enorme. Una molécula de ADN típica del genoma humano tiene aproximadamente 4 cm de largo y contiene aproximadamente 4 mil millones de átomos. Supongamos que quieres hacer una molécula realmente, muy grande como esta. ¿Cómo podrías hacerlo? ¿Qué elemento o elementos probablemente estarían involucrados? ¿Qué tipo de reacción química podría utilizarse? Construir un proceso modelo, basado en la estructura molecular y tipos de reacciones químicas, que permita la síntesis de moléculas muy grandes. Escribe una descripción del proceso en tu libreta.
Los polímeros son moléculas grandes hechas uniendo covalentemente muchas, muchas moléculas pequeñas. Las pequeñas moléculas que se unen para formar un polímero se denominan monómeros. Los polímeros pueden ser naturales (como almidón y proteínas) o sintéticos (como nylon y polipropileno). Debido a que incluyen una variedad de estructuras y grupos funcionales, los polímeros tienen una amplia gama de propiedades y usos que hacen que los plásticos basados en polímeros sean partes integrales de nuestra vida cotidiana.
Los polímeros proporcionan buenos ejemplos de cómo podemos aplicar modelos que involucran estructura molecular, grupos funcionales y atracciones intermoleculares para explicar y predecir las propiedades químicas y físicas de los materiales.
Polímeros de adición D14.1
Los polímeros de adición se preparan mediante reacciones de adición, en las que dos moléculas se combinan para formar una sola molécula de producto (ver ejemplos de reacciones de adición que involucran alquenos en la Sección D7.4). Los monómeros típicos para la polimerización por adición tienen al menos un doble enlace.
La Figura 1 muestra polietileno, un polímero de adición, que se forma a partir de monómeros de etileno (eteno, H 2 C=CH 2)
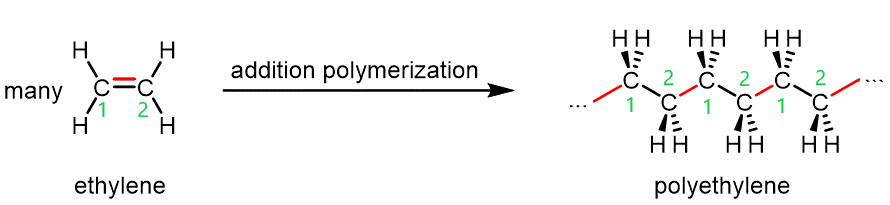
Figura 1. Se muestra la polimerización de etileno a polietileno. Los enlaces σ recién formados entre las unidades monoméricas de etileno se resaltan en rojo (derecha); se forman a partir de los dos electrones en el enlace de etileno π (mostrado en rojo, izquierda). Los números de átomos de carbono verdes en el polímero corresponden a la numeración en la estructura de etileno.
La reacción puede ser iniciada por una molécula con un electrón desapareado: un radical libre. Un iniciador de ejemplo es un peróxido orgánico, que puede formar dos radicales libres cuando se rompe el enlace O-O relativamente débil:

Actividad 1: Análisis de la descomposición del peróxido
Cuando un radical se encuentra con un monómero de etileno, el enlace de etileno π se rompe. Un electrón del enlace π va a emparejarse con el electrón del radical y formar un enlace σ. El otro electrón del enlace π sigue siendo un radical, y puede continuar reaccionando con otro monómero de etileno.
El proceso de la Figura 2 se repite con muchos, muchos más monómeros, a veces hasta 100,000 unidades, produciendo una larga cadena polimérica de átomos de carbono.
Estructura y propiedades del polímero D14.2
En el polietileno, las reacciones de adición convierten todos los dobles enlaces de etileno en enlaces simples y unen los monómeros sin perder ningún átomo. De ahí que este polímero a nivel molecular consiste en una colección de moléculas de alcano de cadena larga, la mayoría de las cuales contienen decenas de miles de átomos de carbono. Muchas de las propiedades del polietileno son las que esperaríamos de esta composición molecular.
Si las fuerzas intermoleculares entre las cadenas son más pequeñas, de manera que es más fácil que las moléculas se muevan más allá de las otras, el polímero será más suave y más fácil de rayar. Si las fuerzas intermoleculares entre las cadenas son lo suficientemente fuertes como para evitar el movimiento de las moléculas más allá de las otras, el polímero será más duro o más rígido. Debido a que el polietileno es una mezcla de moléculas de alcano largas, cada una de longitud de cadena ligeramente diferente, se ablanda en un rango de temperaturas en lugar de tener un solo punto de fusión. Es posible que hayas notado que algunos plásticos, cuando se envuelven alrededor de algo en un horno microondas, se ablandan y cambian de forma pero nunca se vuelven líquidos.
Esto lleva a una idea importante en el campo de la ciencia de los materiales: los materiales se pueden “afinar” para dar exactamente las propiedades deseadas. Ajustando las resistencias de las fuerzas intermoleculares se pueden obtener materiales plásticos con una gama de propiedades.
Para el polietileno, se puede variar el grado de ramificación de una hebra de polímero. Dependiendo del proceso de producción, una hebra de polímero puede ser una cadena lineal muy larga o puede haber ramificación en la cadena:
Las propiedades del polímero también pueden verse afectadas por la reticulación. Un entrecruzamiento es un enlace covalente σ entre dos cadenas poliméricas separadas que no está al final de ninguna de las cadenas.
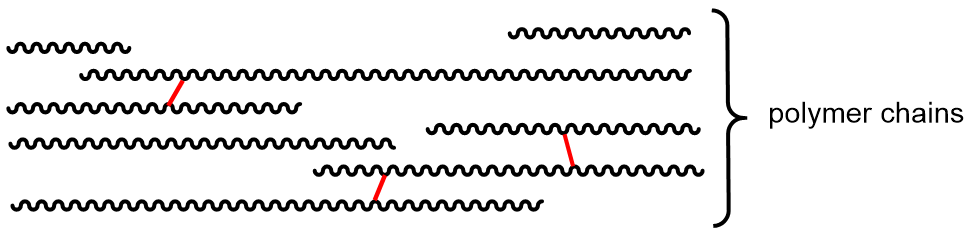
Los enlaces cruzados aumentan el peso molecular y limitan los movimientos de las cadenas entre sí. Con suficientes enlaces cruzados, una muestra de un polímero puede convertirse en una red tridimensional sostenida por enlaces σ, una sola molécula gigantesca. Otra forma de pensar sobre los enlaces cruzados: por ser enlaces covalentes, son más fuertes que las fuerzas intermoleculares entre las cadenas poliméricas y, por lo tanto, amplifican el efecto de aumentar las fuerzas intermoleculares sobre las propiedades de los polímeros.
D14.3 Diversos Polímeros de Adición
La Tabla 1 a continuación enumera monómeros para algunos polímeros de adición bien conocidos y también algunos de sus usos. Probablemente puedas encontrar al menos un ejemplo de cada uno de ellos en tu hogar. Cada monómero es una variación de la estructura de etileno (eteno) en la que uno o más átomos de H han sido reemplazados por otro grupo (resaltado en la tabla). Dicha sustitución (es) en el monómero permite controlar con precisión las propiedades físicas del polímero, tales como densidad, rango de fusión, resistencia e hidrofobicidad, y el polímero adaptado para usos especializados. Tenga en cuenta que en la siguiente ecuación la estructura del polímero se especifica encerrando una sola unidad repetitiva entre paréntesis y especificando la naturaleza repetitiva por un subíndice n.
| Monómero | Nombre común | Polímero | Algunos usos típicos |
|---|---|---|---|
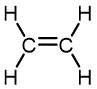 |
Etileno | Polietileno | Película para empaques y bolsas, juguetes, botellas, recubrimientos |
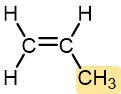 |
Propileno | Polipropileno (Herculon) | Cartones de leche, cuerda, alfombras para exteriores |
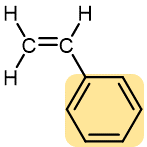 |
Estireno | Poliestireno (Styrofoam, Styron) | Contenedores transparentes, vasos de plástico, refrigeradores, espuma de poliestireno |
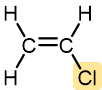 |
Cloruro de vinilo | Cloruro de polivinilo (PVC) | Tuberías y tubos, impermeables, cortinas, discos fonográficos, equipaje, baldosas |
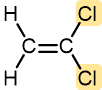 |
Cloruro de vinilideno | Cloruro de polivinilideno (Saran) | Envoltura alimenticia aferrada |
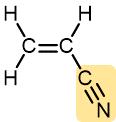 |
Acrilonitrilo | Poliacrilonitrilo (Orlon, Acrilan) | Textiles, tapetes |
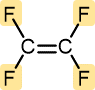 |
Tetrafloroetileno | Politetrafluoroetileno (Teflon) | Recubrimientos antiadherentes, cojinetes, juntas |
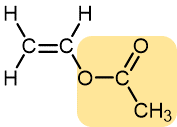 |
Acetato de vinilo | Acetato polivinílico | Pegamento Elmer's, pegamento para madera |
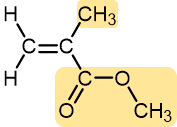 |
Metacrilato de metilo | Polimetil metacrilato (Plexiglás, Lucite) | Láminas rígidas, transparentes, de plástico, bloques, tubos y otras formas |
La notación donde una unidad repetitiva en una cadena polimérica se muestra entre paréntesis enfatiza que es importante poder reconocer una unidad repetitiva dentro de una cadena polimérica. También es importante poder generar la estructura polimérica completa a partir de una unidad repetitiva. Encerrado dentro del corchete puede haber una unidad repetitiva (equivalente a un monómero), o dos, o tres, etc. Usemos cloruro de polivinilideno como ejemplo:
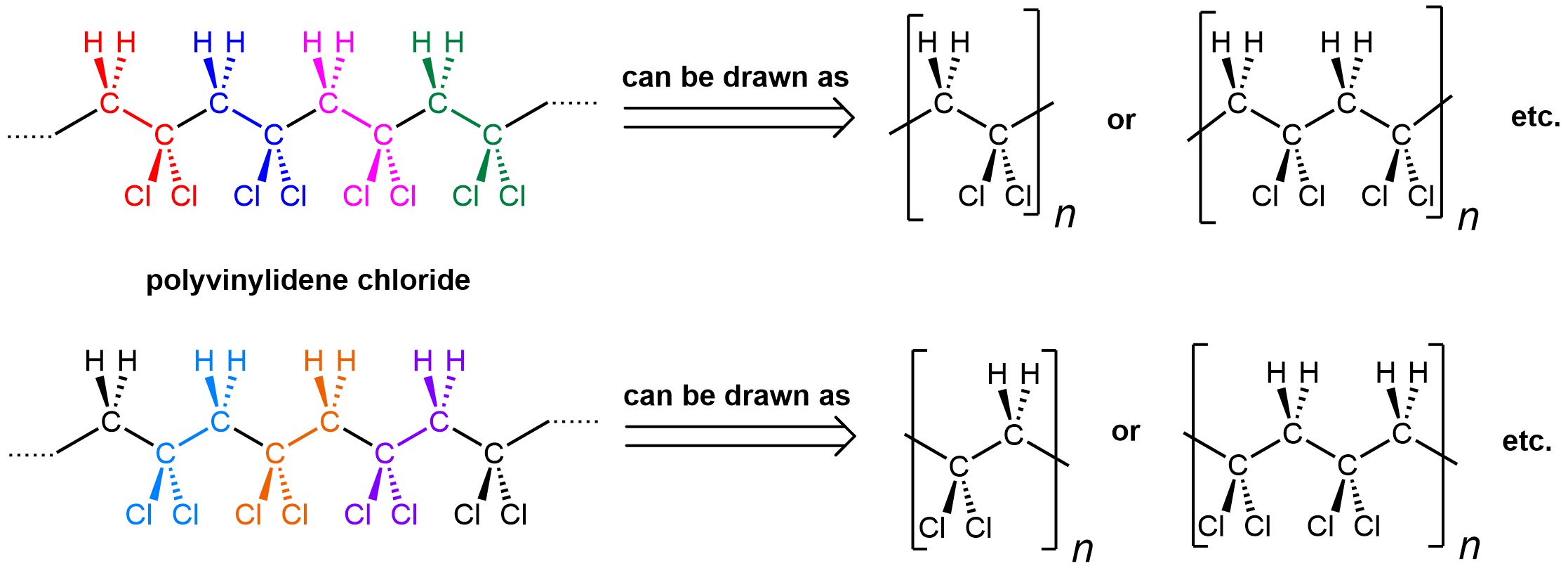
A la izquierda se muestra una hebra de polímero de cloruro de polivinilideno. Las unidades repetitivas individuales están codificadas por colores. Sin embargo, hay dos formas de considerar las unidades repetitivas: comenzando en el CH 2 (arriba) o el CCl 2 (abajo). De cualquier manera está bien.
Se puede ver que el patrón repetitivo en este polímero es alternando CH 2 y CCl 2. Cuando pones un soporte alrededor de una unidad repetitiva, estás comunicando que lo que está fuera del soporte repite exactamente lo que hay dentro, comenzando inmediatamente con los enlaces que están divididos por el corchete. Por lo tanto, el átomo de carbono más a la izquierda de la siguiente unidad repetitiva está directamente unido al carbono más a la derecha de la unidad mostrada.
En otras palabras, algo así como lo siguiente es incorrecto para representar cloruro de polivinilideno:
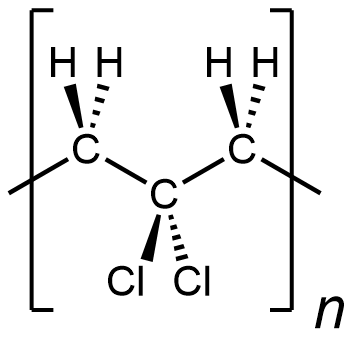
Se representa un polímero donde hay unidades CH 2 unidas a la unidad CH 2, lo que no ocurre en el cloruro de polivinilideno. (este polímero es... -CH 2 -CH 2 -CCl 2 -CH 2 -CH 2 -CCl 2 -CH 2 -CH 2 -CH 2 -CCl 2 -...)
Polímeros de dieno conjugado D14.4
Los dienos conjugados (alquenos con dos dobles enlaces y un enlace sencillo entre ellos) se pueden polimerizar para formar sustancias importantes, como el caucho. Esto ocurre tanto en la naturaleza como en el laboratorio. El dieno conjugado más simple es el 1,3-butadieno; la Figura 4 muestra la 1,4-polimerización de este monómero. En el polímero resultante, se forma un nuevo enlace σ (resaltado en rojo) entre el carbono 1 de un monómero y el carbono 4 de otro monómero, y dentro de cada monómero, se mueve un enlace π entre el carbono 2 y el carbono 3.
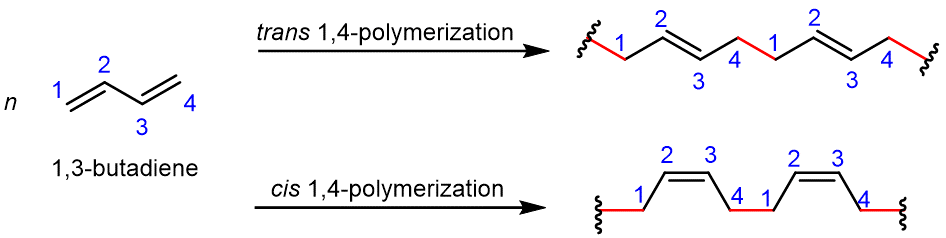
Consideremos la reacción con un poco más de detalle. Durante la reacción de polimerización: un electrón del enlace C1 =C2 π en el monómero B se empareja con un electrón de un monómero adyacente A para formar un nuevo enlace σ que implica C1; de manera similar, un electrón del enlace C3 =C4 π en el monómero B se empareja con un electrón de otro monómero adyacente C para formar un nuevo enlace σ que involucra C 4; el otro electrón de cada enlace π se mueve al centro de la molécula, y forma un nuevo enlace π entre C 2 y C 3.
Actividad 2: Polimerización por adición 1,4-
Las reacciones químicas que involucran dobles enlaces en cadenas poliméricas adyacentes pueden conducir a la reticulación, lo que mejora la elasticidad del polímero. En 1839, Charles Goodyear descubrió que cuando el caucho natural se calentaba a 140—160 °C en presencia de azufre, el caucho se volvió más duro, más resistente al calor y al frío, y más elástico. Este proceso se denominó posteriormente vulcanización después de Vulcano, el dios romano del fuego y los volcanes. Por encima de 140 °C, se forman enlaces S-S en moléculas de azufre, S 8, ruptura y cadenas lineales de átomos de azufre. Estas cadenas reaccionan entonces con algunos de los dobles enlaces restantes en el polímero, formando reticulaciones. El desarrollo de caucho vulcanizado para llantas de automóviles contribuyó enormemente a la industria automotriz.
Otro dieno conjugado importante utilizado en el caucho sintético es el cloropreno (2-cloro-1,3-butadieno). El cloropreno polimerizado fue desarrollado por DuPont y se le dio el nombre comercial Neopreno. La reticulación en policloropreno implica la combinación de dos átomos de cloro de cadenas adyacentes con un ion Zn 2 + para formar ZnCl 2. Los enlaces C—Cl en el polímero no reticulado se convierten en enlaces C—C, la reticulación. La reticulación contribuye a la elasticidad general del neopreno.
Copolímeros D14.5
Algunos de los polímeros de adición más importantes comercialmente son los copolímeros, hechos polimerizando una mezcla de dos o más monómeros. Por ejemplo, caucho de estireno-butadieno (SBR), que es un copolímero de 1,3-butadieno y estireno mezclado en una relación de aproximadamente 3:1.
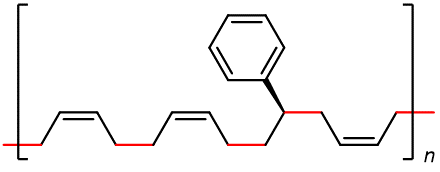
Las propiedades de un copolímero son distintas de las de una mezcla de los polímeros individuales. Por ejemplo, las propiedades del SBR son diferentes de una mezcla que contiene polibutadieno y poliestireno, sin importar cuál sea la relación de la mezcla.
SBR se desarrolló en Estados Unidos durante la Segunda Guerra Mundial cuando se cortaron importantes suministros de caucho natural. Es más resistente a la abrasión y oxidación que el caucho natural y también puede vulcanizarse. Más del 40% de la producción de caucho sintético es SBR, que se utiliza en la producción de llantas. Varios otros tipos de caucho son los copolímeros, como el caucho butílico, que se copolimeriza a partir de 2-metilpropeno (H 2 C=C (CH 3) 2) y un pequeño porcentaje de isopreno.
Día 14 Problema Podia Pre-clase: Polímeros y Fuerzas Intermoleculares
La resistencia o tenacidad de un material polimérico depende de las resistencias de las fuerzas intermoleculares entre las cadenas poliméricas y varios otros factores. Suponiendo que otros factores son iguales, compare la dureza/resistencia del polietileno y el poliacrilonitrilo. Explique claramente cuál es más fuerte y por qué.
Dos días antes de la próxima sesión de toda la clase, esta pregunta de Podia se pondrá en vivo en Podia, donde podrás enviar tu respuesta.


